
构建白内障合并2型糖尿病患者术前药物性散瞳受限风险预测模型并验证其效能。
横断面研究。纳入2022年10月至2023年3月浙江大学医学院附属第二医院行白内障手术的376例白内障合并2型糖尿病患者。其中2022年10至12月的268例作为建模组,根据是否发生药物性散瞳受限,分为散瞳受限组(187例)和散瞳未受限组(81例)。采用logistic回归建立风险预测模型,使用R软件绘制列线图,运用Hosmer-Lemeshow检验判断模型的拟合优度,采用受试者工作特征(ROC)曲线检验模型的预测效果。选取2023年1至3月的108例白内障合并2型糖尿病手术患者作为验证组,采用Hosmer-Lemeshow检验和ROC曲线对模型进行外部验证。
建模组268例,男124例,女144例,年龄(66.6±6.8)岁;验证组108例,男51例,女57例,年龄(64.9±9.1)岁。白内障合并2型糖尿病患者术前药物性散瞳受限发生率为69.8%(187/268)。多因素logistic回归分析结果显示,糖尿病病程(OR=1.134,95%CI:1.074~1.198,P<0.001)、体质指数(BMI)(OR=0.863,95%CI:0.767~0.972,P=0.015)、糖化血红蛋白(HbA1c)水平(OR=1.397,95%CI:1.055~1.849,P=0.019)及瞳孔直径基线值(OR=0.089,95%CI:0.045~0.179,P<0.001)是药物性散瞳受限的相关因素。Hosmer-Lemeshow检验χ2=6.231,P=0.621,ROC曲线下面积为0.897(95%CI:0.857~0.937,P<0.001),约登指数最大时(0.655),灵敏度为0.877,特异度为0.778。外部验证结果显示,ROC曲线下面积为0.928(95%CI:0.875~0.981,P<0.001),约登指数最大时(0.761),灵敏度为0.932,特异度为0.829,准确率为89.8%。
本研究建立的风险预测模型可为临床评估白内障合并2型糖尿病患者术前药物性散瞳受限发生风险提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病为常见的慢性代谢性疾病,持续的高浓度血糖可通过改变晶状体渗透压、诱发晶状体氧化应激、引起晶状体蛋白糖基化等多种途径加速白内障的发生与发展[1]。散瞳是白内障手术术前重要准备步骤,也是手术成功的关键因素之一[2, 3, 4],但合并2型糖尿病的白内障患者药物性散瞳后30 min常出现瞳孔直径明显小于非糖尿病患者,瞳孔散大较难达到理想状态(瞳孔直径>6 mm)[5, 6],即散瞳受限。糖尿病病程对散瞳后瞳孔直径有明显影响,其发生机制较复杂[7]。研究发现药物性散瞳后瞳孔直径受糖化血红蛋白(glycated hemoglobin A1c,HbA1c)水平、糖尿病病程、糖尿病性视网膜病变等因素影响[8, 9, 10, 11],高风险患者散瞳后瞳孔散大受限的可能性为低风险患者的3~4倍[8,12],高风险因素越多,散瞳后瞳孔散大受限的发生率越高。瞳孔扩张不足可增加手术难度,如撕囊和人工晶状体植入困难,且增加术源性并发症的发生,如瞳孔括约肌损伤、虹膜损伤、后囊膜破裂和皮质残留等[9,13, 14],影响患者预后。有研究提示抗胆碱能散瞳药与非甾体类滴眼液联合使用,可促进糖尿病患者瞳孔散大,提高散瞳效果[4]。但并非所有糖尿病患者均会出现散瞳受限,如何精准筛选出受限目标人群,合理干预是值得临床探讨的问题。基于此,本研究拟构建白内障合并2型糖尿病患者药物性散瞳受限风险预测模型,以帮助临床早期精准预测及合理干预,提高白内障合并2型糖尿病患者术前药物性散瞳达标率,进一步提升白内障手术安全性。
横断面研究。采用便利抽样法,选取2022年10月至2023年3月在浙江大学医学院附属第二医院进行白内障手术的白内障合并2型糖尿病患者。纳入标准:(1)符合白内障诊断标准,并有手术指征;(2)2型糖尿病病程超过1年,空腹血糖或餐前血糖>3.9~10 mmol/L;(3)白内障手术前接受复方托吡卡胺眼液散瞳;(4)无眼部手术史;(5)基线瞳孔(自然光线下)直径2~4 mm,虹膜结构清;(6)入院时术眼眼压11~21 mmHg(1 mmHg=0.133 kPa)。排除标准:(1)虹膜萎缩或缺损、瞳孔粘连、房角新生血管;(2)术前服用影响自主神经功能的食品(如咖啡、茶叶)、药物(如抗精神类药物:利培酮、奥氮平、阿立哌唑及喹硫平);(3)散瞳药物过敏;(4)强直性瞳孔;(5)双眼弱视、斜视;(6)合并甲状腺功能亢进、眼部急性感染、精神类疾病、严重肝肾功能不全。本研究已通过浙江大学医学院附属第二医院伦理委员会批准(伦理批号:20230339),研究对象均知情同意,自愿参加本研究。
根据流行病学研究要求样本量取自变量的5~10倍[15],本研究纳入自变量10个,根据既往研究,合并2型糖尿病的白内障患者散瞳后30 min瞳孔受限发生率55%~70%,取平均值62.5%≈63%,考虑10%的脱落率,所需样本量为20×5×(1+0.1)/0.63=175例。设定建模组与验证组样本量比例7∶3,验证组样本量至少75例,因此总样本量至少250例,本研究样本量可满足建模要求。2022年10至12月符合标准的268例白内障合并2型糖尿病手术患者作为建模组,根据是否发生药物性散瞳受限,将其分为散瞳受限组和散瞳未受限组,以构建散瞳受限风险的预测模型;2023年1至3月符合标准的108例白内障合并2型糖尿病手术患者作为外部验证组,验证模型预测效能。
1. 散瞳方法:术前1 h,遵医嘱采用复方托吡卡胺滴眼液(河北永光制药有限公司,国药准字H20066782)滴眼,每次1滴,每10分钟滴1次,共3次。
2. 瞳孔直径测量方式:(1)基线瞳孔直径测量:在自然光照的病房内,患者明适应后固视前方,在患者眼前1 cm处放置标准瞳孔测量毫米标尺,使得刻度线与待测径线瞳孔两侧缘平行,然后读取两个瞳孔缘间180°轴线直径的数值;(2)散瞳后30 min瞳孔直径测量:使用裂隙灯测量,读取方法同前。测量3次后取平均值。
3. 瞳孔受限定义:散瞳后30 min瞳孔直径未达6 mm定义为散瞳受限[16]。
4. 瞳孔受限风险因素纳入方法:通过查阅中国知网、万方数据库、维普数据库、PubMed、Web of Science、Cochrane Library中相关文献[5,17, 18, 19, 20],并咨询内分泌科、神经内科、眼科专家筛选可能影响白内障合并2型糖尿病患者药物性散瞳受限的相关因素,相关因素纳入原则:具有针对性,可量化且便捷可取。主要包括人口学资料、实验室检查指标和眼专科检查指标。人口学资料:年龄、性别、体质指数(body mass index,BMI)、文化程度、高血压、吸烟、糖尿病性视网膜病变、降糖给药途径及糖尿病病程。实验室检查:术前1个月内HbA1c、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、血肌酐、尿蛋白发生情况,手术当日散瞳前空腹血糖、收缩压及舒张压。眼专科指标:基线瞳孔直径、散瞳后30 min瞳孔直径。
5. 资料收集方法:由1名研究组成员收集相关资料,并由另1名研究组人员进行核对。基线及散瞳后30 min的瞳孔直径测量由1名研究护士测量3次,取平均值。人口学资料、实验室检查结果通过查阅病历系统及检验系统提取并记录,发现异常、缺陷、重复等及时反馈并进行核对,以保证评估内容的完整性和准确性。
采用 SPSS 27.0和R 4.0.3软件对数据进行处理。正态分布的计量资料用描述,组间比较采用独立样本t检验;非正态分布的计量资料用M(Q1,Q3)描述,组间比较采用Mann-Whitney U检验。计数资料用频数和百分比描述,组间比较采用χ2检验。将单因素分析中P<0.05的变量纳入多因素logistic回归模型,明确最终纳入模型的变量,基于多变量模型,使用R软件绘制列线图。采用Hosmer-Lemeshow χ2检验、受试者工作特征(receiver operating characteristic,ROC)曲线下面积评价模型的区分度;采用灵敏度、特异度和准确率评价模型的应用效能。均为双侧检验,检验水准α=0.05。
本研究纳入376例白内障合并2型糖尿病患者,建模组268例,男124例,女144例,年龄(66.6±6.8)岁;验证组108例,男51例,女57例,年龄(64.9±9.1)岁。两组患者基线特征比较差异均无统计学意义(均P>0.05)(表1)。建模组和验证组中瞳孔受限发生率分别为69.8%(187/268)和67.6%(73/108)。
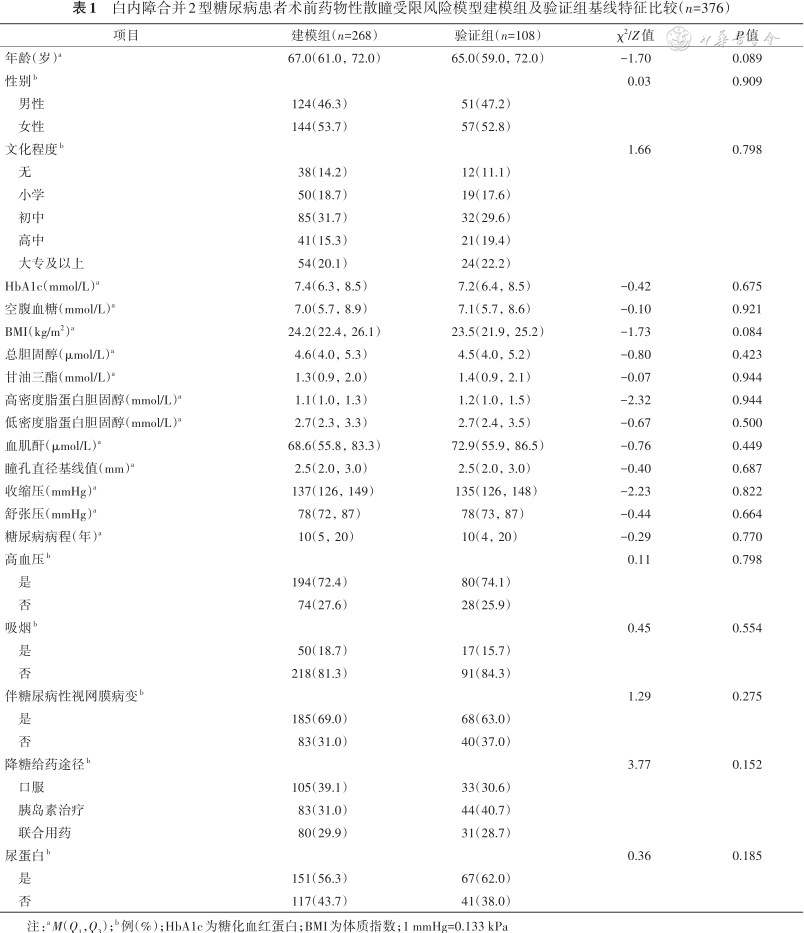
白内障合并2型糖尿病患者术前药物性散瞳受限风险模型建模组及验证组基线特征比较(n=376)
白内障合并2型糖尿病患者术前药物性散瞳受限风险模型建模组及验证组基线特征比较(n=376)
| 项目 | 建模组(n=268) | 验证组(n=108) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 67.0(61.0,72.0) | 65.0(59.0,72.0) | -1.70 | 0.089 |
| 性别b | 0.03 | 0.909 | ||
| 男性 | 124(46.3) | 51(47.2) | ||
| 女性 | 144(53.7) | 57(52.8) | ||
| 文化程度b | 1.66 | 0.798 | ||
| 无 | 38(14.2) | 12(11.1) | ||
| 小学 | 50(18.7) | 19(17.6) | ||
| 初中 | 85(31.7) | 32(29.6) | ||
| 高中 | 41(15.3) | 21(19.4) | ||
| 大专及以上 | 54(20.1) | 24(22.2) | ||
| HbA1c(mmol/L)a | 7.4(6.3,8.5) | 7.2(6.4,8.5) | -0.42 | 0.675 |
| 空腹血糖(mmol/L)a | 7.0(5.7,8.9) | 7.1(5.7,8.6) | -0.10 | 0.921 |
| BMI(kg/m2)a | 24.2(22.4,26.1) | 23.5(21.9,25.2) | -1.73 | 0.084 |
| 总胆固醇(μmol/L)a | 4.6(4.0,5.3) | 4.5(4.0,5.2) | -0.80 | 0.423 |
| 甘油三酯(mmol/L)a | 1.3(0.9,2.0) | 1.4(0.9,2.1) | -0.07 | 0.944 |
| 高密度脂蛋白胆固醇(mmol/L)a | 1.1(1.0,1.3) | 1.2(1.0,1.5) | -2.32 | 0.944 |
| 低密度脂蛋白胆固醇(mmol/L)a | 2.7(2.3,3.3) | 2.7(2.4,3.5) | -0.67 | 0.500 |
| 血肌酐(μmol/L)a | 68.6(55.8,83.3) | 72.9(55.9,86.5) | -0.76 | 0.449 |
| 瞳孔直径基线值(mm)a | 2.5(2.0,3.0) | 2.5(2.0,3.0) | -0.40 | 0.687 |
| 收缩压(mmHg)a | 137(126,149) | 135(126,148) | -2.23 | 0.822 |
| 舒张压(mmHg)a | 78(72,87) | 78(73,87) | -0.44 | 0.664 |
| 糖尿病病程(年)a | 10(5,20) | 10(4,20) | -0.29 | 0.770 |
| 高血压b | 0.11 | 0.798 | ||
| 是 | 194(72.4) | 80(74.1) | ||
| 否 | 74(27.6) | 28(25.9) | ||
| 吸烟b | 0.45 | 0.554 | ||
| 是 | 50(18.7) | 17(15.7) | ||
| 否 | 218(81.3) | 91(84.3) | ||
| 伴糖尿病性视网膜病变b | 1.29 | 0.275 | ||
| 是 | 185(69.0) | 68(63.0) | ||
| 否 | 83(31.0) | 40(37.0) | ||
| 降糖给药途径b | 3.77 | 0.152 | ||
| 口服 | 105(39.1) | 33(30.6) | ||
| 胰岛素治疗 | 83(31.0) | 44(40.7) | ||
| 联合用药 | 80(29.9) | 31(28.7) | ||
| 尿蛋白b | 0.36 | 0.185 | ||
| 是 | 151(56.3) | 67(62.0) | ||
| 否 | 117(43.7) | 41(38.0) |
注:aM(Q1,Q3);b 例(%);HbA1c为糖化血红蛋白;BMI为体质指数;1 mmHg=0.133 kPa
与散瞳未受限组相比,散瞳受限组患者HbA1c水平较高、糖尿病病程较长、BMI较小,瞳孔直径基线值较小,差异均有统计学意义(均P<0.05),其他临床资料两组比较差异均无统计学意义(均P>0.05)(表2)。
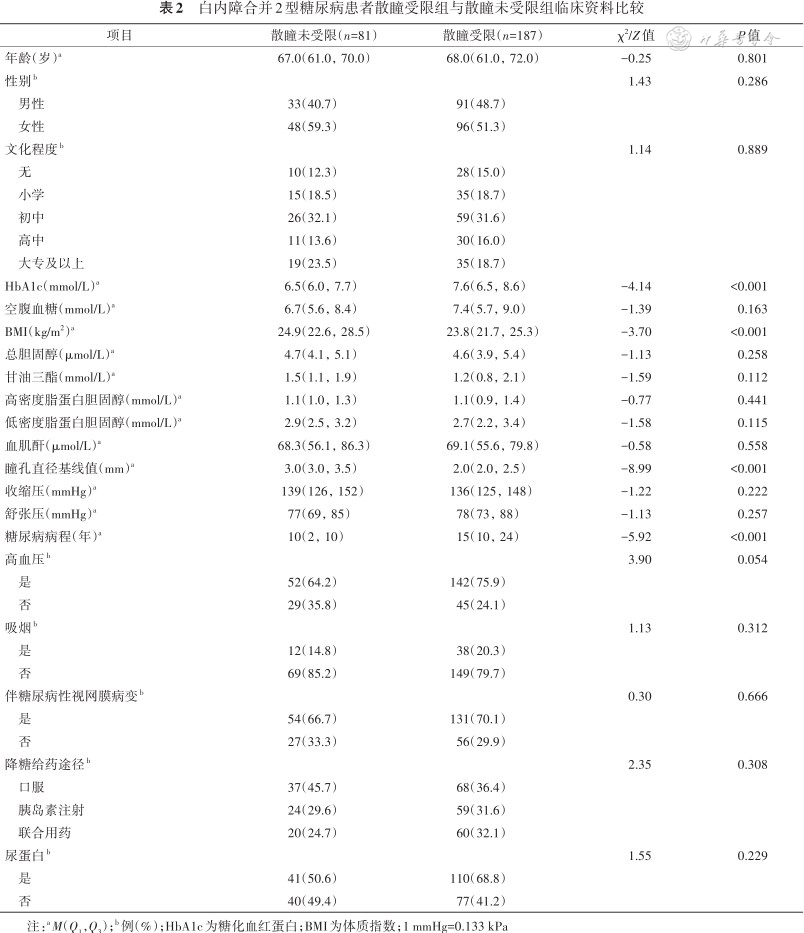
白内障合并2型糖尿病患者散瞳受限组与散瞳未受限组临床资料比较
白内障合并2型糖尿病患者散瞳受限组与散瞳未受限组临床资料比较
| 项目 | 散瞳未受限(n=81) | 散瞳受限(n=187) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 年龄(岁)a | 67.0(61.0,70.0) | 68.0(61.0,72.0) | -0.25 | 0.801 |
| 性别b | 1.43 | 0.286 | ||
| 男性 | 33(40.7) | 91(48.7) | ||
| 女性 | 48(59.3) | 96(51.3) | ||
| 文化程度b | 1.14 | 0.889 | ||
| 无 | 10(12.3) | 28(15.0) | ||
| 小学 | 15(18.5) | 35(18.7) | ||
| 初中 | 26(32.1) | 59(31.6) | ||
| 高中 | 11(13.6) | 30(16.0) | ||
| 大专及以上 | 19(23.5) | 35(18.7) | ||
| HbA1c(mmol/L)a | 6.5(6.0,7.7) | 7.6(6.5,8.6) | -4.14 | <0.001 |
| 空腹血糖(mmol/L)a | 6.7(5.6,8.4) | 7.4(5.7,9.0) | -1.39 | 0.163 |
| BMI(kg/m2)a | 24.9(22.6,28.5) | 23.8(21.7,25.3) | -3.70 | <0.001 |
| 总胆固醇(μmol/L)a | 4.7(4.1,5.1) | 4.6(3.9,5.4) | -1.13 | 0.258 |
| 甘油三酯(mmol/L)a | 1.5(1.1,1.9) | 1.2(0.8,2.1) | -1.59 | 0.112 |
| 高密度脂蛋白胆固醇(mmol/L)a | 1.1(1.0,1.3) | 1.1(0.9,1.4) | -0.77 | 0.441 |
| 低密度脂蛋白胆固醇(mmol/L)a | 2.9(2.5,3.2) | 2.7(2.2,3.4) | -1.58 | 0.115 |
| 血肌酐(μmol/L)a | 68.3(56.1,86.3) | 69.1(55.6,79.8) | -0.58 | 0.558 |
| 瞳孔直径基线值(mm)a | 3.0(3.0,3.5) | 2.0(2.0,2.5) | -8.99 | <0.001 |
| 收缩压(mmHg)a | 139(126,152) | 136(125,148) | -1.22 | 0.222 |
| 舒张压(mmHg)a | 77(69,85) | 78(73,88) | -1.13 | 0.257 |
| 糖尿病病程(年)a | 10(2,10) | 15(10,24) | -5.92 | <0.001 |
| 高血压b | 3.90 | 0.054 | ||
| 是 | 52(64.2) | 142(75.9) | ||
| 否 | 29(35.8) | 45(24.1) | ||
| 吸烟b | 1.13 | 0.312 | ||
| 是 | 12(14.8) | 38(20.3) | ||
| 否 | 69(85.2) | 149(79.7) | ||
| 伴糖尿病性视网膜病变b | 0.30 | 0.666 | ||
| 是 | 54(66.7) | 131(70.1) | ||
| 否 | 27(33.3) | 56(29.9) | ||
| 降糖给药途径b | 2.35 | 0.308 | ||
| 口服 | 37(45.7) | 68(36.4) | ||
| 胰岛素注射 | 24(29.6) | 59(31.6) | ||
| 联合用药 | 20(24.7) | 60(32.1) | ||
| 尿蛋白b | 1.55 | 0.229 | ||
| 是 | 41(50.6) | 110(68.8) | ||
| 否 | 40(49.4) | 77(41.2) |
注:aM(Q1,Q3);b 例(%);HbA1c为糖化血红蛋白;BMI为体质指数;1 mmHg=0.133 kPa
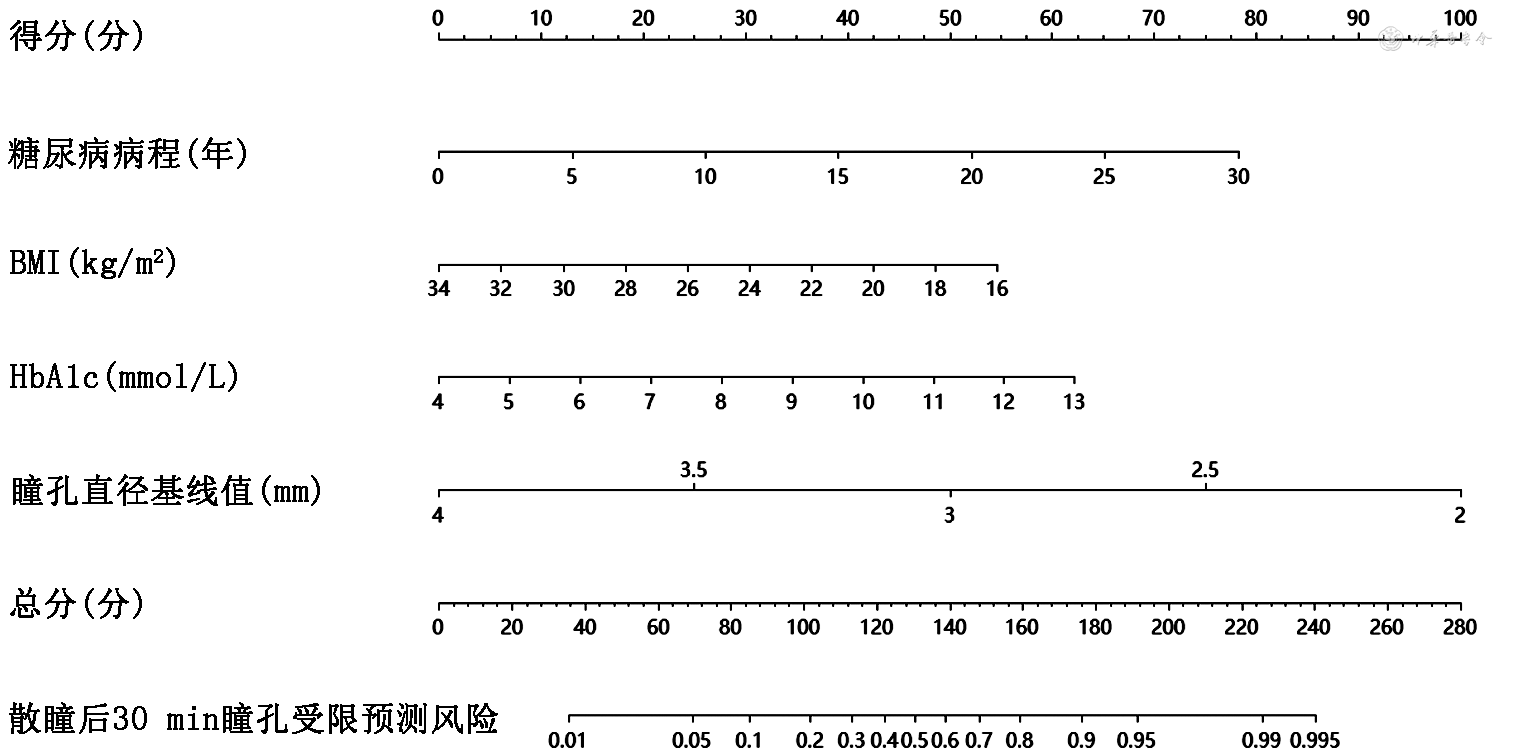
将单因素分析中P<0.05的4个因素作为自变量,以是否发生散瞳后瞳孔直径受限为因变量进行多因素logistic回归分析,结果显示,HbA1c水平、糖尿病病程、BMI及瞳孔直径基线值是药物性散瞳受限的相关因素(表3),最终构建风险预测模型。预测公式为:logit P=7.010+0.126×糖尿病病程(年)-0.147×BMI(kg/m2)+0.334×HbA1c(mmol/L)-2.416×瞳孔直径基线值(mm)。绘制可视化列线图如图1。
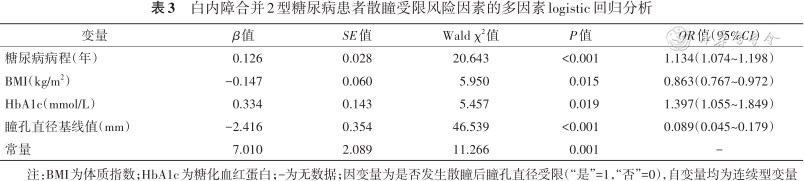
白内障合并2型糖尿病患者散瞳受限风险因素的多因素logistic回归分析
白内障合并2型糖尿病患者散瞳受限风险因素的多因素logistic回归分析
| 变量 | β值 | SE值 | Wald χ2值 | P值 | OR值(95%CI) |
|---|---|---|---|---|---|
| 糖尿病病程(年) | 0.126 | 0.028 | 20.643 | <0.001 | 1.134(1.074~1.198) |
| BMI(kg/m2) | -0.147 | 0.060 | 5.950 | 0.015 | 0.863(0.767~0.972) |
| HbA1c(mmol/L) | 0.334 | 0.143 | 5.457 | 0.019 | 1.397(1.055~1.849) |
| 瞳孔直径基线值(mm) | -2.416 | 0.354 | 46.539 | <0.001 | 0.089(0.045~0.179) |
| 常量 | 7.010 | 2.089 | 11.266 | 0.001 | - |
注:BMI为体质指数;HbA1c为糖化血红蛋白;-为无数据;因变量为是否发生散瞳后瞳孔直径受限(“是”=1,“否”=0),自变量均为连续型变量

注:BMI为体质指数;HbA1c为糖化血红蛋白
使用列线图对白内障合并2型糖尿病患者术前药物性散瞳受限风险预测流程为:(1)首先确定患者4个变量在分值刻度尺上对应的分值;(2)将4个分值相加得出总分并在总分刻度尺上找到对应位置;(3)从该位置向下画一条垂直线与百分线的交点即为术前药物性散瞳受限发生概率。
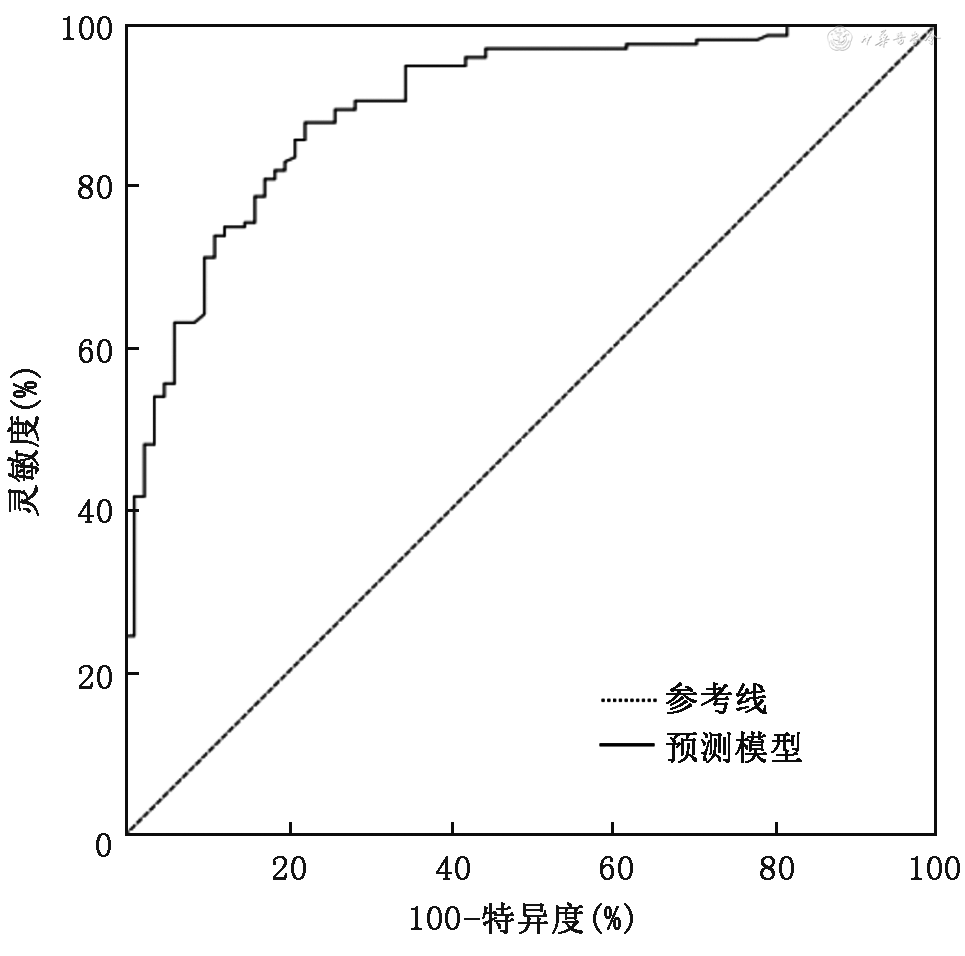
Hosmer-Lemeshow检验结果显示,χ2=6.231,P=0.621,根据预测模型绘制ROC曲线,曲线下面积为0.897(95%CI:0.857~0.937,P<0.001),约登指数最大值时(0.655),灵敏度为0.877,特异度为0.778(图2)。

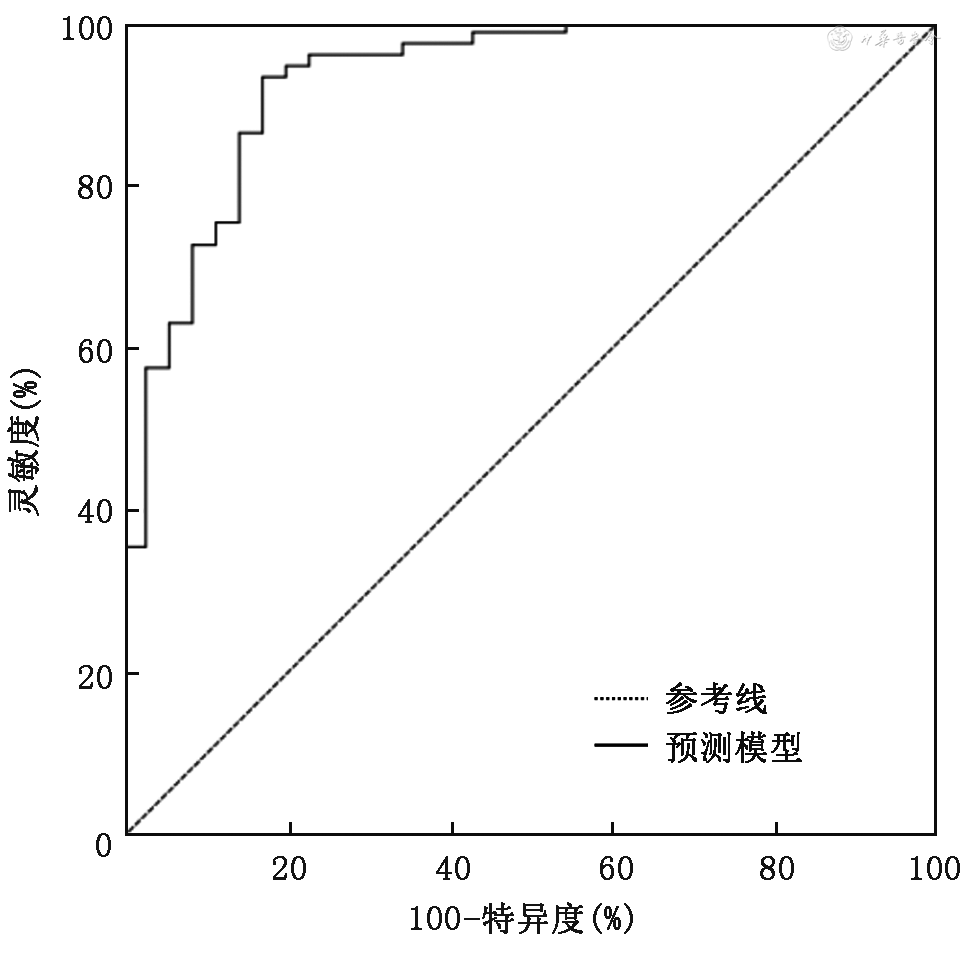
验证组中,Hosmer-Lemeshow检验结果显示,χ2=7.597,P=0.474 根据预测模型绘制ROC曲线,曲线下面积为0.928(95%CI:0.875~0.981,P<0.001),约登指数最大值时(0.761),灵敏度为0.932,特异度为0.829(图3)。108例患者中,风险预测模型判断散瞳受限69例,28例未受限,实际散瞳受限73例,35例未受限,模型误判11例,总准确率为89.8%。

散瞳是白内障手术的重要准备步骤,术前药物性散瞳受限易引起虹膜损伤、瞳孔括约肌撕裂,影响人工晶状体植入[6,16,21]。白内障合并2型糖尿病患者药物性散瞳后的瞳孔直径均值明显小于非糖尿病白内障患者[5],但有关该人群药物性散瞳受限的发生率鲜有文献报道。本研究结果显示,建模组白内障合并2型糖尿病患者散瞳受限发生率为69.8%,说明散瞳受限并非发生在所有糖尿病患者中。针对散瞳受限问题,已有学者提出通过联合用药干预提高散瞳效果,改善术前散瞳准备有效率[4],但目前临床尚缺乏特异性指标判断白内障合并2型糖尿病患者是否会出现散瞳受限,如全人群覆盖干预,存在增加药物眼表毒性风险和浪费医疗资源等问题。基于此,建立有效的预测工具帮助临床实现快速筛查、精准干预非常有必要。
构建白内障合并2型糖尿病患者术前药物性散瞳受限风险预测模型,对保障白内障手术安全性具有重要意义。本研究共筛选出4个预测因素,分别为HbA1c水平、糖尿病病程、BMI及瞳孔直径基线值,其中HbA1c水平、糖尿病病程与散瞳受限风险呈正向关系,BMI、基线瞳孔直径与散瞳受限风险呈负向关系。本研究利用R语言,通过建模组构建简单、直观、实用的列线图预测模型,经验证,该模型识别散瞳受限风险预测能力良好,总准确率达89.8%。该模型有利于临床医护人员快速、精准筛选出高危人群实施个性化干预,包括延长散瞳准备时间、联合使用非甾体类药物散瞳、术中扩瞳措施准备(如肾上腺素注入前房、推注黏弹剂、虹膜拉钩等),提高手术安全性。
既往研究显示,影响白内障合并2型糖尿病患者药物性散瞳直径的相关因素可能有HbA1c水平、糖尿病病程、糖尿病性视网膜病变等[8, 9,11]。糖尿病病程对瞳孔功能具有显著影响[5,22],与散瞳受限发生关系密切[7,23]。本研究结论与既往研究相符,2型糖尿病患者病程越长,药物性散瞳受限风险越高。这可能是由于机体长期处于高血糖状态,出现血管硬化闭塞、细胞损伤,影响神经传导速度,诱发自主神经病变[2,17],累及交感与副交感神经,使交感神经支配的瞳孔开大肌功能降低,对抗胆碱类散瞳药物的敏感性下降,引起药物性瞳孔散大受限。本研究中,白内障合并2型糖尿病患者药物性散瞳受限人群较未受限人群的BMI低。BMI与人体肌肉含量密切相关,既往研究指出,肌肉含量减少是导致糖尿病性周围神经及自主神经病变的危险因素[24]。Koenig等[25]研究发现,BMI与副交感神经活性呈负相关,BMI越高副交感神经活性越弱,乙酰胆碱释放减少,抗胆碱能药物敏感性增强,瞳孔散大不易受限;反之,BMI越低,副交感神经活性越高,患者瞳孔药物性散大困难。此外,HbA1c水平影响药物性散瞳受限的相关性已得到国内外学者的认可[7,11,22],本研究结论与其相一致,HbA1c水平越高,发生散瞳受限风险越高,主要是由于HbA1c水平持续较高的状态下,机体长期处于高糖环境中,进而降低糖尿病患者的虹膜组织弹性,从而造成散瞳困难。因此,对于白内障合并2型糖尿病患者,临床工作中可考虑将血糖管理提前至院前,关注并管理好患者术前1个月的HbA1c水平,降低对虹膜组织的影响,减少散瞳受限风险。既往研究表明,2型糖尿病患者基线瞳孔与散瞳后瞳孔直径均显著小于正常人群,且基线瞳孔直径与散瞳后瞳孔直径呈正相关[22]。本研究结论与之相符,患者基线瞳孔直径越小,发生药物性散瞳受限概率越高。
本研究存在以下不足:(1)用于建立模型的验证数据较少,需纳入更多样本量来完善模型。(2)仅单中心取样,下一步将结合多中心、大样本进行验证,进一步评估模型的实用性及科学性。
综上所述,本研究建立的白内障合并2型糖尿病患者术前药物性散瞳受限风险预测模型以临床较易获取的指标建立列线图,通过可视化量化指标呈现,可估算出患者散瞳受限发生风险,有助于医护人员快速甄别高危患者,并调整建立个性化的术前药物性散瞳方案,以改善此类患者的术前药物性散瞳达标率,对临床提高白内障合并2型糖尿病患者手术安全性有一定的参考价值。
乔丹妮, 董佩芳, 陆水花, 等. 白内障合并2型糖尿病患者术前药物性散瞳受限风险预测模型的构建及验证[J]. 中华医学杂志, 2023, 103(36): 2859-2866. DOI: 10.3760/cma.j.cn112137-20230530-00886.
所有作者声明不存在利益冲突



























