
分析不同类型及年龄阶段的冠状动脉异常主动脉起源(AAOCA)患儿的临床特点,揭示心肌缺血表现的相关因素。
纳入首都医科大学附属北京儿童医院2014年1月1日至2022年12月31日经CT冠状动脉成像确诊为AAOCA患儿,分别按AAOCA类型、年龄段、高危解剖结构分组,比较不同异常冠状动脉类型及年龄段患儿的临床特点,分析临床表现严重程度与高危解剖结构的相关性。
共纳入69例AAOCA患儿,男34例(49.3%),女35例(50.7%),首次发病年龄为(8.89±4.40)岁。其中左侧冠状动脉起源于右冠状窦(ALCA)10例(14.5%)、右侧冠状动脉起源于左冠状窦(ARCA)57例(82.6%)、冠状动脉异常起源于无冠窦2例(2.9%)。19例(27.5%)无自诉临床症状,35例(50.7%)表现为胸闷、胸痛、乏力等轻型症状,13例(18.8%)为晕厥,2例(2.9%)表现为阵发性哭闹。所有患儿经治疗后均临床症状好转出院,无死亡病例。ALCA、ARCA、冠状动脉异常起源于无冠窦3组在性别、临床表现、心肌损伤标志物阳性比例、心电图、经胸超声心动图、高危解剖结构比例上差异均无统计学意义。按年龄段分组,婴幼儿组9例(13.1%)、学龄前组11例(15.9%)、学龄组49例(71.0%),婴幼儿组和学龄前组患儿无症状比例高(P<0.001)。按是否合并高危解剖结构分组,高危组43例(62.3%),包括锐角起始2例、开口狭窄或裂隙样开口4例、动脉间走行37例;非高危组26例(37.7%)。两组比较发现合并高危解剖结构患儿症状重,易发生心源性晕厥(P<0.05)。多因素Logistic回归分析提示存在高危解剖结构为发生心源性晕厥的独立危险因素(OR=9.026,95%CI 1.071~76.084,P=0.043)。
不同类型AAOCA患儿合并高危解剖结构的比例及临床特征均无明显差异;婴幼儿可因临床症状不典型或不显著而易被漏诊;该疾病的临床症状严重程度与是否合并高危解剖结构密切相关,高危解剖结构为AAOCA患儿发生心源性晕厥的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
冠状动脉异常主动脉起源(anomalous aortic origin of a coronary artery,AAOCA)指其中一个(极少情况下可为两个)冠状动脉起源于错误的主动脉窦,是一种罕见的先天性心脏病。AAOCA以起源于对侧冠状窦为主,包括左冠状动脉异常起源于右冠状窦(anomalous origin of the left coronary artery from the right coronary artery sinus,ALCA)及右冠状动脉异常起源于左冠状窦(anomalous origin of the right coronary artery from the left coronary artery sinus,ARCA),极少情况下左冠状动脉或右冠状动脉可起源于无冠窦(仅个案报道)。儿童AAOCA患者临床表现多样,心肌损伤标志物、心电图、经胸超声心动图(transthoracic echocardiography,TTE)等常规检查结果缺乏特异性,TTE为首选筛查方法,而经CT冠状动脉成像(CT coronary angiography,CTCA)为其主要确诊方法。研究显示AAOCA是运动员和新兵心源性猝死(sudden cardiac death,SCD)的第二大原因[1]。美国心脏病学会/美国心脏协会(American College of Cardiology/American Heart Association,AHA/ACC)指南[2]指出,存在高危解剖结构、运动、心脏症状(晕厥、胸闷等)、ALCA是AAOCA发生SCD的高危因素。因此,本研究对我院69例AAOCA儿童进行回顾性研究,比较不同冠状动脉类型及年龄阶段的临床特点,分析高危解剖结构与临床表现严重程度的关系,以提高广大儿科医生对该疾病的认识。
选择首都医科大学附属北京儿童医院心脏内科2014年1月1日至2022年12月31日经CTCA确诊为AAOCA患儿69例作为研究对象。本研究患儿监护人均签署知情同意书,并经首都医科大学附属北京儿童医院医学伦理委员会批准(批号:[2023]-E-021-R)。
纳入标准:(1)年龄<18岁;(2)通过CTCA或外科手术诊断为AAOCA,包括:①ALCA;②ARCA;③冠状动脉异常起源于无冠窦。排除标准:(1)复杂性先天性心脏病(如法洛四联症、大动脉转位、肺动脉闭锁等)合并冠状动脉异常;(2)后天性冠状动脉病变。
本研究为回顾性研究,收集研究对象临床资料包括年龄、性别、临床表现、心肌损伤标志物、心电图、TTE及CTCA、治疗及预后转归。出院后随访时间为2个月至9年不等。
采用VCT64 Discovery CT750HD(GE公司,美国)扫描、重建冠状动脉及主、肺动脉图像进行诊断。采用飞利浦IE33彩色多普勒超声心动诊断仪,对患儿心脏结构、冠状动脉开口位置及分支走行情况、心脏收缩功能等进行探查。左心室射血分数≤55%定义为心功能下降。心肌损伤标志物判定方法:包括肌酸激酶同工酶、肌钙蛋白I、B型利钠肽、N末端B型利钠肽原,其中≥1种指标高于正常值定义为阳性。心电图判定:将心电图改变分为以下5类[3]:(1)心肌缺血改变:ST-T改变/病理性Q波;(2)传导系统损伤:房室传导阻滞/束支传导阻滞;(3)窦房结功能不良:窦性心动过缓/窦性停搏/窦房传导阻滞;(4)窦性心动过速;(5)期前收缩:房性早搏/室性早搏。
(1)按AAOCA类型分组:根据CTCA或外科手术结果,分为ALCA组、ARCA组及冠状动脉异常起源于无冠窦组3组。(2)按年龄段分组,分为婴幼儿组(<3岁)、学龄前组(3~6岁)及学龄组(≥6岁)3组。(3)按高危解剖结构分组:高危结构包括冠状动脉开口狭窄或裂隙样开口、动脉间走行、锐角起始、壁内走行。(4)按照临床表现是否发生晕厥,分为晕厥组和非晕厥组。
冠状动脉开口狭窄或裂隙样开口:测量异常冠状动脉开口的面积值、两个正交直径值,以异常冠状动脉起点与其返回到正确解剖位置之间距离的一半处为参考范围,评估开口是否存在狭窄。裂隙样开口定义为冠状动脉开口最大直径值超过其正交测量值的两倍以上。
动脉间走行:右前斜位CTCA可显示主动脉和肺动脉间异常冠状动脉的横截面,若其直径纵横比大于2∶1则存在明显管腔狭窄,称Cheong-Angelini征象。该征象为判断存在动脉间走行的依据。
锐角起始:即冠状动脉起始段与主动脉壁成锐角。在平行于主动脉环的平面上测量平行于冠状窦壁的线与平行于冠状动脉近端走行的线之间的夹角,若该角度<45°,则定义为锐角起始。
壁内走行:即冠状动脉走行于主动脉壁内。壁内长度为从冠状动脉口到冠状动脉不再平行于主动脉壁(离开主动脉壁)的点的长度。
采用SPSS 26.0对数据进行统计分析,计量资料采用均数±标准差(Mean±SD)表示,计数资料采用频数(百分比)表示,计数资料组间比较采用卡方检验、校正卡方、Fisher确切概率法。对单因素分析P<0.1的变量,进行多因素Logistic回归分析,以P<0.05为差异有统计学意义。
共纳入69例AAOCA患儿,男34例(49.3%),女35例(50.7%),首次发病年龄为(8.89±4.40)岁。其中ALCA 10例(14.5%)、ARCA 57例(82.6%)、左侧冠状动脉起源于无冠窦2例(2.9%)。在行CTCA确诊之前,首次就诊时误诊为心肌炎或疑似心肌炎共59例(85.5%)。
69例患儿中,19例(27.5%)无自诉临床症状,35例(50.7%)以胸闷、胸痛、乏力等轻型症状为主要表现,13例(18.8%)以晕厥等重型症状为首发症状,2例(2.9%)以阵发性哭闹等不典型症状为主诉就诊。
ALCA、ARCA、冠状动脉异常起源于无冠窦组3组在性别、临床表现、心肌损伤标志物阳性比例、心电图、TTE、高危解剖结构比例上差异均无统计学意义(P均>0.05),见表1。
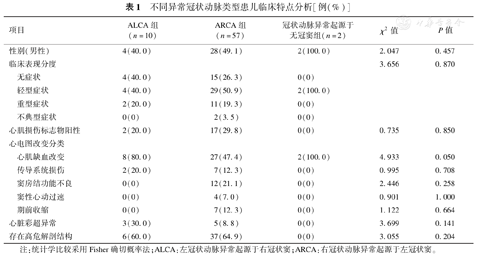
不同异常冠状动脉类型患儿临床特点分析[例(%)]
不同异常冠状动脉类型患儿临床特点分析[例(%)]
| 项目 | ALCA组(n=10) | ARCA组(n=57) | 冠状动脉异常起源于无冠窦组(n=2) | χ2值 | P值 |
|---|---|---|---|---|---|
| 性别(男性) | 4(40.0) | 28(49.1) | 2(100.0) | 2.047 | 0.457 |
| 临床表现分度 | 3.656 | 0.870 | |||
| 无症状 | 4(40.0) | 15(26.3) | 0(0) | ||
| 轻型症状 | 4(40.0) | 29(50.9) | 2(100.0) | ||
| 重型症状 | 2(20.0) | 11(19.3) | 0(0) | ||
| 不典型症状 | 0(0) | 2(3.5) | 0(0) | ||
| 心肌损伤标志物阳性 | 2(20.0) | 17(29.8) | 0(0) | 0.735 | 0.850 |
| 心电图改变分类 | |||||
| 心肌缺血改变 | 8(80.0) | 27(47.4) | 2(100.0) | 4.933 | 0.050 |
| 传导系统损伤 | 2(20.0) | 7(12.3) | 0(0) | 0.995 | 0.708 |
| 窦房结功能不良 | 0(0) | 12(21.1) | 0(0) | 2.446 | 0.258 |
| 窦性心动过速 | 0(0) | 4(7.0) | 0(0) | 0.901 | 1.000 |
| 期前收缩 | 0(0) | 7(12.3) | 0(0) | 1.122 | 0.664 |
| 心脏彩超异常 | 3(30.0) | 5(8.8) | 0(0) | 3.699 | 0.141 |
| 存在高危解剖结构 | 6(60.0) | 37(64.9) | 0(0) | 3.055 | 0.204 |
注:统计学比较采用Fisher确切概率法;ALCA:左冠状动脉异常起源于右冠状窦;ARCA:右冠状动脉异常起源于左冠状窦。
婴幼儿组和学龄前组患儿无症状比例高(P<0.001)。而不同年龄患儿在冠状动脉类型、心肌损伤标志物阳性率、心电图结果类型、心脏彩超异常、高危解剖结构比例上差异均无统计学意义(P均>0.05),见表2。
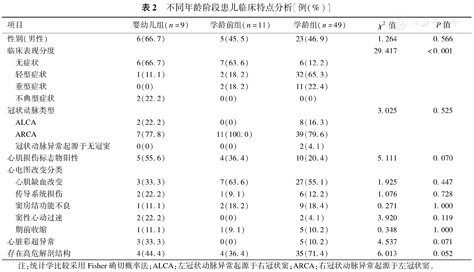
不同年龄阶段患儿临床特点分析[例(%)]
不同年龄阶段患儿临床特点分析[例(%)]
| 项目 | 婴幼儿组(n=9) | 学龄前组(n=11) | 学龄组(n=49) | χ2值 | P值 |
|---|---|---|---|---|---|
| 性别(男性) | 6(66.7) | 5(45.5) | 23(46.9) | 1.264 | 0.566 |
| 临床表现分度 | 29.417 | <0.001 | |||
| 无症状 | 6(66.7) | 7(63.6) | 6(12.2) | ||
| 轻型症状 | 1(11.1) | 2(18.2) | 32(65.3) | ||
| 重型症状 | 0(0) | 2(18.2) | 11(22.4) | ||
| 不典型症状 | 2(22.2) | 0(0) | 0(0) | ||
| 冠状动脉类型 | 3.025 | 0.525 | |||
| ALCA | 2(22.2) | 0(0) | 8(16.3) | ||
| ARCA | 7(77.8) | 11(100.0) | 39(79.6) | ||
| 冠状动脉异常起源于无冠窦 | 0(0) | 0(0) | 2(4.1) | ||
| 心肌损伤标志物阳性 | 5(55.6) | 4(36.4) | 10(20.4) | 5.111 | 0.070 |
| 心电图改变分类 | |||||
| 心肌缺血改变 | 3(33.3) | 7(63.6) | 27(55.1) | 1.925 | 0.447 |
| 传导系统损伤 | 2(22.2) | 1(9.1) | 6(12.2) | 1.076 | 0.728 |
| 窦房结功能不良 | 1(11.1) | 2(18.2) | 9(18.4) | 0.271 | 1.000 |
| 窦性心动过速 | 2(22.2) | 0(0) | 2(4.1) | 3.920 | 0.119 |
| 期前收缩 | 1(11.1) | 1(9.1) | 5(10.2) | 0.348 | 1.000 |
| 心脏彩超异常 | 3(33.3) | 0(0) | 5(10.2) | 4.537 | 0.071 |
| 存在高危解剖结构 | 4(44.4) | 4(36.4) | 35(71.4) | 6.013 | 0.052 |
注:统计学比较采用Fisher确切概率法;ALCA:左冠状动脉异常起源于右冠状窦;ARCA:右冠状动脉异常起源于左冠状窦。
高危组共纳入43例(62.3%)患儿,其中锐角起始2例、开口狭窄或裂隙样开口4例、动脉间走行37例(纳入患儿均无壁内走行);非高危组纳入26例(37.7%)。两组比较发现合并高危解剖结构患儿临床症状重,易发生心源性晕厥(P<0.05)。见表3。
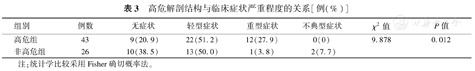
高危解剖结构与临床症状严重程度的关系[例(%)]
高危解剖结构与临床症状严重程度的关系[例(%)]
| 组别 | 例数 | 无症状 | 轻型症状 | 重型症状 | 不典型症状 | χ2值 | P值 |
|---|---|---|---|---|---|---|---|
| 高危组 | 43 | 9(20.9) | 22(51.2) | 12(27.9) | 0(0) | 9.878 | 0.012 |
| 非高危组 | 26 | 10(38.5) | 13(50.0) | 1(3.8) | 2(7.7) |
注:统计学比较采用Fisher确切概率法。
69例患儿中共13例患儿纳入晕厥组,56例患儿纳入非晕厥组。两组患儿进行单因素分析发现,AAOCA患儿发生晕厥与合并高危解剖结构相关(P=0.031),与心电图改变提示窦房结功能不良可能有关(P=0.069);而与患儿性别、年龄、AAOCA类型、心肌损伤标志物、其他心电图改变及心脏彩超异常均无明显相关性(表4)。将单因素分析P<0.1结果进行多因素Logistic回归分析,结果显示合并高危解剖结构为AAOCA患儿晕厥的独立危险因素(P<0.05),见表5。
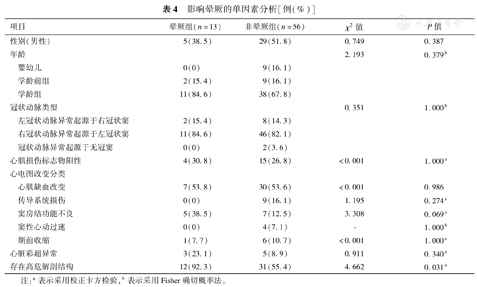
影响晕厥的单因素分析[例(%)]
影响晕厥的单因素分析[例(%)]
| 项目 | 晕厥组(n=13) | 非晕厥组(n=56) | χ2值 | P值 |
|---|---|---|---|---|
| 性别(男性) | 5(38.5) | 29(51.8) | 0.749 | 0.387 |
| 年龄 | 2.193 | 0.379b | ||
| 婴幼儿 | 0(0) | 9(16.1) | ||
| 学龄前组 | 2(15.4) | 9(16.1) | ||
| 学龄组 | 11(84.6) | 38(67.8) | ||
| 冠状动脉类型 | 0.351 | 1.000b | ||
| 左冠状动脉异常起源于右冠状窦 | 2(15.4) | 8(14.3) | ||
| 右冠状动脉异常起源于左冠状窦 | 11(84.6) | 46(82.1) | ||
| 冠状动脉异常起源于无冠窦 | 0(0) | 2(3.6) | ||
| 心肌损伤标志物阳性 | 4(30.8) | 15(26.8) | <0.001 | 1.000a |
| 心电图改变分类 | ||||
| 心肌缺血改变 | 7(53.8) | 30(53.6) | <0.001 | 0.986 |
| 传导系统损伤 | 0(0) | 9(16.1) | 1.195 | 0.274a |
| 窦房结功能不良 | 5(38.5) | 7(12.5) | 3.308 | 0.069a |
| 窦性心动过速 | 0(0) | 4(7.1) | - | 1.000b |
| 期前收缩 | 1(7.7) | 6(10.7) | <0.001 | 1.000a |
| 心脏彩超异常 | 3(23.1) | 5(8.9) | 0.911 | 0.340a |
| 存在高危解剖结构 | 12(92.3) | 31(55.4) | 4.662 | 0.031a |
注:a表示采用校正卡方检验,b表示采用Fisher确切概率法。
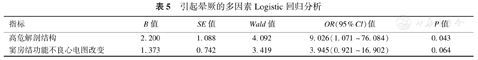
引起晕厥的多因素Logistic回归分析
引起晕厥的多因素Logistic回归分析
| 指标 | B值 | SE值 | Wald值 | OR(95%CI)值 | P值 |
|---|---|---|---|---|---|
| 高危解剖结构 | 2.200 | 1.088 | 4.092 | 9.026(1.071~76.084) | 0.043 |
| 窦房结功能不良心电图改变 | 1.373 | 0.742 | 3.419 | 3.945(0.921~16.902) | 0.064 |
69例AAOCA患儿均限制剧烈活动,住院期间予磷酸肌酸钠静点、辅酶Q10片口服营养心肌治疗;合并心脏扩大,予加用卡托普利0.5~1.0 mg/(kg·d),分2次口服,至心脏大小恢复正常后停用;平均心率快于同年龄儿童正常高值,予口服美托洛尔0.5~1.0 mg/(kg·d),分2次口服控制心率、增加冠状动脉供血;合并心功能不全,予地高辛3~6 μg/(kg·d),分2次口服强心治疗。
67例(97.1%)患儿基于家长意愿选择保守治疗,2例(2.9%)ALCA并近端走形于主动脉和肺动脉之间者行冠状动脉去顶术。所有患儿院内治疗均顺利进行并好转出院,住院期间无晕厥等心源性事件发生。其中1例手术患儿于术后16个月再次出现无诱因一过性晕厥1次,已随访67个月,未再出现晕厥等不适。余患儿未再出现晕厥。4例患儿出现心功能不全,合并左心室室壁瘤,左心室射血分数出现下降(46%~55%)。所有患儿随访期均存活,生活质量可。
AAOCA是先天性冠状动脉起源异常的一种类型,通常认为与青少年运动时SCD相关。CTCA对异常冠状动脉开口的识别及高危结构的评估准确性均较高[4],是我国诊断该疾病的主要方法。AAOCA的患病率由于纳入人群、纳入标准及诊断检查方法的不同而差异较大。以CTCA为确诊手段所统计的患病率在0.27%~2.26%[5]。虽然AAOCA在人群中真实患病率仍不明确,但ARCA通常高于ALCA[6],冠状动脉异常起源于无冠窦极为罕见,仅有个案报道[7]。本研究纳入的患儿中有57例ARCA和10例ALCA,与既往研究及AAOCA的人口统计学特点相符[8,9,10,11]。有2例(2.9%)患儿为冠状动脉异常起源于无冠窦,比例相对高,可能与数据量较少或纳入者均为因心脏症状或辅助检查异常收治入院的病患有关。此外,Krupiński等[12]以CTCA为确诊手段、成人为研究对象的研究显示,ARCA与ALCA相比更易合并裂隙样开口、动脉间走行、壁内走行等高危解剖结构。Cheezum等[5]的荟萃分析研究显示,具有动脉间走行的ARCA加权患病率比ALCA更高,而本研究中合并高危解剖结构的患儿在不同AAOCA类型中占比相当,可能与纳入人群及检查方法不同有关。
AAOCA患儿的临床表现多样且缺乏特异性,可无症状或症状不典型,也可以胸闷、胸痛、心悸、乏力起病,重者可致心源性晕厥。本研究发现,婴幼儿组和学龄前组患儿无症状比例高,且婴幼儿症状多不典型。一方面,这可能与小年龄组患儿不会表达有关,导致此类患儿更易漏诊、误诊。心电图、TTE及心肌损伤标志物提示心肌缺血可能对小年龄AAOCA患儿的诊断有所帮助,而对于有心肌缺血证据的疑似AAOCA者,待病情稳定后应尽快完善CTCA确诊。另一方面,Molossi等[13]对201例AAOCA患儿进行风险评估,将高风险定义为存在高危解剖结构以及心肌缺血的症状或证据,发现诊断时年龄较大是高危病变的预测因素之一。既往研究所统计的AAOCA引起的SCD也更常发生在青春期到成年早期。因此,心肌缺血及其症状的严重程度可能与患儿年龄正相关。这可能是由于随着年龄增长,患儿活动量显著增加,从而增加心肌耗氧量。同时对于冠状动脉走行于主动脉与肺动脉之间这一类型患儿,在运动时主动脉及肺动脉张力增高,对行走其间的冠状动脉进行双重挤压,因此易造成冠状动脉远端血流减少,导致心肌缺血,造成心绞痛及猝死。
AAOCA患者的SCD为国内外研究关注的重点。AHA/ACC指南及既往研究通常认为ALCA与SCD的高风险相关[2,5,14,15]。既往文献报道,ALCA和ARCA引起的运动员年死亡风险的估计值和敏感性分析的范围分别为0.35%(0.08%~0.9%)和0.02%(0.003 5%~0.06%)[16]。但是,最新研究更倾向于将SCD与高危解剖结构相联系而不是异常冠状动脉类型。Finocchiaro等[17]基于英国心脏病理学中心的研究发现,伴有动脉间走行的ARCA和ALCA是SCD受害者最常见的冠状动脉异常解剖类型,ALCA患者猝死通常在运动时发生,而ARCA患者更常在休息状态下。而Kurosu等[15]纳入的9例运动时猝死患儿均为动脉间走行AAOCA伴锐角起始。此外,以晕厥为首的心脏症状可能为AAOCA患儿SCD的先兆表现。Finocchiaro等[17]研究发现,37%的患者发生猝死前有晕厥、胸痛、乏力等症状,以晕厥最多见。Kurosu等[15]报道的AAOCA患儿SCD均在运动中或运动后瞬间发生,其中2例猝死前出现了晕厥,1例出现了胸痛。Molossi等[13]的风险评估中,壁内走行和运动性晕厥均是高危病变的预测因素。本研究纳入患儿均未发生SCD,但有2例ALCA和11例ARCA表现为晕厥,分别占该类型总数的20.0%和19.3%,无明显统计学差异。ALCA、ARCA、冠状动脉异常起源于无冠窦3种AAOCA类型的临床特征(临床表现、心肌损伤标志物阳性比例、心电图、心脏彩超、高危解剖结构比例)也无明显差异。但是,我们将高危解剖结构与临床表现相联系,发现合并高危解剖结构的患儿比未合并者临床症状重,更易出现晕厥,与既往研究一致[4,5,9]。但是,AAOCA患儿合并的高危解剖结构以动脉间走行为主,也有研究认为冠状动脉壁内走行、开口狭窄与患者的症状无关[18],仍需要大规模、多中心的研究来验证这种联系。我们建议临床上对于出现过胸痛、晕厥症状(特别是与运动相关的发作)的患儿,应考虑到是否为AAOCA,建议完善CTCA协诊明确是否存在冠状动脉起源异常及是否合并高危解剖结构。
高危解剖结构与临床表现关系的病理学机制尚不明确。SCD及心脏症状的出现往往与运动相关,运动可刺激心肌收缩并使主动脉扩张,从而压迫大动脉间或壁内走行冠状动脉,导致冠状动脉供血不足和心肌缺血,可引起胸痛。长期心肌缺血也可通过引起心律失常和心肌收缩力下降,导致心脏射血分数降低,进而使脑部血流灌注不足,出现晕厥发作。此外,运动期间异常冠状动脉扭转还可引起锐角起始角减小和开口狭窄增加,导致局部缺血,引起胸痛、胸闷,甚至晕厥[19]。基于AAOCA致心肌缺血的病理学机制,运动限制和药物治疗可能有一定疗效。Mery等[16]对ARCA和ALCA分别建立了内科治疗、手术、限制运动3种决策的模拟模型,发现在20岁及以下患者中,仅一小部分支持手术,绝大多数都倾向于药物治疗,而对于所有年龄段,限制运动都是一种次优策略。但是,对于儿童患者,长期的药物治疗及限制运动可导致负面情绪及心血管健康问题。根据美国胸外科协会指南[20],患有AAOCA且有疑似室性心律失常引起的缺血性胸痛或晕厥症状患者,或有SCD病史的患者,ALCA伴动脉间走行患者(无论有无症状),建议行手术治疗。因此,应根据患儿的症状、解剖及血流动力学评估结果,选择个体化治疗方案。AAOCA患儿预后差异较大,目前认为终身随访,运动试验阳性者避免剧烈运动、酌情口服β受体阻滞剂,可减少不良事件的发生[21]。本研究纳入的69例AAOCA患儿中,67例选择内科保守治疗。2例(2.9%)ALCA伴动脉间走行患儿行冠状动脉去顶术,1例预后良好,1例于术后16个月再次发生晕厥。故高危解剖结构在去顶术后常有残留,术后也可能出现心肌缺血症状及SCD[22,23],此类患儿术后需继续应用β受体阻滞剂等药物治疗,远期预后仍有待观察[24]。
综上,不同类型AAOCA患儿合并高危解剖结构的比例及其临床表现均无明显差异。但无症状患儿在小年龄组更多见、更易被漏诊。该疾病的临床症状严重程度与是否合并高危解剖结构密切相关,高危解剖结构为AAOCA患儿发生心源性晕厥的独立危险因素。因此,对于有心肌缺血证据、疑似AAOCA的患儿,建议完善CTCA以避免漏诊。对于出现过胸痛、晕厥症状(尤其是运动相关发作)的AAOCA患儿,应警惕合并高危解剖结构,需尽快评估病情并进行个体化治疗。
所有作者均声明不存在利益冲突



























