
分析社区获得性肺炎(CAP)患儿肺炎支原体(MP)感染发生与基因分型以及大环内酯类耐药基因突变分型的流行病学特征,为儿童肺炎支原体肺炎(MPP)的防治提供依据。
检测佛山市三水区妇幼保健院2018年1月至2021年12月住院的620例CAP患儿MP感染情况,对MP阳性者行P1限制性片段长度多态性分析(P1-RFLP),分析阳性者及P1 Ⅰ型、P1 Ⅱ型在不同年份、性别、年龄、季节中分布的差异。检测MP对大环内酯类药物耐药基因突变情况,分析23SrRNA结构域A2063G、A2064G突变在不同年份、性别、年龄、季节中分布的差异。
620例CAP患儿中,198例MP阳性,感染率为31.94%。2018至2021年各年MP阳性率差异不大。女性感染率高于男性。MP感染率随年龄增长逐渐升高,以学龄前期、学龄期感染率最高。夏秋季感染率明显高于春冬季。198例患儿中,P1-RFLP分型P1-Ⅰ型157例(79.29%),P1-Ⅱ型41例(20.71%)。Ⅰ型、Ⅱ型在不同年份、性别、年龄、季节中分布差异不大。对其中143例患儿行大环内酯类药物耐药检测,其中125例出现耐药,总体耐药率为87.41%。125例耐药基因突变患儿中,A2063G突变66例(52.80%),A2064G突变53例(42.40%)。耐药基因突变率及两型突变位点在不同年份、性别、年龄、季节之间分布差异不大。
本院儿童CAP中MP感染率为31.94%,以女性较为常见,以学龄前期、学龄期感染率最高,夏秋季为高发季节。P1-RFLP分型不受年度、性别、年龄、季节的影响。儿童MP耐药基因突变率居高不降,耐药基因突变分型不受年度、性别、年龄、季节的影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia,MPP)是儿童常见的肺炎,如果得不到有效的控制有可能危及生命[1]。肺炎支原体(Mycoplasma pneumoniae,MP)感染在5~15岁的儿童患病率最高,MPP占社区获得性肺炎(community acquired pneumonia,CAP)患儿的10%~40%[2]。世界各国的MP基因分型多采用P1限制性片段长度多态性分析(restriction fragment length polymorphism,P1-RFLP),P1-RFLP基因分型包括P1-Ⅰ型和P1-Ⅱ型。大环内酯类抗生素能有效抑制MP,但其耐药的出现会导致治疗失败[3]。我国儿童对大环内酯类药物的耐药性很高,统计表明大于60%的MP分离株具有耐药性[4]。MP对大环内酯类抗生素耐药绝大多数与23SrRNA结构域基因位点突变有关,突变导致大环内酯类与核糖体亲和力下降,从而引起耐药,其中A2063G、A2064G突变引起的耐药占绝大多数[5]。MP的基因分型及大环内酯类耐药的基因突变分型有助于预测感染的流行趋势,对MP感染暴发流行的菌株溯源、临床研究、疾病控制有重要意义[6]。本研究分析佛山市三水区妇幼保健院就诊的620例CAP患儿中MPP的发生率、MP基因分型及耐药基因突变分型的流行病学特征。
选择佛山市三水区妇幼保健院2018年1月至2021年12月确诊为CAP的0~17岁入院患儿620例,CAP诊断符合《儿童社区获得性肺炎诊疗规范(2019年版)》[7]。其中MP阳性患儿198例,符合《儿童肺炎支原体肺炎诊治专家共识(2015年版)》[8]诊断标准。本研究方案经佛山市三水区妇幼保健院伦理委员会审查通过(批号:伦审[2020]16号),患儿监护人知情同意并签署知情书。
采用实时荧光恒温扩增技术检测620例CAP患儿的口咽拭子,对MP阳性者采用改良的PCR-RFLP法进行P1-RFLP基因分型[9,10]。198例MP阳性患儿中,143例自愿行大环内酯类药物耐药检测,并检测MP耐药突变位点(23SrRNA A2063G、A2064G等)。MP核酸和耐药突变位点检测试剂盒购于默乐生物科技有限公司,操作参考试剂盒说明书[11]。
分析MP阳性患儿、MP基因分型及耐药基因突变在不同年份、性别、年龄、季节中分布的差异。
采用SPSS 23.0进行统计学分析,计数资料以例(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
共纳入CAP患儿620例,其中男306例,女314例;婴儿期(≤1岁)140例,幼儿期(1~3岁)142例,学龄前期(3~6岁)160例,学龄期(6~17岁)178例。MP阳性198例,感染率为31.94%。
2018至2021年,各年的MP感染阳性率差异无统计学意义(P=0.855)。女性MP感染阳性率高于男性(P<0.001)。MP感染阳性率随年龄增长逐渐升高,以学龄前期、学龄期最高(P<0.001)。夏秋季MP感染阳性率明显高于春冬季(P<0.001),见表1。
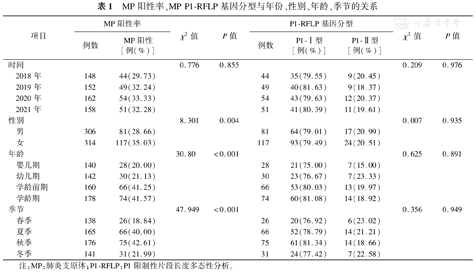
MP阳性率、MP P1-RFLP基因分型与年份、性别、年龄、季节的关系
MP阳性率、MP P1-RFLP基因分型与年份、性别、年龄、季节的关系
| 项目 | MP阳性率 | χ2值 | P值 | P1-RFLP基因分型 | χ2值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|
| 例数 | MP阳性[例(%)] | 例数 | P1-Ⅰ型[例(%)] | P1-Ⅱ型[例(%)] | |||||
| 时间 | 0.776 | 0.855 | 0.209 | 0.976 | |||||
| 2018年 | 148 | 44(29.73) | 44 | 35(79.55) | 9(20.45) | ||||
| 2019年 | 152 | 49(32.24) | 49 | 40(81.63) | 9(18.37) | ||||
| 2020年 | 162 | 54(33.33) | 54 | 43(79.63) | 12(20.37) | ||||
| 2021年 | 158 | 51(32.28) | 51 | 41(80.39) | 11(19.61) | ||||
| 性别 | 8.301 | 0.004 | 0.007 | 0.935 | |||||
| 男 | 306 | 81(28.66) | 81 | 64(79.01) | 17(20.99) | ||||
| 女 | 314 | 117(35.03) | 117 | 93(79.49) | 24(20.51) | ||||
| 年龄 | 30.80 | <0.001 | 0.625 | 0.891 | |||||
| 婴儿期 | 140 | 28(20.00) | 28 | 21(75.00) | 7(15.00) | ||||
| 幼儿期 | 142 | 30(21.13) | 30 | 23(76.67) | 7(23.33) | ||||
| 学龄前期 | 160 | 66(41.25) | 66 | 53(80.03) | 13(19.97) | ||||
| 学龄期 | 178 | 74(41.57) | 74 | 60(81.08) | 14(18.92) | ||||
| 季节 | 47.949 | <0.001 | 0.356 | 0.949 | |||||
| 春季 | 138 | 26(18.84) | 26 | 20(76.92) | 6(23.02) | ||||
| 夏季 | 165 | 66(40.00) | 66 | 52(78.79) | 14(21.21) | ||||
| 秋季 | 176 | 75(42.61) | 75 | 61(81.34) | 14(18.66) | ||||
| 冬季 | 141 | 31(21.99) | 31 | 24(77.42) | 7(22.58) | ||||
注:MP:肺炎支原体;P1-RFLP:P1限制性片段长度多态性分析。
198例患儿中,P1-Ⅰ型157例(79.29%),P1-Ⅱ型41例(20.71%)。Ⅰ型、Ⅱ型在不同年份、性别、年龄、季节中的分布差异无统计学意义(均P>0.05),见表1。
在143例检测MP耐药基因的患儿中,125例出现耐药基因突变,总体突变率为87.41%。2018至2021年耐药基因突变率差异无统计学意义(P均>0.05)。MP耐药基因突变在不同性别和季节中差异无统计学意义(P均>0.05)。学龄前期、学龄期MP耐药基因突变率最高,婴儿期最低,但各年龄组耐药基因突变率差异无统计学意义(P=0.495)。见表2。
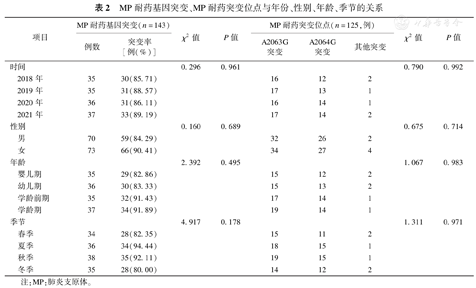
MP耐药基因突变、MP耐药突变位点与年份、性别、年龄、季节的关系
MP耐药基因突变、MP耐药突变位点与年份、性别、年龄、季节的关系
| 项目 | MP耐药基因突变(n=143) | χ2值 | P值 | MP耐药突变位点(n=125,例) | χ2值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|
| 例数 | 突变率[例(%)] | A2063G突变 | A2064G突变 | 其他突变 | |||||
| 时间 | 0.296 | 0.961 | 0.790 | 0.992 | |||||
| 2018年 | 35 | 30(85.71) | 16 | 12 | 2 | ||||
| 2019年 | 35 | 31(88.57) | 17 | 13 | 1 | ||||
| 2020年 | 36 | 31(86.11) | 16 | 14 | 1 | ||||
| 2021年 | 37 | 33(89.19) | 17 | 14 | 2 | ||||
| 性别 | 0.160 | 0.689 | 0.675 | 0.714 | |||||
| 男 | 70 | 59(84.29) | 32 | 26 | 2 | ||||
| 女 | 73 | 66(90.41) | 34 | 27 | 4 | ||||
| 年龄 | 2.392 | 0.495 | 1.067 | 0.983 | |||||
| 婴儿期 | 35 | 29(82.86) | 15 | 12 | 2 | ||||
| 幼儿期 | 36 | 30(83.33) | 15 | 13 | 2 | ||||
| 学龄前期 | 35 | 32(91.43) | 17 | 14 | 1 | ||||
| 学龄期 | 37 | 34(91.89) | 19 | 14 | 1 | ||||
| 季节 | 4.917 | 0.178 | 1.311 | 0.971 | |||||
| 春季 | 34 | 28(82.35) | 15 | 11 | 2 | ||||
| 夏季 | 36 | 34(94.44) | 18 | 15 | 1 | ||||
| 秋季 | 38 | 35(92.11) | 19 | 15 | 1 | ||||
| 冬季 | 35 | 28(80.00) | 14 | 12 | 2 | ||||
注:MP:肺炎支原体。
125例大环内酯类耐药患儿中,A2063G突变66例(52.80%),A2064G突变53例(42.40%)。两型在不同年份、性别、年龄、季节中分布差异无统计学意义(P>0.05),见表2。
MP是全世界CAP的常见病原,已成为儿童CAP中仅次于肺炎链球菌的第二大致病菌[12]。40%以上的儿童CAP由MP引起[13]。有研究显示,MPP在儿童大叶性肺炎中发病率为42.03%[14]。MPP是最常见的儿童CAP之一,也是导致儿童死亡的重要原因。MP导致的坏死性肺炎常见于学龄前和学龄期儿童,热程及住院时间长[15]。
本研究显示MPP占CAP的31.94%,这与相关研究报道一致[16]。虽然各年MPP的占比差异不大,但是女性感染率高于男性,可能与男女体内激素水平不同有关[16]。MPP发病率随着年龄的增长逐渐升高,以学龄前期、学龄期最高,可能与学龄前期、学龄期儿童开始进入学校,环境人口密度大,容易感染有关[17]。有研究显示,与其他CAP患儿相比,MPP患儿年龄更大,出现发热和咳嗽症状的时间延长[18]。MP是6岁以上儿童肺炎的主要病原[19]。本地区夏秋季节气温较高,使用空调较多,容易引起MP感染,可能是MP感染率夏秋季高于春冬季的原因之一[20,21,22,23]。
MP基因分型有助于预测感染的流行趋势,对临床研究和治疗有重要意义[6]。目前,P1-RFLP分型是最常用于MP基因分型的方法之一[24]。据报道,P1-Ⅰ型与发热、重症表现、其他肺外表现等存在一定相关性[6,25,26]。一项研究对356例P1-Ⅰ型和126例P1-Ⅱ型MP感染患儿的临床表现进行分析发现,P1-Ⅱ型MP感染患儿的神经和心血管症状较多,但感染P1-Ⅰ型MP者有其他临床表现,表明不同类型的MP可能具有不同的致病性[27]。这进一步说明基因分型对于流行病学研究和有效疫苗的开发至关重要。对MP基因分型和抗生素敏感性分析的研究表明,MP不同的P1-RFLP基因类型可能在一定程度上与大环内酯类药物耐药有关,P1-Ⅱ型菌株可能对大环内酯类药物更敏感[28]。
2017至2018年对中国吉林、济南等5个城市的154株分离株进行基因分型分析发现,P1-Ⅰ型占76.6%,P1-Ⅱ型占23.4%[29]。2019年中国青岛MP P1-Ⅰ型占57.1%[30]。因此,P1-Ⅰ型是上述几个地区的流行基因型。本研究中198例患儿MP P1-Ⅰ型占79.29%,P1-Ⅱ型占20.71%,符合我国目前的流行病学特征;而且P1-Ⅰ型、P1-Ⅱ型在不同年份、性别、年龄、季节中的分布差异不大。
近10年,全球已有大量MP对大环内酯类药物耐药的报道,对大环内酯类耐药的MP感染率呈全球性增长[18],特别是在亚洲国家[31]。据报道,在亚洲的某些地区,耐药率超过90%,在韩国耐药率为87.2%[32]。而在北美和欧洲,耐药率也达到25%[18]。本研究显示,143例患儿中,125例出现耐药基因突变,总体耐药基因突变率为87.41%,与亚洲的高耐药率相近。MP的耐药基因突变率在不同年份、性别、年龄和季节中差异不大。
研究发现,MP对大环内酯类耐药主要机制是23SrRNA V区突变,导致药物与核糖体之间的亲和力降低,从而导致耐药性,其中A2063G和A2064G突变导致高水平耐药,是最常见的突变位点,而A2067G和C2617G突变与较低耐药相关,而且少见[33,34]。2063位点由A突变到G会导致其对14、15元环大环内酯类药物具有高抗药性[35]。2064位点突变则对14、16元环大环内酯类药物耐药[36]。
有研究显示,湖南地区有52.1%的MP耐药中出现A2063G基因突变,出现突变的患儿发热时间和住院时间有所延长[36]。厦门地区2063位点突变占MP耐药相关位点突变的77%~80%,2064位点突变仅占10%左右,2067、2617位点突变也有个别报道[37]。不同地区的用药习惯差异可能导致耐药位点不同,因此,有必要对不同地区的MP感染进行流行病学监测。
本研究125例MP基因突变导致耐药患儿,A2063G突变66例(52.80%)、A2064G突变53例(42.40%)。两型在不同年份、性别、年龄、季节中分布的差异不大。
总之,了解CAP患儿中MP感染与基因分型和大环内酯类耐药与基因突变分型的流行病学特征对疾病预防和治疗有重要意义。临床医师应该对本院MP感染耐药情况及基因分型进行分析及判断,对MPP选择合适的抗生素和治疗措施,从而缩短治疗及住院时间并改善预后。
所有作者均声明不存在利益冲突



























