
评估肝动脉栓塞术(TAE)治疗神经内分泌肿瘤肝转移(NENLM)患者的疗效,分析患者预后及影响因素。
回顾性分析2018年1月至2022年3月在南京医科大学第一附属医院接受TAE治疗的NENLM患者的临床资料,根据实体瘤反应评价标准及不良事件通用术语标准评价TAE术后客观缓解率(ORR)、疾病控制率(DCR)及不良事件发生率,用中位总生存期(mOS)、中位无进展生存期(mPFS)评价患者预后,采用Kaplan-Meier法绘制生存曲线;多因素Cox回归分析预后的影响因素。
共纳入39例NENLM患者,年龄(53.3±10.3)岁(23~74岁),男23例,女16例。其中9例为功能性神经内分泌肿瘤。原发部位位于消化系统的有31例,原发灶WHO分级为G1、G2级的共有32例。肝转移瘤血供丰富者有27例,13例患者肝肿瘤负荷>50%。30例患者联合长效生长抑素类似物(SSA)治疗。39例患者共行123次TAE,ORR为38.5%(15/39),DCR为76.9%(30/39)。围手术期无4~5级严重不良事件发生。中位随访时间38.7(95%CI:31.3~46.1)个月,mOS为37.3(95%CI:27.0~47.5)个月,mPFS为12.6(95%CI:7.1~18.1)个月。多因素Cox回归分析发现,联合长效SSA治疗是患者总生存期长的影响因素(HR=0.207,95%CI:0.076~0.567,P=0.002)。
TAE能有效降低NENLM患者肝转移瘤负荷,联合长效SSA治疗可提高患者的总生存期。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)是起源于全身神经内分泌细胞,能够分泌肽类激素及生物活性胺的一类实体肿瘤,约70%原发于胃、肠、胰等消化器官,即胃肠胰NENs(gastroenteropancreatic NENs,GEP-NENs)[1]。既往认为NENs是罕见病,但近40年来其发病率持续上升,2016年美国NENs发病率约为8.4/10万,较40年前增长近8倍[2]。GEP-NENs包括高分化的神经内分泌瘤(neuroendocrine tumor,NET)和低分化的神经内分泌癌(neuroendocrine carcinoma,NEC),G1、G2级NET恶性程度相对低,无转移患者的总生存期(OS)可达30年[3]。然而,28%~77%的NENs患者在病程中发生NENs肝转移(NENs liver metastases,NENLM),中位总生存期(median overall survival,mOS)可急剧缩短至5~57个月,是患者预后不良的因素之一[4, 5, 6]。除极少数低、中级别NENLM符合根治性切除术或减瘤术适应证外,大多数患者需接受肝脏局部治疗和全身治疗[7, 8]。肝导向疗法包括射频消融、动脉栓塞术(transarterial embolization,TAE)、动脉化疗栓塞术(transarterial chemoembolization,TACE)以及放射性栓塞术(transarterial radioembolization,TARE)。射频消融常无法完全消融>3 cm的肝转移灶,限制了其临床应用[9, 10]。尚无临床试验支持TACE、TARE在治疗NENLM的患者时较TAE具有明显优势,且TACE的化疗药物选择无统一标准,TARE费用昂贵,故目前仍以TAE临床应用最多[11]。但因NENs发病率低,患者分散,国内对于TAE治疗NENLM的研究报道较少。本研究基于单中心的NENLM患者数据,在评估TAE疗效及安全性的基础上,进一步分析患者预后及影响因素,探讨TAE在NENLM患者综合治疗中的价值。
病例系列研究。纳入2018年1月至2022年3月在南京医科大学第一附属医院神经内分泌肿瘤诊治中心接受TAE治疗的39例NENLM患者。纳入标准:(1)肝穿刺活检或外科手术标本经病理学检查确诊为NENLM;(2)由多学科团队讨论,无外科手术指征;(3)体力状况(performance status,PS)评分≤2分;(4)心、肺、肝、肾脏等重要器官功能可耐受肝脏介入治疗;(5)TAE治疗前后均完善肝脏增强CT检查,可对比进行疗效评价。排除标准:(1)既往曾接受TACE、射频消融等其他肝脏局部治疗;(2)重要器官(心、肺、肝、肾脏等)功能不全;(3)TAE治疗前后影像学资料缺失,无法进行疗效评价。本研究经南京医科大学第一附属医院伦理委员会批准实施(伦理号:2023-SR-154)。所有患者在接受TAE或全身治疗前均签署了相关知情同意书。
通过南京医科大学第一附属医院住院患者信息系统收集患者资料,包括年龄、性别、原发部位、原发灶分级、Ki-67指数、肝转移瘤负荷、肝转移瘤血供情况、肝外转移情况、原发灶外科手术史和全身治疗情况等。分级参考2019年WHO标准,Ki-67<3%为G1级,Ki-67介于4%~20%为G2级,Ki-67>20%为G3级[12]。选择10%作为Ki-67的截断值,评价其对患者预后的影响[13, 14]。对于肝转移瘤血供的评估依赖于肝脏多期增强CT,若病灶在动脉期强化,认为其血供丰富;若病灶在动脉期密度低于正常肝实质,认为其乏血供[15]。根据CT或MRI影像对肝转移瘤占肝脏总体积的百分比进行评估,定义<25%为低负荷,25%~50%为中负荷,>50%为高负荷[16]。
患者取仰卧位,术中予以心电监护。消毒铺巾,在局部麻醉下穿刺右股动脉,置入4 F或5 F导管鞘,经鞘插管,进入肝总动脉,利用数字减影血管造影探查肿瘤血供及染色情况。以3 F微导管超选插入肝左、右动脉肿瘤供血分支,透视下经微导管缓慢注射100~300 μm Emspheres(美国Merit Medical Systems公司),直至造影显示肿瘤供血动脉闭塞,肿瘤染色基本消失。术毕,退出导管并拔除导管鞘,右股动脉压迫止血,局部加压包扎。所有患者在TAE治疗前1 h至治疗后48 h内静脉应用短效生长抑素类似物(somatostatin analogue,SSA),0.6 g/次,1次/12 h。术后根据患者症状予对症支持处理。4~6周后若患者条件允许,可重复TAE治疗,直至肝内病灶出现缓解或进展。
1.主要终点:mOS和中位无进展生存期(median progression-free survival,mPFS)。OS指首次接受TAE治疗至死亡或末次随访的时间;PFS指首次接受TAE治疗至肝内病灶进展或死亡的时间。
2.次要终点:客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)。将初次TAE治疗前1周内的肝脏增强CT作为基线资料,术后1~3个月内相同方式复查。依照2009年修订的实体瘤反应评价标准(RECIST1.1)[17]评价TAE术后疗效,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),并计算ORR和DCR。
3.安全性:依据不良事件通用术语标准(CTCAE v 5.0)[18]评估TAE术后各器官系统并发症,并根据其严重程度进行分级。1~2级:轻、中度,借助工具的日常生活活动受到限制;3级:重度,自理性的日常生活活动受到限制;4级:危及生命,需要紧急治疗;5级:死亡。
利用SPSS 26.0软件进行数据处理。符合正态分布的计量资料用表示,计数资料用例(%)表示。使用Kaplan-Meier法计算OS和PFS,并绘制生存曲线,并行log-rank检验;单因素及多因素Cox回归分析预后的影响因素。双侧检验,检验水准α=0.05。
共纳入39例NENLM患者,年龄(53.3±10.3)岁(23~74岁),男23例,女16例。其中9例为功能性NENs。肿瘤原发部位包括消化系统31例(胰腺15例、直肠14例、小肠2例),非消化系统8例(呼吸系统5例、3例原发部位不明)。原发灶WHO分级G1、G2、G3级分别有4、28和7例。25例患者发生肝外转移,肝外转移主要分布在淋巴结、骨、腹腔等部位。其中27例患者肝转移瘤血供丰富,13例患者肝肿瘤负荷>50%。TAE术前接受过原发灶切除的患者有21例。全身治疗中,以长效SSA的应用最为普遍,有30例(表1)。
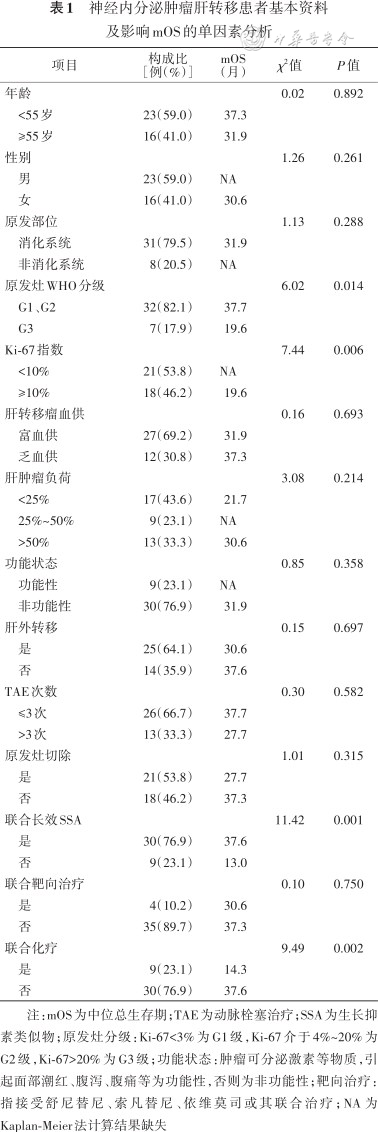
神经内分泌肿瘤肝转移患者基本资料及影响mOS的单因素分析
神经内分泌肿瘤肝转移患者基本资料及影响mOS的单因素分析
| 项目 | 构成比[例(%)] | mOS(月) | χ2值 | P值 |
|---|---|---|---|---|
| 年龄 | 0.02 | 0.892 | ||
| <55岁 | 23(59.0) | 37.3 | ||
| ≥55岁 | 16(41.0) | 31.9 | ||
| 性别 | 1.26 | 0.261 | ||
| 男 | 23(59.0) | NA | ||
| 女 | 16(41.0) | 30.6 | ||
| 原发部位 | 1.13 | 0.288 | ||
| 消化系统 | 31(79.5) | 31.9 | ||
| 非消化系统 | 8(20.5) | NA | ||
| 原发灶WHO分级 | 6.02 | 0.014 | ||
| G1、G2 | 32(82.1) | 37.7 | ||
| G3 | 7(17.9) | 19.6 | ||
| Ki-67指数 | 7.44 | 0.006 | ||
| <10% | 21(53.8) | NA | ||
| ≥10% | 18(46.2) | 19.6 | ||
| 肝转移瘤血供 | 0.16 | 0.693 | ||
| 富血供 | 27(69.2) | 31.9 | ||
| 乏血供 | 12(30.8) | 37.3 | ||
| 肝肿瘤负荷 | 3.08 | 0.214 | ||
| <25% | 17(43.6) | 21.7 | ||
| 25%~50% | 9(23.1) | NA | ||
| >50% | 13(33.3) | 30.6 | ||
| 功能状态 | 0.85 | 0.358 | ||
| 功能性 | 9(23.1) | NA | ||
| 非功能性 | 30(76.9) | 31.9 | ||
| 肝外转移 | 0.15 | 0.697 | ||
| 是 | 25(64.1) | 30.6 | ||
| 否 | 14(35.9) | 37.6 | ||
| TAE次数 | 0.30 | 0.582 | ||
| ≤3次 | 26(66.7) | 37.7 | ||
| >3次 | 13(33.3) | 27.7 | ||
| 原发灶切除 | 1.01 | 0.315 | ||
| 是 | 21(53.8) | 27.7 | ||
| 否 | 18(46.2) | 37.3 | ||
| 联合长效SSA | 11.42 | 0.001 | ||
| 是 | 30(76.9) | 37.6 | ||
| 否 | 9(23.1) | 13.0 | ||
| 联合靶向治疗 | 0.10 | 0.750 | ||
| 是 | 4(10.2) | 30.6 | ||
| 否 | 35(89.7) | 37.3 | ||
| 联合化疗 | 9.49 | 0.002 | ||
| 是 | 9(23.1) | 14.3 | ||
| 否 | 30(76.9) | 37.6 |
注:mOS为中位总生存期;TAE为动脉栓塞治疗;SSA为生长抑素类似物;原发灶分级:Ki-67<3%为G1级,Ki-67介于4%~20%为G2级,Ki-67>20%为G3级;功能状态:肿瘤可分泌激素等物质,引起面部潮红、腹泻、腹痛等为功能性,否则为非功能性;靶向治疗:指接受舒尼替尼、索凡替尼、依维莫司或其联合治疗;NA为Kaplan-Meier法计算结果缺失
39例NENLM患者共接受123次TAE治疗,治疗间隔时间为1~3个月。9例功能性患者均获得不同程度的缓解。RECIST1.1疗效评估结果为PR 15例(38.5%)、SD 15例(38.5%)、PD 9例(23.1%)。ORR为38.5%(15/39),DCR为76.9%(30/39)。
所有患者治疗过程顺利,未发生围手术期死亡。34例患者发生术后不良事件,均为1~3级,包括30例栓塞后综合征、2例血小板下降、1例血压升高及1例急性胆囊炎。30例发生栓塞后综合征患者以一过性转氨酶升高及肝区疼痛为主要表现,其次是发热、恶心呕吐,症状具有自限性或经镇痛、退热、护胃、止吐等治疗好转。血压升高及血小板下降的患者分别经静脉予以降压药物、血小板生成素后好转。1例急性胆囊炎患者经抗感染、胆囊穿刺引流等治疗后好转(表2)。
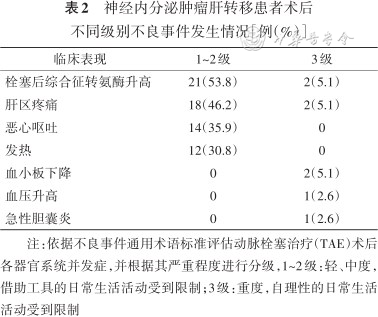
神经内分泌肿瘤肝转移患者术后不同级别不良事件发生情况[例(%)]
神经内分泌肿瘤肝转移患者术后不同级别不良事件发生情况[例(%)]
| 临床表现 | 1~2级 | 3级 |
|---|---|---|
| 栓塞后综合征转氨酶升高 | 21(53.8) | 2(5.1) |
| 肝区疼痛 | 18(46.2) | 2(5.1) |
| 恶心呕吐 | 14(35.9) | 0 |
| 发热 | 12(30.8) | 0 |
| 血小板下降 | 0 | 2(5.1) |
| 血压升高 | 0 | 1(2.6) |
| 急性胆囊炎 | 0 | 1(2.6) |
注:依据不良事件通用术语标准评估动脉栓塞治疗(TAE)术后各器官系统并发症,并根据其严重程度进行分级,1~2级:轻、中度,借助工具的日常生活活动受到限制;3级:重度,自理性的日常生活活动受到限制
所有患者随访至2023年3月31日,中位随访时间38.7(95%CI:31.3~46.1)个月。共18例患者死亡,死因均系肿瘤进展。患者mPFS为12.6(95%CI:7.1~18.1)个月,mOS为37.3(95%CI:27.0~47.5)个月(图1A、1B)。其中30例联合长效SSA治疗的患者mOS为37.6(95%CI:20.6~54.0)个月,优于9例未联合治疗患者的13.0(95%CI:11.8~14.3)个月(P=0.001,图1C)。
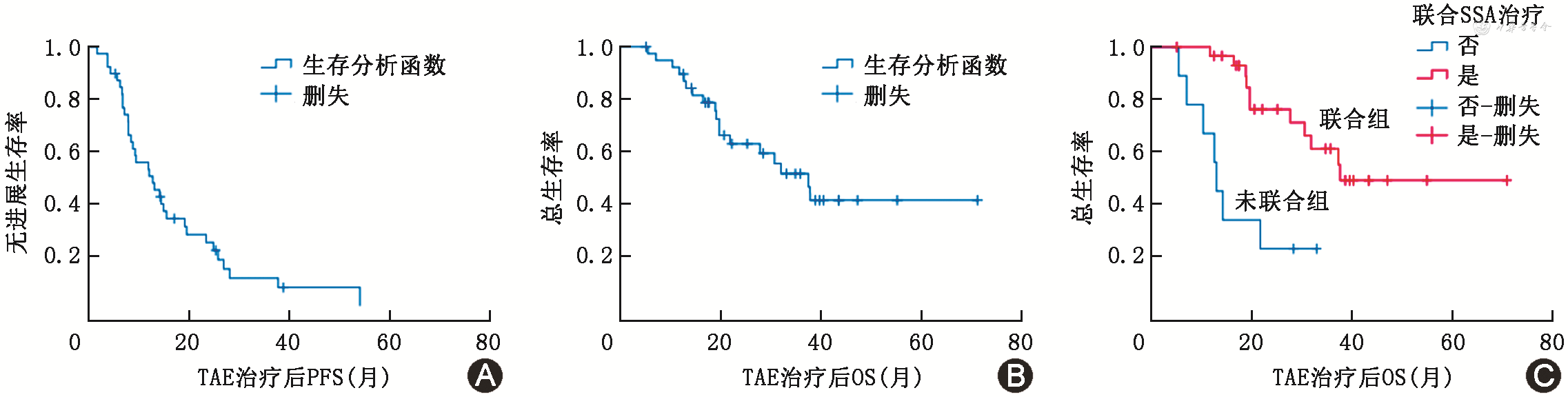

注:TAE为动脉栓塞治疗;PFS为无进展生存期;OS为总生存期
单因素分析显示,影响mOS的因素包括原发灶WHO分级、Ki-67指数、联合长效SSA治疗及联合化疗,并将肝转移瘤血供、肝肿瘤负荷、原发灶是否切除等因素均纳入Cox回归模型进行多因素分析。结果显示,联合长效SSA治疗是mOS的影响因素(HR=0.207,95%CI:0.076~0.567,P=0.002)(表3)。
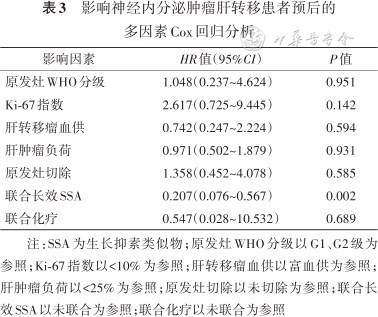
影响神经内分泌肿瘤肝转移患者预后的多因素Cox回归分析
影响神经内分泌肿瘤肝转移患者预后的多因素Cox回归分析
| 影响因素 | HR值(95%CI) | P值 |
|---|---|---|
| 原发灶WHO分级 | 1.048(0.237~4.624) | 0.951 |
| Ki-67指数 | 2.617(0.725~9.445) | 0.142 |
| 肝转移瘤血供 | 0.742(0.247~2.224) | 0.594 |
| 肝肿瘤负荷 | 0.971(0.502~1.879) | 0.931 |
| 原发灶切除 | 1.358(0.452~4.078) | 0.585 |
| 联合长效SSA | 0.207(0.076~0.567) | 0.002 |
| 联合化疗 | 0.547(0.028~10.532) | 0.689 |
注:SSA为生长抑素类似物;原发灶WHO分级以G1、G2级为参照;Ki-67指数以<10%为参照;肝转移瘤血供以富血供为参照;肝肿瘤负荷以<25%为参照;原发灶切除以未切除为参照;联合长效SSA以未联合为参照;联合化疗以未联合为参照
NENs发病率逐年升高,但临床仍少见,且大多是非功能性的,不易早期诊断与治疗。分别有21%、30%、50%的G1、G2、G3级患者在初诊时即已发生肝转移[4,19, 20],本研究中,发生肝转移的患者占71.8%。肝转移是影响NENs患者预后的重要危险因素,不伴肝转移的患者5年生存率为75%~99%,远高于NENLM患者的13%~54%[8]。仅约10%的NENLM患者为低级别分化,有条件接受肝切除手术[21],其余NENLM为中高级别,肝转移瘤呈Ⅱ型及Ⅲ型分布,治疗手段匮乏。
TAE、TACE、TARE作为目前三种主要的介入方式,栓塞介质有所差异。TACE的栓塞剂中混合了铂类、多柔比星、丝裂霉素或链脲霉素等一种或多种细胞毒性抗肿瘤药物;TARE则是将嵌入了放射性粒子钇-90(yttrium-90,90Y)或钬-166(holmium-166,166Ho)的陶瓷、玻璃或树脂聚合物小微球选择性注入肿瘤供血动脉,达到近距离放射的目的。在一项纳入了101个研究的荟萃分析中,接受TARE、TAE、TACE治疗的NENLM患者症状缓解率分别为77.4%、60.0%、47.2%,而三者生存结局间的差异无统计学意义[11]。但相较于TACE和TARE,TAE不良反应较轻,患者耐受性更高,几乎无长期毒性,所以目前临床实践中仍较多应用TAE治疗。
TAE能迅速降低NENLM患者肝转移瘤的负荷,临床疗效确切。国外多项研究报道,NENLM患者TAE术后症状改善率达80%~91%,DCR达77%~100%,mOS为24~44个月[22, 23, 24, 25, 26]。本研究中39例患者DCR为76.9%,mOS为37.3个月。TAE的主要栓塞材料有碘油、微球、聚乙烯醇颗粒、明胶海绵颗粒,在栓塞剂粒径的选择上,Zener等[26]报道,相较于直径>100 μm的颗粒,≤100 μm的小粒径固体栓塞剂在提高客观反应率的同时,并不增加并发症的发生率。小颗粒介质固然栓塞更加充分,但一次性大量注入可增加肺栓塞风险[27]。故出于安全考虑,本研究采用100~300 μm的栓塞微球。
大多数患者对TAE治疗耐受性良好。既往研究报道的术后不良反应主要是栓塞后综合征,但仍需警惕个别患者发生肝脓肿、胆囊坏死、肠缺血和肝功能不全的可能[22,26,28, 29]。此外,在治疗功能性NENs时还可能发生类癌综合征(carcinoid syndrome,CS),甚至发生类癌危象,严重时危及生命[30]。本研究中1例患者肝转移灶靠近胆囊动脉,在TAE治疗后发生胆囊动脉异位栓塞,诱发急性胆囊炎,经积极治疗后好转出院;因研究中TAE术前术后均静脉使用短效SSA,故治疗中并未发生类癌危象。
多因素Cox回归分析显示联合长效SSA治疗是NENLM患者OS的预测因素,联合长效SSA治疗的患者mOS较未联合治疗患者延长(P=0.001)。SSA是最常用的控制CS的药物,而Rinke等[31]的研究肯定了长效奥曲肽对于高分化转移性NENs的抗肿瘤增殖作用。目前有关TAE及长效SSA联合治疗NENLM的研究较少,TAE局部抗肿瘤增殖作用与SSA全身作用协同,或能更好控制NENLM进展。TAE通过阻塞肝动脉分支使富血供肿瘤缺血缺氧,而大部分NENLM血供丰富,理论上对治疗更加敏感[15]。Marrache等[32]报道增强CT表现为动脉期强化的NENLM在介入治疗后可获得更好的疗效。Liu等[33]对50例接受介入治疗的NENLM患者进行了生存分析,发现肿瘤血供与患者生存获益呈正相关。本研究中,虽然27例(69.2%)NENLM为富血供型,但富血供与乏血供NENLM患者mOS间的差异无统计学意义,这可能与样本量较少相关。国内学者也有研究指出,TAE对乏血供型NENLM同样疗效显著,ORR为66.7%~85.7%,DCR为92.9%[34]。
本研究存在一定局限性。首先,作为单中心回顾性分析,样本量较少,可能导致结果存在偏倚;其次,NENs异质性高,而本研究纳入的NENLM患者大多为G1、G2级,G3级NET及NEC患者的临床诊治有待进一步探讨。
综上,TAE是NENLM患者综合治疗中的重要手段,对于晚期不能手术切除的NENLM患者,TAE安全可行,创伤较小的同时能有效降低肝转移瘤负荷。对于低中级别NENLM患者,TAE联合长效SSA治疗使患者生存获益。未来还需要更大规模的临床病例以及更长的随访时间进一步探讨TAE及其联合全身治疗在NENLM患者多学科治疗中的价值。
张扬, 徐瑞彤, 柏建安, 等. 肝动脉栓塞术治疗神经内分泌肿瘤肝转移患者的疗效、预后和影响因素分析[J]. 中华医学杂志, 2023, 103(37): 2952-2958. DOI: 10.3760/cma.j.cn112137-20230512-00776.
所有作者声明不存在利益冲突



























