
骨质疏松症是威胁老年人健康的常见疾病之一,随着人口老龄化的进展,其发病率逐年升高。骨质疏松症表现为骨量减少、易发骨折,影像学检查在其防治中发挥着重要作用,主要包括X线光片、双能X射线吸收法、常规CT、定量超声、定量计算机断层扫描、磁共振成像等,该文就上述影像学检查技术在骨质疏松症诊断与评估中的应用进行介绍。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨质疏松症是由于骨量减低、骨组织微结构损坏导致骨脆性增加,以易发生骨折为特征的全身性骨病,可发生于任何年龄,但多见于绝经后女性和老年男性[1, 2, 3, 4, 5, 6, 7, 8]。我国≥50岁的男性和女性原发性骨质疏松症患病率分别为6.46%和29.13%[9]。骨质疏松症的发生、发展受多种因素影响,包括饮食(如钙和蛋白的摄入)、体力活动、内分泌状态、共存疾病和遗传因素[3]。按病因分为原发性和继发性骨质疏松症两大类。原发性骨质疏松症包括绝经后骨质疏松症、老年骨质疏松症和特发性骨质疏松症。继发性骨质疏松症则是指继发于其他疾病或不良刺激的骨质疏松症。虽然骨质疏松症是一种可防可治的疾病,但如在骨量减少初期未采取预防措施,在出现疼痛、脊柱畸形和骨折等时才发现,则延误了防治的最佳时机。采用影像学检查判断的骨量是诊断骨质疏松症的重要依据,选择合适的影像学检查方法评估骨质疏松程度,对于早期发现高危人群、预防脆性骨折的发生,具有重要临床意义。本文就目前在骨质疏松症诊断与评估中常用的影像学检查技术作一介绍。
骨量指单位体积内骨组织的含量,包括骨矿物质(钙、磷等)和骨基质(骨胶原、蛋白质、无机盐等)。而骨强度代表骨的韧性和载荷能力,由骨量和骨质量决定,可用于评估人体抗骨折能力。骨密度是反映骨量的主要指标,故也是决定骨强度的主要因素之一。骨质疏松症的诊断应基于明确的病史、危险因素、临床表现,结合影像学检查、骨密度测量及实验室检查等,目前的诊断标准为:①影像学检查明确脆性骨折时,无论骨密度结果是否低于标准值,均可诊断为骨质疏松症;②无脆性骨折时,骨密度测量结果低于标准值[1,10]。
脆性骨折是骨质疏松症的严重并发症,其中脊柱受累最为常见,髋部骨折临床危害最为严重,此外还包括腕部Colles骨折和肱骨近端骨折等[1]。脆性骨折的诊断需同时具备以下3个条件:①无外伤史或仅有轻微外伤史;②影像学检查可明确诊断为骨折;③除外继发性骨质疏松症。另外,值得注意的是肌少症在老年人群中的发病率较高,其与原发性骨质疏松症相伴被称为活动障碍综合征,可能增加骨折风险[11],在骨质疏松的研究中备受关注。
测量骨密度主要是基于X线通过不同介质衰减程度不同的原理,通过分析人体骨骼的矿物质含量及体质成分而获得,测量方法无创。随着影像学技术的发展,出现了诸多可用于诊断和评估骨质疏松症的方法,其中X线片、双能X射线吸收法(dual X-ray absorptiometry,DXA)、定量计算机断层扫描(QCT)、定量超声、磁共振成像(MRI)等临床应用较多[12]。此外,一些较为先进的影像学检查技术,如骨小梁评分(trabecular bone score,TBS)、显微CT、高显微分辨率CT等,可清晰显示骨小梁的三维结构,可更好地反映骨强度水平,目前阶段主要用于科学研究,尚未在临床推广。
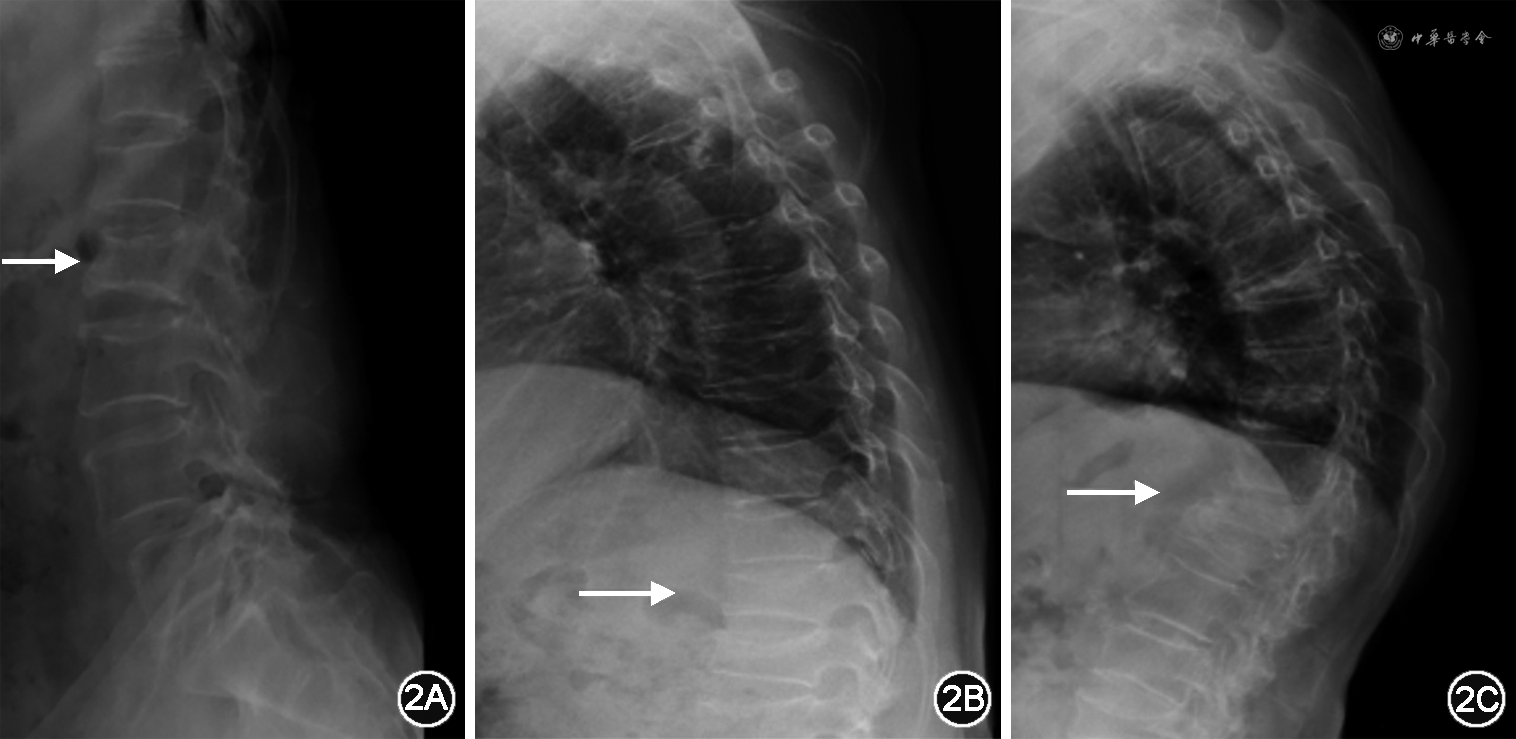
1.X线片:X线片是骨骼疾病诊断与评估最常用的影像学方法。骨质疏松时X线片主要表现为骨皮质菲薄,骨小梁稀疏、变细,骨质透明度增加,以椎体和骨盆表现明显,特别是负重胸椎和腰椎,椎体呈楔形改变或双面凹陷,骨小梁呈垂直栅状排列,也可见椎体压缩性骨折。普通胸、腰椎正侧位X线片是骨质疏松症椎体压缩性骨折及其程度判定的首选方法。基于胸腰椎侧位X线影像并采用Genant目视半定量判定方法[13],椎体压缩性骨折可分为3型、3度(图1)。3型分别为楔形骨折、双凹骨折和垂直压缩性骨折。3度分别为Ⅰ度即轻度骨折,原椎体高度压缩>20%~<25%;Ⅱ度即中度骨折,原椎体高度压缩了25%~40%;Ⅲ度即重度骨折,原椎体高度压缩>40%。X线片诊断骨质疏松症具有经济、方便、快捷的优点,可全面观察骨的形态、结构,是脆性骨折尤其是椎体骨折的首选检查方法(图2)。X线片检查设备成本较低,且能够进行全身各部位成像,因此在基层医疗机构普及率高。但敏感度和准确度均较低是其缺陷所在,只有当骨矿物质减少达30%~50%以上时,X线片才能有阳性表现[14]。此外,X线片不能量化评估骨密度,只能作定性判断,故X线片不用于骨质疏松症的早期诊断[15, 16, 17],且其判读受主客观因素影响大,故不能用于骨质疏松症的筛查和评估。



2.DXA:DXA检测是基于2个不同能量等级(40和70 keV)的X线束在通过人体不同组织成分和厚度后呈指数衰减,因此到达探测器的X线强度不同,通过扫描系统将X线能量强度信号传送至计算机进行处理,获得精确的骨骼矿物质含量、肌肉量和脂肪量等数据。20世纪90年代Kanis[18]提出DXA是骨密度诊断的金标准,1994年世界卫生组织推荐DXA为骨密度诊断的标准方法[14]。DXA操作简单、准确、特异度较高、可重复性高,应用广泛。该诊断标准以腰椎和股骨近端DXA 测量结果为依据[14,18, 19],如腰椎和股骨近端测量受限,可选择非优势侧桡骨远端1/3。临床上常用的测量部位是腰1~4椎体、髋部和股骨颈。DXA诊断的主要指标包括T值和Z值,T值是与20岁青年人骨密度的峰值比较所得,反映骨折的绝对危险性;Z值是与同年龄段正常人群的骨密度比较所得,反映骨折的相对危险性(图3)。对于儿童、青少年、绝经前女性以及<50岁的男性,骨密度判断建议采用同种族人群数据库计算出的Z值,将Z值≤-2.0 标准差(SD)定义为“低于同年龄段预期范围”或低骨量。DXA的优点在于精确度高、检查时间短、操作简便、价格较低,在严格质控的情况下可重复性高;缺点在于因其利用平面投影技术,测量时包括了椎体皮质骨、松质骨以及椎体前后方结构等所有X线投射过程中遇到的矿物质成分,通常情况下骨密度仅能反映骨强度的60%[5],因此对于腰椎退行性变者DXA诊断的假阴性率较高[20]。有学者探讨了在60~91岁人群中DXA对腰椎和股骨颈骨质疏松症的诊断率,在骨折患者中分别为11.5%和15.9%,无骨折者中分别为9.7%和28.3%,发现股骨颈的诊断率高于腰椎,研究者认为可能是由于随年龄增长,脊椎退行性改变较为严重,因此腰椎DXA测量的骨密度值未能反映其骨质疏松的真实情况,而股骨颈较少受退变影响[21]。DXA测得骨密度值减低是目前公认的脆性骨折的主要危险因素,骨密度每下降 1 个SD骨折风险增加1.5~3.0倍[22]。
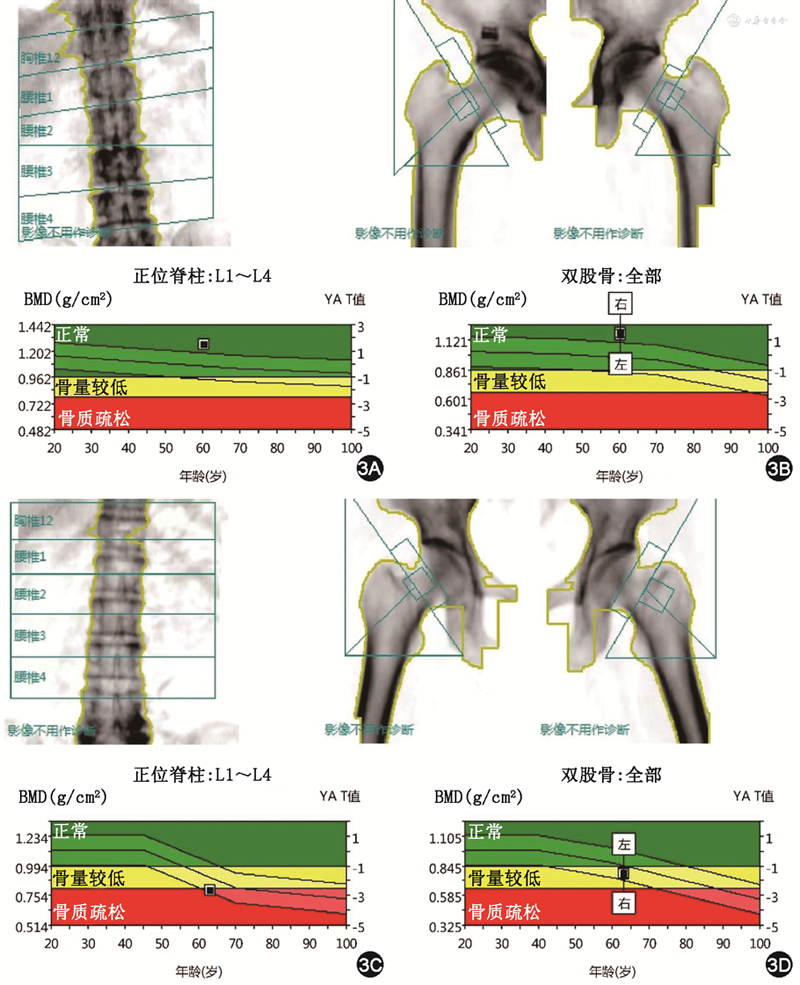

注:BMD 骨密度
DXA 骨密度仪为高精度仪器,对操作要求高,必须采取有效的质量控制方法。DXA 虽然是目前诊断骨质疏松症的金标准[14,19,23],但在我国应用并不广泛,主要是因为:①DXA在我国使用不到20年,骨科及全科医师中接受过DXA质量控制及规范操作培训者较少;②DXA设备的价格虽与X线片机相近,但使用率大大低于X线片机,故性价比较低,基层医疗机构配备率低;③临床上患者可能为腰椎病变,仅做了股骨DXA检查,也可能为股骨病变,仅做腰椎DXA检查;④缺乏动态DXA监测及长期随访资料,尚不能为评估药物等的治疗效果提供参考。
3.TBS:TBS主要应用于腰椎,是美国食品药品监督管理局认证的一种灰度纹理分析参数,是通过腰椎DXA检查获得二维平面图像后,通过计算机软件分析该骨密度图像的灰度变异水平,TBS可在一定程度上反映骨骼三维特征,如骨小梁数量、间隔和连接密度,能够提供骨微观结构和骨强度信息[24, 25, 26, 27, 28]。目前认为绝经后女性TBS≥1.35为正常,>1.2~<1.35为骨微结构部分退化,≤1.2为骨微结构退化,但世界卫生组织尚未界定标准的 TBS 阈值,且尚未提出男性的 TBS阈值[26]。TBS主要优点是获取简单、成本低廉,并且一些涉及绝经后妇女的观察性研究结果显示TBS与骨折明显相关,TBS预测腰椎和骨质疏松性骨折的ROC曲线下面积为0.6~0.7[29, 30],预测骨折风险的能力和腰椎DXA相近[31],但其是否可用来监测抗骨质疏松治疗的效果还有待进一步研究。
4.常规CT:相比X线,常规CT对于骨密度降低更为敏感、客观,是一种机会性检查方法,即对患者胸部、腹部和骨盆进行CT扫描的影像可详细显示出部分脊柱及其CT值,可为诊断骨质疏松症和各种脊椎骨折评估提供影像学资料,是诊断骨质疏松症和预测骨折风险的新手段。英国国家医疗服务体系每年进行50多万次CT扫描,每年检出骨质疏松症患者的增长率约为5%[32, 33]。有学者根据2万多例成人机会性CT检查资料计算出各年龄段成人腰1椎体骨密度的标准值范围,发现腰1椎体平均CT值随年龄呈线性下降,每个年龄段约减少2.5 HU,总体腰1椎体CT值为(160±49)HU,其中<30岁者为(226±44)HU,≥90岁者为(89±38)HU[34]。由于是机会性检查,患者不会承担额外的辐射和费用,且可在临床怀疑骨质疏松症前判断患者是否存在骨量减少/骨质疏松、肌肉减少等,有助于早发现、早治疗[33,35]。但也正是因为其为机会性检查,检查部位、设备及扫描参数、重建方式等存在差异,目前尚缺乏大样本的针对性研究,故我国对CT检查的骨骼评估尚缺乏统一标准。
5.生物力学CT(biomechanical computed tomography,BCT):BCT是常规CT扫描信息的有限元分析,即用常规CT扫描信息进行虚拟应力测试得到骨强度和骨密度值。虚拟应力测试是应用先进的医学图像处理技术、骨生物力学原理和非线性有限元分析的工程结构分析技术,在标准化加载配置中虚拟骨折所需的应力。目前,BCT已用于脊柱、髋关节区域及身体其他部位骨质疏松性骨折风险的预测,临床可根据测得的骨强度和骨密度T值、脊柱骨小梁的体积骨密度,判断骨质疏松和评估骨折的风险[36, 37],以及判断是否需行DXA检查,在诊断骨质疏松和评估骨折风险方面的效能等同于DXA[36, 37]。美国已将BCT用于医疗保险中骨质疏松的筛查[38]。由于在诊断骨质疏松和评估骨折风险方面等同于DXA,故BCT特别适合在未行DXA检查的人群中应用,也适用于近期进行或即将进行常规CT检查的人群,可避免额外的辐射暴露[38]。目前,在我国BCT主要应用于生物力学如骨科骨折、畸形等模型的建立,在骨质疏松方面的研究很少,尚未应用于其相关临床。
6.QCT:QCT为采用CT三维容积数据进行分析得到的体积骨密度(vBMD,单位mg/cm3),测量结果不受感兴趣区周围组织结构的影响(图4)。临床扫描时将体模置于受检者下方,与受检者同时接受扫描,在CT扫描数据的基础上,经过QCT体模校准和专业软件分析,得到骨密度值[39]。国际临床骨密度学会推荐的诊断标准为,骨密度>120 mg/cm3为正常,80~120 mg/cm3为骨量减少,<80 mg/cm3为骨质疏松(图4),我国相关指南采用了该标准[10,39]。QCT的质量控制对判断疗效和病情进展的准确性非常重要,标准高于普通CT和BCT。质量控制包括两方面,一是CT设备本身的维护,一是QCT软件、体模和配件的维护。应用QCT可对骨质疏松性胸腰椎骨折椎体成形术进行指导,可根据患者腰椎QCT检测结果明确骨质疏松的程度,指导穿刺方法,缩短手术时间,同时能够减少X线检查次数,有效提高椎体成形术的安全性。相较于DXA,QCT对骨质疏松症的诊断效能较高,其可避免骨皮质对骨质增生图像的影响,但QCT体模设备目前费用仍较高,需要在普通CT设备的基础上单独购置QCT测量体模及软件,目前在国内仅三甲医院开展了QCT检查。
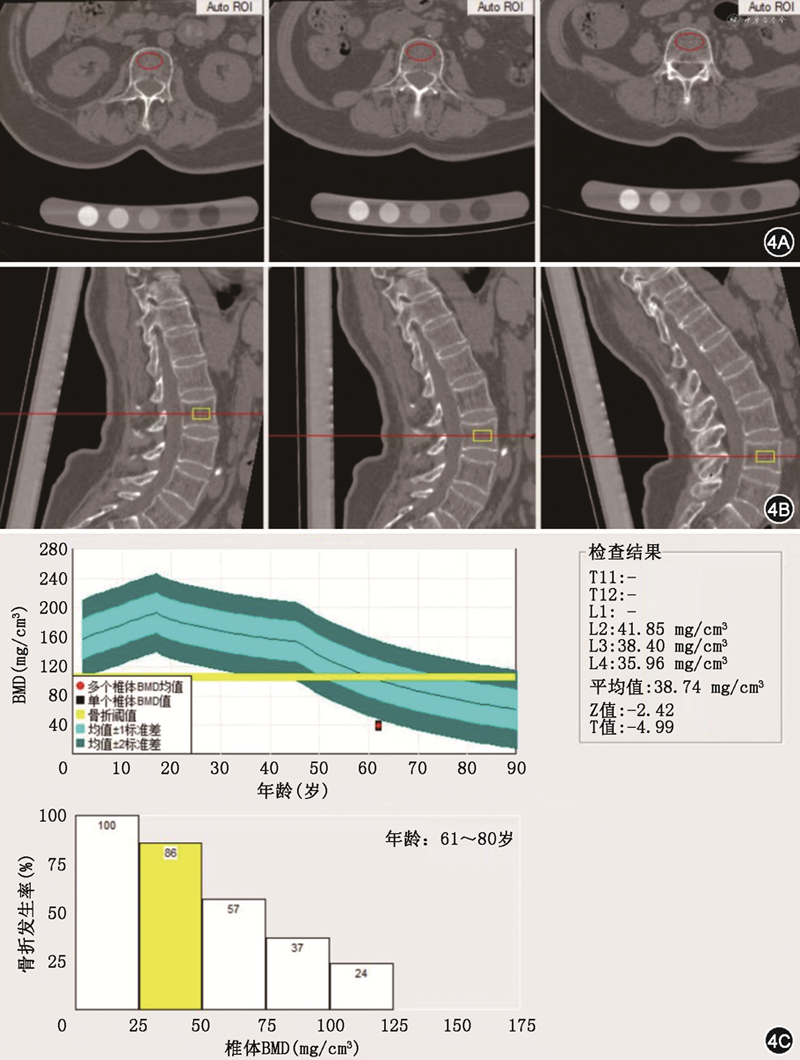

注:BMD 骨密度
7.外周QCT(peripheral QCT,pQCT):pQCT为测量外周骨即四肢(非优势侧桡骨、胫骨)的QCT骨密度测量方法,检测原理同QCT,并将松质骨与皮质骨独立检测。具有辐射小,不涉及关键的、对辐射敏感器官的优点,具有广阔的应用前景[40]。缺点在于检测费用较高,需要频繁校正以维护仪器准确性;仅限于外周骨骼的测量,因定位困难、灵敏度较差无法直接了解腰椎或股骨近端的骨质量,而这些部位恰恰是骨质疏松性脆性骨折的常见部位,故其对躯干骨密度的评价价值有限。
8.定量超声检查:定量超声检查是近年临床常见的骨质疏松症筛查工具之一,利用超声对物质的特征性衰减评估骨质量,在反映骨密度的同时,还能反映骨结构、骨小梁分布和骨延展性等骨结构特征,是一种评价骨强度的方法[41]。超声检测骨密度广泛应用于骨质疏松症的筛查及健康体检[42]。目前定量超声检查的常见部位为跟骨,因为跟骨两侧面几乎平行,便于测量,此外跟骨以松质骨为主,对骨质变化更敏感(图5)。研究显示跟骨定量超声指数与股骨转子区和股骨头区DXA显著相关[41]。与金标准DXA相比,定量超声检查的ROC曲线下面积为0.832,敏感度、特异度分别为 0.670、0.875,具有较高的诊断价值[43]。但有研究显示,对于DXA诊断为骨质疏松症的患者,定量超声的敏感度及特异度较高,但对于正常人群或骨量减低者定量超声特异度较低,研究者认为跟骨在定量超声领域的应用价值仍需进一步探索[44]。定量超声检查的优点在于便携、无辐射、无创。但是所用仪器不同、超声穿透骨的径路不易保持一致、周围软组织的影响以及种族不同,均可造成测量数值存在差异,所以用于诊断骨质疏松症时需建立每个超声检查仪器自身正常参考值。此外,定量超声筛查阈值因测量部位和设备厂家不同给出的参考值不同,缺乏统一标准。
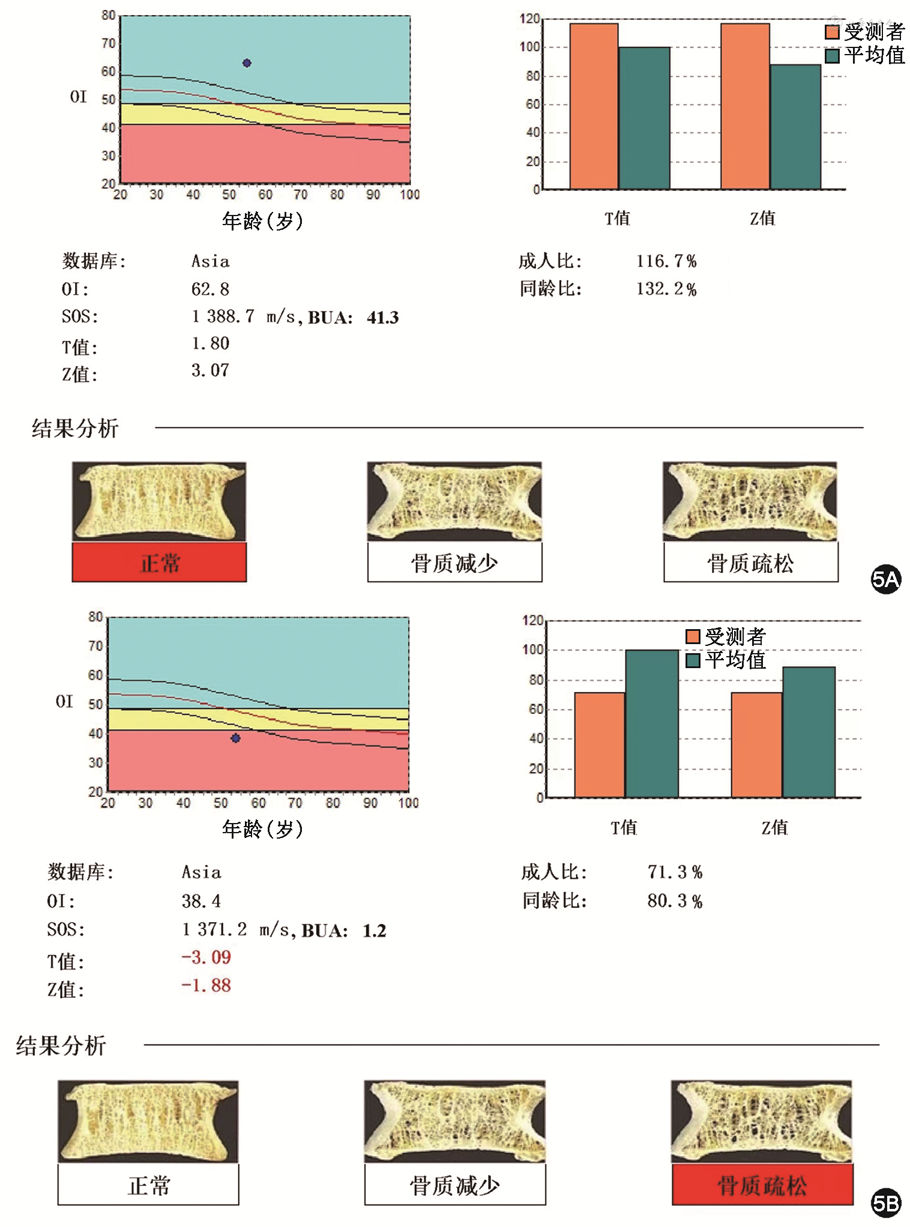

注:Asia 亚洲人群,OI 骨质疏松指数,SOS 超声声速,BUA 超声频率衰减
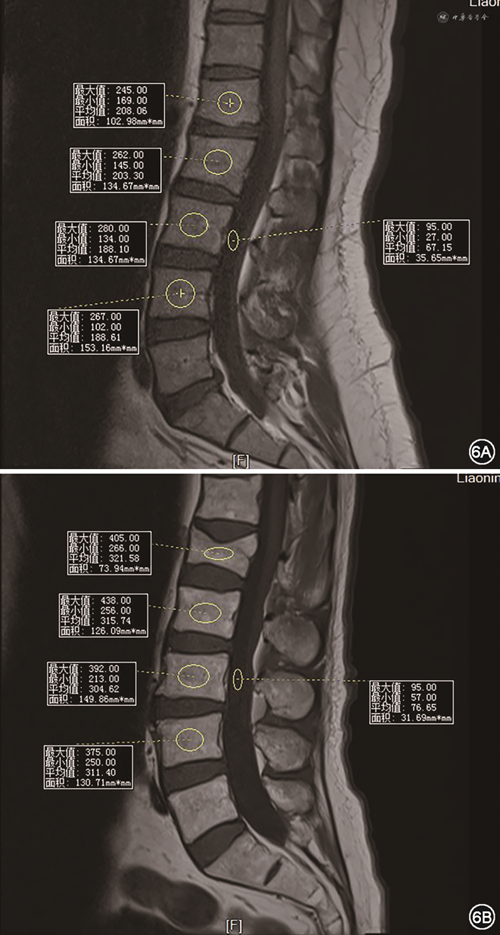
9.MRI:基于腰椎MRI T1加权(T1WI)像,通过测量椎体内部感兴趣区的信号强度来评估椎体内部脂肪浸润程度以及椎体骨的质量(vertebral bone quality,VBQ)[45],有助于评估骨质疏松情况。采用腰1~4椎体感兴趣区内平均信号强度(SIL1~L4)除以脑脊液的信号强度(SICSF),得出 VBQ 评分,研究显示VBQ评分与DXA的T值呈负相关[45](图6),该研究显示较高的VBQ评分与骨量减少/骨质疏松症显著相关,预测准确性为81%。有学者将VBQ临界值设置为2.93,此时诊断低BMD的敏感度为77.25%、特异度为70%[46]。临床上MRI用于脊柱脆性骨折的诊断、X线和CT不能明确诊断的隐性骨折、背部疼痛诱导试验阳性患者,以及骨质疏松性骨折、骨肿瘤及其他疾病引起的病理性骨折的鉴别[47]。其优点在于无放射性损害、软组织对比度高、可显示骨髓的早期变化[48, 49]、不受观察者影响等[50]。但是其成本较高、设备使用的有限性和复杂性较高,同时该评分仅能区分骨量正常与骨量减少或骨质疏松,尚缺乏采用MRI进行骨量减少和骨质疏松划定的研究,缺乏二者的量化区分标准,尚不能用于治疗方案的选择及疗效判定。

目前常用的几种骨密度影像学检测方法均在一定程度上对早期发现骨质疏松症高危者具有提示意义,同时也各有欠缺,故临床上需依患者情况选择适宜的检测方法。X线片、常规CT、MRI及DXA检测结果的比照见图7。
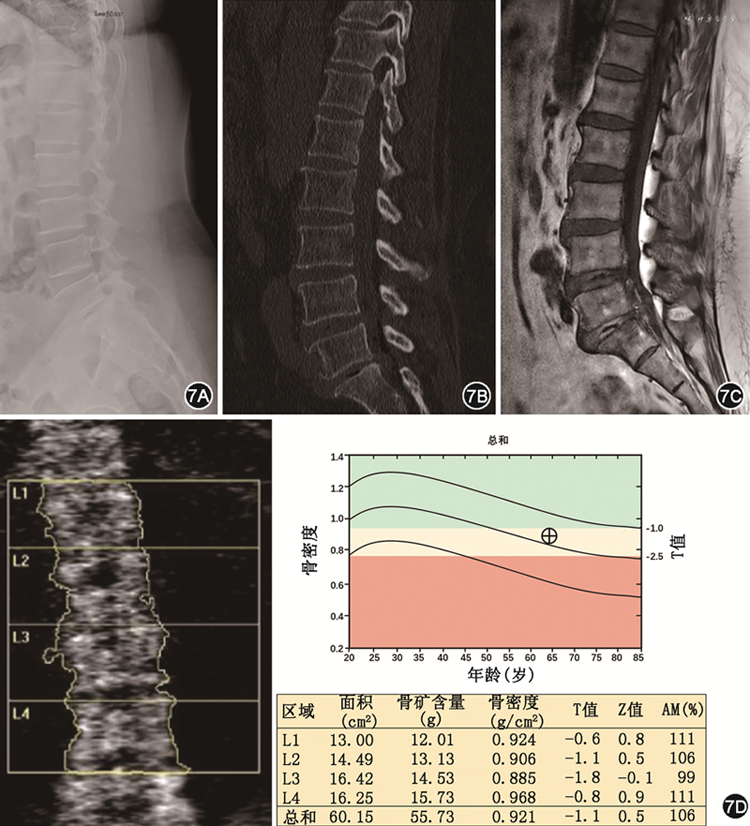

注:AM年龄匹配
综上,骨质疏松症重在预防,影像学方法有助于早期发现骨质疏松症的高危人群,预防脆性骨折的发生,降低骨质疏松症患者的致残率和致死率,特别是对于老年人群。每种影像学技术有各自的优势和不足,临床上需要简便有效的工具为骨质疏松症的早期预防和诊断提供参考。目前X线片+DXA是骨质疏松症诊断与鉴别诊断的基本影像学模式,单一DXA或X线片均具有局限性,二者结合(多模态)是最佳模式。
李琦, 王磊. 原发性骨质疏松症的影像学检查与诊断[J]. 中华全科医师杂志, 2023, 22(10): 1097-1104. DOI: 10.3760/cma.j.cn114798-20230806-00045.
所有作者声明不存在利益冲突
继续教育测试题请见本期第1096页。



























