
原发性皮肤弥漫大B细胞淋巴瘤,腿型(PCDLBCL,LT)多发于老年患者,是一种罕见的侵袭性非霍奇金淋巴瘤(NHL),在每年新发原发性皮肤淋巴瘤中约占4%[1]。研究表明,PCDLBCL,LT患者中存在MYD88、PIM1、CD79B等基因的高频突变,且BCR信号通路上的基因(CD79A/B或CARD11)突变与患者的不良预后相关[2]。目前,国内对于PCDLBCL,LT的研究仅见于个别病例报告及小样本量的临床病理研究,尚未开展对PCDLBCL,LT的分子病理学研究。为了进一步明确中国PCDLBCL,LT患者的临床病理特征和疗效,本文收集了11例PCDLBCL,LT患者的临床资料并进行了相关研究。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性皮肤弥漫大B细胞淋巴瘤,腿型(PCDLBCL,LT)多发于老年患者,是一种罕见的侵袭性非霍奇金淋巴瘤(NHL),在每年新发原发性皮肤淋巴瘤中约占4%[1]。研究表明,PCDLBCL,LT患者中存在MYD88、PIM1、CD79B等基因的高频突变,且BCR信号通路上的基因(CD79A/B或CARD11)突变与患者的不良预后相关[2]。目前,国内对于PCDLBCL,LT的研究仅见于个别病例报告及小样本量的临床病理研究,尚未开展对PCDLBCL,LT的分子病理学研究。为了进一步明确中国PCDLBCL,LT患者的临床病理特征和疗效,本文收集了11例PCDLBCL,LT患者的临床资料并进行了相关研究。
收集上海交通大学医学院附属瑞金医院自2014年8月至2022年3月收治的11例诊断为PCDLBCL,LT的患者。完善血常规、生化常规、心电图、骨髓穿刺、病理、全身CT或PET-CT等检查,所有患者均经皮肤病理及免疫组织化学染色确诊,诊断参照WHO-EORTC分类标准[3]。
大部分患者接受了以R-CHOP方案(利妥昔单抗+环磷酰胺+阿霉素+长春新碱+泼尼松)为基础的治疗方案,疗效评估参照2014年Lugano会议修订标准[4],包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。总有效率(ORR)为CR率与PR率之和。
利用石蜡包埋组织基因组DNA提取试剂盒(德国QIAGEN公司产品)提取患者肿瘤组织石蜡切片中的gDNA,取200 ng gDNA,利用预文库构建试剂盒[艾吉泰康生物科技(北京)有限公司]构建预文库,利用靶向测序试剂盒对目的基因(55个淋巴瘤相关基因,分别为ARID1A、ATM、B2M、BCL6、BTG1、BTG2、CARD11、CCND3、CD58、CD70、CD79A、CD79B、CIITA、CREBBP、DDX3X、DTX1、DUSP2、EBF1、EP300、EZH2、FAS、FBXW7、FOXO1、GNA13、HIST1H1C、HIST1H1E、IRF4、IRF8、KMT2C、KMT2D、LYN、MAPK7、MPEG1、MTOR、MYC、MYD88、NFKBIE、NOTCH1、NOTCH2、PIM1、PRDM1、PTPN6、SGK1、SOCS1、STAT3、STAT6、TBL1XR1、TET2、TMSB4X、TNFAIP3、TNFRSF14、TP53、TSC2、ZFP36L1、ZNF608)进行液相杂交捕获并构建文库,采用Novaseq测序平台(美国Illumina公司产品)进行测序。测序由上海睿昂基因科技股份有限公司辅助完成,测序完成后,将原始测序序列与人类参考基因组hg19进行比对,将重复序列剔除,重新校准碱基质量后,利用GATK进行SNP calling并使用ANNOVAR进行分析。过滤掉以下突变:①在genomAD、千人基因组数据库中频率高于0.001的突变;②位于非编码区的突变;③同义突变;④被SIFT、Polyphen2、CADD等生物信息学软件预测为无害的错义突变。
整理患者的住院病历资料,于2022年6月20日对所有患者进行电话随访,确认患者的疾病进展状态及生存状态,中位随访时间为38.5(2.4~68.0)个月。随访截止日期为2022年6月。总生存(OS)期指患者自确诊到死亡或随访截止的时间,无进展生存(PFS)期指患者自确诊到疾病进展、复发、死亡或随访截止的时间。
应用SPSS软件进行数据分析,计数资料以例数(百分比)表示,计量资料用中位数(范围)或 ±s表示。Fisher精确检验用于评估两组间CR率的差异,Kaplan-Meier法、Log-rank检验和单因素Cox比例风险模型进行生存分析。
±s表示。Fisher精确检验用于评估两组间CR率的差异,Kaplan-Meier法、Log-rank检验和单因素Cox比例风险模型进行生存分析。
本研究共纳入11例PCDLBCL,LT患者,其中男8例(62.7%),女3例(27.3%),男女比例为2.7∶1;患者中位年龄为72岁,其中9例(81.8%)患者年龄大于60岁;有B症状患者2例(18.2%);生发中心来源(GCB)患者1例(9.1%),非生发中心来源(non-GCB)患者10例(90.9%);Ann Arbor分期Ⅰ~Ⅱ期患者6例(54.5%),Ⅲ~Ⅳ期患者5例(45.5%);7例(63.6%)患者乳酸脱氢酶(LDH)含量升高;7例(63.6%)患者美国东部肿瘤协作组体力状况(ECOG)评分为0~1分,4例(36.4%)患者ECOG评分≥2分;所有患者均结外受累,其中6例(54.5%)患者下肢受累,7例(63.6%)患者结外受累个数为1,2例(18.2%)患者结外受累个数为2,2例(18.2%)患者结外受累个数大于2;国际预后指数(IPI)评分0~2分的患者5例(45.5%),6例(54.5%)患者IPI评分≥3分。
11例PCDLBCL,LT患者中7例(63.6%)接受以R-CHOP方案为基础的治疗方案,均获得CR;3例(27.3%)接受泽布替尼联合来那度胺及利妥昔单抗(ZR2)方案,其中2例患者获得CR,1例患者获得PR;1例(9.1%)未接受化疗,予口服沙利度胺、维A酸治疗。应用R-CHOP方案患者的CR率为100%,应用ZR2治疗方案患者的CR率为66.7%,两者的差异无统计学意义(P=0.300)。
11例PCDLBCL,LT患者的中位随访时间为38.5(2.4~68.0)个月,随访期间4例(36.4%)患者PD,3年PFS率为(61.4±15.3)%。7例接受R-CHOP方案治疗患者的3年PFS率为(57.1±18.7)%,3例接受ZR2方案治疗患者的3年PFS率为(66.7±27.2)%。随访期间2例(18.2%)患者死亡,3年OS率为(80.8±12.2)%。7例接受R-CHOP方案治疗患者的3年OS率为(85.7±13.2)%,3例接受ZR2方案治疗患者的3年OS率为(50.0±35.4)%。
靶向测序结果显示,9例PCDLBCL,LT患者中共检出21个基因突变,突变频率≥20%的基因包括PIM1(67%)、MYD88(44%)、TMSB4X(33%)、TBL1XR1(33%)、KMT2D(33%)、CD79B(33%)、CARD11(33%)、BTG2(33%)、BTG1(22%)(图1)。
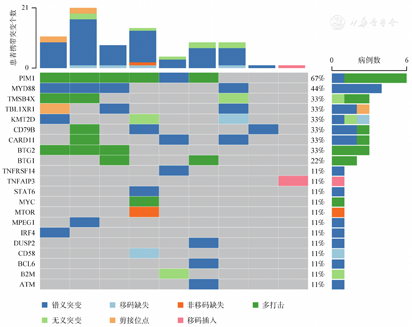

单因素分析结果显示,KMT2D基因突变与患者较短的OS期有相关趋势,但差异无统计学意义(P=0.083)(表1)。B症状与患者较短的PFS期有相关趋势,但差异无统计学意义(P=0.065)(表1)。
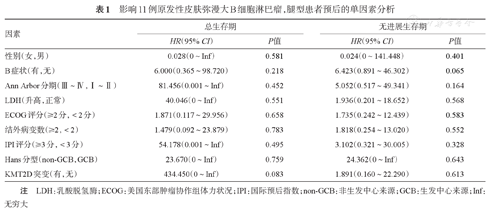
影响11例原发性皮肤弥漫大B细胞淋巴瘤,腿型患者预后的单因素分析
影响11例原发性皮肤弥漫大B细胞淋巴瘤,腿型患者预后的单因素分析
| 因素 | 总生存期 | 无进展生存期 | ||
|---|---|---|---|---|
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 性别(女,男) | 0.028(0~Inf) | 0.581 | 0.024(0~141.448) | 0.401 |
| B症状(有,无) | 6.000(0.365~98.720) | 0.218 | 6.423(0.891~46.302) | 0.065 |
| Ann Arbor分期(Ⅲ~Ⅳ,Ⅰ~Ⅱ) | 81.456(0.001~Inf) | 0.452 | 5.052(0.517~49.341) | 0.164 |
| LDH(升高,正常) | 40.046(0~Inf) | 0.551 | 1.936(0.201~18.652) | 0.568 |
| ECOG评分(≥2分,<2分) | 1.871(0.117~29.956) | 0.658 | 1.735(0.242~12.439) | 0.583 |
| 结外病变数(≥2,<2) | 1.479(0.092~23.879) | 0.783 | 1.818(0.254~13.020) | 0.552 |
| IPI评分(≥3分,<3分) | 54.178(0.001~Inf) | 0.495 | 3.102(0.321~30.005) | 0.328 |
| Hans分型(non-GCB,GCB) | 23.670(0~Inf) | 0.759 | 24.362(0~Inf) | 0.643 |
| KMT2D突变(有,无) | 434.450(0~Inf) | 0.083 | 1.891(0.160~22.290) | 0.613 |
注 LDH:乳酸脱氢酶;ECOG:美国东部肿瘤协作组体力状况;IPI:国际预后指数;non-GCB:非生发中心来源;GCB:生发中心来源;Inf:无穷大
PCDLBCL,LT十分罕见,临床中需要与其他累及皮肤的淋巴瘤进行鉴别,尤其是原发性皮肤滤泡中心淋巴瘤(PCFCL)。国外的一项研究表明,PCFCL与GCB型弥漫大B细胞淋巴瘤(DLBCL)基因表达谱相似,而PCDLBCL,LT与ABC型DLBCL基因表达谱相似[5],进行CD10、BCL6、MUM-1等免疫表型的检测有助于二者的鉴别。在本研究中non-GCB型患者比例高达90.9%,仅有1例GCB型患者,表明了PCDLBCL,LT与non-GCB型DLBCL的相关性。GCB型PCDLBCL,LT在国外也有少量报道[6,7]。国外数据显示,PCDLBCL,LT多发于老年患者[8],国内2篇报道均显示男性患者数量高于女性患者[9,10]。本研究中11例PCDLBCL,LT患者的中位年龄72岁,女性患者占27.3%,和相关研究报道一致[9,10]。R-CHOP方案显著改善了PCDLBCL,LT患者的预后,使患者的3年生存率从不足50%提升至80%[11]。本研究中7例接受R-CHOP方案治疗患者的3年OS率为(85.7±13.2)%,与文献报道相近,而3例接受ZR2方案治疗患者的3年OS率为(50.0±35.4)%。尽管受限于样本量,该结果表明以R-CHOP方案为基础的治疗可能使中国PCDLBCL,LT患者受益。
研究报道,MYD88(69%~75%)、PIM1(69%~70%)、CD79B(40%~56%)、HIST1H1E(41%)、TBL1XR1(33%)、CREBBP(26%)、MYC(20%~26%)、IRF4(16%)、KMT2D(15%)和CARD11(5%)是PCDLBCL,LT患者的常见突变基因,这些基因在B细胞信号转导和NF-κB活化中发挥重要作用[2,12]。本研究同样检测了PIM1、MYD88、TBL1XR1、CD79B、CARD11、MYC等基因的突变情况,突变频率与既往报道接近。此外,研究发现基因的突变状态与PCDLBCL,LT患者的预后显著相关。如BCR信号通路基因(CD79A/B或CARD11)的突变与PCDLBCL,LT患者PFS期和OS期缩短相关,且携带该基因突变的患者会出现治疗抵抗[2]。由于样本量的限制,本研究探究了突变频率≥20%基因的突变状态与患者预后的关系,结果提示KMT2D突变与患者较短的OS期有相关趋势。KMT2D基因编码的蛋白在表观遗传调控中发挥重要作用,累积的证据显示,KMT2D突变与多种淋巴瘤的预后相关。Ferrero等[13]发现携带KMT2D突变的套细胞淋巴瘤患者预后较差,病情恶化和死亡风险升高。Li等[14]发现,在血浆循环肿瘤DNA中检测到KMT2D突变的NK/T细胞淋巴瘤患者预后较差。Khanam等[15]发现KMT2D突变的淋巴母细胞淋巴瘤患者的复发率显著升高。但本研究未发现CD79B和CARD11基因的突变状态与PCDLBCL,LT患者的OS和PFS具有相关性,可能与PCDLBCL,LT的异质性及样本量较少有关。
此外,本研究结果提示B症状与PCDLBCL,LT患者PFS期缩短相关,但差异无统计学意义。既往与PCDLBCL,LT相关的研究均未关注患者是否出现B症状,但针对中国淋巴瘤患者的研究显示B症状与多种淋巴瘤的预后相关。周智俊等[16]发现B症状是影响原发性乳腺淋巴瘤患者预后的因素;杨渤彦等[17]发现B症状与DLBCL患者的OS率显著相关等。上述结果进一步表明B症状与PCDLBCL,LT患者的预后可能存在相关性。
综上所述,本研究探究了11例PCDLBCL,LT患者的临床特征,初步展示了中国PCDLBCL,LT患者的突变图谱。本研究结果显示KMT2D突变和B症状可能是影响中国PCDLBCL,LT患者预后的因素,可能为PCDLBCL,LT患者的治疗和预后评估提供新的思路。
所有作者声明无利益冲突


























