
探讨有血流动力学意义的动脉导管未闭(haemodynamically significant patent ductus arteriosus,hsPDA)极早产儿早期保守管理失败后口服对乙酰氨基酚或高剂量布洛芬营救治疗hsPDA的疗效及安全性。
选择2020年5月至2022年11月徐州市中心医院新生儿重症监护病房收治的胎龄<32周、生后4~6 d诊断hsPDA的极早产儿进行前瞻性研究。若保守管理3~4 d后仍存在hsPDA,则给予营救治疗。随机分为对乙酰氨基酚组(口服15 mg/kg,每6 h 1次,共3 d)和高剂量布洛芬组(口服首剂20 mg/kg,24 h、48 h后各10 mg/kg)。治疗前后均进行超声心动图、血常规、血生化、B型尿钠肽、粪便隐血、颅脑彩超检查,记录尿量及并发症。应用SPSS 20.0统计软件进行数据分析。
共纳入对乙酰氨基酚组36例,高剂量布洛芬组37例,两组营救治疗成功率差异无统计学意义[80.6%(29/36)比78.4%(29/37),P>0.05]。营救治疗期间,两组上消化道出血、粪便隐血阳性、少尿、Ⅱ~Ⅲ期坏死性小肠结肠炎和Ⅲ~Ⅳ级脑室内出血发生率差异均无统计学意义(P>0.05)。营救治疗后,高剂量布洛芬组血清胱抑素C高于对乙酰氨基酚组[(1.72±0.29)mg/L比(1.58±0.26)mg/L]、24 h尿量低于对乙酰氨基酚组[(3.1±1.0)ml/(kg·h)比(3.7±0.7)ml/(kg·h)],差异均有统计学意义(P<0.05);两组血清肌酐、血小板计数、B型尿钠肽、谷丙转氨酶、血清总胆红素等差异均无统计学意义(P>0.05)。
hsPDA极早产儿早期保守管理失败后,生后7~10 d开始口服对乙酰氨基酚或高剂量布洛芬营救治疗,成功率均为80%左右,均较安全。口服高剂量布洛芬对肾功能的影响可能大于对乙酰氨基酚。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
有血流动力学意义的动脉导管未闭(haemodynamically significant patent ductus arteriosus,hsPDA)对早产儿的影响主要表现为肺循环血流量分流性增加、体循环血流量盗血性减少,以往多数学者主张尽早使用药物促进导管关闭,减少短期并发症[1, 2]。但近年研究发现早期积极促进hsPDA早产儿导管关闭并未明显改善远期结局,且在校正胎龄40周前大多数导管可自发闭合[1,3],而使用环氧化酶抑制剂可能会带来严重不良反应[4, 5]。因此2020年美国儿科学会和2022年加拿大指南均指出,早产儿hsPDA的干预模式已经转变为倾向于早期保守管理[1,3]。在保守管理失败后的营救治疗中,口服高剂量布洛芬疗效相对较好,口服对乙酰氨基酚安全性相对较好[3,6],但目前尚未取得共识[3,7, 8, 9, 10]。本团队曾开展对乙酰氨基酚与标准剂量布洛芬的对照研究,结果显示两者疗效相似[11]。近期有研究显示高剂量布洛芬疗效优于标准剂量,且安全性没有差异[12]。目前对比口服对乙酰氨基酚和高剂量布洛芬疗效的相关研究较少,本团队从2020年5月起开展了极早产儿hsPDA保守管理失败后应用以上两种营救治疗的前瞻性研究,现报告如下。
选择2020年5月至2022年11月徐州市中心医院新生儿重症监护病房收治的hsPDA极早产儿进行前瞻性研究。入选标准:(1)胎龄<32周;(2)生后24 h内入院;(3)生后4~6 d完成超声心动图检查并诊断hsPDA。hsPDA诊断标准:①具备以下所有超声心动图特点:导管内径≥1.5 mm,左房内径/主动脉根部内径≥1.5,舒张期降主动脉反流;②同时具备以下临床表现之一:心前区收缩期杂音、搏动增强、水冲脉、脉压差增大、呼吸状况恶化[3,13]。排除标准:(1)生命体征极不稳定、有依赖动脉导管开放的先天性心脏病、持续肺动脉高压。(2)因监护人不配合/自动出院/死亡等原因导致临床资料不可信或不完整。(3)患儿家长拒绝签署知情同意书。本研究经我院医学伦理委员会审批(XZYY-LJ-20200514-064)。患儿家长均签署知情同意书。
1.临床资料:记录患儿人口学特征及hsPDA可能相关因素,包括性别、胎龄、出生体重、分娩方式、5 min Apgar评分、小于胎龄儿、分娩前7 d内应用完整疗程激素、母孕期高血压、母孕期糖尿病、胎膜早破>18 h、呼吸窘迫综合征、使用肺表面活性物质、有创通气、仅无创通气、临床诊断早发型败血症及生后72 h内总入量等。
2.保守管理:限液≤120 ml/(kg·d)、减少各种刺激、提高呼气末正压、必要时使用利尿剂减轻肺水肿等[1,3,13]。3~4 d后复查超声心动图、评估临床表现,若仍符合hsPDA诊断标准,则查血常规、血生化[包括胱抑素(cystatin,Cys)C、肌酐、谷丙转氨酶、总胆红素等]、B型尿钠肽(B-type natriuretic peptide,BNP)、粪便隐血、颅脑彩超等。若不存在用药禁忌证[13],则准备给予药物营救治疗。
3.营救治疗:将准备药物营救治疗的患儿按随机数字表法分为两组:(1)对乙酰氨基酚组:鼻饲给予对乙酰氨基酚(泰诺林混悬液,上海强生制药有限公司),1 ml(15 mg)/kg,每6 h 1次,共3 d[3,6]。(2)高剂量布洛芬组:鼻饲给予高剂量布洛芬(美林混悬液,上海强生制药有限公司),首剂2 ml(20 mg)/kg,24 h、48 h后再各给予1 ml(10 mg)/kg[3,6]。两组患儿首剂给药后72 h内均暂不增加经口喂养量,首剂给药后72~96 h复查超声心动图等上述指标。营救治疗失败者继续保守管理,必要时给予第2疗程高剂量布洛芬或手术结扎[3]。
4.疗效判断:保守管理或营救治疗后3~4 d复查超声心动图、评估临床表现。(1)治疗成功:动脉导管已关闭,或动脉导管未关闭但已经不符合hsPDA诊断标准。(2)治疗失败:仍符合hsPDA诊断标准。
5.研究指标:(1)主要指标:营救治疗前后血清Cys C(乳胶增强免疫透射比浊法,参考值0.5~1.5 mg/L)。(2)次要指标:保守管理和营救治疗成功率、营救治疗日龄、第2疗程高剂量布洛芬营救治疗率、手术结扎率;校正胎龄40周前动脉导管关闭率、有创通气天数、吸氧天数、肺出血、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、首次筛查需要治疗的早产儿视网膜病(retinopathy of prematurity,ROP)发生率及病死率等结局;营救治疗前后血清肌酐、24 h尿量、血小板计数、BNP、谷丙转氨酶、血清总胆红素;营救治疗期间(首剂给药后72~96 h内)上消化道出血率、粪便隐血阳性率、少尿(8 h尿量<8 ml/kg)、Ⅱ~Ⅲ期坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、Ⅲ~Ⅳ级脑室内出血(intraventricular hemorrhage,IVH)、肠穿孔等药物不良反应发生率。
6.样本量估计:基于预试验,营救治疗后主要指标血清Cys C呈正态分布,标准差约0.30 mg/L。假设高剂量布洛芬组营救治疗后血清Cys C比对乙酰氨基酚组增加或降低0.25 mg/L(成人标准差)或以上,临床上对肾功能的影响有意义。设定功效为80%,α=0.05(双侧),两组样本量比接近1∶1,则每组所需样本量至少约为31例。计算公式:n=2[(1.960+1.282)/(0.25/0.30)]2≈31。考虑到不超过10%的退出或排除等脱落率,则每组至少纳入35例。
应用SPSS 20.0统计软件进行数据分析。采用偏度和峰度法进行正态性检验。正态分布的计量资料以±s表示,两组比较采用独立样本t检验,各组治疗前后比较采用配对样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,两组比较采用独立样本非参数检验的Wilcoxon秩和检验(Mann-Whitney U法)。计数资料以例(%)表示,两组比较采用四格表资料的χ2检验。P<0.05为差异有统计学意义。
研究期间我院共收治极早产儿241例,生后24 h内入院229例,生后4~6 d完成超声心动图检查并诊断hsPDA 187例,排除生命体征极不稳定2例、有依赖动脉导管开放的先天性心脏病1例、持续肺动脉高压6例、临床资料不完整3例,共纳入175例。保守管理成功95例(54.3%),失败80例,因存在用药禁忌证、药源问题、意外因素等退出或排除7例,最终有73例随机分为两组给予营救治疗:对乙酰氨基酚组36例、高剂量布洛芬组37例。两组性别、胎龄、出生体重、剖宫产、5 min Apgar评分、小于胎龄儿、分娩前7 d内应用完整疗程激素、母孕期高血压、母孕期糖尿病、胎膜早破>18 h、呼吸窘迫综合征、使用肺表面活性物质、有创通气、仅无创通气、临床诊断早发型败血症、生后72 h内总入量及动脉导管内径等一般资料比较,差异均无统计学意义(P>0.05),见表1。
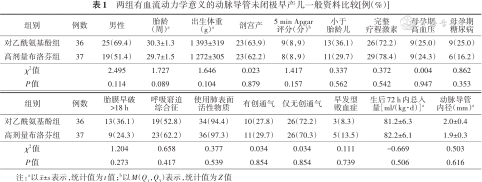
两组有血流动力学意义的动脉导管未闭极早产儿一般资料比较[例(%)]
两组有血流动力学意义的动脉导管未闭极早产儿一般资料比较[例(%)]
| 组别 | 例数 | 男性 | 胎龄 (周)a | 出生体重 (g)a | 剖宫产 | 5 min Apgar 评分(分)b | 小于 胎龄儿 | 完整 疗程激素 | 母孕期 高血压 | 母孕期 糖尿病 |
|---|---|---|---|---|---|---|---|---|---|---|
| 对乙酰氨基酚组 | 36 | 25(69.4) | 30.3±1.3 | 1 393±319 | 23(63.9) | 9(8,9) | 13(36.1) | 26(72.2) | 9(25.0) | 9(25.0) |
| 高剂量布洛芬组 | 37 | 19(51.4) | 29.7±1.5 | 1 272±305 | 23(62.2) | 8(8,9) | 11(29.7) | 29(78.4) | 9(24.3) | 6(16.2) |
| χ2值 | 2.495 | 1.727 | 1.646 | 0.023 | 1.417 | 0.337 | 0.372 | 0.004 | 0.862 | |
| P值 | 0.114 | 0.089 | 0.104 | 0.879 | 0.157 | 0.562 | 0.542 | 0.947 | 0.353 |
| 组别 | 例数 | 胎膜早破 >18 h | 呼吸窘迫 综合征 | 使用肺表面 活性物质 | 有创通气 | 仅无创通气 | 早发型 败血症 | 生后72 h内总入量[ml/(kg·d)]a | 动脉导管 内径(mm)a |
|---|---|---|---|---|---|---|---|---|---|
| 对乙酰氨基酚组 | 36 | 13(36.1) | 19(52.8) | 34(94.4) | 10(27.8) | 26(72.2) | 3(8.3) | 81.2±6.3 | 2.0±0.4 |
| 高剂量布洛芬组 | 37 | 9(24.3) | 23(62.2) | 36(97.3) | 11(29.7) | 26(70.3) | 5(13.5) | 82.2±6.1 | 1.9±0.3 |
| χ2值 | 1.204 | 0.658 | 0.377 | 0.034 | 0.034 | 0.111 | -0.669 | 0.503 | |
| P值 | 0.273 | 0.417 | 0.539 | 0.854 | 0.854 | 0.739 | 0.506 | 0.616 |
注:a以±s表示,统计值为t值;b以M(Q1,Q3)表示,统计值为Z值
两组营救治疗开始用药日龄及治疗成功率差异无统计学意义(P>0.05)。治疗失败15例(20.5%),其中4例给予第2疗程高剂量布洛芬、1例手术结扎,出院时动脉导管总关闭率91.8%(67/73),两组校正胎龄40周前动脉导管关闭率、有创通气天数、吸氧天数、肺出血、BPD、首次筛查需要治疗的ROP发生率及病死率等hsPDA相关不良结局差异均无统计学意义(P>0.05)。营救治疗期间,高剂量布洛芬组上消化道出血、粪便隐血阳性和少尿发生率虽然高于对乙酰氨基酚组,但差异均无统计学意义(P>0.05)。两组Ⅱ~Ⅲ期NEC和Ⅲ~Ⅳ级IVH发生率均较低,差异无统计学意义(P>0.05)。见表2。两组均未出现血小板计数<50×109/L、脉搏氧饱和度持续<90%、休克、弥散性血管内凝血、需要换血的高胆红素血症、肠穿孔等药物不良反应。
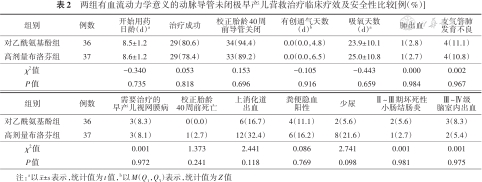
两组有血流动力学意义的动脉导管未闭极早产儿营救治疗临床疗效及安全性比较[例(%)]
两组有血流动力学意义的动脉导管未闭极早产儿营救治疗临床疗效及安全性比较[例(%)]
| 组别 | 例数 | 开始用药日龄(d)a | 治疗成功 | 校正胎龄40周 前导管关闭 | 有创通气天数 (d)b | 吸氧天数 (d)a | 肺出血 | 支气管肺 发育不良 |
|---|---|---|---|---|---|---|---|---|
| 对乙酰氨基酚组 | 36 | 8.5±1.2 | 29(80.6) | 34(94.4) | 0.0(0.0,4.8) | 23.9±10.1 | 1(2.8) | 4(11.1) |
| 高剂量布洛芬组 | 37 | 8.6±1.2 | 29(78.4) | 33(89.2) | 0.0(0.0,6.5) | 25.0±10.8 | 1(2.7) | 4(10.8) |
| χ2值 | -0.340 | 0.053 | 0.153 | -0.105 | -0.443 | 0.000 | 0.002 | |
| P值 | 0.735 | 0.818 | 0.696 | 0.916 | 0.659 | 0.984 | 0.967 |
| 组别 | 例数 | 需要治疗的 早产儿视网膜病 | 校正胎龄 40周前死亡 | 上消化道 出血 | 粪便隐血 阳性 | 少尿 | Ⅱ~Ⅲ期坏死性 小肠结肠炎 | Ⅲ~Ⅳ级 脑室内出血 |
|---|---|---|---|---|---|---|---|---|
| 对乙酰氨基酚组 | 36 | 3(8.3) | 0(0.0) | 6(16.7) | 4(11.1) | 2(5.6) | 2(5.6) | 3(8.3) |
| 高剂量布洛芬组 | 37 | 3(8.1) | 1(2.7) | 12(32.4) | 6(16.2) | 8(21.6) | 1(2.7) | 2(5.4) |
| χ2值 | 0.001 | 1.373 | 2.441 | 0.086 | 2.741 | 0.001 | 0.001 | |
| P值 | 0.972 | 0.241 | 0.118 | 0.769 | 0.098 | 0.981 | 0.975 |
注:a以±s表示,统计值为t值,b以M(Q1,Q3)表示,统计值为Z值
两组营救治疗前血清Cys C、血清肌酐、24 h尿量、血小板计数、BNP、谷丙转氨酶、血清总胆红素等比较差异均无统计学意义(P>0.05)。营救治疗后高剂量布洛芬组血清Cys C高于对乙酰氨基酚组,24 h尿量低于对乙酰氨基酚组,差异有统计学意义(P<0.05)。营救治疗后两组血清肌酐、血小板计数、BNP、谷丙转氨酶、血清总胆红素等差异均无统计学意义(P>0.05)。见表3。
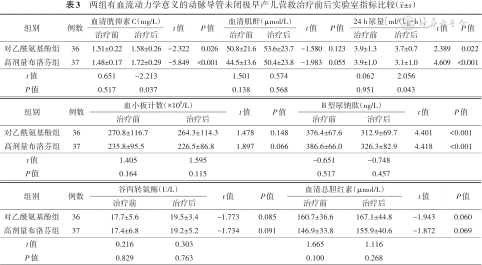
两组有血流动力学意义的动脉导管未闭极早产儿营救治疗前后实验室指标比较(±s)
两组有血流动力学意义的动脉导管未闭极早产儿营救治疗前后实验室指标比较(±s)
| 组别 | 例数 | 血清胱抑素C(mg/L) | t值 | P值 | 血清肌酐(μmol/L) | t值 | P值 | 24 h尿量[ml/(kg·h)] | t值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||||||||
| 对乙酰氨基酚组 | 36 | 1.51±0.22 | 1.58±0.26 | -2.322 | 0.026 | 50.8±21.6 | 53.6±23.7 | -1.580 | 0.123 | 3.9±1.3 | 3.7±0.7 | 2.389 | 0.022 |
| 高剂量布洛芬组 | 37 | 1.48±0.17 | 1.72±0.29 | -5.849 | <0.001 | 44.5±13.6 | 50.4±23.8 | -1.983 | 0.055 | 3.9±1.0 | 3.1±1.0 | 4.609 | <0.001 |
| t值 | 0.651 | -2.213 | 1.501 | 0.574 | 0.062 | 2.056 | |||||||
| P值 | 0.517 | 0.037 | 0.138 | 0.568 | 0.951 | 0.043 | |||||||
| 组别 | 例数 | 谷丙转氨酶(U/L) | t值 | P值 | 血清总胆红素(μmol/L) | t值 | P值 | ||
|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||||||
| 对乙酰氨基酚组 | 36 | 17.7±5.6 | 19.5±3.4 | -1.773 | 0.085 | 160.7±36.6 | 167.1±44.8 | -1.943 | 0.060 |
| 高剂量布洛芬组 | 37 | 17.4±6.8 | 19.2±5.2 | -1.734 | 0.091 | 146.9±33.8 | 155.9±40.6 | -1.872 | 0.069 |
| t值 | 0.216 | 0.303 | 1.665 | 1.116 | |||||
| P值 | 0.829 | 0.763 | 0.100 | 0.268 | |||||
| 组别 | 例数 | 血小板计数(×109/L) | t值 | P值 | B型尿钠肽(ng/L) | t值 | P值 | ||
|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||||||
| 对乙酰氨基酚组 | 36 | 270.8±116.7 | 264.3±114.3 | 1.478 | 0.148 | 376.4±67.6 | 312.9±69.7 | 4.401 | <0.001 |
| 高剂量布洛芬组 | 37 | 235.8±95.5 | 226.5±86.8 | 1.897 | 0.066 | 386.6±66.0 | 326.3±82.9 | 4.418 | <0.001 |
| t值 | 1.405 | 1.595 | -0.651 | -0.748 | |||||
| P值 | 0.164 | 0.115 | 0.517 | 0.457 | |||||
两组营救治疗后血清Cys C均高于治疗前,24 h尿量及BNP均低于治疗前,差异均有统计学意义(P<0.05)。两组治疗前后血清肌酐、血小板计数、谷丙转氨酶及血清总胆红素均无明显变化,差异无统计学意义(P>0.05)。见表3。
早产儿hsPDA的管理目前存在较大争议,生后早期药物治疗虽然有效,但并未明显改善远期结局,故目前趋向于保守管理[1,3,8, 9,13, 14, 15]。但保守管理失败后,选用哪种营救治疗,尚无一致建议[3,16]。
2023年《新英格兰医学杂志》发表的一项多中心非劣效性试验结果显示,在hsPDA超早产儿校正胎龄36周前发生严重不良结局方面,早期保守管理不劣于使用布洛芬[9]。早产儿hsPDA持续开放<7 d并未明显增加校正胎龄36周前发生BPD或死亡的风险,可以选择保守管理;但持续开放7~13 d,上述风险显著增加,建议在出生14 d内开始营救治疗[17, 18]。本研究选择了在出生2周内“先保守管理、后营救治疗”的延期干预策略,结果显示,hsPDA极早产儿生后7~10 d内保守管理成功率达50%以上,明显减少了极早产儿出生早期环氧化酶抑制剂的暴露。
已有较多关于标准剂量布洛芬的相关研究。Xie等[10]荟萃分析了13项口服对乙酰氨基酚与标准剂量布洛芬的随机对照试验,结果显示在第一个疗程后导管关闭率差异无统计学意义;与口服标准剂量布洛芬相比,口服对乙酰氨基酚可降低消化道出血/粪便隐血阳性率和少尿发生率。本团队以往研究也显示,口服对乙酰氨基酚组和口服标准剂量布洛芬组一个疗程后的导管关闭率相似,对乙酰氨基酚组少尿发生率虽更低,但差异无统计学意义,两组粪便隐血阳性、IVH、NEC等发生率相似[11]。
因此,本研究未再对比口服标准剂量布洛芬,而是对比口服对乙酰氨基酚及高剂量布洛芬。结果显示,对乙酰氨基酚营救治疗成功率与高剂量布洛芬相似,校正胎龄40周时两组动脉导管关闭率也相似,其他hsPDA相关不良结局差异无统计学意义。本组患儿延期至生后1~2周开始营救治疗,成功率仍可达80%左右(可能有一定比例系自发闭合),与大多早期药物干预及本团队以往的研究相比,失败率并无明显升高[18, 19]。2022年一项荟萃分析显示,对乙酰氨基酚与布洛芬(大多为标准剂量、少数为高剂量)治疗极早产儿hsPDA一个疗程后,导管关闭失败率无明显差异[18],与本研究结果基本一致。
本研究显示,营救治疗期间高剂量布洛芬组上消化道出血率、粪便隐血阳性率和少尿发生率虽高于对乙酰氨基酚组,但差异均无统计学意义;两组严重NEC及IVH发生率均较低,均未出现血小板计数<50×109/L、脉搏氧饱和度持续<90%、休克、弥散性血管内凝血、需要换血的高胆红素血症、肠穿孔等严重不良发应,与最新荟萃分析结果一致[18]。
Cys C是小分子分泌性蛋白,浓度不受胎龄、日龄、肌肉质量、母体水平等影响,可更早更敏感地预测早产儿72 h内发生急性肾损伤的风险[20]。本研究在患儿出生1周后开始药物干预,治疗后均出现血清Cys C升高、尿量减少,但血清肌酐无明显变化,提示血清Cys C可更早更敏感地反映药物对肾功能的轻微影响。本研究还发现高剂量布洛芬对肾功能的影响可能大于对乙酰氨基酚,考虑原因为:布洛芬非选择性抑制环氧化酶1和2的环氧化酶位点,而对乙酰氨基酚选择性抑制环氧化酶3和过氧化物酶位点,对外周血管的作用较弱[21]。故在使用对乙酰氨基酚或布洛芬,尤其高剂量布洛芬时,应监测血清Cys C及尿量。Ting等[22]比较了生后1周内接受吲哚美辛或布洛芬治疗时早产儿急性肾损伤的发生率,结果显示,无hsPDA的预防组急性肾损伤发生率显著低于有hsPDA的治疗组,且治疗时间越早,急性肾损伤发生率越高,提示患儿存在hsPDA、肾血流可能减少时,出生1周内慎用布洛芬。
BNP是由心室肌细胞分泌的心脏神经激素,心室容量增加和(或)压力增高后,被合成释放入血,能敏感而特异地定量反映心功能尤其是左心室功能变化[23]。一项荟萃分析显示,BNP预测胎龄<30周、生后1~3 d早产儿 hsPDA的界值为250 ng/L,且具有中等准确性[23]。本研究中两组BNP水平在营救治疗后均低于治疗前,提示导管闭合后心功能(主要是左心室前负荷)明显改善。
本研究未发现对乙酰氨基酚与高剂量布洛芬对血小板、谷丙转氨酶及总胆红素有明显影响,考虑与使用时间较短有关。因为本研究主要纳入了极早产儿,hsPDA相关不良结局发生率较低,故研究结论无法推及更需要关注、hsPDA相关不良结局发生率较高的超早产儿的管理。
综上,hsPDA极早产儿早期保守管理失败后,在生后7~10 d开始口服对乙酰氨基酚或高剂量布洛芬营救治疗,成功率为80%左右,均较安全。口服高剂量布洛芬对肾功能的影响可能大于对乙酰氨基酚,但远期影响尚不明确。
王乐瑶, 施鸿珊, 张崇巽, 等. 极早产儿动脉导管未闭营救治疗疗效与安全性的前瞻性研究[J]. 中华新生儿科杂志, 2023, 38(10): 615-620. DOI: 10.3760/cma.j.issn.2096-2932.2023.10.008.
所有作者声明无利益冲突



























