
探讨异机融合11C-蛋氨酸正电子发射断层显像(11C-MET PET)/MRI 对疑似原发性、残留/复发性脑胶质瘤患者的诊断价值。
回顾性分析。纳入2019年6月—2022年12月于武汉大学人民医院PET中心行异机融合11C-MET PET/MRI的65例疑似原发性或残留/复发性脑胶质瘤的患者资料,其中男36例、女29例,年龄13~71(40.6±15.2)岁。疑似原发性脑胶质瘤的初诊患者41例纳入初诊组,脑胶质瘤手术/放射治疗后疑似肿瘤残留/复发患者24例纳入复诊组。初诊组于治疗前、复诊组于治疗结束1个月后,接受11C-MET PET/CT与MR扫描,两种检查均于同日内完成,并进行PET/CT与MRI的异机融合。评估PET与MRI各序列及PET/MRI融合图像特征,于AW 4.6后处理工作站测量并计算病灶的标准化最大摄取值(SUVmax)、靶与非靶比值(T/N)、肿瘤代谢体积(MTV)等PET半定量参数,以及脑血流量(CBF)、表观弥散系数(ADC)与胆碱/N-乙酰基天门冬氨酸比值(Cho/NAA)等MRI半定量参数。以患者的病理组织学诊断或经长期临床或影像学随访所获的临床最终诊断为金标准,评估并比较异机融合11C-MET PET/MRI、11C-MET PET/CT或MRI诊断原发性脑胶质瘤和术后残留/复发性胶质瘤的灵敏度、特异度和准确度。对比分析初诊组内良性与恶性病变患者间、恶性病变不同病理类型的患者间,以及复诊组内肿瘤残留/复发与治疗后改变患者间MR图像特征、PET和MRI半定量参数。
(1)初诊组:11C-MET PET/MRI对原发性胶质瘤诊断的灵敏度(91.7%)高于MRI(66.7%),特异度(94.1%)高于11C-MET PET/CT(64.7%),准确度(92.7%)高于11C-MET PET/CT(75.6%)与MRI(73.2%)。7例良性病变患者与34例恶性病变患者间,瘤周水肿、强化特征与占位效应分级等MR图像特征比较,SUVmax、T/N、CBF、Cho/NAA等半定量参数比较,差异均有统计学意义(P值均<0.05);不同病理类型的恶性病变患者间瘤周水肿、占位效应与强化特征等MR图像特征比较,差异均有统计学意义(P值均<0.05)。(2)复诊组:11C-MET PET/MRI对残留/复发性胶质瘤诊断的灵敏度、准确度(100%、95.8%)均高于11C-MET PET/CT(86.7%、79.2%)和MRI(66.7%、70.8%)。15例肿瘤残留/复发患者与9例治疗后改变患者间SUVmax、MTV、T/N、CBF、Cho/NAA等半定量参数比较,差异均有统计学意义(P值均<0.05)。
异机融合11C-MET PET/MRI在发现与勾勒原发性或残留/复发性脑胶质瘤病灶方面具有重要价值,其诊断效能优于11C-MET PET/CT或MRI单独应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
PET/CT利用不同类型的示踪剂反映组织细胞在代谢、分子与受体水平的变化,在脑肿瘤的诊断和鉴别诊断,放疗计划的制定,肿瘤边界的判断,以及预后评价等方面均有重要作用[1]。目前,临床最常用的PET显像剂为18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG),但脑灰质的生理性摄取以及非肿瘤性病变(如炎症)的摄取会干扰其用于脑肿瘤的诊断,对靠近灰质的低度恶性肿瘤病灶的显像尤其不理想[2]。氨基酸代谢显像剂11C-蛋氨酸(methionine,MET)、脂肪酸代谢显像剂11C-乙酸盐(acetate,ACE)与核酸代谢显像剂18F-胸苷(fluorothymidine,FLT)等多种新型PET放射性示踪剂的研发应用,或PET与MRI同机或异机融合,可有效弥补这一不足[3]。本研究中,我们通过与11C-MET PET/CT或MRI相比较,探讨异机融合11C-MET PET/MRI在脑胶质瘤初次诊断与治疗后评估中的应用价值,旨在为临床脑胶质瘤的精确诊断提供最优化策略。
纳入标准:(1)疑似原发性或残留/复发性脑胶质瘤患者;(2)于同日内先后接受MRI及11C-MET PET/CT检查;(3)无心血管、肝脏及肾脏等严重并发症;(4)疑似残留/复发性脑胶质瘤患者治疗后随访时间>6个月。排除标准:(1)影像学资料质量差,影响观察;(2)临床资料不全。
回顾性分析。纳入2019年6月—2022年12月武汉大学人民医院65例疑似原发性或残留/复发性脑胶质瘤的患者,其中男36例、女29例,年龄13~71(40.6±15.2)岁。患者分2组:疑似脑胶质瘤的初诊患者41例为初诊组,患者均未接受过任何治疗;疑为治疗后肿瘤残留/复发的患者24例为复诊组,治疗方式为脑胶质瘤切除术+术后标准放疗。初诊组患者于治疗前、复诊组于治疗结束1个月后,接受11C-MET PET/CT与MRI检查,要求2种检查于同日内完成。
初诊组41例均经穿刺活检或术后组织病理学检查获得病理诊断:恶性肿瘤患者34例,包括原发性脑胶质瘤24例(低级别14例,高级别10例)、肺癌脑转移3例、原发性中枢神经系统淋巴瘤7例;良性病变7例,包括脱髓鞘性病变2例、感染性病变4例、原发性中枢神经系统血管炎1例。
复诊组24例中,以穿刺活检或二次手术后组织病理学检查获得病理诊断者19例;另外5例患者因拒绝二次手术或穿刺活检,依据其>6个月的临床及影像学随访结果,参考神经肿瘤反应评价(response assessment in neuro-oncology,RANO)的标准[4],作出临床最终诊断。24例中,诊断为肿瘤残留/复发15例、治疗后改变9例。
本研究获得武汉大学人民医院医学伦理委员会审核批准(2019-X-70),所有患者在检查前签署了知情同意书。
采用美国GE公司 Healthcare 750 W 3.0T超导MR仪,扫描序列包括T1WI、T2WI、T2 FLAIR、钆喷替酸葡甲胺(gadolinium dtpa,Gd-DTPA)双倍剂量T1WI Bravo增强,DWI、动脉自旋标记(arterial spin labeling,ASL)与MR波谱(magnetic resonance spectroscopy,MRS)成像。不同序列扫描参数如下。(1)T1WI:TR 2 989 ms,TE 24.0 ms,层厚5 mm,矩阵256×256,视野256 mm×256 mm;(2)T2WI:TR 5 037 ms,TE 105 ms,层厚5 mm,矩阵128×128,视野256 mm×256 mm;(3)T2 FLAIR:TR 9 000 ms,TE 145 ms,层厚为5 mm,视野256 mm×256 mm;(3)Gd-DTPA双倍剂量T1WI Bravo增强:TR 8.5 ms,TE 3.3 ms,层厚1.0 mm;矩阵256×256;(4)DWI:TR 6 000 ms,TE为Minimum,层厚5 mm,矩阵140×140;(5)ASL:TR 4 852.0 ms,TE 10.7 ms,层厚4 mm,矩阵512×512;(6)MRS:TR 1 000 ms,TE 144 ms,体素厚度15 mm。各序列扫描原始数据保存为DICOM格式,传送至PACS。
采用美国GE公司64排128层PET/CT Discovery 710扫描仪进行11C-MET PET/CT扫描。患者静脉注射由本科室制备的 11C-MET(放射性原料为11C-CO2,前体为高半胱氨酸,采用美国GE-TRACERlab FX C Pro全自动11C标记合成模块半自动化合成。放化纯度>95%,无菌热源检测合格),剂量(按患者体质量)为5~7 mg/kg,注射15 min后开始扫描。取仰卧位,采用低剂量CT扫描(管电压80 kV,管电流150 mA)获取头部初始定位像,用于解剖定位与衰减校正。CT平扫参数:电压100 kV,电流120 mA,螺距0.531∶1,球管单圈旋转时间0.8 s,层厚3.75 mm。保持患者体位不变继续行三维静态单床位PET扫描,扫描时间为20 min。扫描完成后,将图像传输至扫描仪自带的AW 4.6后处理工作站,PET通过CT进行衰减校正,采用迭代法重建后,得到多平面(冠状面、矢状面及横断面)CT图像、PET图像及PET/CT融合图像。PET图像原始数据同时保存为DICOM格式,传送至PACS。
将PET与颅脑MRI各序列扫描的DICOM数据从PACS中导出,传输到AW 4.6后处理工作站。以颅骨或头皮为参照,自动结合手动调整MRI与PET的横断面、冠状面与矢状面图像,将图像准确定位融合后保存,得到异机融合11C-MET PET/MRI图像[5]。
采用双盲方法。MRI特征的判断与半定量参数的确定由2名具有10年以上神经系统疾病诊断经验的放射科医师完成,PET/CT及异机融合PET/MRI数据的分析则由2名具有10年以上经验的核医学诊断医师完成,意见有分歧时经讨论达成一致。
MRI的图像特征包括肿瘤的病灶部位、占位效应、瘤周水肿与强化特征等。瘤周水肿分级标准采用水肿指数(edema index,EI)[6]进行评价:EI=1,无水肿;1<EI≤1.5,轻度水肿;1.5<EI≤3,中度水肿;EI>3,重度水肿。脑肿瘤占位效应分级标准[7]:0级,无占位效应;Ⅰ级,局部脑沟、脑池受压,脑室及中线结构无受压变形与移位;Ⅱ级,脑室受压变形,中线结构无移位;Ⅲ级,脑室受压变形,中线结构向对侧移位,但未超过1 cm;Ⅳ级,中线结构向对侧移位超过1 cm。
由2名高年资医生目测确认后,在病灶摄取最高的区域勾画ROI进行半定量分析,使用AW 4.6后处理工作站的软件自动生成标准化最大摄取值(standardized uptake value maximum,SUVmax)及代谢肿瘤体积(metabolic tumor volume,MTV)。靶与非靶比值(target to nontarget ratio,T/N)通过计算脑肿瘤组织与对侧镜像位置正常脑组织SUVmax的比值。
(1)表观弥散系数(apparent diffusion coefficient,ADC)的获得:将DWI原始数据导入AW 4.6后处理工作站,在扩散敏感系数(b值)为1 000 s/mm2状态下,确定肿瘤实质最明显解剖平面,手动勾画ROI,肿瘤实质测量时尽可能避开囊变坏死区域,水肿区测量则避开脑室、脑沟,求取肿瘤实质以及健侧正常脑组织区域ADC值,重复测量3次,取平均值;(2)脑血流量(cerebral blood flow,CBF):使用AW 4.6后处理工作站对原始灌注图像进行后处理,采用去卷积灌注软件进行分析,获得CBF;(3)测算肿瘤实质区及对侧正常脑组织代谢物胆碱/N-乙酰基天门冬氨酸(Cho/NAA)比值。
以患者的病理组织学诊断或经长期临床或影像学随访所获的临床最终诊断为金标准,评估并比较异机融合11C-MET PET/MRI、11C-MET PET/CT或MRI诊断原发性脑胶质瘤和术后残留/复发性胶质瘤的灵敏度、特异度和准确度。对比分析初诊组内良性与恶性病变患者间、恶性病变不同病理类型的患者间,以及复诊组内肿瘤残留/复发与治疗后改变患者间MR图像特征、PET和MRI半定量参数。
应用SPSS 27.0统计软件进行数据分析。计量资料以±s或M(Q1,Q3)表示,两组间比较采用t检验或Mann-Whitney U检验,多组间比较采用方差分析或Mann-Whitney检验;分类资料以例数或百分率(%)表示,采用χ2检验、Fisher确切概率法;等级资料采用Mann-Whitney U检验和Kruskal-Wallis H检验。采用Kappa一致性检验评估2名放射科医生与2名核医学医生的评估与测量结果的一致性。以Kappa<0.40为一致性较差、0.40≤Kappa<0.75为一致性一般、Kappa≥0.75为一致性较好。以P<0.05为差异有统计学意义。
2名放射科医生与2名核医学医生判断结果的一致性检验的Kappa值均≥0.75,一致性均较好。
MRI诊断:16例真阳性、3例假阳性、14例真阴性和8例假阴性。3例假阳性中,肺癌脑转移、病毒性脑炎、脑结核各1例,均被误诊为胶质瘤;8例假阴性中,被误诊为转移瘤、脑脓肿与病毒性脑炎各2例,被误诊为脑膜瘤与自身免疫性脑炎各1例。
11C-MET PET/CT诊断:20例真阳性、6例假阳性、11例真阴性和4例假阴性。6例假阳性中,转移瘤、淋巴瘤各3例,均被误诊为胶质瘤。4例假阴性中,被误诊为转移瘤、淋巴瘤各2例。
异机融合11C-MET PET/MRI诊断:22例真阳性、1例假阳性、16例真阴性和2例假阴性。1例假阳性为转移瘤,2例假阴性中,被误诊为转移瘤、淋巴瘤各1例。
异机融合11C-MET PET/MRI对原发性脑胶质瘤初诊的灵敏度、特异度和准确度均高于11C-MET PET/CT和MRI,见表1。
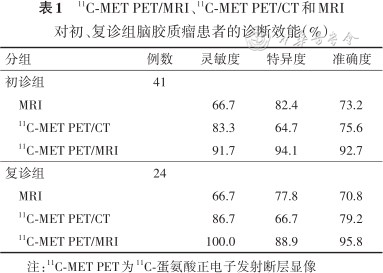
11C-MET PET/MRI、11C-MET PET/CT和MRI对初、复诊组脑胶质瘤患者的诊断效能(%)
11C-MET PET/MRI、11C-MET PET/CT和MRI对初、复诊组脑胶质瘤患者的诊断效能(%)
| 分组 | 例数 | 灵敏度 | 特异度 | 准确度 |
|---|---|---|---|---|
| 初诊组 | 41 | |||
| MRI | 66.7 | 82.4 | 73.2 | |
| 11C-MET PET/CT | 83.3 | 64.7 | 75.6 | |
| 11C-MET PET/MRI | 91.7 | 94.1 | 92.7 | |
| 复诊组 | 24 | |||
| MRI | 66.7 | 77.8 | 70.8 | |
| 11C-MET PET/CT | 86.7 | 66.7 | 79.2 | |
| 11C-MET PET/MRI | 100.0 | 88.9 | 95.8 |
注:11C-MET PET为11C-蛋氨酸正电子发射断层显像
MRI诊断:10例真阳性、2例假阳性、7例真阴性和5例假阴性;11C-MET PET/CT诊断:13例真阳性、3例假阳性、6例真阴性和2例假阴性;异机融合11C-MET PET/MRI诊断:15例真阳性、1例假阳性、8例真阴性和0例假阴性。
异机融合11C-MET PET/MRI对残留/复发性胶质瘤诊断的灵敏度、特异度和准确度均高于11C-MET PET/CT与MRI,见表1。
7例良性病变患者与34例恶性病变患者间,以及34例不同病理类型的恶性病变患者间,MRI图像特征比较,包括瘤周水肿、强化特征、占位效应分级比较,差异均有统计学意义(P值均<0.05),见表2。良性病变患者的半定量参数SUVmax、T/N、CBF与Cho/NAA均低于恶性病变患者,差异均有统计学意义(P值均<0.01),见表3;34例不同病理类型的恶性病变患者间各半定量参数比较,差异均无统计学意义(P值均>0.05),见表4。
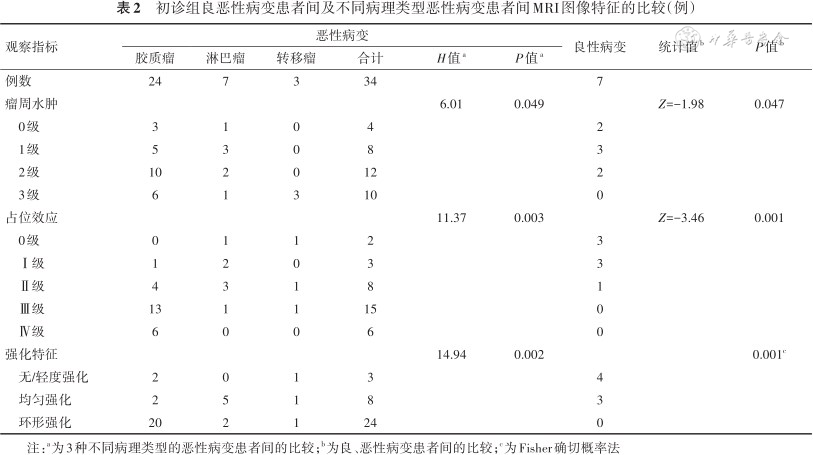
初诊组良恶性病变患者间及不同病理类型恶性病变患者间MRI图像特征的比较(例)
初诊组良恶性病变患者间及不同病理类型恶性病变患者间MRI图像特征的比较(例)
| 观察指标 | 恶性病变 | 良性病变 | 统计值b | P值b | |||||
|---|---|---|---|---|---|---|---|---|---|
| 胶质瘤 | 淋巴瘤 | 转移瘤 | 合计 | H值a | P值a | ||||
| 例数 | 24 | 7 | 3 | 34 | 7 | ||||
| 瘤周水肿 | 6.01 | 0.049 | Z=-1.98 | 0.047 | |||||
| 0级 | 3 | 1 | 0 | 4 | 2 | ||||
| 1级 | 5 | 3 | 0 | 8 | 3 | ||||
| 2级 | 10 | 2 | 0 | 12 | 2 | ||||
| 3级 | 6 | 1 | 3 | 10 | 0 | ||||
| 占位效应 | 11.37 | 0.003 | Z=-3.46 | 0.001 | |||||
| 0级 | 0 | 1 | 1 | 2 | 3 | ||||
| Ⅰ级 | 1 | 2 | 0 | 3 | 3 | ||||
| Ⅱ级 | 4 | 3 | 1 | 8 | 1 | ||||
| Ⅲ级 | 13 | 1 | 1 | 15 | 0 | ||||
| Ⅳ级 | 6 | 0 | 0 | 6 | 0 | ||||
| 强化特征 | 14.94 | 0.002 | 0.001c | ||||||
| 无/轻度强化 | 2 | 0 | 1 | 3 | 4 | ||||
| 均匀强化 | 2 | 5 | 1 | 8 | 3 | ||||
| 环形强化 | 20 | 2 | 1 | 24 | 0 | ||||
注:a为3种不同病理类型的恶性病变患者间的比较;b为良、恶性病变患者间的比较;c为Fisher确切概率法
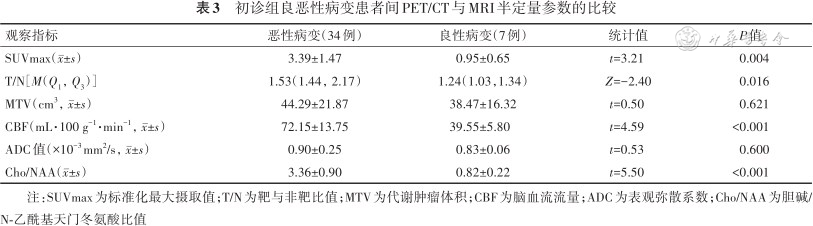
初诊组良恶性病变患者间PET/CT与MRI半定量参数的比较
初诊组良恶性病变患者间PET/CT与MRI半定量参数的比较
| 观察指标 | 恶性病变(34例) | 良性病变(7例) | 统计值 | P值 |
|---|---|---|---|---|
| SUVmax(±s) | 3.39±1.47 | 0.95±0.65 | t=3.21 | 0.004 |
| T/N[M(Q1,Q3)] | 1.53(1.44,2.17) | 1.24(1.03,1.34) | Z=-2.40 | 0.016 |
| MTV(cm3,±s) | 44.29±21.87 | 38.47±16.32 | t=0.50 | 0.621 |
| CBF(mL·100 g-1·min-1,±s) | 72.15±13.75 | 39.55±5.80 | t=4.59 | <0.001 |
| ADC值(×10-3mm2/s,±s) | 0.90±0.25 | 0.83±0.06 | t=0.53 | 0.600 |
| Cho/NAA(±s) | 3.36±0.90 | 0.82±0.22 | t=5.50 | <0.001 |
注:SUVmax为标准化最大摄取值;T/N为靶与非靶比值;MTV为代谢肿瘤体积;CBF为脑血流流量;ADC为表观弥散系数;Cho/NAA为胆碱/ N-乙酰基天门冬氨酸比值
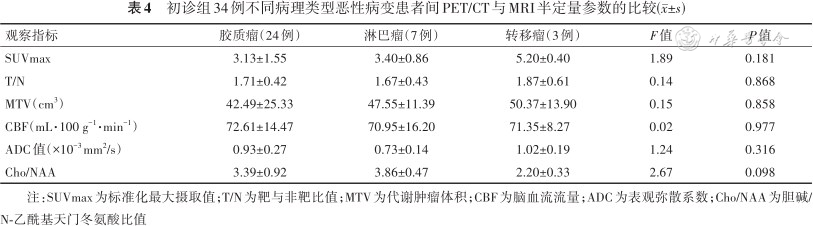
初诊组34例不同病理类型恶性病变患者间PET/CT与MRI半定量参数的比较(±s)
初诊组34例不同病理类型恶性病变患者间PET/CT与MRI半定量参数的比较(±s)
| 观察指标 | 胶质瘤(24例) | 淋巴瘤(7例) | 转移瘤(3例) | F值 | P值 |
|---|---|---|---|---|---|
| SUVmax | 3.13±1.55 | 3.40±0.86 | 5.20±0.40 | 1.89 | 0.181 |
| T/N | 1.71±0.42 | 1.67±0.43 | 1.87±0.61 | 0.14 | 0.868 |
| MTV(cm3) | 42.49±25.33 | 47.55±11.39 | 50.37±13.90 | 0.15 | 0.858 |
| CBF(mL·100 g-1·min-1) | 72.61±14.47 | 70.95±16.20 | 71.35±8.27 | 0.02 | 0.977 |
| ADC值(×10-3mm2/s) | 0.93±0.27 | 0.73±0.14 | 1.02±0.19 | 1.24 | 0.316 |
| Cho/NAA | 3.39±0.92 | 3.86±0.47 | 2.20±0.33 | 2.67 | 0.098 |
注:SUVmax为标准化最大摄取值;T/N为靶与非靶比值;MTV为代谢肿瘤体积;CBF为脑血流流量;ADC为表观弥散系数;Cho/NAA为胆碱/ N-乙酰基天门冬氨酸比值
残留/复发性脑胶质瘤患者的半定量参数,包括SUVmax、MTV、T/N、CBF与Cho/NAA,均高于治疗后改变的患者,差异均有统计学意义(P值均<0.05),见表5。
复诊组15例肿瘤残留/复发患者与9例治疗后改变患者间PET/CT和MRI半定量参数的比较
复诊组15例肿瘤残留/复发患者与9例治疗后改变患者间PET/CT和MRI半定量参数的比较
| 半定量参数 | 肿瘤残留/复发(15例) | 治疗后改变(9例) | 统计值 | P值 |
|---|---|---|---|---|
| SUVmax(±s) | 3.36±1.02 | 2.52±0.71 | t=2.17 | 0.041 |
| T/N[M(Q1,Q3)] | 1.88±0.21 | 1.25±0.22 | t=6.86 | <0.001 |
| MTV(cm3,±s) | 43.37±20.10 | 24.02±7.99 | t=2.74 | 0.012 |
| CBF(mL·100 g-1·min-1,±s) | 54.93(48.60,60.40) | 33.05(24.60,33.05) | Z=-3.90 | <0.001 |
| ADC值(×10-3mm2/s,±s) | 1.01±0.22 | 0.96±0.14 | t=0.67 | 0.505 |
| Cho/NAA(±s) | 3.31±0.78 | 1.18±0.51 | t=7.30 | <0.001 |
注:SUVmax为标准化最大摄取值;T/N为靶与非靶比值;MTV为代谢肿瘤体积;CBF为脑血流流量;ADC为表观弥散系数;Cho/NAA为胆碱/ N-乙酰基天门冬氨酸比值
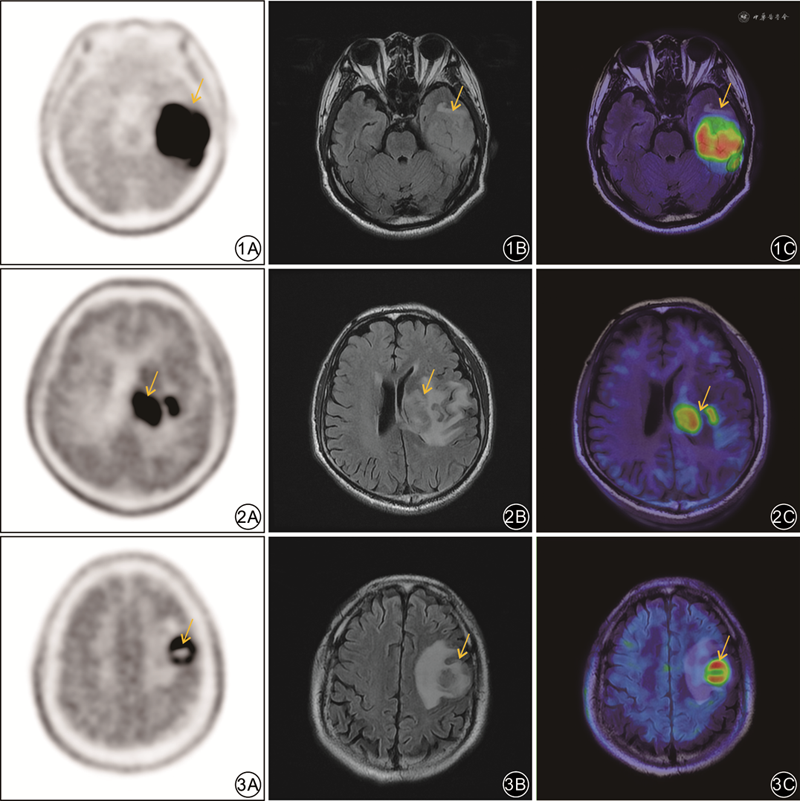

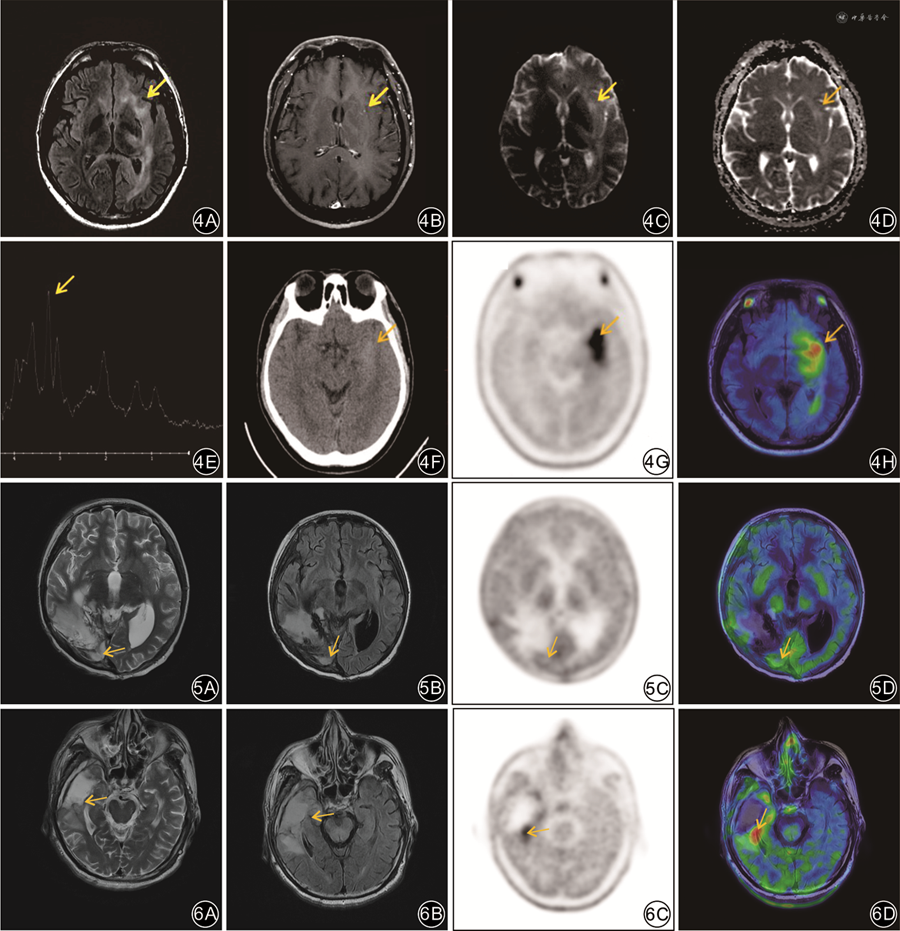

临床实践证实,11C-MET PET/CT在脑胶质瘤的诊断、分级、预后评估、浸润范围的勾画、活检及放疗计划的制定、放射性脑损伤与肿瘤残留/复发的鉴别诊断等方面起到重要作用[8]。同时异机融合软件功能也日益成熟,保证了脑部融合图像的准确可靠,成为提升脑肿瘤诊断的有效策略。本研究结果显示,异机融合11C-MET PET/MRI在原发性和残留/复发性脑胶质瘤的诊断与鉴别诊断方面均有较高的临床应用价值,其诊断效能优于11C-MET PET/CT或MRI单独应用。
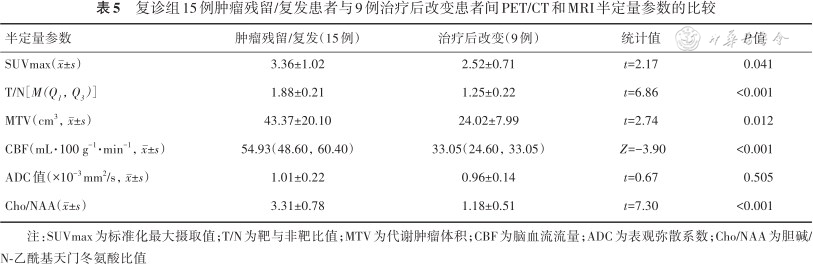
本研究结果显示,11C-MET PET/MRI对原发性胶质瘤初诊的灵敏度(91.7%)较MRI(66.7%)明显提高。初诊组MRI诊断8例假阴性,其中6例将脑胶质瘤误诊为良性病变,11C-MET PET/CT诊断4例假阴性,均将脑胶质瘤误诊为其他病理类型的恶性肿瘤。11C-MET PET/CT诊断脑胶质瘤的假阴性率(16.7%)低于MRI(33.3%),说明MRI可能对病变良恶性的鉴别诊断缺乏特异性;而11C-MET PET/CT在良恶性鉴别方面具有一定优势。然而在某些情况下,11C-MET PET对脑良恶性病变的鉴别也会有困难,主要是由于各种原因造成的血-脑屏障破坏、胶质增生、炎性细胞浸润等,可能会引起良性病变中11C-MET摄取的增加[9],但本研究中未发现类似情况。同时,我们进一步分析了PET/MRI半定量指标在病变良恶性鉴别方面的应用价值,结果发现,除了PET半定量指标SUVmax与T/N具有很大优势之外,ASL半定量指标CBF及MRS半定量指标Cho/NAA在初诊组良恶性肿瘤患者之间的差异也有统计学意义,与以往报道相同[10],说明功能MRI技术对肿瘤良恶性鉴别也具有重要价值。CBF可定量评估脑肿瘤血流灌注情况,在脑肿瘤诊断方面具有一定优势。由于肿瘤异质性,为了满足其异常增生细胞的氧供,血管内皮生长因子表达增加,进而新生血管增多,血流量丰富[11]。但ASL对运动非常敏感,易出现大量伪影[12],临床应用价值有限。MRS也存在一定的局限性:包括要求磁场均匀度足够高以保证其谱线质量,要求成像组织或区域内含脂与含水相对较少,成像体素内尽量避免包含骨板、气窦、血流、脑脊液、金属、坏死、钙化、脂肪、出血等有磁敏感效应的组织结构等[13]。以上因素均可影响分析结果的准确性,导致误诊。本研究中的图1病例是弥漫性脑胶质瘤患者,采用MRS分析其病灶的Cho峰升高、NAA峰稍降低,Cho/NAA比值较对侧轻度增加,考虑为炎性细胞浸润导致的Cho峰升高,因而被误诊为脑炎。
本研究结果还显示,11C-MET PET/CT对脑胶质瘤初诊患者的假阳性率较高,说明11C-MET PET/CT在不同病理类型恶性肿瘤的鉴别诊断中存在困难。初诊组41例中,11C-MET PET/CT诊断假阳性6例(14.6%),其中3例转移瘤与3例淋巴瘤被误诊为脑胶质瘤;在融合MRI后,其中5例(5/6)假阳性得到了纠正,因此11C-MET PET/MRI的准确性明显提高,为92.7%(38/41),高于11C-MET PET/CT或MRI,说明MRI可为11C-MET PET/CT诊断胶质瘤初诊带来明显的增益。通过进一步分析PET/MRI的不同影像特征对不同病理类型恶性肿瘤的鉴别诊断价值,发现MRI所提供的瘤周水肿、占位效应与强化特征在不同病理类型恶性肿瘤间差异有统计学意义(P<0.05),可见MRI在不同病理类型恶性肿瘤的鉴别诊断中为11C-MET PET提供重要增益价值。
本研究中,对24例临床怀疑残留/复发性胶质瘤的患者研究结果表明:11C-MET PET在鉴别肿瘤残留/复发与治疗后改变时,其灵敏度与准确度均优于MRI,与以往报道相同[14]。肿瘤细胞处于异常增殖状态,尤其是脑胶质瘤残留/复发时,其恶性程度可进一步增加,氨基酸代谢率也大幅提高,导致11C-MET在病变部位明显富集[15];而由于手术或放疗等治疗手段可能会导致血-脑屏障的损伤、胶质增生与炎性细胞浸润,有时会引起治疗后11C-MET摄取增加,增加的幅度一般会低于肿瘤残留/复发[16],但二者之间的SUVmax值仍会存在一定的重叠。Tripathi等[17]研究表明,肿瘤与正常脑组织的SUVmax比值(T/N)>1.9是11C-MET PET/CT区分残留/复发性脑胶质瘤与治疗后改变的最佳截断值,灵敏度与特异度可达95%与89%;Deuschl等[18]以T/N1.47作为最佳截断值,灵敏度与特异度分别为76%与87%。D'Souza等[19]对11C-MET PET/CT与MRI对脑胶质瘤治疗后是否残留/复发的评估效能进行比较,结果显示11C-MET PET/CT在识别肿瘤复发/残留方面表现出更高的灵敏度(94.7%),MRI则表现出更高的特异度(90.0%)。在本研究中,11C-MET PET/CT对残留/复发性胶质瘤诊断灵敏度(86.7%)高于MRI(66.7%),MRI的特异度(77.8%)高于11C-MET PET/CT(66.7%)。因此,两者融合可在一定程度上优势互补,大大提高诊断性能(95.8%),与既往研究结果相仿(96.0%)[18]。
本研究主要存在的局限性:(1)样本量尚显不足,尤其是在比较不同显像方式在初诊组及复诊组中的诊断价值时;(2)复诊组中由于部分患者拒绝二次手术或穿刺活检,导致缺乏明确的组织病理学诊断,所以更多依靠后期影像随访,因此选择何种无创性影像手段对于治疗后评估十分重要;(3)本研究仅使用部分图像特征及半定量参数来进行鉴别诊断,未来还需进一步研究更多影像参数结合的鉴别诊断效能。
综上所述,11C-MET PET/CT在区分原发性胶质瘤与良性病变、残留/复发性脑胶质瘤与治疗后改变方面具有明显优势,ASL、MRS也具有重要意义,二者可强强联合;但11C-MET PET/CT在不同病理类型恶性病变的鉴别诊断方面存在不足,而MRI的图像特征(瘤周水肿、占位效应及强化特征)则对其有很大的弥补作用。11C-MET PET/MRI在脑胶质瘤初诊与治疗后评估中具有重要应用价值,其诊断效能较11C-MET PET/CT或MRI单独应用均有明显的提升。
姜双士, 刘烜利, 冯洪燕, 等. 异机融合11C-蛋氨酸PET/MRI在原发性、残留/复发性脑胶质瘤诊断中的应用[J]. 中华解剖与临床杂志, 2023, 28(10): 631-639. DOI: 10.3760/cma.j.cn101202-20230217-00040.
所有作者声明不存在利益冲突































