
对比分析食管床路径与胸骨后路径胸腔镜食管癌切除术的临床疗效。
回顾性列队研究。纳入2018年1月—2022年1月于南阳南石医院食管癌患者116例,其中男69例、女47例,年龄45~67(56.5±5.5)岁,食管癌分期Ⅰ期26例、Ⅱ期67例、Ⅲ期23例。116例患者均行食管癌胸腔镜切除术,根据手术路径不同分为2组:经食管床路径行食管癌胸腔镜切除术的58例患者纳入食管床组,经胸骨后路径行食管癌胸腔镜切除术的58例患者纳入胸骨后组。观察指标:(1)比较2组患者性别、年龄、病程、肿瘤类型、肿瘤位置、合并症等基线资料;(2)对比2组患者手术时间、术中出血量,术后引流管留置时间、术后胃液引流总量,以及术后切口感染、肺部感染、乳糜胸、吻合口瘘、心律失常等并发症发生率。(3)采用标准吞咽功能评分量表(SSA)评分、Burke吞咽障碍筛查量表评分(简称Burke评分)及X线荧光透视(VFSS)评分评估并对比2组患者术前、术后3个月吞咽功能。(4)对比2组患者术后3个月生活质量总评分和生活质量各单项评分。(5)比较2组患者随访期间复发率、转移率和生存情况。
(1)2组患者基线资料比较,差异均无统计学意义(P值均>0.05)。(2)116例患者均顺利完成手术,2组患者手术时间、术中出血量比较,差异均无统计学意义(t=1.50、1.20,P值均>0.05)。胸骨后组术后胃液引流总量(349.7±41.9)mL小于食管床组的(736.2±52.1)mL,吻合口瘘发生率(8/58,13.8%)高于食管床组(1/58,1.7%),差异均有统计学意义(t=44.03、χ2=4.34,P值均<0.05);2组患者术后引流管留置时间及肺部感染、乳糜胸、心律失常等并发症发生率比较,差异均无统计学意义(P值均>0.05)。(3)116例患者均获随访,随访时间3~12(7.3±1.5)个月。术后3个月吞咽功能SSA、Burke、VFSS评分,食管床组分别为(24.2±1.2)、(2.5±0.3)、(7.2±0.9)分,胸骨后组分别为(24.5±1.2)、(2.6±0.3)、(7.0±0.8)分。吞咽功能组内比较,2组术后3个月SSA、Burke评分均低于术前,VFSS评分高于术前,差异均有统计学意义(P值均<0.05);组间比较,2组术前、术后3个月SSA、Burke、VFSS评分差异均无统计学意义(P值均>0.05)。(4)术后3个月2组患者生活质量总分和各单项评分比较,差异均无统计学意义(P值均>0.05)。(5)随访期间胸骨后组复发2例、肝转移1例,食管床组复发1例、骨转移和脑转移各1例,2组患者复发率、转移率差异均无统计学意义(χ2=0.51、0.00,P值均>0.05)。2组患者随访期间无一例死亡。
食管床路径与胸骨后路径胸腔镜食管癌切除术均可获得良好的肿瘤治疗效果,能够改善患者吞咽功能,提高患者生活质量;食管床路径手术患者术后吻合口瘘发生率较低,胸骨后路径手术患者术后胃液引流总量较低。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
食管癌是一种消化道恶性肿瘤,发病率较高;据统计,我国北方发病率高于南方,40岁以上中老年人为该病高发人群,男性发病率高于女性[1]。食管癌侵袭性较强,且预后不佳,5年生存率较低,仅有15%~25%[2]。食管切除术是局部食管癌临床治疗的主要手段,传统开胸食管切除术创伤大、恢复慢、术后并发症较多,因此,侵入性较小的胸腔镜手术越来越受到关注[3]。食管癌胸腔镜切除术能够切除较长食管,同时可清扫颈、胸和上腹部淋巴结,创伤小、恢复快,具有较好的临床效果[4]。临床上常采用胸骨后路径和食管床路径两种方式进行食管癌胸腔镜切除术[5, 6],但有关两种手术路径术后疗效对比研究的报道较少。因此,在本研究中我们回顾性分析116例食管癌胸腔镜切除术患者的临床资料,比较经食管床路径与胸骨后路径行食管癌胸腔镜切除术的临床疗效,旨在为临床食管癌治疗方案的选择提供参考。
纳入标准:(1)经术前活检首次确诊为食管癌,且TNM分期为Ⅰ~Ⅲ期;(2)彩超、CT检查未发现肿瘤远处转移;(3)行胸骨后路径或食管床路径胸腔镜切除手术;(4)资料完整。排除标准:(1)合并其他恶性肿瘤;(2)既往有胸腔、胃肠手术史;(3)术前行新辅助化疗等抗肿瘤治疗;(4)合并血液、免疫系统疾病;(5)有严重心、肝、脑、肾等器官功能障碍。
回顾性队列研究。纳入2018年1月—2022年1月南阳南石医院收治的食管癌患者116例,其中男69例、女47例,年龄45~67(56.5±5.5)岁。患者临床表现吞咽困难59例、胸口疼痛35例、有异物感22例,病程4~11(6.5±2.1)个月。患者术前均行胃镜、彩超、CT检查,肿瘤位于食管上段15例、中段68例、下段33例,肿瘤体积3~8(5.3±1.0)cm3;TNM分期Ⅰ期26例,Ⅱ期67例,Ⅲ期23例。116例患者中,合并高血压38例,糖尿病42例,高脂血症36例。116例患者根据手术路径不同分为2组:经食管床路径行食管癌胸腔镜切除术的58例患者纳入食管床组,经胸骨后路径行食管癌胸腔镜切除术的58例患者纳入胸骨后组。
本研究符合《赫尔辛基宣言》要求。所有患者签署手术知情同意书。
双腔气管麻醉后行静脉注射复合麻醉。
胸腔镜手术:患者选择左侧卧位,第1切口取腋后线第7或8肋间隙作为观察孔,第2切口取腋后线第6肋间隙作为主操作孔,第3、4切口分别取肩胛骨后下角线第7、9肋间作为辅助操作孔。从观察孔置入内视镜,确定肿瘤组织切除位置。从操作孔采用电凝钩将外膜肌层切开,充分分离后离断奇静脉,牵引食管,做胸部食管的全程游离,清扫隆突下及全段食管旁淋巴结,食管床彻底止血后,从操作孔将胸腔引流管置入胸腔并关闭切口。
腹腔手术:患者改为平卧位,头部要高于脚部。留置胃管导出患者胃内积液、积气。第1切口取脐上1 cm处作为观察孔,第2、3切口分别取锁骨中线脐旁左、右1 cm处作为主操作孔,第4切口取腹正中剑突线下3 cm处作为辅助操作孔。从观察孔置入腹腔镜探查腹腔内粘连和转移情况。从操作孔使用超声刀先游离胃大弯侧,游离并切断脾胃韧带,同时切断胃短动脉,即胃网膜左动脉。脾胃间隙完全游离开后,把胃底向前牵拉,沿胃网膜右动脉切断大网膜至胃网膜右动脉根部,勿损伤胃网膜右动脉,胃大弯侧彻底游离开后,把胃大弯向前牵拉翻转,游离并切断胃后动脉,显露胰腺上缘,暴露胃左动脉及冠状静脉。清扫胃左动脉旁淋巴结,在胰腺上缘切断结扎胃左动脉及胃冠状静脉后,胃复位并向左下牵拉,充分显露并切断肝胃韧带。在近幽门处切断胃右动脉,胃大小弯彻底游离后,打开两侧膈肌脚部,游离并切断贲门及食管下段。用腔镜切割缝合器以胃底最高点距离胃小弯侧1.5 cm处为起点,平行于胃大弯至幽门上2.5 cm处做外径4.0~5.0 cm管状胃,切除贲门及胃小弯侧胃组织送病理检查,留取胃大弯侧管状胃做代食管。
颈部手术:从胸锁关节处沿左胸乳突肌前侧做长约5 cm切口,分离胸锁乳头肌及胸骨甲状肌,切断肩胛舌骨肌。钝性游离食管床,充分暴露颈部食管,距食管入口5 cm处切断食管。颈部食管游离完成后,在上腹剑突下正中线做4~5 cm的纵切口,从切口处将切除的食管及其肿瘤和管状胃拉出,切除食管及肿瘤送病理检查,在管状胃的头端制作牵引管。由食管床路径将游离的管状胃上提至颈部。用吻合器做颈段食管与管状胃的端侧吻合并包埋。术毕放置颈部、胸腔和腹部引流管,缝合切口。
麻醉方式、胸腔镜手术、腹腔手术步骤同食管床组。
颈部手术:从胸廓入口做长约4 cm切口,钝性分离胸骨后组织,打通约3横指宽通道至剑突下,完成胸骨后隧道。然后充分扩展胸骨后隧道,经胸骨后隧道将管状胃上提至颈部,切除病灶部食管,切缘距离肿瘤边缘大于4 cm。完成左颈部食管与管状胃的端侧吻合。放置颈部、胸腔和腹部引流管,缝合切口。
2组患者术后常规抗感染、补液、营养支持治疗。观察胸腔、颈部、腹部引流管和胃管术后引流量,24 h引流液颜色明显变浅且引流量明显减少,胸腔引流管引流量<200 mL/d、连续3 d即可拔管,颈部和腹腔引流管引流量<50 mL/d、连续3 d即可拔管。胃管引流量<40 mL/d、连续2 d即可拔管。待患者切口愈合后常规行术后化疗治疗。术后1、3、6、12个月定期随访,观察患者手术相关并发症发生情况、吞咽功能恢复情况、生活质量及生存情况,以及食管癌复发、转移情况。
(1)比较2组患者性别、年龄、病程、肿瘤类型、肿瘤位置、合并症等基线资料。(2)对比2组患者手术时间、术中出血量,术后胃管留置时间、胃液引流总量,以及术后切口感染、肺部感染、乳糜胸、吻合口瘘、心律失常等并发症发生情况。(3)对比2组患者术前、术后3个月吞咽功能。吞咽功能采用标准吞咽功能评分量表(standardized swallowing assessment,SSA)[7]、Burke吞咽障碍筛查量表(简称Burke评分)[8]及X线荧光透视(video fluoroscopic swallowing study,VFSS)评分[9]进行评估。SSA评分总分46分,得分越高,吞咽功能越差;Burke评分总分7分,得分越高,吞咽功能越差;VFSS评分总分10分,得分越高,吞咽功能越好。(4)对比2组患者术后3个月生活质量总评分和生活质量各单项评分。参照欧洲癌症病人生命质量核心量表(quality of life questionnaire-core 30,QLQ-C 30)[10]和欧洲癌症病人生命质量-食管癌专用量表(European quality of life for cancer patients-special scale for esophageal cancer,QLQ-OES)[11]制作生活质量调查问卷,问卷有吞咽困难、疼痛、胃食管反流、社交障碍、情绪低落5个不良症状,每个症状按严重程度评分0~10分,得分越高,症状越严重。生活质量总评分=100-2×不良症状总分。(5)统计对比2组患者随访期间食管癌复发、转移情况和患者生存情况。
应用SPSS 20.0统计软件进行数据分析。服从正态分布的计量资料以±s表示,组间比较采用独立样本t检验,组内不同时间比较采用配对t检验。分类资料采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2组患者基线资料比较,差异均无统计学意义(P值均>0.05)。见表1。
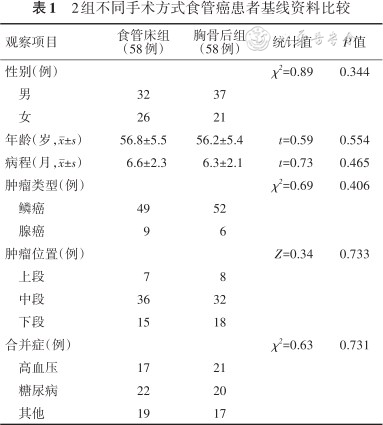
2组不同手术方式食管癌患者基线资料比较
2组不同手术方式食管癌患者基线资料比较
| 观察项目 | 食管床组(58例) | 胸骨后组(58例) | 统计值 | P值 |
|---|---|---|---|---|
| 性别(例) | χ2=0.89 | 0.344 | ||
| 男 | 32 | 37 | ||
| 女 | 26 | 21 | ||
| 年龄(岁,±s) | 56.8±5.5 | 56.2±5.4 | t=0.59 | 0.554 |
| 病程(月,±s) | 6.6±2.3 | 6.3±2.1 | t=0.73 | 0.465 |
| 肿瘤类型(例) | χ2=0.69 | 0.406 | ||
| 鳞癌 | 49 | 52 | ||
| 腺癌 | 9 | 6 | ||
| 肿瘤位置(例) | Z=0.34 | 0.733 | ||
| 上段 | 7 | 8 | ||
| 中段 | 36 | 32 | ||
| 下段 | 15 | 18 | ||
| 合并症(例) | χ2=0.63 | 0.731 | ||
| 高血压 | 17 | 21 | ||
| 糖尿病 | 22 | 20 | ||
| 其他 | 19 | 17 |
116例患者均顺利完成手术,术中均无严重并发症及异常情况发生。2组患者手术时间、术中出血量比较,差异均无统计学意义(P值均>0.05)。见表2。
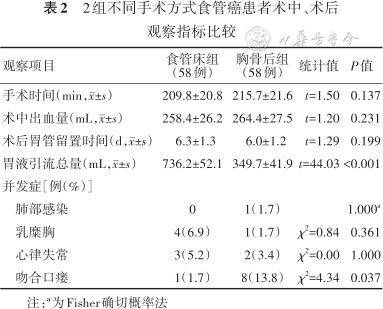
2组不同手术方式食管癌患者术中、术后观察指标比较
2组不同手术方式食管癌患者术中、术后观察指标比较
| 观察项目 | 食管床组(58例) | 胸骨后组(58例) | 统计值 | P值 |
|---|---|---|---|---|
| 手术时间(min,±s) | 209.8±20.8 | 215.7±21.6 | t=1.50 | 0.137 |
| 术中出血量(mL,±s) | 258.4±26.2 | 264.4±27.5 | t=1.20 | 0.231 |
| 术后胃管留置时间(d,±s) | 6.3±1.3 | 6.0±1.2 | t=1.29 | 0.199 |
| 胃液引流总量(mL,±s) | 736.2±52.1 | 349.7±41.9 | t=44.03 | <0.001 |
| 并发症[例(%)] | ||||
| 肺部感染 | 0 | 1(1.7) | 1.000a | |
| 乳糜胸 | 4(6.9) | 1(1.7) | χ2=0.84 | 0.361 |
| 心律失常 | 3(5.2) | 2(3.4) | χ2=0.00 | 1.000 |
| 吻合口瘘 | 1(1.7) | 8(13.8) | χ2=4.34 | 0.037 |
注:a为Fisher确切概率法
116例患者术后均无切口感染;肺部感染1例,予头孢菌素、抗假单胞菌β内酰胺等抗感染处理后恢复良好;乳糜胸5例,予禁食、胸膜腔引流处理后,恢复良好;吻合口瘘9例,予清除脓液及坏死组织、胃肠减压处理后,瘘口愈合;心律失常5例,予适当β受体阻滞剂处理后,心律恢复良好。2组患者术后观察指标比较,胸骨后组术后胃液引流总量小于食管床组,吻合口瘘发生率高于食管床组,差异均有统计学意义(P值均<0.05);胃管留置时间及肺部感染、乳糜胸、心律失常等并发症发生率比较,差异均无统计学意义(P值均>0.05)。见表2。
2组患者均获随访,随访时间3~12(7.3±1.5)个月。吞咽功能比较:2组患者术后3个月SSA、Burke评分均低于术前,VFSS评分高于术前,差异均有统计学意义(P值均<0.001);2组间术前、术后3个月SSA、Burke、VFSS评分比较,差异均无统计学意义(P值均>0.05)。见表3。术后3个月2组间生活质量总分和单项评分比较,差异均无统计学意义(P值均>0.05)。见表4。
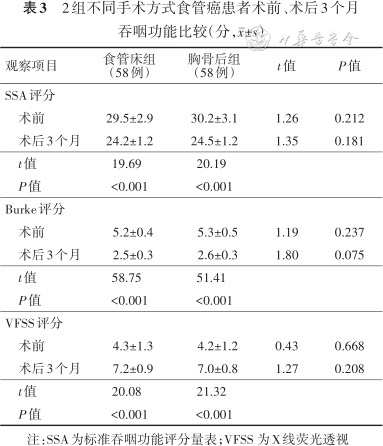
2组不同手术方式食管癌患者术前、术后3个月吞咽功能比较(分,±s)
2组不同手术方式食管癌患者术前、术后3个月吞咽功能比较(分,±s)
| 观察项目 | 食管床组 (58例) | 胸骨后组 (58例) | t值 | P值 |
|---|---|---|---|---|
| SSA评分 | ||||
| 术前 | 29.5±2.9 | 30.2±3.1 | 1.26 | 0.212 |
| 术后3个月 | 24.2±1.2 | 24.5±1.2 | 1.35 | 0.181 |
| t值 | 19.69 | 20.19 | ||
| P值 | <0.001 | <0.001 | ||
| Burke评分 | ||||
| 术前 | 5.2±0.4 | 5.3±0.5 | 1.19 | 0.237 |
| 术后3个月 | 2.5±0.3 | 2.6±0.3 | 1.80 | 0.075 |
| t值 | 58.75 | 51.41 | ||
| P值 | <0.001 | <0.001 | ||
| VFSS评分 | ||||
| 术前 | 4.3±1.3 | 4.2±1.2 | 0.43 | 0.668 |
| 术后3个月 | 7.2±0.9 | 7.0±0.8 | 1.27 | 0.208 |
| t值 | 20.08 | 21.32 | ||
| P值 | <0.001 | <0.001 |
注:SSA为标准吞咽功能评分量表;VFSS 为X线荧光透视
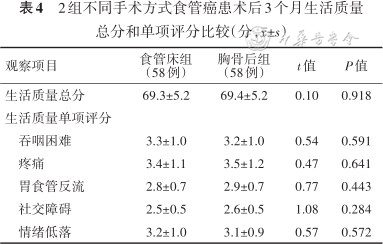
2组不同手术方式食管癌患术后3个月生活质量总分和单项评分比较(分,±s)
2组不同手术方式食管癌患术后3个月生活质量总分和单项评分比较(分,±s)
| 观察项目 | 食管床组(58例) | 胸骨后组(58例) | t值 | P值 |
|---|---|---|---|---|
| 生活质量总分 | 69.3±5.2 | 69.4±5.2 | 0.10 | 0.918 |
| 生活质量单项评分 | ||||
| 吞咽困难 | 3.3±1.0 | 3.2±1.0 | 0.54 | 0.591 |
| 疼痛 | 3.4±1.1 | 3.5±1.2 | 0.47 | 0.641 |
| 胃食管反流 | 2.8±0.7 | 2.9±0.7 | 0.77 | 0.443 |
| 社交障碍 | 2.5±0.5 | 2.6±0.5 | 1.08 | 0.284 |
| 情绪低落 | 3.2±1.0 | 3.1±0.9 | 0.57 | 0.572 |
胸骨后组术后3、6个月食管癌复发各1例,均予放射治疗;术后6个月肝转移1例,给予免疫治疗。食管床组术后6个月食管癌复发1例,采用放射治疗;术后12个月骨转移1例予姑息性放疗,脑转移1例予放射治疗。2组患者食管癌复发率、转移率比较,差异均无统计学意义(χ2=0.51、0.00,P=0.476、1.000)。随访期间2组患者无一例死亡。
食管癌致病因素很多,包括遗传、吸烟、饮酒、熏腊食品中的亚硝胺、促亚硝胺形成的真菌感染及缺乏维生素引起的免疫力降低等[12]。食管癌患者临床表现为吞咽困难、胸骨后疼痛,随着后期病情加重,患者可发生呼吸困难、肺气肿等情况。此外,肿瘤引起的食管阻塞,可导致患者吞咽功能丧失,引发患者营养不良,严重影响患者生活质量[13]。根据病理发展进程,可分为早期食管癌、黏膜内食管癌、浸润或黏膜下食管癌及中晚期食管癌[14]。食管癌早期无明显特异性症状及体征,大多患者首次确诊时已发展为中晚期。目前,食管癌主要采用放化疗及手术治疗等手段,对TNM为Ⅰ~Ⅲ期的食管癌患者手术治疗为根治性手段,可以扩大切除病灶,清除食管旁淋巴结,阻止肿瘤组织转移,延长患者生存期[15]。经胸腔食管癌切除是目前常规手术方法,包括传统开放手术和胸腔镜下微创手术,其中传统开放手术能够有效清扫淋巴结,降低食管癌复发率;但手术创伤较大,术中会挤压患者肺部,且手术时间较长,胸腔长时间暴露易引发呼吸紊乱、膈肌损伤、肺容量降低等[16]。
近年来,胸腔镜技术因其创伤小、术野清晰、恢复快等优点已被广泛应用于食管癌临床治疗,但其手术指征尚无统一标准。且采用胸腔镜治疗食管癌也存在一定限制:一方面,手术难度大,对医生技术要求高;另一方面,对胸膜广泛粘连的患者,胸腔镜无法顺利进入,淋巴结清除困难,而且术中一旦损伤大血管则止血困难[17, 18]。因此,手术路径的选择对提高手术成功率、降低手术损伤及促进术后恢复尤为重要。目前,临床上主要通过食管床路径和胸骨后路径进行消化道重建。经食管床路径手术难度小,管状胃的吻合距离短、吻合效果好,且术中可避开血管,出血风险小;但经食管床路径手术在管状胃制作过程中易对肺部产生压迫导致咳嗽,食管残端吻合口糜烂易导致吻合口漏而引发胸腔内感染[19]。经胸骨后路径手术无需钝性分离胸骨,可减少手术出血风险;能够将胸胃与胸腔分离,降低肺部压力,且开口位置在胸廓处,独特构造形成斜坡,促进胃液引流,对胸腔与肺部功能破坏小,术后肺部感染少;此外,肺呼吸运动及心脏搏动可促进胃蠕动,有利于胃排空。但经胸骨后路径胸骨会压迫心包,影响血液循环,减弱供氧功能[20, 21, 22]。经食管床路径和胸骨后路径行胸腔镜手术治疗食管癌各有优劣,而有关两种路径的对比研究报道较少。目前,哪种路径更有优势临床上尚未达成共识。因此,在本研究中我们选择TNM分期Ⅰ~Ⅲ期的食管癌患者,观察并对比经食管床路径和胸骨后路径胸腔镜手术的治疗效果。本研究结果显示:两种路径下手术时间、引流管滞留时间、术中出血量无明显差异,而食管床组胃液引流总量明显高于胸骨后组,表明两种路径下食管癌胸腔镜切除术手术效果相当,但食管床组胃液引流总量较多,与马生茂等[23]的研究结论一致。笔者分析原因,可能是因为食管床路径手术可导致十二指肠液增多,十二指肠液返流导致胃引流液增多;而胸骨后路径中胸骨后隧道与腹腔存在一定角度,经胸骨后径对心包压迫明显,胸骨和心包对胃的压力增加,使胃减压引流液的量减少,同时胸骨与膈肌的位置存在坡度差,此解剖结构可以减轻胸膜对胃挤压,使胃液分泌量减少,进而减少胃液引流总量。
食管癌术后常伴有切口感染、肺部感染、乳糜胸、吻合口瘘、心律失常等并发症[24]。在本研究中,胸骨后组与食管床组肺部感染、乳糜胸、心律失常等并发症发生率差异无统计学意义,与姜睿[24]研究结果一致;而吻合口瘘的发生率,食管床组低于胸骨后组,与姜睿[24]研究结果不同。笔者分析,胸骨后路径吻合口位置较浅,没有颈前肌群的保护,术后咳嗽容易压迫位于前纵膈的管状胃,冲击吻合口导致吻合口糜发生[25];而食管床路径手术操作便捷,吻合距离比胸骨后路径短,无需分离间隙,术后所需吻合张力较小,因此吻合口瘘发生率低于胸骨后路径。此外,有研究显示,加强术前营养补充、提高手术质量、加强术后处理及术后促进胃肠功能恢复均可减少吻合口瘘发生[26]。
吞咽功能及生活质量常用于评估食管癌手术疗效。目前临床上主要采用SSA评分、Burke评分评估食管癌患者术后吞咽功能[7, 8]。VFSS评分能在胃肠造影下清晰观察到造影剂进入气管的全过程,并发现可能存在的隐匿性误吸,是判断患者吞咽障碍的金标准[9]。QLQ-C 30量表包含功能领域(躯体、角色、认知、情绪、社会)、症状领域(疲劳、疼痛、恶心呕吐)、总体健康状况领域和6个单一条目,常用于评估癌症患者生活质量[10];QLQ-OES评分包括疼痛、进食、吞咽困难、反流、咽口水、吞咽梗阻、口干、食欲减退、咳嗽、言语领域,为评估食管癌患者生命质量专用量表[11]。在本研究中,我们采用SSA、Burke、VFSS评分评估患者术后吞咽功能,参照QLQ-C 30及QLQ-OES评分制作生活质量调查问卷评估患者生活质量,结果显示,食管床组和胸骨后组患者术后吞咽功能和生活质量差异无统计学意义。笔者分析,这两种路径的手术均能清除肿瘤组织,使消化道保持通畅,改善患者吞咽功能;且手术创伤小,易于恢复,能够改善患者吞咽功能,进而改善患者生活质量。
综上所述,食管床路径与胸骨后路径用于食管癌胸腔镜切除术,均能取得较好的临床效果,且安全性高,对患者吞咽功能及生活质量提高有利。但食管床胃液引流总量较高,胸骨后路径吻合口瘘发生率较高,因此,需根据患者自身情况选择合适的手术路径。本研究不足之处为回顾性研究,纳入病例量较少,且随访时间较短。后续我们将扩大样本量,延长随访时间,进一步深入观察。
余德旺, 王东方, 靳红领, 等. 食管床路径与胸骨后路径胸腔镜食管癌切除术的疗效比较[J]. 中华解剖与临床杂志, 2023, 28(10): 672-678. DOI: 10.3760/cma.j.cn101202-20221103-00336.
所有作者声明不存在利益冲突



























