
主动脉狭窄(AS)合并二尖瓣狭窄(MS)多见于风湿性心脏病,传统治疗策略为外科手术,但外科手术高风险的严重AS合并MS患者通常难以耐受开放性手术,随着介入技术的发展,同期经导管治疗为其提供了一种新的选择。该文报道了2例行经导管主动脉瓣置换术联合经皮二尖瓣球囊成形术治疗AS合并MS的病例,2例患者的主动脉瓣及二尖瓣狭窄均得到了有效缓解,术后心功能明显改善,未出现严重并发症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
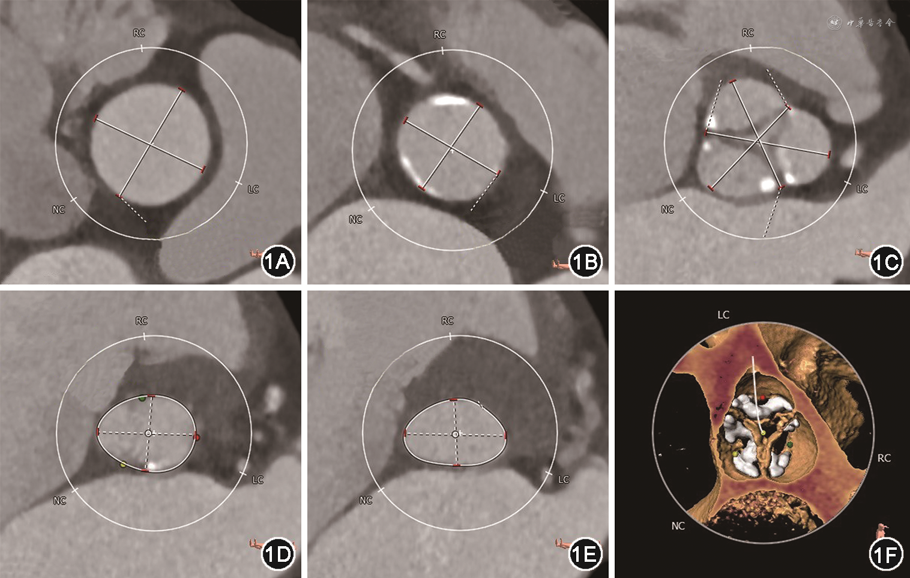
病例1 患者男,83岁,因“反复活动后气促4年余,加重1个月”入院。既往有高血压、心房颤动病史。入院体格检查:主动脉瓣听诊区可闻及收缩期喷射样杂音,二尖瓣区可闻及舒张期隆隆样杂音,双下肺可闻及湿啰音。N末端B型利钠肽原(N-terminal pro-B-type natriuretic peptide,NT-proBNP)10 674 ng/L(参考值0~125 ng/L)。超声心动图提示:风湿性心脏病,重度主动脉瓣狭窄(aortic stenosis,AS)并中-重度关闭不全[主动脉瓣瓣缘结节样增厚,回声增强伴钙化,开放受限,关闭不全,主动脉瓣口血流速度5.0 m/s,峰值压差99 mmHg(1 mmHg=0.133 kPa),反流彩束面积6.0 cm2],重度二尖瓣狭窄(mitral stenosis,MS)并中度关闭不全(二尖瓣瓣尖增厚,回声增强,瓣下结构增粗,前后联合未见明显钙化,开放受限,M型超声心动图示瓣叶呈城墙样改变,瓣口面积0.8 cm2,反流彩束面积7.0 cm2,Wilkins评分为6)。诊断:重度AS,重度MS。患者术前纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅳ级,欧洲心脏手术风险评估系统Ⅱ(EuroSCORE Ⅱ)评分为13.26%。术前主动脉CT血管成像(computed tomography angiography,CTA)提示:主动脉瓣为三叶瓣,重度钙化,钙化相对均匀分布在瓣叶上;升主动脉内径31.7 mm,窦管结合部内径26 mm,窦部内径分别为30.5 mm(右冠窦)、32.7 mm(左冠窦)、29.3 mm(无冠窦),主动脉瓣环内径22.2 mm,左心室流出道内径21.7 mm,左、右冠状动脉开口高度分别为15.1、17.8 mm,解剖适合经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)(图1)。

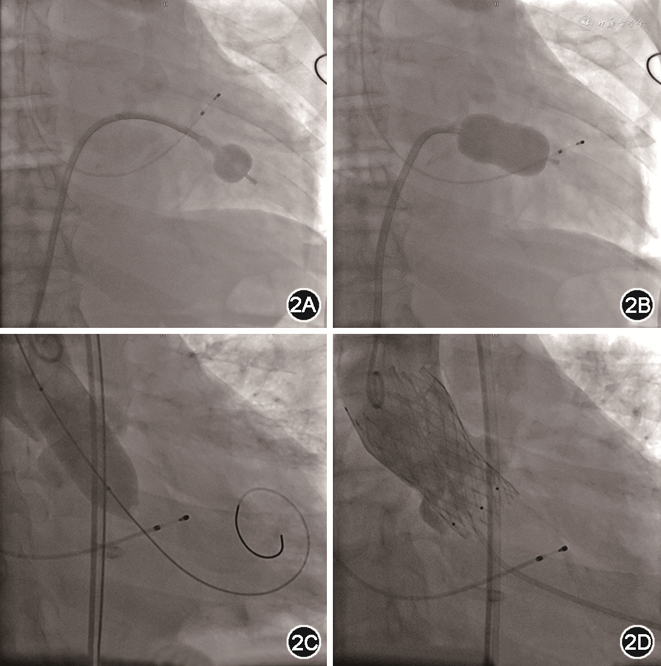
经与患者及其家属沟通后拟行经导管瓣膜手术。术中先行经皮二尖瓣球囊成形术(percutaneous balloon mitral valvuloplasty,PBMV),经右侧股静脉入路,选用24 mm Inoue球囊(日本Toray Industries Inc.)扩张二尖瓣。随后行TAVR,使用20 mm球囊预扩主动脉瓣后,植入26 mm VenusA人工主动脉瓣膜(杭州启明医疗),术后主动脉瓣最大跨瓣压差由80 mmHg降至3 mmHg(图2)。术后复查经胸超声心动图,结果示二尖瓣瓣口面积由0.8 cm2扩大至2.0 cm2,反流面积减少至4.9 cm2,主动脉瓣口血流速度降至1.62 m/s,峰值压差11 mmHg。NT-proBNP降至4 333 ng/L。

患者于术后1周出院,出院半年复诊,自觉活动后胸闷气促症状较前明显好转,复查超声心动图,结果示主动脉瓣口血流速度1.5 m/s,二尖瓣瓣口面积1.4 cm2,反流彩束面积6.0 cm2(表1)。
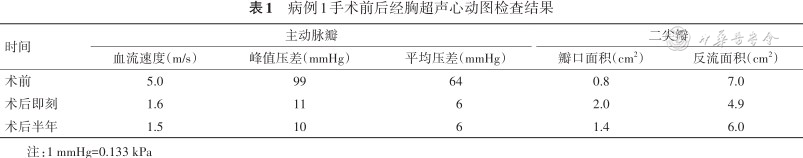
病例1手术前后经胸超声心动图检查结果
病例1手术前后经胸超声心动图检查结果
| 时间 | 主动脉瓣 | 二尖瓣 | |||
|---|---|---|---|---|---|
| 血流速度(m/s) | 峰值压差(mmHg) | 平均压差(mmHg) | 瓣口面积(cm2) | 反流面积(cm2) | |
| 术前 | 5.0 | 99 | 64 | 0.8 | 7.0 |
| 术后即刻 | 1.6 | 11 | 6 | 2.0 | 4.9 |
| 术后半年 | 1.5 | 10 | 6 | 1.4 | 6.0 |
注:1 mmHg=0.133 kPa
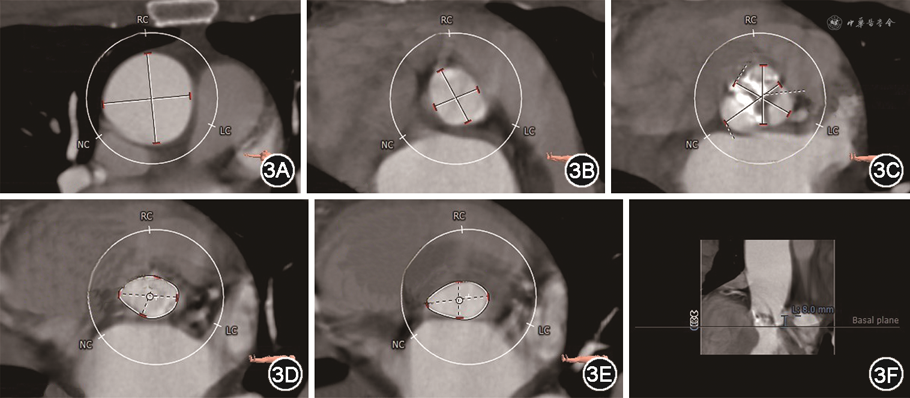
病例2 患者男,72岁,因“活动后气促半年,加重1个月”入院。否认高血压、糖尿病、冠心病史。入院体格检查:心率齐,主动脉瓣区可闻及收缩期喷射样杂音,二尖瓣区可闻及舒张期隆隆样杂音。超声心动图提示:风湿性心脏病,重度AS并轻度关闭不全(主动脉瓣口血流速度5.8 m/s,峰值压差138 mmHg,反流彩束面积3.0 cm2),中-重度MS并轻度关闭不全(二尖瓣后叶基底部回声增强,瓣环钙化,开放受限,二维超声心动图测得二尖瓣口面积1.3 cm2,反流彩束面积3.2 cm2,Wilkins评分为7)。诊断:重度AS,重度MS。患者年龄>65岁,NYHA心功能分级Ⅲ级,Euroscore Ⅱ评分4.1%,结合手术风险及患者意愿,决定行经导管瓣膜手术。术前CTA提示:主动脉瓣为二叶式type-1型,瓣叶游离缘重度钙化;左心室流出道内径18.1 mm,主动脉瓣环内径18.1 mm,窦部内径分别为22.5 mm(右冠窦)、23.7 mm(左冠窦)、25.3 mm(无冠窦),窦管结合部内径20 mm,升主动脉内径33.9 mm,左右冠状动脉开口高度分别为8.0、14.6 mm(图3)。考虑患者左冠状动脉开口位置低,主动脉根部较小,传统瓣架对瓣叶的径向推挤力量大,冠状动脉闭塞风险高,拟采用J-Valve心脏瓣膜置换系统(苏州杰成医疗)行经心尖TAVR,并同期行PBMV。J-Valve属于短支架瓣膜,且瓣膜通过定位翼固定,不依赖径向张力,对原生瓣膜的推挤力量不大,故阻塞冠状动脉开口的风险较小。

术中透视下取左侧腋前线第6肋间水平开胸,显露心尖后穿刺心尖,逐步交换引入加硬导丝至降主动脉,经心尖送入21 mm J-Valve输送系统,释放支架瓣膜后进行造影及经食道超声行动图检查,提示瓣膜位置满意,未见明显瓣周漏,瓣口流速1.6 m/s,冠状动脉显影良好。再行PBMV,经心尖入路,选用26 mm Inoue球囊(日本Toray Industries Inc.)扩张二尖瓣,术后经食道超声心动图见二尖瓣狭窄明显好转,无明显反流(图4)。
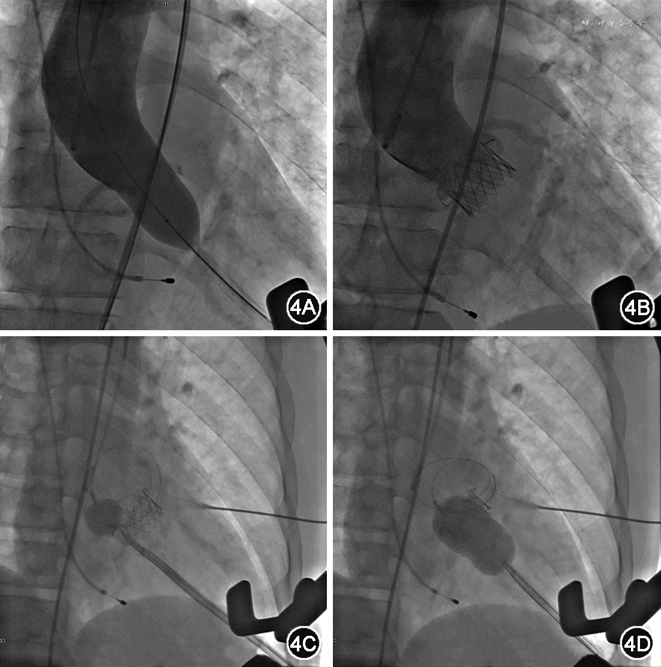

患者于术后5 d顺利出院。出院半年后复查超声心动图,结果示主动脉瓣口血流速度2.2 m/s,二尖瓣瓣口面积1.7 cm2,反流彩束面积1.5 cm2。运动耐量较前明显改善。出院1年复诊,诉日常活动无明显受限,复查超声心动图,结果示主动脉瓣口血流速度2.6 m/s,二尖瓣瓣口面积1.4 cm2,反流彩束面积3.0 cm2(表2)。
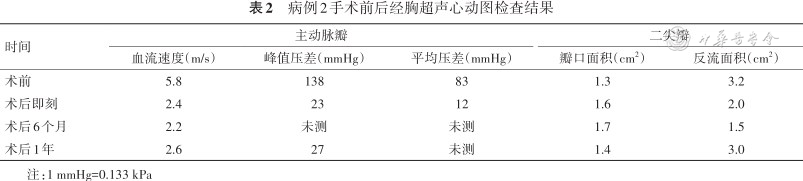
病例2手术前后经胸超声心动图检查结果
病例2手术前后经胸超声心动图检查结果
| 时间 | 主动脉瓣 | 二尖瓣 | |||
|---|---|---|---|---|---|
| 血流速度(m/s) | 峰值压差(mmHg) | 平均压差(mmHg) | 瓣口面积(cm2) | 反流面积(cm2) | |
| 术前 | 5.8 | 138 | 83 | 1.3 | 3.2 |
| 术后即刻 | 2.4 | 23 | 12 | 1.6 | 2.0 |
| 术后6个月 | 2.2 | 未测 | 未测 | 1.7 | 1.5 |
| 术后1年 | 2.6 | 27 | 未测 | 1.4 | 3.0 |
注:1 mmHg=0.133 kPa
AS合并MS多见于风湿性心脏病及退行性瓣膜病,据报道,因AS行TAVR的患者中,约18%合并不同程度的MS[1],AS及MS在血流动力学上存在协同作用,患者在疾病早期即可出现明显的心排血量下降及肺部淤血相关症状[2]。根据现行瓣膜病诊疗指南,心脏外科手术为重度AS合并重度MS患者的首选手术策略[3, 4],但在临床实践中,部分AS+MS病例为高龄、虚弱的外科手术高风险患者,为治疗带来挑战。对于AS或MS患者,经导管瓣膜手术已被证实可改善症状及预后[5, 6, 7]。但目前我国经导管瓣膜手术多为处理单瓣病变,“一站式”处理AS合并MS等联合瓣膜病变的经验较少。
经导管瓣膜手术,因创伤小、手术时间短、术后康复快、不需要开胸及体外循环等优势,在瓣膜病治疗中的应用日益广泛。随着PARTNER系列研究结果的公布,TAVR已成为外科高风险患者的一线治疗手段[7]。根据2020美国心脏病学会(ACC)/美国心脏协会(AHA)心脏瓣膜病管理指南,TAVR可作为65岁以上重度AS患者的合理选择[8]。自20世纪80年代起,陈传荣团队在国内率先使用Inoue球囊导管开展PBMV,随后逐渐在全国推广,成为二尖瓣重度狭窄有效的治疗方式,目前仍作为延缓外科手术时间或外科高风险患者改善症状的重要手段[4,8, 9, 10],长期随访研究结果也证实了PBMV的有效性[11, 12]。目前行PBMV的主要指征包括:中、重度MS,瓣膜无明显变形、具有良好弹性、无严重钙化,瓣膜下结构无明显异常,排除左心房血栓,无严重关闭不全。基于瓣膜形态、瓣下结构及瓣叶增厚程度、钙化等参数的Wilkins评分是评估是否适合接受PBMV的重要参考,一般认为<8分者适合手术。
AS合并MS最常见于风湿性心脏病,行TAVR的AS患者,若合并MS,1年心血管死亡风险为无MS患者的3倍[1]。此类病例传统治疗策略为外科手术,但对于外科手术风险高危的严重AS+MS联合瓣膜病变患者,同期经导管治疗为此类患者提供了一种新的选择。目前国内外经导管同期治疗重度AS+MS患者的经验很少,仅少量个案报道初探其可行性[13, 14, 15],但尚无系统性观察性研究或随机对照试验资料。在本文中,我们报道了2例行TAVR+PBMV治疗联合瓣膜病变的病例,1例采用经外周血管入路进行,1例采用经心尖入路。2例病例均有效的缓解了患者主动脉瓣及二尖瓣狭窄病情,术后患者心功能亦得到明显改善,未出现严重并发症。
目前关于开展TAVR+PBMV的手术流程并无标准,回顾本团队的实践经验及其他类似个案,有以下几点值得注意和探讨:(1)TAVR与PBMV的先后问题。由于目前国内临床上使用较多的是自膨式长瓣架主动脉支架(如VenusA系列),此类支架释放后,支架底端将突入左心室流出道,此时支架底端与二尖瓣前叶较近;经股静脉入路行PBMV时,二尖瓣球囊前囊在左心室充盈后回拉过程中可能拉扯到瓣架,且球囊扩张时对主动脉瓣瓣架及主动脉瓣环的挤压有导致瓣架移位、瓣膜及邻近组织损伤的风险,故先行PBMV后再行TAVR更为合理。英国诺丁汉大学医院Mrevlje等[13]2016年发表的双瓣介入治疗的病例报告,也是采用了类似手术策略。而对于短瓣架支架、经心尖途径介入,则较少有此类牵拉风险。(2)合并二尖瓣反流的评估与处理。一般而言,严重的二尖瓣反流通常为PBMV的禁忌证[3, 4],但AS患者绝大部分合并不同程度的二尖瓣反流[16];另一方面,AS解除后,伴随的二尖瓣反流可得到一定程度缓解[17]。本报道中的2例病例,术前都合并了二尖瓣反流,而术后二尖瓣反流情况均得到改善,未见术后严重反流。提示针对合并轻-中度二尖瓣反流的AS+MS患者,若Wilkins评分提示瓣膜条件适合,尝试PBMV是合理的。(3)合并二尖瓣瓣叶钙化的处理。通常无外科手术条件的AS+MS患者大多为高龄、长病程患者,二尖瓣钙化较为常见,将为PBMV开展带来挑战,合适的扩张尺度及术者的技术熟练度是保证手术安全及有效性的关键,对于钙化病例,相对“保守”的扩张策略或更为合理,结合术中经食道超声心动图指引、杂交手术室手术等多方面手段保障手术安全。此外,随着经导管二尖瓣置换器械的发展,亦有欧美团队开始尝试将其与TAVR结合,替代TAVR+PBMV治疗AS+MS伴严重二尖瓣钙化[18, 19]。
虽然目前心脏外科换瓣手术仍为重度AS合并重度MS患者的首选手术策略,但同期TAVR+PBMV的手术较传统外科手术耐受性更好,患者术后恢复更快,可为没有外科手术机会的重度AS合并MS患者提供一种新的手术策略,帮助他们缓解症状,改善生活质量,延长生存时间。本文案例及国内外类似个案的成功开展初步证明了该手术策略的可行性,后续更多的病例积累及相关临床研究有助于进一步验证其安全性及有效性。随着经导管瓣膜治疗技术的发展,将有更多经导管瓣膜技术的组合用于联合瓣膜病变治疗。
董豪坚, 王锐, 王侠, 等. 同期经导管主动脉瓣置换及二尖瓣球囊成形术治疗主动脉瓣并二尖瓣重度狭窄2例[J]. 中华心血管病杂志, 2023, 51(10): 1082-1086. DOI: 10.3760/cma.j.cn112148-20230808-00062.
所有作者声明无利益冲突































