
报道长径≤1 cm高风险甲状腺结节患者主动监测的肿瘤学结局。
前瞻性、单中心队列研究,纳入2017年1月至2022年11月就诊于中国医学科学院北京协和医院的534例经超声评估为具有高风险甲状腺结节(美国甲状腺协会指南甲状腺结节超声风险分层标准评估为高度可疑恶性结节)的患者,并进行主动监测,入组患者每6个月随诊1次,行体格检查及颈部超声检查。评估随诊过程中患者的肿瘤学结局(疾病进展、疾病复发/转移率等),同时探索了肿瘤体积变化对于评估疾病进展的价值。
所有患者中,女413例(77.3%),男121例(22.7%),年龄(42.6±11.8)岁。在中位45.6个月(3.5~176.0个月)的随访期间,534例高风险甲状腺结节患者中,共26例(4.9%)出现疾病进展,其中19例(3.6%)肿瘤长径增大≥3 mm,7例(1.3%)发现淋巴结转移。47例患者因各种原因行延迟手术,其中29例原因为意愿改变。延迟手术患者中,疾病进展患者与改变意愿患者的病理结果与随诊结局无明显差别。年龄≤40岁患者的5年疾病进展累积发生率较>40岁患者高(4.9%比1.9%,P=0.060)。所有患者均无远处转移和死亡发生。在可获得连续体积监测数据且结节长径增大未超过3 mm的595个高风险甲状腺结节中,多次测量中出现过体积增大超过50%和100%的结节分别有184个(30.9%)和79个(13.3%);在体积变化超过50%和100%的结节中,基线肿瘤长径≤0.5 cm结节的比例均明显高于>0.5 cm的结节,分别为(69.0%比31.0%,P<0.001)和(77.2%比22.8%,P<0.001)。
长径≤1 cm的高风险甲状腺结节患者采取主动监测短期肿瘤学结局较好,可考虑作为手术的替代方案。由于病灶体积测量结果的变异度大,其并不适宜作为评估病灶增大的指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全球范围内,甲状腺癌的发病率呈上升趋势[1, 2, 3],甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占全部甲状腺癌的比例超过90%,其中直径≤1 cm的甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)增加最为明显,约占新发PTC的一半[4, 5],此类肿瘤生长缓慢,具有惰性的生物学特征,局部或区域复发率为2%~6%,远处转移率为1%~2%,20年疾病特异生存率超过99%[6, 7, 8]。基于PTMC患者良好的预后,日本学者首先提出并实施了低危PTMC患者的主动监测,来作为手术治疗的替代方案,其结果初步证实了主动监测的安全性和可行性[6,9, 10]。后续其他研究进一步证实了主动监测的安全性和可行性[11, 12, 13, 14]。虽然中国已有少量相关研究报道[15, 16],但到目前为止仍缺乏大样本、前瞻性的队列研究来验证主动监测方案的安全性和可行性。美国甲状腺协会指南并不推荐对于≤1 cm的高风险甲状腺结节进行穿刺病理检查[17]。因此,本研究主要通过超声检查来筛选长径≤1 cm、符合主动监测条件的高风险甲状腺结节患者,报告本中心主动监测队列的肿瘤学结局。
本项前瞻性队列研究评估、随诊了534例于2017年1月至2022年11月就诊于北京协和医院并选择主动监测的高风险甲状腺结节(长径≤1 cm)患者。纳入标准:(1)最大高风险甲状腺结节长径≤1 cm;(2)美国甲状腺协会(American Thyroid Association,ATA)指南甲状腺结节超声风险分层标准评估为高度可疑恶性(高风险)结节[17];(3)无甲状腺外侵犯、无临床发现的淋巴结转移或远处转移;(4)不靠近喉返神经、气管或食管等重要结构。排除标准:(1)既往甲状腺恶性肿瘤手术史;(2)拒绝签署知情同意书的患者;(3)不能坚持定期随访的患者;(4)甲状腺癌家族史(≥2个直系亲属诊断甲状腺癌)。本研究获得北京协和医院伦理审查委员会的批准(伦理批号:JS-2454),所有患者均签署知情同意书。
本研究采集患者如下信息:人口学特征(性别、年龄、随访时间、教育水平、婚姻状态、经济水平、既往史、家族史、激素替代治疗等)、超声特征(肿瘤长径、肿瘤体积、颈部淋巴结等)、穿刺病理(如果已行)、实验室检查[促甲状腺激素(thyroid stimulating hormone,TSH)、甲状腺球蛋白(thyroglobulin,Tg)、甲状腺球蛋白抗体(thyroglobulin antibodies,Tg-Ab)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPO-Ab)、癌胚抗原(carcinoembryonic antigen,CEA)、降钙素]、胸部低剂量CT、手术方式、术后病理、不良事件、随访结局等。肿瘤体积计算公式:肿瘤体积(mm3)=长(mm)×宽(mm)×高(mm)×π/6,肿瘤体积变化率计算公式:[末次肿瘤体积(mm3)-初次肿瘤体积(mm3)]/初次肿瘤体积(mm3)×100%。
入组患者每6个月随诊1次,行体格检查及颈部超声检查;每12个月加做血清Tg、Tg-Ab、CEA、降钙素和胸部低剂量CT。当患者出现以下情况建议行手术治疗:(1)原发肿瘤长径较基线增加≥3 mm;(2)出现颈部淋巴结转移或远处转移;(3)肿瘤进展侵犯喉返神经、气管或食管等重要结构;(4)患者改变随诊意愿,要求手术。基于上述标准,本研究将延迟手术患者分为疾病进展组和意愿改变组进行统计分析。术后随访计划:术后1周、1个月行血清学检查,术后3个月行血清学和甲状腺超声检查,术后6个月行血清学和超声检查,术后6个月至2年每6个月行血清学和超声检查,每年行胸部低剂量CT检查,术后2年后每年行血清学、甲状腺超声和CT检查。根据术后复发风险分层,使用左甲状腺素维持血清TSH于目标水平。暂时性甲状旁腺功能减低(简称甲旁减)是指6个月以内的甲状旁腺激素水平降低(<10.0 ng/L)、低血钙(<2.0 mmol/L)的情况。永久性甲旁减是指6个月以上的甲旁减。主要的研究终点指标:疾病进展率;次要终点指标:转手术比率(包括疾病进展转手术比率,随诊改变意愿转手术比率),术后肿瘤持续存在/复发率等。
所有统计分析均由SPSS 26.0和R软件4.2.2完成。分类变量以例(%)表示,组间比较采用χ2检验;符合正态分布的连续变量以表示,组间比较采用独立样本t检验;非正态分布连续变量以M(Q1,Q3)表示,使用曼惠特尼检验进行组间比较。竞争风险模型用于分析疾病进展及改变意愿的累积发生率以及相关风险因素。双侧检验,取α=0.05。
所有患者中位随访时间为45.6个月(3.5~176.0个月),女413例(77.3%),男121例(22.7%)。所有患者年龄(42.6±11.8)岁,其中≤40岁245例(45.8%)。甲状腺结节的基线长径为(0.58±0.19)cm,多灶患者209例(39.1%),Tg-Ab或TPO-Ab阳性者120例(22.5%)。在主动监测期间,15例(2.8%)未手术患者接受左旋甲状腺素替代治疗,5例(0.9%)合并甲状腺功能亢进,18例(3.4%)有甲状腺癌家族史。18例(3.9%)患者既往诊断其他部位的恶性肿瘤。142例患者行甲状腺细针穿刺(26.6%),其中133例(93.7%)恶性和可疑恶性(表1)。
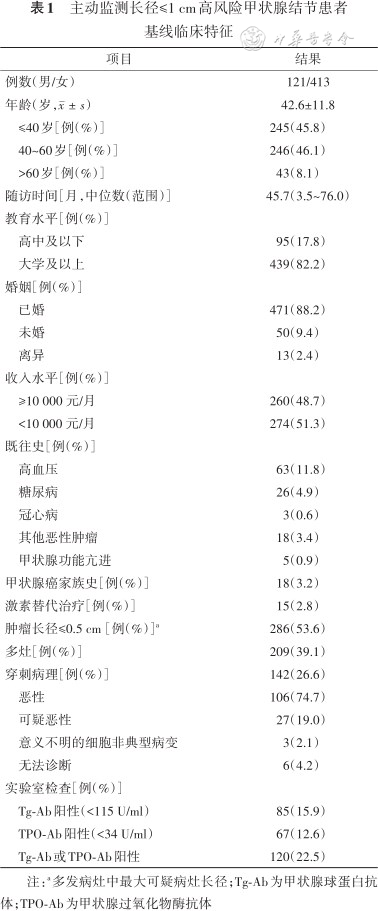
主动监测长径≤1 cm高风险甲状腺结节患者基线临床特征
主动监测长径≤1 cm高风险甲状腺结节患者基线临床特征
| 项目 | 结果 |
|---|---|
| 例数(男/女) | 121/413 |
| 年龄(岁,) | 42.6±11.8 |
| ≤40岁[例(%)] | 245(45.8) |
| 40~60岁[例(%)] | 246(46.1) |
| >60岁[例(%)] | 43(8.1) |
| 随访时间[月,中位数(范围)] | 45.7(3.5~76.0) |
| 教育水平[例(%)] | |
| 高中及以下 | 95(17.8) |
| 大学及以上 | 439(82.2) |
| 婚姻[例(%)] | |
| 已婚 | 471(88.2) |
| 未婚 | 50(9.4) |
| 离异 | 13(2.4) |
| 收入水平[例(%)] | |
| ≥10 000 元/月 | 260(48.7) |
| <10 000 元/月 | 274(51.3) |
| 既往史[例(%)] | |
| 高血压 | 63(11.8) |
| 糖尿病 | 26(4.9) |
| 冠心病 | 3(0.6) |
| 其他恶性肿瘤 | 18(3.4) |
| 甲状腺功能亢进 | 5(0.9) |
| 甲状腺癌家族史[例(%)] | 18(3.2) |
| 激素替代治疗[例(%)] | 15(2.8) |
| 肿瘤长径≤0.5 cm[例(%)]a | 286(53.6) |
| 多灶[例(%)] | 209(39.1) |
| 穿刺病理[例(%)] | 142(26.6) |
| 恶性 | 106(74.7) |
| 可疑恶性 | 27(19.0) |
| 意义不明的细胞非典型病变 | 3(2.1) |
| 无法诊断 | 6(4.2) |
| 实验室检查[例(%)] | |
| Tg-Ab阳性(<115 U/ml) | 85(15.9) |
| TPO-Ab阳性(<34 U/ml) | 67(12.6) |
| Tg-Ab或TPO-Ab阳性 | 120(22.5) |
注:a多发病灶中最大可疑病灶长径;Tg-Ab为甲状腺球蛋白抗体;TPO-Ab为甲状腺过氧化物酶抗体
在中位45.6个月(3.5~176.0个月)的随访期间,共26例(4.9%)出现疾病进展,其中19例(3.6%)结节长径增大≥3 mm,7例(1.3%)发现颈部淋巴结转移,其中1例(0.2%)合并侧颈区淋巴结转移,此外,另有1例(0.2%)合并良性结节增大>4 cm,共47例接受延迟手术。共5例患者在随诊过程中怀孕,其中3例末次随诊时仍在孕期,目前病灶稳定,无进展;2例处于产后随访状态,其中1例病灶稳定,无进展,另1例在产后5个月按计划随访时发现肿瘤增大,接受手术治疗。在延迟手术患者中,与改变意愿者相比,疾病进展者甲状腺全切比例更高(44.4%比20.6%,P=0.014),其他临床病理特征差异均无统计学意义(表 2)。9例术后出现暂时性低钙血症,1例出现暂时性声带麻痹,无其他相关并发症出现。在中位12.1个月的术后随访中,改变意愿组中1例(3.5%)在术后1年发现侧颈淋巴结转移,行根治性侧颈区淋巴结清扫;1例(3.5%)因术后大量淋巴结转移而行补充的全甲状腺切除术。疾病进展组无患者复发,也无患者因术后大量淋巴结转移行二次手术。所有患者(包括延迟手术患者)均未发生远处转移,也无患者因甲状腺癌而死亡。
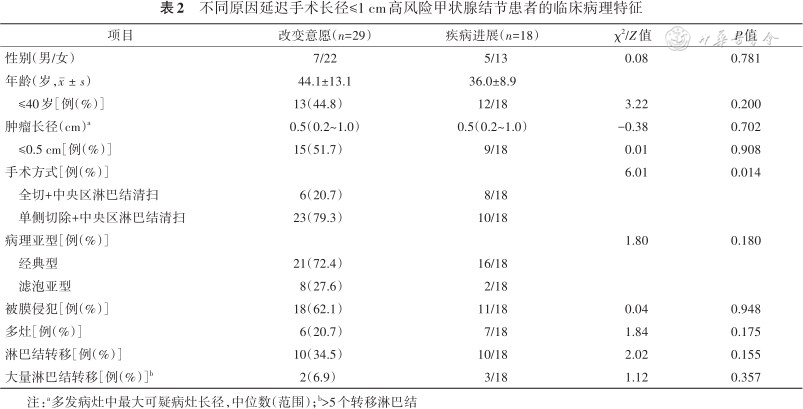
不同原因延迟手术长径≤1 cm高风险甲状腺结节患者的临床病理特征
不同原因延迟手术长径≤1 cm高风险甲状腺结节患者的临床病理特征
| 项目 | 改变意愿(n=29) | 疾病进展(n=18) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 性别(男/女) | 7/22 | 5/13 | 0.08 | 0.781 |
| 年龄(岁,) | 44.1±13.1 | 36.0±8.9 | ||
| ≤40岁[例(%)] | 13(44.8) | 12/18 | 3.22 | 0.200 |
| 肿瘤长径(cm)a | 0.5(0.2~1.0) | 0.5(0.2~1.0) | -0.38 | 0.702 |
| ≤0.5 cm[例(%)] | 15(51.7) | 9/18 | 0.01 | 0.908 |
| 手术方式[例(%)] | 6.01 | 0.014 | ||
| 全切+中央区淋巴结清扫 | 6(20.7) | 8/18 | ||
| 单侧切除+中央区淋巴结清扫 | 23(79.3) | 10/18 | ||
| 病理亚型[例(%)] | 1.80 | 0.180 | ||
| 经典型 | 21(72.4) | 16/18 | ||
| 滤泡亚型 | 8(27.6) | 2/18 | ||
| 被膜侵犯[例(%)] | 18(62.1) | 11/18 | 0.04 | 0.948 |
| 多灶[例(%)] | 6(20.7) | 7/18 | 1.84 | 0.175 |
| 淋巴结转移[例(%)] | 10(34.5) | 10/18 | 2.02 | 0.155 |
| 大量淋巴结转移[例(%)]b | 2(6.9) | 3/18 | 1.12 | 0.357 |
注:a多发病灶中最大可疑病灶长径,中位数(范围);b>5个转移淋巴结
疾病进展患者的2、5和10年的累积发生率分别为1.1%、3.2%和10.7%,改变意愿患者的2、5和10年的累积发生率为3.2%、6.0%和13.9%(表3)。风险因素分析显示,在年龄(分别以40岁和60岁为界)、性别、肿瘤大小(0.5 cm为界)和多灶分组中疾病进展和改变意愿的累积发生率差异均无统计学意义,但是年龄≤40岁患者的5年疾病累积进展率高于>40岁患者(4.9%比1.9%,P=0.060),而年龄>60岁的患者的5年疾病累积进展率低于≤60岁患者(0比3.5%,P=0.203)。
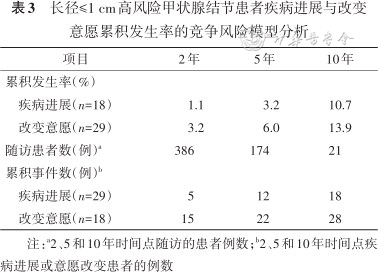
长径≤1 cm高风险甲状腺结节患者疾病进展与改变意愿累积发生率的竞争风险模型分析
长径≤1 cm高风险甲状腺结节患者疾病进展与改变意愿累积发生率的竞争风险模型分析
| 项目 | 2年 | 5年 | 10年 |
|---|---|---|---|
| 累积发生率(%) | |||
| 疾病进展(n=18) | 1.1 | 3.2 | 10.7 |
| 改变意愿(n=29) | 3.2 | 6.0 | 13.9 |
| 随访患者数(例)a | 386 | 174 | 21 |
| 累积事件数(例)b | |||
| 疾病进展(n=29) | 5 | 12 | 18 |
| 改变意愿(n=18) | 15 | 22 | 28 |
注:a2、5和10年时间点随访的患者例数;b2、5和10年时间点疾病进展或意愿改变患者的例数
在487例具有完整体积监测数据的患者中,373例(76.6%)为单发高风险甲状腺结节,114例(23.4%)为多发高风险甲状腺结节,最终共纳入611个结节进行分析。在611个高风险甲状腺结节中,结节长径增大≥3 mm的结节16个(2.6%)。所有结节中,多次测量出现过体积增大超过50%、100%和200%的结节分别有200个(32.7%)、95个(15.5%)和30个(4.9%);排除长径增大≥3 mm的结节后,多次测量体积出现超过50%、100%和200%的结节分别为184个(30.9%)、79个(13.3%)和17个(2.9%)(表4)。在体积变化超过50%、100%和200%的稳定结节中,基线长径≤0.5 cm结节的比例均明显高于长径>0.5 cm的结节,分别为69.0%比31.0%、77.2%比22.8%和100%比0,差异均有统计学意义(均P<0.001)(表5)。
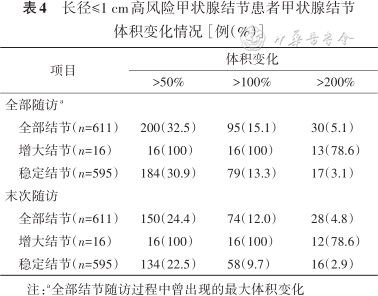
长径≤1 cm高风险甲状腺结节患者甲状腺结节体积变化情况[例(%)]
长径≤1 cm高风险甲状腺结节患者甲状腺结节体积变化情况[例(%)]
| 项目 | 体积变化 | ||
|---|---|---|---|
| >50% | >100% | >200% | |
| 全部随访a | |||
| 全部结节(n=611) | 200(32.5) | 95(15.1) | 30(5.1) |
| 增大结节(n=16) | 16(100) | 16(100) | 13(78.6) |
| 稳定结节(n=595) | 184(30.9) | 79(13.3) | 17(3.1) |
| 末次随访 | |||
| 全部结节(n=611) | 150(24.4) | 74(12.0) | 28(4.8) |
| 增大结节(n=16) | 16(100) | 16(100) | 12(78.6) |
| 稳定结节(n=595) | 134(22.5) | 58(9.7) | 16(2.9) |
注:a全部结节随访过程中曾出现的最大体积变化
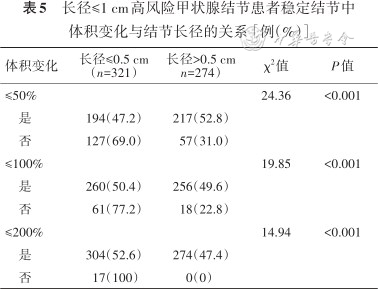
长径≤1 cm高风险甲状腺结节患者稳定结节中体积变化与结节长径的关系[例(%)]
长径≤1 cm高风险甲状腺结节患者稳定结节中体积变化与结节长径的关系[例(%)]
| 体积变化 | 长径≤0.5 cm(n=321) | 长径>0.5 cmn=274) | χ2值 | P值 |
|---|---|---|---|---|
| ≤50% | 24.36 | <0.001 | ||
| 是 | 194(47.2) | 217(52.8) | ||
| 否 | 127(69.0) | 57(31.0) | ||
| ≤100% | 19.85 | <0.001 | ||
| 是 | 260(50.4) | 256(49.6) | ||
| 否 | 61(77.2) | 18(22.8) | ||
| ≤200% | 14.94 | <0.001 | ||
| 是 | 304(52.6) | 274(47.4) | ||
| 否 | 17(100) | 0(0) |
主动监测已被认为是低危PTMC患者手术治疗的安全替代方案[12,14,17, 18]。与既往研究不同的是:本研究主要通过ATA超声甲状腺结节风险分层来筛选高风险甲状腺结节患者,其对于甲状腺恶性结节的诊断敏感性约95%,准确性约85%[19, 20]。本研究共纳入534例具有高风险甲状腺结节的患者,中位随访时间45.6个月,共26例(4.9%)患者出现疾病进展,5年疾病进展的累积发生率为5.5%,与一项荟萃分析中4.4%~6.4%的结果相似[21]。共47例患者接受延迟手术,但是疾病进展并不是接受延迟手术的首要原因,主要原因是意愿改变(29/47),与既往研究相似[13,18]。延迟手术患者的总体淋巴结转移率为42.6%,接受延迟手术的疾病进展与改变意愿患者的病理结果相似,没有表现出更具侵袭性的病理特征[22]。所有患者均无手术相关永久并发症的发生。本研究的初步随诊结果显示中国低危微小癌患者行主动监测具有短期内良好的肿瘤学结局,是安全、可行的。
分化型甲状腺癌治疗中年龄是最重要的风险因素[17,22, 23]。既往研究发现,在主动监测期间,年龄较小与疾病进展有关[9,18,24]。在本研究中,笔者进行了不同年龄分组间疾病进展累积发生率的比较,均没有观察到统计学差别,但是年龄≤40岁患者疾病进展累积发生率较>40岁患者更高(5年疾病进展率:4.9%比1.9%,P=0.080),同时年龄>60岁患者较≤60岁患者的疾病进展累积发生率更低(5年疾病进展率:0比3.5%,P=0.150),而且在60岁以上的患者中没有观察到疾病进展发生。虽然上述结果均未达到统计学差别,但是P值接近0.05,原因可能与患者数量相对较少,随诊时间较短有关,但是仍然提示年轻患者可能更易出现疾病进展。在既往研究中,Ito等[9,25]的研究也发现年龄<40岁比>40岁的患者具有更高的疾病进展累积发生率。因此,根据既往的研究和本研究的数据,对于年轻患者,肿瘤进展仍需要特别关注,因为他们有更长的预期寿命和随诊时间。
本研究所采用的针对结节增大的判断标准为结节长径较基线增大≥3 mm,这是既往研究中使用最多的病灶增大的判断标准[14,21]。新近一些研究显示体积较基线增大>50%是更敏感的判断病灶增大的指标[13,18,26, 27]。在本研究中,共有611个高风险甲状腺结节可进行体积变化分析,体积增大>50%和>100%的结节分别可达到32.7%(200个)和15.5%(95个),而其中长径增大≥3 mm的结节仅占2.6%(16个)。这似乎也表明体积变化是反映病灶增大更敏感的指标。但是,需要判别的是:体积变化到底是结节生长所致,还是检查误差导致。临床中,患者即使在同一个医院复查,超声检查也多是由不同医生完成,结节各径线测量结果误差1~2 mm是较常见的情况,这对体积结果会有更显著的影响,尤其对较小病灶。由此可见,结节体积测量变异度大,因此需要设置合理的体积变化标准来判断病灶增大。既往研究表明结节体积变化超过72%多可能是结节生长所致。在本研究中,体积增大>100%的结节占比为15.5%;而且长径增大≥3 mm的结节末次随访体积增大均>100%。因此,体积增大>100%可能是一个便于临床操作、判断结节增大的标准[26]。需要谨记的是,上述患者预后很好,在主动监测中即便结节有所增大,给予及时处理也不会对患者产生不良影响。因此,对于结节增大的判断,准确性更高的指标比敏感的指标更具实际价值。
本研究存在一定的局限性:(1)研究纳入的人群主要是超声评估的高风险甲状腺结节患者,可能有较小误诊率;(2)作为一个单中心研究,病例数量相对较小,随访时间相对较短,仍需要继续扩大样本,增加随访时间,以获得更充分的数据;(3)主动监测过程中病灶体积的测量变异度大,尤其是对于较小的肿瘤,因此应慎重将体积变化作为评估疾病进展的指标。
综上,在我国对长径≤1 cm高风险甲状腺结节的患者采取主动监测有较好的短期肿瘤学结局,可考虑作为手术的安全替代方案。但年轻患者可能较老年患者更容易出现疾病进展,老年患者可能是更适合的监测对象。体积监测可能并不适合作为肿瘤增大的评估方法。
刘春浩, 赵豪, 夏宇, 等. 长径≤1 cm高风险甲状腺结节主动监测肿瘤学结局的单中心研究[J]. 中华医学杂志, 2023, 103(40): 3186-3192. DOI: 10.3760/cma.j.cn112137-20230206-00168.
所有作者声明不存在利益冲突



























