
人呼吸道合胞病毒(Human respiratory syncytial virus,HRSV)是全球引起5岁以下儿童、老年人及免疫功能低下人群急性下呼吸道感染的重要病原体,可在高危人群聚集场所,如医院、产后母婴康复机构(月子中心)、养老院等引起聚集性/暴发疫情。HRSV感染导致5岁以下儿童和≥65岁老年人疾病负担较重。HRSV感染无特异性抗病毒治疗药物,HRSV疫苗和预防性单克隆抗体已在国外获批使用,但在国内还没有批准上市。建立HRSV感染监测系统并持续开展监测,对明确流行特征与趋势、评估疾病负担、制订免疫策略,以及评价防控效果至关重要。至今,世界卫生组织未建立全球统一的HRSV感染监测体系,我国也缺乏覆盖全面、功能完备的HRSV感染监测网络。为此,浙江省疾病预防控制中心、国家儿童医学中心(上海)复旦大学附属儿科医院和国家传染病医学中心复旦大学附属华山医院等机构组织了感染病和公共卫生领域的专家,讨论形成了以医院为基础的HRSV感染哨点监测、聚集性疫情监测、病原监测方案,并在监测系统构建、监测内容与方法,包括监测目标、病例定义、监测医院与哨点选择、监测对象、聚集性疫情监测场所、采样时机与标本种类、检测方法、测序与分型,以及监测结果报告与分析、感染预防控制等方面达成共识。专家组建议依托现有全国流感监测网络进一步拓展建立HRSV感染监测系统,并在中国疾病预防控制传染病监测信息系统增加HRSV病例报告与管理。本共识将为加快建设我国统一、规范的HRSV感染监测系统,进一步提高我国HRSV感染监测防控水平,并为今后制订人群HRSV抗体与疫苗免疫策略提供科学依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人呼吸道合胞病毒(Human respiratory syncytial virus,HRSV)是常见的呼吸道病毒,可感染各年龄段人群,但主要集中在儿童、老年人和免疫功能低下者等高危人群,是全球5岁以下儿童急性下呼吸道感染(Acute lower respiratory tract infections,ALRTI)的主要病原体之一[1]。HRSV感染在全球广泛流行,导致5岁以下儿童和≥65岁老年人疾病负担较重。The Lancet 2022年发布的最新HRSV感染疾病负担显示,2019年全球约有3 300万5岁以下儿童因HRSV感染引起的ALRTI病例,其中360万需要住院治疗,26 300例院内死亡[1]。2015年全球工业化国家约有150万老年人感染HRSV,其中14.5%的病例需要住院治疗,1.4万例病例院内死亡[2]。中国是全球HRSV疾病负担较重的5个国家之一,估计2019年全国5岁以下儿童HRSV-ALRTI发病约350万例,占全球10%以上,其中62万~95万需住院治疗,占全球的17%~24%[3]。同时,新型冠状病毒感染(COVID-19)大流行对HRSV感染流行产生影响,多个国家与地区报道HRSV感染疫情低流行后反弹,并伴随季节性、发病人群特征,以及疾病负担的改变[4]。我国多个地区也于2023年3至4月出现HRSV疫情春季流行高峰,随后波动下降。可见,全球HRSV感染防控面临着新形势和新挑战。
开展HRSV感染监测是防控的基础,但是,当前全球没有统一的HRSV感染监测系统[5],我国也缺乏覆盖广泛、功能完备的HRSV感染监测网络,HRSV感染还未纳入法定报告传染病系统,监测工作处于研究探索阶段,监测系统设置、监测病例定义、标本采集规范及检测技术方法等方面均有待进一步完善,全国范围内的HRSV感染流行特征和疾病负担还不完全清楚[6]。HRSV感染尚无特异性抗病毒治疗药物,在预防性生物制品研发方面,世界卫生组织(WHO)于2017年和2021年先后发布了HRSV疫苗和HRSV单克隆抗体的理想产品特性指导性技术文件[7,8]。目前针对老年人群、孕妇的HRSV疫苗和预防婴幼儿HRSV感染的单克隆抗体已研发成功,并在国外获批上市。基于HRSV感染防控领域新进展,迫切需要开展HRSV感染和病毒变异的持续监测[6]。因此,浙江省疾病预防控制中心、国家儿童医学中心(上海)复旦大学附属儿科医院和国家传染病医学中心(上海)复旦大学附属华山医院等机构组织了HRSV感染的流行病学、传染病学、儿科学、临床医学、病原学,以及疾病预防控制等方面的专家,讨论形成了HRSV感染监测与防控专家共识。本共识将为加快建设我国统一、规范的HRSV感染监测系统,进一步提高我国HRSV感染监测防控水平,并为今后制订HRSV抗体与疫苗免疫策略提供科学依据。
HRSV最早于1957年从婴儿呼吸道标本中分离出来[9]。由于该病毒在组织培养时可引起细胞间界限消失而融合在一起形成合胞体,故命名为呼吸道合胞病毒[10]。2015年,国际病毒分类委员会将HRSV归为肺炎病毒科(Pneumoviridae)人正肺病毒属(Human orthopneumovirus)[11]。HRSV外形呈球状或丝状颗粒[11],基因组结构为单股负链RNA,基因组全长约15 191~15 288 bp,共10个基因编码11个蛋白质,其中最重要的是病毒表面G蛋白和F蛋白[12]。G基因变异较大,目前国际上基于G基因第二高变区的核苷酸序列,将HRSV分为A和B两个亚型,HRSV A和HRSV B再分为15和30个基因型[12]。近年来,在G基因第二高变区出现的含有碱基重复插入序列的A亚型的ON1基因型和B亚型的BA9基因型成为全球多个国家流行的优势基因型,也是近年来我国流行的主要基因型[13,14]。与G基因相比,F基因在A、B亚型间和亚型内均具有较高的保守性,是目前HRSV单克隆抗体、疫苗及其他治疗性药物研发的热点基因[15]。目前已鉴定出F蛋白三聚体(包括融合前和融合后)含有6处抗原表位Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和ϕ,针对抗原表位的单克隆抗体中和活性远远高于针对其他表位诱导的抗体[16]。这些抗原表位的氨基酸变异可能改变HRSV对疫苗的抗原性[6]。
HRSV是亲脂性病毒/包膜病毒,对紫外线和热均敏感,56℃ 30 min即可有效灭活该病毒。经注册备案的复方季铵盐消毒液、含醇消毒液、含碘消毒液和含氯消毒剂等均可有效灭活HRSV。美国疾病预防控制中心(CDC)研究表明:HRSV可在硬质物体表面,如桌子和婴儿床栏杆等存活数小时,但在柔软的物体表面,如纸巾和手上存活时间较短[17]。英国《呼吸道合胞病毒:症状、传播、预防、治疗》指南[18]提示HRSV可在物体或表面存活4~7 h。
患者和无症状感染者是主要传染源。HRSV感染者在临床症状出现前1~2 d即有传染性,传染性通常持续3~8 d,但是对于免疫功能低下的婴幼儿和老年人,即使临床症状消失,其传染期可长达4周[17]。
HRSV主要通过呼吸道飞沫以及密切接触传播,也能通过接触含病毒的分泌物或污染物间接接触传播,特定条件下可通过气溶胶传播[19]。HRSV传染性较强,基本再生数(R0)为3(1~5)[19]。
各年龄段人群均可感染HRSV,但HRSV感染的高危人群主要集中在儿童、老年人和免疫功能低下人群。
HRSV感染后,潜伏期通常为2~8 d,平均4~6 d[20]。
全球不同国家/地区HRSV感染监测的开始时间、监测网络平台、监测病例定义不尽相同。WHO自2016年始在全球流感监测和应对系统(Global influenza surveillance and response system,GISRS)基础上,建立了一套以实验室检测为基础的HRSV监测系统,在21个国家与地区实施。通过局部地区的试点监测,获得了上述监测地区HRSV流行的季节特征、发病人群分布特征以及疾病负担。2020年,WHO系统评估了在GISRS系统上开展HRSV监测,对GISRS系统本身的流感监测没有明显影响。目前,我国尚未加入WHO的HRSV监测网络。欧洲自2003年开始,利用流感监测平台(EISN)在部分国家开展了HRSV感染监测工作,发现了HRSV流行趋势、季节性,以及2022年秋冬疫情反弹。为加快欧洲建立统一的HRSV感染监测系统和技术标准[21],2021年欧洲发布了HRSV监测专家共识。美国是建立HRSV监测系统最早的国家,自1989年以来建立了6个HRSV监测系统,监测对象广泛,包括了轻症与住院患者等,发现了美国HRSV的流行趋势、季节特征、人群分布、患病率、住院率,以及高危因素等[22]。
我国缺乏系统完整的HRSV监测系统,依托国家科技重大专项、国家自然科学基金等科研项目探索开展了HRSV监测,以急性呼吸道感染(Acute respiratory infection,ARI)为监测对象,在11个省试点探索了监测技术与方法,初步建立了HRSV临床标本库、毒株资源库、基因数据库与临床信息库,研究发现我国ARI病例中,全人群、儿童、成人及老年人中HRSV阳性检出率分别是16.8%、25.7%、4.5%和7.4%[23]。但全国各实验室所用的HRSV监测病例定义不一致,监测对象和检测方法不统一,不同实验室的结果难以比对分析,我国HRSV感染的流行趋势、流行特征,以及疾病负担还不完全清楚。因此,急须研究构建全国HRSV监测系统,统一监测标准方案,完善监测实验室网络,采用标准化的HRSV检测方法,开展HRSV感染流行特征和病毒变异特征的监测,为提高我国HRSV感染防治水平和制订人群免疫策略提供科学数据。
我国自1957年设立了国家流感中心,自2000年以来,尤其是2009年以来,流感监测网络逐渐扩大和完善,目前该网络已经覆盖全国31个省的所有地市级和部分县级医院和CDC,由554家国家级流感监测哨点医院和410家国家级流感监测网络实验室组成。我国国家流感中心也于2010年被WHO任命为全球流感参比和研究合作中心,是全球第五个,发展中国家唯一一个WHO全球流感参比和研究合作中心。我国的流感监测系统已成为全球流感监测与应对系统(GISRS)的重要组成部分。该系统运行时间长、监测技术成熟,监测所需的临床基础设施、专业人员、网络平台、实验室和其他资源比较完善[24]。结合国际HRSV监测经验,在我国流感监测系统基础上开拓建立全国HRSV监测系统是比较经济、可行的方法,但在监测病例定义与监测对象选择上应有所区别。
推荐意见1:依托目前全国流感监测系统、流感监测哨点和网络实验室平台,制订全国HRSV感染监测方案,尽快建立以实验室检测为基础的全国HRSV感染哨点监测系统。
通过HRSV监测,阐明我国HRSV感染流行的地域性、季节性、年龄分布特征和流行传播规律,为制订HRSV预防免疫策略和差异化的防治措施提供科学依据。HRSV监测目标具体包括[21]:
(1)阐明我国不同地区HRSV感染流行趋势、流行水平及季节性特征;
(2)掌握我国HRSV感染的发病人群分布特征,发现高危感染人群,确定防治优先干预人群;
(3)评估不同年龄人群因HRSV感染就诊、住院、死亡的疾病负担;
(4)实时追踪HRSV变异,及时发现HRSV基因型与抗原特征,评估HRSV变异对流行与疾病严重性影响并做出预警;
(5)了解我国HRSV在不同环境下的传播动力和传播风险,提高聚集性疫情的发现与处置能力。
WHO和欧洲的HRSV感染监测均采用ARI[急性起病(10 d内发病)伴呼吸道感染症状(至少有一种症状:咳嗽、咽痛、呼吸急促或流涕)]作为HRSV门诊监测病例定义[21,25],WHO也支持采用拓展的流感样病例[Extended influenza-like illness, Extended ILI,急性起病(10 d内发病)伴呼吸道感染症状(如咳嗽等)]定义作为HRSV门诊监测病例定义。这两种病例定义共同特点是不包括发热。国内外多个研究发现,HRSV感染者中,发热不是最常见的症状。例如,2015年Zhang等[26]对25篇来自我国的研究进行了系统综述,发现HRSV急性呼吸道感染者的主要症状为咳嗽(93.9%)、咳痰(66.3%)、喘息(65.7%)、发热(43%)、流涕(42.7%)和呼吸急促(32.2%)。Jiang等[27]也报道了2岁以下HRSV感染婴幼儿中仅45%出现发热,且HRSV阳性组比HRSV阴性组更容易出现喘息(OR=3.12),这表明以发热为监测症状不是识别HRSV感染者的合适监测策略。总之,无论采取ARI还是拓展的ILI作为病例定义,由于未纳入发热症状,比采用ILI [发热(体温≥38℃),伴咳嗽或咽痛之一者]作为HRSV监测病例定义更敏感,更容易发现HRSV感染者[28]。
推荐意见2:用拓展的ILI[急性起病(10 d内发病),伴呼吸道感染症状(咳嗽或者急性喘息发作)]定义作为HRSV门诊监测病例定义。
大多数情况下,HRSV引起轻度的上呼吸道感染,少部分可以发展为下呼吸道感染,主要表现为毛细支气管炎或肺炎,多见于2岁以下婴幼儿。HRSV也是造成1岁以内的婴儿下呼吸道感染住院的首要病因。欧洲发布的HRSV感染监测专家共识以及全球多个地区监测结果发现:由于感染HRSV的婴幼儿和老年患者中有很大一部分(通常>50%)无发热[29],因此,在设置HRSV住院病例定义时,如果将发热作为HRSV监测条件,则将近50%的小龄儿童或老年HRSV感染者排除在外[30]。Rha等[31]报告了WHO的监测结果:2009至2014年在南非共纳入9 969例5岁以下的严重急性呼吸道感染(Severe acute respiratory infections,SARI)病例,其中2 723例(27%)检测出HRSV阳性。3月龄以下HRSV阳性患儿发热比例仅占57%,而1岁以上HRSV阳性患儿发热比例为82%。从SARI病例发现因HRSV住院患者的敏感度只有55%~81%,特异度只有27%~54%,特别是对于≤6月龄的患儿,敏感度最低。如果使用SARI病例定义来监测HRSV将会导致36%的5岁以下儿童和49%的3月龄以下婴儿漏检;反之,如果将发热从SARI监测病例中去掉,将会发现2 676例(98%) HRSV感染者[31]。可见,SARI的病例定义不能满足HRSV住院病例监测标准[32],需要进一步拓展SARI病例定义。因此,WHO采用拓展的SARI[Extended SARI,急性起病(10 d内发病)的呼吸道感染(咳嗽或呼吸急促),超过24 h住院的严重感染]作为HRSV住院病例监测定义。欧洲根据WHO推荐建议也采用拓展的SARI作为HRSV住院病例的监测定义[28,31]。
推荐意见3:以拓展的SARI [急性起病(10 d内发病)伴呼吸道感染(咳嗽或呼吸急促等)]作为HRSV住院病例监测对象,即被诊断为"社区获得性肺炎、支气管炎、毛细支气管炎和喘息性支气管炎"的住院病例。
HRSV可致所有年龄段人群感染,但主要见于5岁以下儿童和≥65岁老年人、免疫功能低下人群。HRSV感染后的临床表现以呼吸道感染症状为主[33]。HRSV感染者人群特征与临床表现影响了患者的就医行为和就医科室。本团队前期在流感监测医院的调查发现,HRSV阳性检出率比较高的门诊科室主要分布在综合医院或者儿科医院的发热门诊、儿内科门诊/急诊、呼吸内科、感染内科等;HRSV检出率比较高的住院科室主要是综合医院或者儿科医院的新生儿病房、儿内科、呼吸内科、重症监护病房(Intensive care unit, ICU)/儿科ICU、感染科、老年科和肿瘤科病房等。其中,内科门诊/急诊、发热门诊和(或)儿内科门诊、儿内科急诊均是全国流感监测的哨点,具有比较成熟的经验和技术,可为HRSV监测提供良好的基础。WHO的监测方案中将儿科病房,儿科/新生儿病房、ICU和急诊室纳入HRSV住院病例的监测科室[34]。因此,根据HRSV感染的人群分布、临床表现以及就诊科室分布,推荐以下科室作为监测哨点,以便发现更多的HRSV感染者。
推荐意见4:以地市为监测区域,选择综合医院和儿童专科医院作为HRSV感染监测哨点医院。门诊病例监测,选择哨点医院的发热门诊、儿内科门诊/急诊、呼吸内科、感染内科门诊;住院病例监测,选择哨点医院的新生儿病房、儿内科、呼吸内科、ICU/儿科ICU、感染科、老年科和肿瘤科病房等。
全球不同地区的监测数据支持5岁以下儿童是HRSV感染的高危人群,其中2岁以下儿童感染风险最高,疾病负担最重。因此,HRSV感染监测时2岁以下儿童应作为优先监测人群,这与WHO第二阶段监测的人群分组一致。全球以及我国研究结果表明,在5岁以下HRSV感染引起的ALRTI住院病例中,约75%为1岁以下婴儿,50%为≤6月龄婴儿[35]。≤6月龄婴儿HRSV感染流行率为5.2/1 000,其中新生儿流行率高达26/1 000,19.6%的新生儿HRSV感染者需要住院治疗。新生儿HRSV感染后引起的病死率为2%~3%,高于1~4岁儿童(1.6%)[36]。美国CDC监测也发现:新生儿HRSV感染住院率最高。说明1岁以下婴儿HRSV感染比例高,其中新生儿HRSV感染疾病负担最重。因此HRSV感染监测时,1岁以下婴儿,特别是新生儿应作为优先监测对象。
全球研究发现:老年人也是HRSV感染高危人群。Jiang等[37]研究发现,成人HRSV感染率随年龄增加而升高,HRSV是引起老年人ARI重要的病原体(OR值为8.5),在65~75、>75岁年龄组引起的相关呼吸系统疾病发病率分别为71/10万和251/10万。美国需要长期护理的老年人HRSV感染率为5%~10%,其中可导致10%~20%的感染者住院,以及2%~5%感染者死亡[38]。引起老年人发生严重感染的主要原因是高龄(尤其是≥65岁人群)、患有慢性心脏病或肺部疾病等基础疾病者、免疫功能低下等。由于老年人群免疫力降低,慢性基础性疾病和共患病比例较高,一旦HRSV感染后易发展为重症。因此,老年人,特别是≥65岁人群应作为HRSV感染重点监测人群。
由于目前我国各年龄段HRSV疾病负担与传播模式尚不完全清楚,HRSV感染监测对象最好能覆盖所有年龄段,其中5岁以下不同年龄组感染HRSV的风险明显不同,因此,5岁以下儿童推荐年龄分组:新生儿(0~28 d),>28 d~<1岁,1~2岁,>2~5岁。这和WHO监测的目标人群分组,以及欧洲HRSV监测共识推荐意见一致[21,39]。通过监测可以发现HRSV感染的高危人群,对于确定公共卫生干预、免疫接种优先人群有重要的公共卫生意义[40]。
推荐意见5:HRSV监测对象覆盖所有年龄段人群,以5岁以下儿童和≥65岁老年人为重点监测对象。5岁以下儿童年龄分组为新生儿(0~28 d)、>28 d~<1岁、1~2岁和>2~5岁。
HRSV在全球广泛流行,但在不同地区呈现不同的季节性和周期性[41]。COVID-19大流行前,HRSV有相对明确的季节性分布特征,在北半球,HRSV感染流行季节一般出现在10或11月至次年4或5月,1或2月为高峰期[42,43]。在南半球,HRSV感染流行出现在5至9月,高峰期在5、6或7月[44]。在热带和亚热带气候地区,雨季HRSV感染率出现明显增高。COVID-19大流行期间,HRSV流行季节性发生了改变,如2022年秋冬季,英国、美国和加拿大等出现了HRSV感染者激增。我国南方和北方HRSV流行具有季节性差异:北方地区,流行高峰通常在10月中旬至次年5月中旬[45];部分南方地区,冬季或潮湿的雨季是感染高峰季节。全年持续开展HRSV监测,可发现HRSV流行季节性特征,这对于制订公共卫生干预措施,特别是未来实施免疫接种的时间有重要意义。
推荐意见6:HRSV感染监测应全年持续开展,以掌握HRSV流行季节性和动态变化。
HRSV可在特定场所和特定人群中引起聚集或者暴发流行,如儿科病房、新生儿ICU、移植病房、产后母婴康复机构(月子中心)[46]、癌症中心及养老院等免疫功能低下人群聚集场所[47,48,49,50,51]。Moreno等[52]报道,2012年10至12月,西班牙一家医院的新生儿ICU发生一起HRSV医院感染,48例住院患儿中有20例HRSV阳性,其中2例死亡,患儿平均年龄只有36 d,罹患率为42%。Bing等[46]报道了2021年1至2月,我国沈阳一家产后母婴康复机构(月子中心)发生一起HRSV-B/BA9型暴发疫情,共导致20人感染:21名新生儿中,16例HRSV阳性(7例入住ICU,9例入住普通病房);13名护理人员中有4例无症状感染。Hababou等[53]报道了2019年法国一家老年护理中心一起HRSV暴发,共12人感染,平均年龄为89岁,所有患者都存在基础疾病,2例患者死亡。但是,国内外幼托机构或者学校HRSV聚集性/暴发疫情报道较少。可见,HRSV感染聚集性疫情常发生于婴幼儿、≥65岁人群、免疫功能低下人群的聚集场所,如医疗机构的儿内科病房、新生儿病房、儿科ICU、产后母婴康复机构(月子中心);ICU、移植中心;老年医院/长期照护中心、养老院等。由于这些特殊场所一旦出现聚集性疫情,传播速度快,罹患率高,病情重,因此,早期发现HRSV感染聚集性疫情非常重要。
推荐意见7:HRSV聚集性疫情监测应考虑重点场所:医疗机构的儿内科病房、新生儿病房以及ICU、儿科ICU、移植病房、产后母婴康复机构(月子中心)、老年医院/长期照护中心,以及养老院等。
传染病聚集性疫情是指传染病确诊病例或者疑似病例在时间或者空间有聚集,是暴发疫情非常重要的一个预警信号,能够及时判断可能的传播风险。HRSV聚集性疫情多见于医疗机构/养老院的儿童、老人以及免疫功能低下人群,且患者的临床表现与临床结局往往比社区获得性感染更严重[54]。目前,全球尚无统一HRSV聚集性疫情的标准,经专家研讨认为:HRSV传染性较强,平均潜伏期长于流感,免疫功能低下人群一旦出现聚集性感染容易发生重症,因此,HRSV聚集性疫情的定义应比流感暴发定义(≥10例或发生≥5例因流感样疾病住院的病例等)更为敏感,便于早发现、早控制疫情。专家们一致推荐:一周内,在一个集体单位的小范围,如一个病区、班级、宿舍等,发现≥5例符合HRSV监测病例定义、临床上症状相似、至少有2例HRSV感染实验室确诊病例,或发生≥2例因HRSV感染住院的病例可定义为HRSV感染聚集性疫情。HRSV感染的聚集性疫情往往是暴发疫情的前兆,及时发现HRSV感染聚集性疫情对于早期发现暴发疫情与控制非常关键。
推荐意见8:HRSV聚集性疫情定义:一周内在小范围,如一个病区、班级、集体单位等出现≥5例符合HRSV监测病例定义的ARI者,其中至少2例为HRSV感染确诊病例,或发生≥2例因HRSV感染住院的病例。
HRSV病原检测结果与采样时机(采样时间与发病时间的间隔)、标本种类和采样、运输、保存质量密切相关。
HRSV监测病例采样时机首先要考虑HRSV感染者排毒规律,大多数的HRSV感染者带毒时间为7 d[55],但带毒时间与疾病严重程度、年龄、基础疾病、基因型等密切相关[56]。在门诊就诊的成人HRSV感染者,平均带毒时间为(9.8±4.8)d[57],但儿童,尤其是婴儿和免疫功能低下患者带毒时间可能长达30 d[58,59]。Coppee等[60]报道:2021年,法国患有基础疾病感染HRSV的住院老人(平均年龄为65岁)中,HRSV平均带毒时间为13(7~30) d。HRSV的带毒时间还与HRSV基因型密切相关。Takeyama等[56]报道:HRSV住院儿童中,A基因型感染儿童排毒时间(9.7 d)明显长于B基因型感染儿童(6.5 d)。其次,HRSV监测病例采样时机还需要考虑检测方法,核酸检测比抗原检测敏感,抗原检测在发病早期阳性率高,但随着时间推移,敏感度明显下降。欧洲HRSV感染监测专家共识建议采集发病10 d内的标本,优先采集发病最初4 d内的标本[21]。因此,为了提高HRSV检出阳性率,建议门诊监测病例采集发病1周内的标本,优先采集发病4 d内的标本;由于住院病例监测主要目标是捕获社区获得性感染,区分医院感染(入院48 h后),建议采集住院后48 h内上或下呼吸道标本。
推荐意见9:对于门诊病例,尽可能采集发病1周内的呼吸道标本,优先采集发病4 d内的上或下呼吸道标本;对于住院病例,采集住院后48 h内上或下呼吸道标本。
标本的采集部位对于提高实验室诊断的敏感度非常重要[21]。由于鼻咽部的HRSV病毒载量比口咽部高[21,61],而且鼻咽拭子标本比鼻拭子标本中的细胞数量更多,鼻咽拭子中HRSV检测的敏感度更高[62]。因此,欧洲HRSV感染监测专家共识建议采集鼻咽拭子进行HRSV监测[21]。WHO监测方案中推荐不同年龄组,不同的临床类型采集不同部位的临床标本[63,64,65]。
应采集病例发病1周内的呼吸道标本,优先采集新发病例的呼吸道标本;根据病例分布特征,选择采样对象,避免集中在同一部门或病区、宿舍采集。重症病例和死亡病例标本应全部采集,尽量采集下呼吸道标本(如痰液)。每起聚集性疫情应至少采集5份呼吸道标本(如果现症病例不足5例,应全部采样)。不能明确病原学诊断的疫情,可酌情增加采样批次和采样数量。
推荐意见10:门诊监测病例采集发病1周内的鼻咽拭子、口咽拭子和痰液标本;住院监测病例采集入院48 h内的标本,上或下呼吸道标本均可,优先采集深咳痰液、呼吸道抽取物、支气管肺泡灌洗液标本。聚集性疫情病例,推荐优先采集新发病例、指示病例、住院病例及重症病例等发病1周内的呼吸道标本。
呼吸道标本采集后应在4℃条件下运送至实验室进行检测,4℃保存时间不宜超过24 h。如24 h内无法检测的标本应置于-70 ℃及以下冰箱保存,标本不宜反复冻融,反复冻融易被灭活[12],对于需要进行病毒分离的呼吸道标本,应尽快送到实验室接种[21]。血清标本在4℃条件下,存放时间不宜超过3 d,-20 ℃以下可长期保存,血清标本也不宜反复冻融[33]。
HRSV感染检测方法主要有4种:核酸检测、抗原检测、病毒分离和抗体检测,目前应用比较广泛的是核酸检测和抗原检测。根据中华预防医学会发布的《人呼吸道合胞病毒感染诊断团体标准》[33],HRSV感染疑似病例,如在呼吸道标本中检测到HRSV核酸阳性、HRSV特异性抗原阳性或者分离到HRSV均可以确诊;或者恢复期血标本HRSV IgG抗体滴度较急性期血标本HRSV IgG抗体滴度出现≥4倍升高,或急性期抗体阴性而恢复期抗体阳性等可以确诊。
(1)核酸检测。HRSV核酸检测方法是目前HRSV监测中容易接受而且全球应用广泛的方法。目前,欧洲评估47%~72%的HRSV核酸检测试剂扩增的靶基因是N基因,10%~22%扩增M基因,6%~12%扩增F基因,扩增L、NS1、NS2、M2-2、P基因各占3%[21]。不管扩增哪一个靶基因,检测HRSV的A基因型、B基因型的敏感度没有差异[21]。实时逆转录聚合酶链反应(Real-time reverse transcription-polymerase chain reaction, rRT-PCR)方法是目前应用最广的核酸检测方法之一,诊断敏感度达到86.4%~100.0%,特异度达到97.7%~100.0%,适用于检测各个年龄段感染者的上或下呼吸道标本,同时适用于HRSV感染早期、中期及晚期。多重RT-PCR检测可同时检测包括HRSV在内的多种呼吸道病原体。核酸检测法主要优点是检测速度快、敏感度和特异度高,并且可以进行HRSV病毒定量和基因分型[66],主要缺点是HRSV在进化过程中可能产生单核苷酸多态性(SNP)和其他突变,采用核酸检测法检测可能会出现假阴性结果。因此,为确保核酸检测法的敏感度与特异度,定期需要根据HRSV流行株的变异特征对检测所用的引物和探针进行评估和更新[21,67]。
推荐意见11:推荐rRT-PCR作为HRSV感染哨点监测和聚集性疫情监测的优先检测方法。
(2)抗原检测。HRSV抗原检测方法包括:快速抗原检测方法(Rapid antigen detection tests,RADT)(如胶体金免疫层析法)、直接免疫荧光法(Direct immunofluorescent assay,DFA)和间接免疫荧光法(Indirect immunofluorescent assay,IFA)等。采用RADT方法检测HRSV抗原的敏感度为12.2%~98.3%,特性度为67.1%~100%[68]。免疫荧光法比RADT方法敏感度和特性度高,分别是65%~94.1%和99%~100%,但是免疫荧光法要求比较高,标本中有足够的呼吸道柱状上皮细胞,适合用于检测鼻咽部吸出物、支气管肺泡灌洗液或鼻咽拭子样本。由于免疫荧光法检测HRSV需要荧光显微镜,对技术人员的要求比较高,因此在基层医院难以推广。HRSV抗原检测敏感度在不同的病程有差异,例如Shafik等[69]研究发现,与rRT-PCR法相比,用DFA方法检测5岁以下儿童发病3 d内的鼻咽拭子标本,HRSV抗原检测敏感度最高(86%),随着病程延长而降低,第1周后降至65%。另外抗原检测的敏感度在不同年龄人群差异较大。美国CDC的研究表明:在婴儿和小龄儿童中HRSV抗原检测敏感度高达80%~90%,但在大龄儿童和成人的感染者中,HRSV载量较低,抗原检测时敏感度下降至29%[70]。可见,抗原检测适用发病早期的病例,特别是年龄小的儿童病例。HRSV抗原检测方法最大优点是操作简便,检测时间短,价格低,适用于医疗机构的快速诊断和暴发疫情早期识别。缺点是不能区分HRSV的A、B基因型,且检测敏感度不如核酸检测方法。HRSV抗原阴性者不能完全排除HRSV感染,必要时须进一步开展核酸检测鉴定。此外,HRSV的F和N蛋白与人偏肺病毒存在免疫交叉反应,基于这两种蛋白的抗原检测方法可能会导致假阳性率升高[21]。
推荐意见12:推荐RADT作为医疗卫生机构HRSV感染早期筛查与暴发疫情早期识别的检测方法。
(3)病毒分离与培养。病毒分离是HRSV感染诊断的金标准,但是病毒培养需要3~7 d。目前,敏感细胞系为异倍体细胞或二倍体细胞,如人喉癌上皮细胞Hep-2、人宫颈癌细胞Hela、人非小细胞肺癌细胞A549、恒河猴肾细胞RMK和非洲绿猴肾细胞Vero等,其中人喉癌上皮细胞Hep-2敏感性好,较为常用[21,33,71]。HRSV分离最重要的步骤是正确处理标本,否则HRSV很快会失去感染活性。合理采集临床标本,采集后立即接种细胞、及时在培养液中添加蔗糖保存HRSV的感染性,可提高HRSV分离的成功率。温度升高、反复冻融和pH值变化对HRSV感染性产生不利的影响。病毒培养与分离费时费力,不适合用于常规的临床HRSV感染诊断,但在HRSV表型特征方面,例如HRSV疫苗诱导的中和抗体、抗病毒特性、与疫苗株的相似性分析,以及其他检测方法的参照等方面仍是非常重要的[21]。
(4)血清学检测。HRSV的血清学诊断方法不作为急性HRSV感染的临床诊断方法,仅在血清流行病学调查或评估人群免疫状态中应用[21]。IgM抗体阳性不能单独作为临床HRSV感染诊断的实验室指标。
4种检测方法的比较见表1。
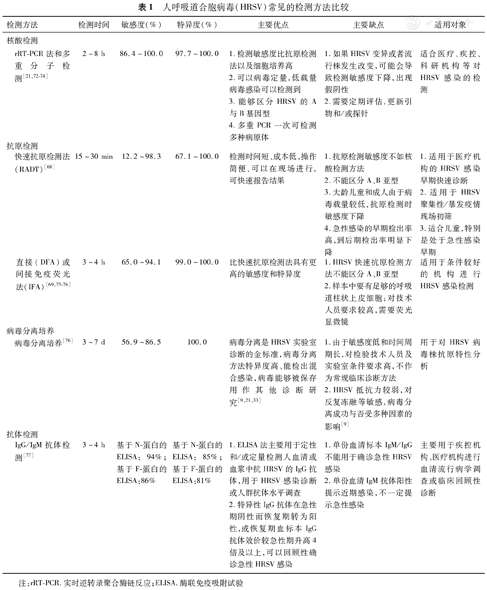
人呼吸道合胞病毒(HRSV)常见的检测方法比较
人呼吸道合胞病毒(HRSV)常见的检测方法比较
| 检测方法 | 检测时间 | 敏感度(%) | 特异度(%) | 主要优点 | 主要缺点 | 适用对象 |
|---|---|---|---|---|---|---|
| 核酸检测 | ||||||
| rRT-PCR法和多重分子检测[21,72,73,74] | 2~8 h | 86.4~100.0 | 97.7~100.0 | 1.检测敏感度比抗原检测法以及细胞培养高2.可以病毒定量,低载量病毒感染可以检测到3.能够区分HRSV的A与B基因型4.多重PCR一次可检测多种病原体 | 1.如果HRSV变异或者流行株发生改变,可能会导致检测敏感度下降,出现假阴性2.需要定期评估,更新引物和/或探针 | 适合医疗、疾控、科研机构等对HRSV感染的检测 |
| 抗原检测 | ||||||
| 快速抗原检测法(RADT)[68] | 15~30 min | 12.2~98.3 | 67.1~100.0 | 检测时间短、成本低,操作简便、可以在现场进行,可快速报告结果 | 1.抗原检测敏感度不如核酸检测方法2.不能区分A、B亚型3.大龄儿童和成人由于病毒载量较低,抗原检测时敏感度下降4.急性感染的早期检出率高,到后期检出率明显下降 | 1.适用于医疗机构的HRSV感染早期快速诊断2.适用于HRSV聚集性/暴发疫情现场初筛3.适合儿童,特别是处于急性感染早期 |
| 直接(DFA)或间接免疫荧光法(IFA)[69,75,76] | 3~4 h | 65.0~94.1 | 99.0~100.0 | 比快速抗原检测法具有更高的敏感度和特异度 | 1.HRSV快速抗原检测方法不能区分A、B亚型2.样本中要有足够的呼吸道柱状上皮细胞;对技术人员要求较高,需要荧光显微镜 | 适用于条件较好的机构进行HRSV感染检测 |
| 病毒分离培养 | ||||||
| 病毒分离培养[76] | 3~7 d | 56.9~86.5 | 100.0 | 病毒分离是HRSV实验室诊断的金标准,病毒分离方法特异度高、能检出混合感染,病毒能够被保存用作其他诊断研究[9,21,33] | 1.由于敏感度低和时间周期长,对检验技术人员及实验室条件要求高,不作为常规临床诊断方法2.HRSV抵抗力较弱,对反复冻融等敏感,病毒分离成功与否受多种因素的影响[9] | 用于对HRSV病毒株抗原特性分析 |
| 抗体检测 | ||||||
| IgG/IgM抗体检测[77] | 3~4 h | 基于N-蛋白的ELISA:94%;基于F-蛋白的ELISA:86% | 基于N-蛋白的ELISA:85%;基于F-蛋白的ELISA:81% | 1.ELISA法主要用于定性和/或定量检测人血清或血浆中抗HRSV的IgG抗体,用于HRSV感染诊断或人群抗体水平调查2.特异性IgG抗体在急性期阴性而恢复期转为阳性,或恢复期血标本IgG抗体效价较急性期升高4倍及以上,可以回顾性确诊急性HRSV感染 | 1.单份血清标本IgM/IgG不能用于确诊急性HRSV感染2.单份血清IgM抗体阳性提示近期感染,不一定提示急性感染 | 主要用于疾控机构、医疗机构进行血清流行病学调查或临床回顾性诊断 |
注:rRT-PCR.实时逆转录聚合酶链反应;ELISA.酶联免疫吸附试验
开展HRSV基因分型,可监测HRSV基因进化,评估基因型与传播、疾病严重性的关联,监测抗原变化等[78]。最新全球分析结果表明,用G基因的全长进行分型,与用部分G基因序列,以及G基因以外的其他片段进行基因分型结果是一致的[79]。由于G基因第二高变区是HRSV分型的结构基础,因此,基因型监测的测序至少要覆盖G基因第二高变区。另外,F蛋白是Ⅰ型跨膜糖蛋白,全长574个氨基酸,是诱导机体产生保护性中和抗体的主要靶蛋白[6]。针对F蛋白抗原表位关键位点进行变异监测,对单克隆抗体、药物以及疫苗的研发和评价具有重要意义。有条件的单位优先进行F全基因测序,如果进行F基因的部分测序,至少覆盖抗原表位Φ和II,这两个位点与中和抗体的产生以及疫苗开发有关[21]。多个研究发现,HRSV感染发病早期、住院病例,特别是HRSV感染重症病例病毒载量比较高,容易获得测序结果。对HRSV聚集性疫情病例,特别是疫情发生早期病例进行测序,对于发现感染来源,确定传播链,评估传播风险有重要的公共卫生意义,因此,这些聚集性病例需要优先测序[54,80,81]。通过基因测序与分型,可以掌握我国HRSV流行的基因型和基因变异特点,以及基因型的地理分布与时间分布,积累我国的HRSV分子流行特征本底资料,为今后我国HRSV单克隆抗体和疫苗的研发、免疫预防策略的制订,预防效果的评估提供重要的科学依据[6]。
推荐意见13:优先选取HRSV感染早期病例、住院病例、重症病例,以及聚集性/暴发相关的病例进行测序,以G和/或F基因(部分或者全长)或HRSV全基因组为测序靶基因。
HRSV感染监测流程图见图1。
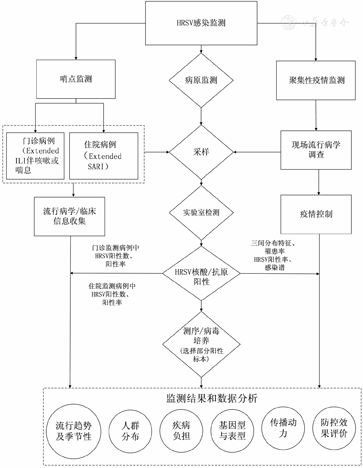

注:Extended ILI.拓展的流感样病例;Extended SARI.拓展的严重急性呼吸道感染
每个监测哨点需要收集HRSV感染病例个案信息和汇总信息。门诊病例收集的信息包括:人口学信息(姓名、性别、年龄、职业和现住址等)、临床诊疗相关信息(发病日期、初诊日期、就诊科室、实验室检测方法及阳性标本采样日期等);住院病例在此基础上增加入院日期、出院日期、出院诊断等。收集汇总信息包括:监测科室门诊人次数/住院总人数,符合监测病例定义的门诊人数/住院人数,确诊为HRSV感染的门诊人数/住院人数等。
自2004年以来,我国建立了一套以网络报告为基础的、实时法定传染病信息报告系统,覆盖了全国31个省、自治区,全国法定传染病报告及时率达到99%以上。目前这套系统已经安全稳定运行19年,显著提高了我国传染病监测与报告水平[82]。尽管目前HRSV没有纳入我国法定报告传染病,但是可依托这套法定传染病信息报告系统,拓展我国HRSV病例的监测报告、管理与分析,这是最经济、最便捷的方法。
HRSV感染聚集性疫情可通过"中国流感监测信息系统"报告,如果达到了突发事件报告标准,通过"突发公共卫生事件管理信息系统"进行报告。
监测数据分析时应将病例的流行病学数据、临床信息与实验室检测结果结合起来,分析指标主要包括:HRSV阳性率、发病率、住院率、罹患率、续发率、病死率、构成比和基因型等。
推荐意见14:建议将HRSV确诊病例,通过中国疾病预防控制传染病监测信息系统,作为"其他传染病"报告与管理;HRSV感染聚集性疫情可通过"中国流感监测信息系统"报告,如果达到了我国突发公共卫生事件标准,通过"突发公共卫生事件管理信息系统"进行报告。
当社区HRSV流行水平增高时,医院内感染暴发风险增加[55]。医疗机构应强化HRSV感染防控措施,特别是一些重点科室,如儿科病房、新生儿病房、呼吸科病房、ICU/儿科ICU等。
(1)病例管理:早期快速识别HRSV感染者,并将HRSV感染者单间隔离或集中收治于同一病房[83];
(2)医护人员防护:在平常的诊疗过程中落实标准预防+飞沫隔离+接触隔离;接触患者前后要严格执行手卫生[84];医务人员如出现发热、咳嗽等呼吸道感染症状,应戴好外科口罩,避免直接接触患者;医务人员在进行容易产生气溶胶的高危诊疗操作(如气管插管、吸痰、雾化等)时,建议在独立的诊室进行,并且做好个人防护,操作结束后要对医疗设备、环境、空气和物体表面进行清洁与消毒。
(3)陪护、探视人员管理:HRSV住院病例陪护人员尽量不离开病区、也不要到其他病房串访,戴好外科口罩,做好手卫生;HRSV流行期间,限制探视人员数量,减少聚集性活动[55];
(4)病房环境卫生:加强HRSV感染者收治病房的通风、环境卫生,特别是经常接触的物体表面清洁与消毒[55];
一旦出现HRSV院内感染暴发,应及时报告;遵循国家《医院感染暴发控制指南》(WS/T524-2016)的要求,启动医院感染暴发调查。暴发期间,及时检测与发现医务人员中的无症状感染者对控制医院感染暴发至关重要。
HRSV聚集性/暴发疫情还可在其他集体机构发生,比如幼托机构、产后母婴康复机构(月子中心)、学校及养老院等,应采取以下重点措施[85]:(1)病例管理:轻症HRSV感染者居家/集中隔离休息;重症者及时就医,追踪住院以及重症病例转归情况;HRSV感染者遵循呼吸道卫生和咳嗽礼仪,不要与他人共用餐具与个人物品;(2)工作人员管理:工作人员护理HRSV感染者时,要做好手卫生和戴好外科口罩,如出现症状或者HRSV阳性,应暂时调离岗位;幼托机构、产后母婴康复机构(月子中心)、学校及养老院的感染者尽量由固定人员进行看护,以避免交叉感染;(3)环境和个人卫生:加强机构环境通风、对污染的区域和物体表面及时进行清洁消毒等;(4)加强应急监测:对疑似病例、密切接触者、共同暴露者进行应急监测,及时发现HRSV阳性人员;(5)其他措施:HRSV暴发期间,尽量减少或停止机构的集体活动,尽可能减少暴露机会;(6)HRSV流行期间,易感人群适当缩短在幼托机构或学校的停留时间,降低感染风险。
当进入HRSV流行季节或者局部地区社区流行增强时,家庭传播风险增加,主要的防控措施如下:(1)因母乳中含有免疫球蛋白,可以抵抗HRSV感染,提倡给婴儿母乳喂养,至少喂养6个月[86];(2)减少高危人群暴露机会,避免与急性呼吸道感染者近距离接触,如接吻、拥抱、握手、共用杯子和餐具[87],加强居室台面、门把手、电灯开关、儿童餐具、玩具等接触频繁部位及浴室、卫生间等共用区域的清洁和消毒[88],HRSV感染流行季节,尽量避免去人群聚集场所等;(3)一旦家庭成员有人感染HRSV,轻症者尽量居家隔离休息,避免进入公共场所、不带病上班或上课;如症状加重,应及时去医院就诊[87]。
HRSV是一种亲脂病毒(有脂质膜的病毒),常规消毒方法即可杀灭HRSV。按医疗机构消毒技术规范(WS/T367-2012),推荐采用以下方法进行消毒。
(1)环境和物体表面的清洁与消毒:选择复方季铵盐消毒液、含醇消毒液或其他可用于物体表面消毒的消毒液擦拭消毒;环境物体表面的消毒首选使用季铵盐消毒湿巾或含醇消毒湿巾擦拭消毒。
(2)患者的衣物、床上用品:患者衣物、床上用品推荐使用清洗消毒机处置;如果手工清洗,建议先使用复方季铵盐消毒液浸泡清洗20~30 min,最后再用清水洗净。
为了促进全球开发高质量、安全、可负担和有效的单克隆抗体,预防全球婴幼儿严重HRSV感染性疾病和HRSV相关死亡,2021年6月WHO制订了"WHO推荐用于HRSV感染被动免疫理想的单克隆抗体产品特性"技术文件,阐明了理想的单克隆抗体应为一种高质量、安全、有效的HRSV预防产品,可用于预防1岁以下婴儿的严重HRSV感染疾病和死亡,并降低5岁以下儿童的发病率。该预防产品易于获取,可在包括中低收入国家的全球范围内使用[89]。目前,两种针对HRSV的特异性单克隆抗体已在国外获批使用,但是,这两种单克隆抗体均未在我国获批使用。
(1)帕利珠单抗(Palivizumab):用于预防2岁以下高危儿童的HRSV严重感染,包括早产、患有中度至重度支气管/肺发育不良或血液动力学显著改变的先天性心脏病(CHD)[90]。在HRSV流行期间,需要每月注射一次帕利珠单抗[8,91]。帕利珠单抗由于价格昂贵,现在主要用于高收入和一些中等收入国家的特定高危婴幼儿。
(2)长效单克隆抗体尼塞韦单抗(Nirsevimab):已在欧盟、英国、美国及加拿大等获批使用,用于预防婴幼儿HRSV感染引起的下呼吸道疾病(Lower respiratory tract disease,LRTD),只需要单剂次给药即可,保护期长达5个月[92]。美国免疫实施咨询委员会(ACIP)推荐尼塞韦单抗适用对象[92]:对在第一个HRSV流行季期间或进入第一个HRSV流行季期间出生的8月龄以下婴儿,以及进入第二个HRSV流行季8~19月龄有严重HRSV感染风险的婴儿和儿童。尼塞韦单抗已在国家药品监督管理局提交了上市申请,目前正在审批中。
在本共识的基础上,尽快构建我国HRSV感染监测系统,统一监测技术标准,实施HRSV感染哨点、聚集性疫情和病原监测,并加强监测数据的分析利用[94]。未来,可进一步拓展社区主动监测,完善监测体系,与教育、民政等多部门实现信息共享,探索多源监测和多点触发预警机制,加快疫苗、预防性生物制品和药物的研发应用,为HRSV感染预防控制,以及人群免疫策略的制订提供科学依据。随着HRSV监测与防控经验积累及相关研究的开展,本共识在具体实践中可能会表现出其局限性,为此,专家组将与时俱进,继续跟进HRSV相关研究证据,并及时更新。
项目负责人:
刘社兰 浙江省疾病预防控制中心传染病预防控制所
专家组名单:(按姓氏笔画排列)
王新宇 国家传染病医学中心 复旦大学附属华山医院
王 兰 浙江大学医学院附属第一医院老年医学科
王淑颖 杭州市第一人民医院院感部
王国华 桐乡市疾病预防控制中心
吕华坤 浙江省疾病预防控制中心免疫规划所
朱 安 缙云县第二人民医院儿科
刘社兰 浙江省疾病预防控制中心传染病预防控制所
许 皓 桐乡市疾病预防控制中心
阮 冰 国家传染病医学中心 浙江大学医学院附属第一医院
孙继民 浙江省疾病预防控制中心传染病预防控制所
孙 昼 杭州市疾病预防控制中心传染病防制所
严剑波 舟山市疾病预防控制中心
李 青 安徽省疾病预防控制中心卫生应急管理与急性传染病防治科
吴家兵 安徽省疾病预防控制中心
余 昭 浙江省疾病预防控制中心传染病预防控制所
陈直平 浙江省疾病预防控制中心
陈恩富 浙江省疾病预防控制中心传染病预防控制所
陈 寅 浙江省疾病预防控制中心微生物检验所
陈 奕 宁波市疾病预防控制中心
陈中文 嘉兴市疾病预防控制中心
胡国庆 浙江省疾病预防控制中心传染病预防控制所
侯 赛 安徽省疾病预防控制中心卫生应急管理与急性传染病防治科
秦淑文 浙江省疾病预防控制中心传染病预防控制所
倪朝荣 温州市疾病预防控制中心传染病防制所
凌 锋 浙江省疾病预防控制中心传染病预防控制所
龚 磊 安徽省疾病预防控制中心卫生应急管理与急性传染病防治科
蒋健敏 浙江省疾病预防控制中心 浙江省传染病疫苗与预防控制研究重点实验室
曾 玫 国家儿童医学中心(上海)复旦大学附属儿科医院感染传染科
富小飞 嘉兴市疾病预防控制中心传染病预防控制科
鲍倡俊 江苏省疾病预防控制中心急性传染病防制所
缪梓萍 浙江省疾病预防控制中心传染病预防控制所
潘 浩 上海市疾病预防控制中心传染病防治所
潘金仁 浙江省疾病预防控制中心传染病预防控制所
学术秘书:潘金仁、孙琬琬、陈奕娟
执笔专家:
刘社兰 浙江省疾病预防控制中心传染病预防控制所
龚 磊 安徽省疾病预防控制中心传染病防治科
潘 浩 上海市疾病预防控制中心传染病防治所
浙江省疾病预防控制中心浙江省传染病疫苗与预防控制研究重点实验室,国家儿童医学中心(上海)复旦大学附属儿科医院,国家传染病医学中心(上海)复旦大学附属华山医院,等.人呼吸道合胞病毒感染监测与防控专家共识(2023年)[J].中华临床感染病杂志,2023,16(5):337-353.DOI:10.3760/cma.j.issn.1674-2397.2023.05.002.
所有作者均声明不存在利益冲突



























