2023年加拿大妇产科医师协会(Society of Obstetricians and Gynaecologists of Canada,SOGC)根据最新的研究结果及循证证据发布了促宫颈成熟和引产指南,该指南分为引产总则、促宫颈成熟和引产三部分,详述了促宫颈成熟和引产的指征和方法。本文就该指南中主要的更新点进行重点解读。该指南重点强调了引产的个体化,更强调了尊重患者选择的人文关怀;建议孕8~12周应用超声核对孕周,提出40岁及以上孕妇≥39周引产的合理性,不建议无指征的意愿选择性引产;在促宫颈成熟方面,球囊和前列腺素制剂同样有效,球囊可用于瘢痕子宫要求阴道分娩者,球囊及前列腺素E2栓剂可用于门诊促宫颈成熟;米索前列醇和前列腺素E2制剂既可用于促宫颈成熟又可用于宫缩诱导剂引产。小剂量米索前列醇口服安全有效,米索前列醇溶液更易于精准给药。若促宫颈成熟时间较长,在母胎安全的情况下,促宫颈成熟过程可以中断休息后再开始。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着我国生育政策的调整和我国医疗总体水平的提高,高龄孕妇和妊娠合并症、并发症的高危孕妇越来越多,临床工作者对高危妊娠识别管理能力逐渐提高,整个孕妇群体中的引产率呈上升趋势。引产作为一项医疗干预措施,在给母胎带来益处的同时也有一定的风险。如何恰当高效引产以达到母胎安全的目标,是我国产科学界面临的需要不断提高的内容。2023年加拿大妇产科医师协会(Society of Obstetricians and Gynaecologists of Canada,SOGC)发布了关于促宫颈成熟和引产的临床指南[1]。该指南分为引产总则、促宫颈成熟和引产三部分,依据最新的研究结果,并根据循证证据分级和推荐强度,对于促进宫颈成熟方法及引产方法给予了更为详尽的指导建议。本文对于该指南及其相关证据进行解读,供国内相关工作者参考。
指南总则部分强调了引产的个体化,医务人员应结合患者病情、文化差异、当地医疗资源等,结合患者的个体需求,制定最终的治疗方案。首先明确以下几个基本概念:早期足月产(early term birth):37+0~38周+6分娩;足月产(full term birth):39+0~40+6周分娩;晚期足月产(late term birth):41+0~41+6周分娩;过期产(post term birth):≥42周分娩;意愿选择性引产(无指征引产):没有孕妇或胎儿医疗指征,孕妇自己有意愿要求引产;宫缩过频:宫缩>5次/10 min,伴或不伴胎心率异常;引产成功:通过引产最终达到阴道分娩,而不管耗时长短,这与此前的定义即引产后24~48 h达到阴道分娩[2]有所不同。决定引产成功的因素:孕妇年龄、体重指数、产次、孕周及宫颈状态。以下将对更新点及重点进行解读,由于篇幅所限,其他常规的引产指征在此不再赘述。
1.核对孕周:所有孕妇都应在妊娠8~12周行早孕期超声检查,明确胎龄(推荐强度:强;证据级别:高)。孕周的准确计算是引产的基础,末次月经不详或月经不规则时超声评估孕周是关键,即使月经规则的孕妇也有必要参考超声的结果[3]。2019年SOGC超声评估孕周的指南[4]提出早孕期头臀长是确定孕周的最佳指标,当头臀长至少为10 mm(孕7周)时,其核对孕周的可靠性和可测量性最佳。有研究认为孕12~14周的头臀长与双顶径确定孕周的准确性相似,但双顶径较头臀长的测量误差更低[5, 6]。考虑到可操作性且为了最大程度避免测量误差,2023年SOGC指南明确了妊娠8~12周行早孕期超声测量胚胎或头臀长确定孕周为强推荐。与既往公认在常规测量颈项透明层厚度时的胎儿头臀长核对孕周的时间相比有所提前。
2.意愿选择性引产(无指征引产):没有孕妇或胎儿医疗指征,孕妇自己有意愿要求引产。首先要避免孕39周以前的无指征引产。出生胎龄37+0~38周+6与超过39周的新生儿相比,新生儿呼吸问题、新生儿重症监护病房(neonatal intensive care unit,NICU)入住率等近期风险增加,注意力缺陷多动障碍和认知缺陷等远期风险也增加[7]。所以要避免39周以前的无指征引产。对于39周后意愿选择性引产,虽然胎儿不成熟的风险以及新生儿NICU入住率并不增加,但是需要增加住院时间、消耗医疗资源,因此并不推荐。有研究显示,孕39周引产与期待相比可以改善母儿结局,但会增加初产妇肩难产风险[8]。但也有研究发现,孕39周引产与期待但不迟于42周分娩相比,围产期死亡率有所增加[9]。所以孕39周是否需要常规引产还需进一步论证。
3.无合并症和并发症的晚期足月妊娠引产应在孕41周或之后进行(推荐强度:强;证据级别:高):虽然大部分孕妇会在孕42周+0之前自然分娩,但是孕41周+0后随着时间的推移,围产儿死亡率、剖宫产率会逐渐升高,所以很多国家指南均建议孕41周后引产[10, 11, 12]。2018年一项meta分析显示,与期待组相比,虽然阴道助产率有所增加,但足月及晚期足月引产可降低剖宫产率、围产期死亡率、NICU入住率和Apgar评分<7分的发生率。妊娠<41周引产组与≥41周引产组的围产儿死亡、死产、NICU入住、剖宫产、软产道损伤等发生风险差异均无统计学意义[13]。所以妊娠41周之后不宜期待观察,应进行引产。
但2023年SOGC指南提出若孕妇拒绝孕41周后引产,则应加强监护,包括每周2次胎心监护及B超测最大羊水深度[14, 15]。需要告知孕妇,监测只能说明当时的母儿情况,不能预防或预测胎儿的不良结局(包括死胎)[16]。
4.高龄(≥40岁)孕妇可于39周引产(推荐强度:强;证据级别:高):高龄(≥40岁)孕妇发生胎盘早剥、前置胎盘、胎位异常、难产、胎儿生长受限、早产、产后出血及死胎死产的风险增加。≥40岁孕妇在39周后发生不良结局的风险与24~29岁孕妇41周后的风险相当[17]。年龄还与剖宫产率呈正相关,≥40岁的经产妇剖宫产率较<30岁经产妇增加了2倍,≥40岁的初产妇剖宫产率较<30岁初产妇增加了3倍以上[18]。因此,2023年SOGC指南推荐≥40岁的高龄孕妇应考虑于39周引产。
5.有争议的引产指征:巨大儿是否引产及何时引产一直存在争议。2023年SOGC指南提出可疑巨大儿或大于胎龄儿不是孕39周前引产的指征(推荐强度:弱;证据级别:低)。研究显示,对疑似巨大儿的胎儿进行引产并没有减少臂丛神经损伤的风险,而且胎儿体重的产前估计往往不准确,许多引产可能并不需要[19]。因早期足月产存在相关风险,故也不推荐<39周分娩。临床工作中应与孕妇充分讨论超声对准确预测胎儿体重的局限性,以及早期足月产儿近远期风险、孕39周后引产发生新生儿肩难产和锁骨骨折的风险、母体尿粪失禁及潜在的剖宫产风险等,再决定引产事宜。
关于辅助生殖技术(assisted reproductive technology,ART)受孕者,没有足够的证据表明引产可使这部分母亲或其胎儿获益(推荐强度:弱;证据级别:低),不宜作为引产指征。一项研究比较了ART与非ART的不孕患者的单胎妊娠结局(妊娠期高血压疾病、前置胎盘、胎盘早剥、剖宫产、早产、极早产、死产、低出生体重和极低出生体重等发生率),ART组仅前置胎盘发生率明显高于非ART组[20]。所以ART本身不是引产指征,临床工作中ART患者应个体化处理,根据其他具体情况决定是否引产。
2023年一项回顾性分析显示孕前肥胖和病态肥胖与更高的产科合并症发生率、更低的自然受孕和自然分娩率、更多的剖宫产率和不良分娩结局相关[21]。2019年SOGC指南[22]关于孕产妇肥胖的孕前和产前护理指出:考虑死产的风险增加,体重指数为40 kg/m2或更高的妇女,建议在妊娠39~40周分娩。
6.胎膜早破:对于单胎足月胎膜早破的孕妇,在条件允许的情况下,无论B族链球菌(group B Streptococcus,GBS)是否阳性都推荐尽快引产;GBS 携带者在等待引产时应开始预防性使用抗生素,而GBS阴性者也可以等待24 h不临产再引产;但是无论GBS阳性与否,在正式临产前应避免阴道指检,临产后应仅在有指征时行阴道指检(推荐强度:弱;证据级别:中)。
2014年一项针对1 439例胎膜早破的低风险孕妇的队列研究显示,胎膜早破的时间并不是孕产妇感染性疾病的独立危险因素,阴道检查的次数是绒毛膜羊膜炎的独立危险因素,<4次时感染率最低,>8次时发生绒毛膜羊膜炎风险明显升高[23]。研究显示,无论宫颈状况或Bishop评分如何,米索前列醇(舌下含服、口服或阴道用药)与缩宫素用于胎膜早破引产的24 h内阴道分娩率差异无统计学意义;与缩宫素相比,使用米索前列醇的安全性相似甚至更优[24, 25, 26]。所以对于胎膜早破孕妇应该严格把握阴道检查指征,减少医源性感染,但需要利用阴道窥器检查确认胎膜破裂,排除脐带脱垂,评估宫颈,利用超声检查明确胎先露。缩宫素和米索前列醇均可用于单胎足月胎膜早破者的引产。
7.人工剥膜:从妊娠38周开始可多次行人工剥膜,以减少过期妊娠的发生。GBS不是人工剥膜的禁忌证(推荐强度:弱;证据级别:低)。
人工剥膜是一个促进分娩发动的方法,其机制是通过剥膜刺激内源性的前列腺素释放等,促进宫颈成熟和产程发动,但是由于频繁的操作有诱发感染的风险,故如何应用此法各国推荐并不一致。对于GBS阳性的孕妇能否行人工剥膜术的证据不足。2020年一项meta分析显示,定期行人工剥膜能促进自然发动产程,且不会增加母儿不良结局,但人工剥膜的最佳时间和频率尚不清楚[27]。因此,2023年SOGC指南对于人工剥膜的证据等级为低,推荐强度为弱推荐。我国2014年的指南[28]并未对此进行推荐,所以在临床实践中要审慎使用,需要积累更多的循证依据。
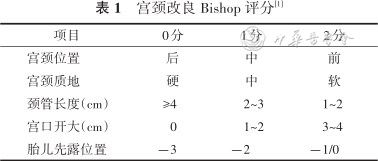
8.宫颈成熟度评估:目前国内外均以改良Bishop评分为标准,2023年SOGC指南将“宫颈管消退程度(%)”改为“宫颈长度(cm)”,更为客观(表1)[1],以改良Bishop评分≥7分提示宫颈成熟。目前我国公认改良Bishop评分≥6分提示宫颈成熟[28]。
指南第二部分是促宫颈成熟。宫颈改良Bishop评分<7分时,推荐促宫颈成熟,对于宫颈不成熟者不宜应用缩宫素静脉点滴或联合人工破膜术促宫颈成熟(推荐强度:强;证据级别:高)。促进宫颈成熟的方法包括球囊和前列腺素制剂。球囊促宫颈成熟的方法作为一线方法推荐。使用前列腺素E1(prostaglandin E1,PGE1)/PGE2阴道凝胶或栓剂促宫颈成熟,安全且有效。球囊与前列腺素制剂同时使用,球囊与缩宫素同时使用,均可用于促宫颈成熟(推荐强度:有条件时;证据级别:中)。如促宫颈成熟和/或引产失败,在最终决定剖宫产之前,应考虑尝试其他方法或联合使用促宫颈成熟或引产方法(推荐强度:强;证据级别:高)。对于有剖宫产史或既往子宫手术史的孕妇,晚孕期禁用前列腺素制剂(推荐强度:强;证据级别:中)。
该部分对于球囊及PGE1(米索前列醇)的知识点进行了更新,突出了球囊的有效性及安全性,强调了口服小剂量米索前列醇的安全性及有效性,提出米索前列醇溶液易于精准给药、方便安全且有效,指出球囊可以与前列腺素制剂或缩宫素同时使用,还提出了门诊促宫颈成熟的观点。
1.球囊促宫颈成熟:专门的促宫颈成熟的球囊和简易的Foley尿管制成的球囊均可用于促宫颈成熟。其原理是通过宫颈管置入宫颈内口与羊膜囊外的间隙,以物理挤压的原理,促使蜕膜、邻近胎膜和/或宫颈释放前列腺素和机械性地扩张宫颈内口,达到促宫颈成熟的目的。
球囊与地诺前列酮一样安全有效,且与地诺前列酮相比,球囊可以减少新生儿严重不良结局[29]。球囊适用于瘢痕子宫的促宫颈成熟,球囊引产的子宫破裂率与自然发动的子宫破裂率相当[30]。单球囊与双球囊效果近似[31]。球囊注水30~60 ml即可达效果,注水更多无明显优势,建议球囊放置24 h取出[32]。增加Foley导管的牵引力不会缩短分娩时间[33]。球囊不宜用于胎膜早破及下生殖道感染者[23],但可以用于胎膜完整的GBS携带者的促宫颈成熟,临产或破膜后立即使用抗生素预防。
2.药物促宫颈成熟:主要是前列腺素制剂,包括PGE1和PGE2。PGE1即米索前列醇,SOGC指南特别指出米索前列醇属于超适应证用药,但是米索前列醇在促宫颈成熟和引产领域进行了大量的高质量的研究,并已经在世界范围内产科领域应用15年以上,超过10万以上孕妇已使用。因此在加拿大应用米索前列醇是合法的。PGE2主要有2种制剂:一种是含有0.5 mg地诺前列酮的阴道凝胶,另一种是含有10 mg地诺前列酮的阴道栓剂,均被美国食品药品监督管理局批准用于足月促宫颈成熟。目前,国内使用的是含有10 mg地诺前列酮的阴道栓剂。其作用机制是通过改变宫颈细胞外基质成分、软化宫颈,诱发宫体平滑肌收缩,牵拉宫颈促进子宫平滑肌细胞间缝隙连接的形成,增加子宫平滑肌对内源性及外源性缩宫素的敏感性。
前列腺素制剂的有效性毋庸置疑,催引产剂量的前列腺素制剂引起孕妇发热的情况罕见,但可能导致部分孕妇宫缩过频,伴或不伴胎心率改变,故不宜用于有潜在胎儿宫内缺氧和足月瘢痕子宫的孕妇。
3.米索前列醇的用法:米索前列醇既能促进宫颈成熟,又能诱发宫缩,且都高效。其在室温下稳定,价格经济,并有多种给药途径,必要时可以重复多次给药。米索前列醇口服、舌下和阴道用药都会在单次剂量使用后使子宫张力增加,增加的静息张力在1~2 h后被节律性收缩所取代。口服1~2 h后,由于经肝脏代谢,血清水平下降,对子宫活动的影响消退;舌下服用对子宫的作用可持续3 h;阴道使用可持续4 h[34]。不同途径米索前列醇的药代动力学见表2。
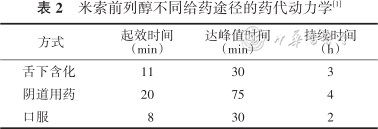
米索前列醇不同给药途径的药代动力学[1]
米索前列醇不同给药途径的药代动力学[1]
| 方式 | 起效时间(min) | 达峰值时间(min) | 持续时间 (h) |
|---|---|---|---|
| 舌下含化 | 11 | 30 | 3 |
| 阴道用药 | 20 | 75 | 4 |
| 口服 | 8 | 30 | 2 |
2021年英国国家卫生医疗质量标准署指南[11]指出,与安慰剂相比,Bishop评分≤6分时,前列腺素不同制剂、不同剂量、不同给药途径发生伴胎心率异常的宫缩过频风险由低到高分别为口服<50 μg米索前列醇、口服>50 μg米索前列醇、阴道用地诺前列酮凝胶、阴道用<50 μg米索前列醇、阴道用缓释地诺前列酮、阴道用>50 μg米索前列醇、颊/舌下米索前列醇。若出现宫缩过频,需移除药物,必要时使用宫缩抑制剂。但该指南提出米索前列醇引起的宫缩过频可能更难逆转,可能因为PGE2更易取出,且其导致的宫缩过频更容易被β2肾上腺素能受体兴奋剂逆转[35]。2021年一项关于低剂量(<50 μg)米索前列醇口服用于引产的meta分析[36]指出:低剂量米索前列醇口服与阴道用地诺前列酮相比,虽然阴道分娩时间延长,但剖宫产、宫缩过频伴胎心变化发生率较低。低剂量米索前列醇口服与Foley球囊相比,剖宫产率更低,宫缩过频发生率相当。低剂量米索前列醇口服与阴道用相比,宫缩过频以及因胎儿窘迫的剖宫产发生率均更低。现有的最佳证据表明,低剂量米索前列醇口服比其他引产方法有更多优点。所以SOGC指南认为低剂量口服米索前列醇安全且有效。
4.米索前列醇溶液的制备及使用:小剂量米索前列醇口服的困难在于难以精确给药。米索前列醇在水中可快速溶解,在溶液中可稳定24 h,口服的半衰期为2 h,所以米索前列醇溶液可准确定量给药,药代动力学和临床试验支持口服每2小时一次给药频率。
研究显示,米索前列醇溶液在足月孕妇引产方面与阴道地诺前列酮一样有效,且不良反应发生率较低,因此效果更安全[37]。口服米索前列醇溶液与舌下含服米索前列醇相比,阴道分娩率显著提高[38]。
SOGC指南提出米索前列醇溶液的制备方法:将100 μg米索前列醇溶于20 ml温水中,或将200 μg米索前列醇溶于40 ml温水中,配制成5 μg/ml的米索前列醇溶液,该溶液可以稳定使用24 h。淀粉载体可能不溶解,但不影响活性药物的浓度。
SOGC指南推荐米索前列醇溶液给药方案:从20 μg开始,每2小时重复一次,必要时加量,直至临产,单次剂量不应超过50 μg;如果24 h内(相当于12剂)没有临产,应更换引产方案。一旦临产或胎膜破裂,继续使用米索前列醇有效,无需改用缩宫素。
5.球囊可以与前列腺素制剂或缩宫素同时使用:2020年一项关于Foley球囊联合前列腺素与Foley球囊联合缩宫素在促进宫颈成熟的meta分析[39]提出,与单独使用Foley球囊相比,Foley球囊联合缩宫素能缩短最终阴道分娩时间;与联合缩宫素相比,Foley球囊联合前列腺素制剂更易导致子宫内膜炎;与联合米索前列醇或者联合缩宫素相比,Foley球囊联合地诺前列酮最终阴道分娩时间更长。所以SOGC指南认为必要时可以同时使用球囊和米索前列醇或者同时使用球囊和缩宫素促宫颈成熟(推荐强度:有条件时;证据级别:中)。目前临床上球囊与前列腺素制剂或者缩宫素序贯使用比较常见,同时使用的效果还有待于进一步研究。
6.门诊促宫颈成熟:SOGC指南对于门诊促宫颈成熟提出2条强推荐强度的建议:(1)条件允许时,应将球囊作为促宫颈成熟的一线方法,因为无论是在门诊还是剖宫产后阴道试产的孕妇,球囊都安全且有效(推荐强度:强;证据级别:高);(2)在胎儿电子监护正常的前提下,PGE2可用于门诊孕妇的促宫颈成熟(推荐强度:强;证据级别:中)。
由于国情不同、住院费用高昂等因素,有些宫颈不成熟的低风险孕妇有意愿接受门诊促宫颈成熟。由于PGE1促进宫颈成熟的缺点是难以把控给药频率及监测时间长,门诊管理困难,所以在门诊促进宫颈成熟的首选方法是使用球囊;若无球囊,建议使用PGE2栓剂。对于门诊促宫颈成熟患者,球囊与前列腺素同样有效,前列腺素的使用与宫缩过频、不良新生儿结局的风险增加有关,所以球囊用于门诊促进宫颈成熟安全、有效、可接受、性价比高,无论在资源丰富还是资源贫乏的国家都具有潜在的价值[40]。前列腺素促宫颈成熟导致孕妇的过敏反应罕见,通常在给药后迅速发生。其对胎儿的不良影响常继发于宫缩过频(通常用药后数个小时才开始),当出现规律宫缩时,应指导患者入院监测。
目前我国2014年指南未建议门诊使用促宫颈成熟处理[28],以后能否开展有待进一步研究。
宫颈改良Bishop评分≥7分时,首选引产方法是口服PGE1溶液或人工破膜术+静脉点滴缩宫素(推荐强度:强;证据级别:高):宫颈改良Bishop评分≥7分时,可行人工破膜术(推荐强度:强;证据级别:高)。人工破膜与宫缩诱导剂(缩宫素或PGE1)联合使用时引产效果最好(推荐强度:强;证据级别:高)。宫颈改良Bishop评分≥7分时,可以使用PGE2凝胶或栓剂引产(推荐强度:强;证据级别:中)。使用缩宫素或重复使用PGE1引产时,建议进行胎心监护(推荐强度:强;证据级别:高)。引产时应记录缩宫素的输注速度,单位为mU/min(推荐强度:强;证据级别:中)。无论输液速度如何,各医疗机构都需要具备缩宫素使用规范和安全检查清单(推荐强度:强;证据级别:中)。如果需要应用缩宫素,应至少在PGE2阴道栓剂取出30 min后,PGE2阴道凝胶使用后6 h,口服PGE1后2 h,以及阴道PGE1放置后4 h后(推荐强度:强;证据级别:高)。
关于宫颈成熟后的引产问题,除传统的人工破膜术联合缩宫素的方法,SOGC指南更新点在于将前列腺素制剂包括PGE1和PGE2凝胶或栓剂,作为宫缩诱导剂进行引产。研究显示,宫颈改良Bishop评分≥7分时,地诺前列酮和米索前列醇用于引产具有较好安全性和有效性,米索前列醇可能更优。2016年一项随机对照研究比较了口服米索前列醇溶液与地诺前列酮用于引产的效果。该研究纳入212例孕37周以上、单胎、头位、改良Bishop 评分高达8分、未临产、胎心正常的孕妇,结果显示,米索前列醇组最终分娩的时间间隔长(975 min 与670 min,P=0.01),但是24 h内的阴道分娩率更高(92.6%与79.8%,P=0.01),地诺前列酮组需要缩宫素的比例更高(38%与10.6%,P<0.01),2组孕产妇其他妊娠结局差异均无统计学意义[41]。在出现规律宫缩后要常规行胎儿电子监护,进入活跃期后应连续电子监护。
总之,2023年SOGC指南重点强调了引产的个体化,更强调了尊重患者选择的人文关怀。建议孕8~12周应用超声核对孕周,提出40岁及以上孕妇在39周引产的合理性;在促宫颈成熟方面,球囊和前列腺素制剂同样有效,球囊可用于瘢痕子宫要求阴道分娩者,球囊及PGE2栓剂可用于门诊促宫颈成熟;米索前列醇和PGE2制剂既可用于促宫颈成熟又可作为宫缩诱导剂来引产。小剂量米索前列醇口服安全有效,米索前列醇溶液更易于精准给药。促宫颈成熟和引产在母胎安全的前提下没有时间限制。SOGC指南推荐的促宫颈成熟和引产的流程见图1。前列腺素制剂是否可用于宫缩诱导剂引产在缺乏我国研究结果的前提下不建议应用。米索前列醇口服制剂促宫颈成熟也应开展更多研究。
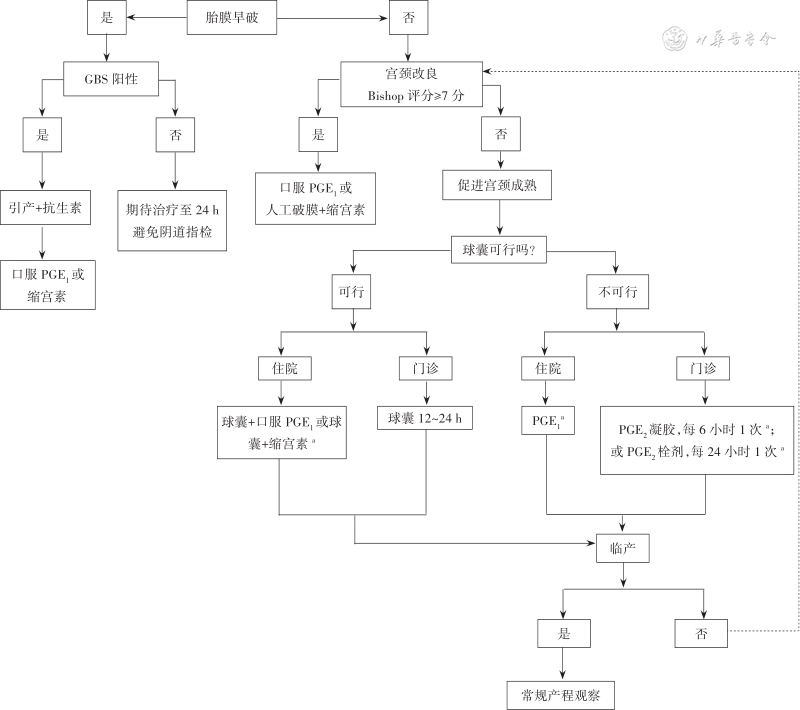

注:a当促进宫颈成熟过程漫长时,只要母胎一般情况稳定,可以中断;GBS:B族链球菌(group B Streptococcus);PGE:前列腺素E(prostaglandin E)
杨丽菊, 时春艳. 促宫颈成熟和引产:2023年加拿大妇产科医师协会指南解读[J]. 中华围产医学杂志, 2023, 26(10): 803-810. DOI: 10.3760/cma.j.cn113903-20230921-00220.
所有作者声明无利益冲突