
评估拉考沙胺添加治疗用于中国局灶性癫痫发作儿童的安全性、耐受性和有效性。
SP848是一项全球多中心单臂研究,收集2018年4月至2019年5月在全国7所医院接受拉考沙胺添加治疗的4~17岁中国局灶性癫痫发作患儿60例,在足疗程且至少使用2种抗癫痫发作药(同期或序贯)治疗后,观察到患儿局灶性癫痫仍然控制不佳;添加口服拉考沙胺口服溶液(糖浆)或片剂。最低起始口服剂量为2 mg/(kg·d),研究期间最大允许服用剂量为12 mg/(kg·d)或600 mg/d,研究者根据患儿的耐受性和癫痫发作控制水平调整服用剂量。记录自基线期至末次访视每28 d局灶性癫痫的发作频率及中位变化百分比,包括50%应答率及75%应答率。
60例中国患儿进入期中分析,患儿平均年龄9.18(4.00~15.40)岁,男39例,女21例,平均癫痫病程为5.04(0.50~15.20)年。其中43例(71.7%)仍在接受治疗,1例(1.7%)完成了6个月至1年的随访,14例(23.3%)完成了6个月随访。自基线期至末次访视,患儿每28 d局灶性癫痫发作频率中位变化为-2.91,百分比变化中位数为-25.46%,50%和75%应答率分别为40.0%、28.3%。共有52例(86.7%)发生265起治疗中出现的不良事件(TEAE),其中11例(18.3%)发生19起严重TEAE,37例(61.7%)发生127起药物相关TEAE,11例(18.3%)发生16起导致终止研究的TEAE。最常见的TEAE为上呼吸道感染(20例,33.3%)、嗜睡(16例,26.7%)、头晕(15例,25.0%)和呕吐(13例,21.7%)。治疗期间未发现具有临床意义的心电图异常变化。
对其他药物控制不佳的≥4岁中国局灶性癫痫患儿,拉考沙胺是一种有效的添加治疗药物,耐受性良好。安全性特征与儿童和成人已报道的研究一致,未发现新的安全性问题。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
癫痫是一种常见的慢性神经系统疾病,主要通过抗癫痫发作药(ASMs)进行治疗[1]。但目前仍有25%~30%的癫痫儿童使用ASMs控制不佳[2],因此,迫切需要新的ASMs选择。
拉考沙胺(LCM)是第三代新型ASMs,可通过选择性增强电压门控钠通道的慢失活而发挥其抗癫痫发作的活性[3],具有吸收速度快、口服生物利用度高的优点[4]。此外,药代动力学研究显示,LCM与临床相关药物间相互作用的可能性低[4]。
多项随机对照试验已证明LCM单药治疗和添加治疗在成人和儿童局灶性发作患者中具有良好的疗效、安全性和耐受性[5,6,7],并得到了真实世界数据的进一步支持[8,9,10,11,12]。两项meta分析的结果也显示LCM单药和添加治疗在成人和儿童癫痫患者中是有效的,且耐受性良好[13,14]。基于以上循证证据,LCM在美国已获批适用于1个月及以上癫痫患者局灶性发作的治疗;在欧洲已获批适用于4岁及以上癫痫患者伴或不伴继发性全面性发作的局灶性发作的单药和添加治疗。在中国,LCM于2018年获得国家药品监督管理局批准用于4岁及以上癫痫患者局灶性发作的添加治疗,并于2021年获批了相同人群的单药治疗适应证。然而,目前LCM添加治疗多为单中心研究,还缺乏LCM添加治疗在中国多中心患儿中的疗效和安全性证据。
SP848(NCT00938912)为一项尚在进行中的全球多中心单臂临床试验,探究在≥4岁且局灶性癫痫发作未得到控制的儿童中LCM作为添加治疗的安全性、耐受性和有效性。该研究包括中国、法国和美国等9个国家共48家研究中心,共197例全球患儿纳入研究;其中,中国有7个研究中心,60例患儿(截至2019年5月15日),均为直接招募入组患者。本研究对SP848的中国人群进行期中分析,旨在提供LCM添加治疗在中国儿童局灶性癫痫发作中的安全性和有效性数据,为其在中国儿童局灶性癫痫患者中的应用提供临床依据。
SP848(临床试验注册号:NCT00938912)是一项全球多中心单臂研究,旨在评估使用LCM口服溶液(糖浆)或片剂作为添加药物治疗局灶性癫痫儿童的安全性、耐受性和有效性。该研究未对患儿进行分组。现对该研究中的中国人群进行期中分析,涵盖研究时间2018年4月9日至2019年5月15日。
中国患者的招募地点包括北京大学第一医院、重庆医科大学附属儿童医院、复旦大学附属儿科医院、吉林大学第一医院、深圳市儿童医院、浙江大学医学院附属儿童医院以及江西省儿童医院。
本研究的研究方案、患者知情同意书已通过招募地点的医学伦理委员会批准[批准文号:复儿伦审(2017)119号;PJ2017016;深儿医伦审(药物)201701103号;2017-独立伦理委员会(IEC)-009;(2017)年伦审(药)第(7)号;(2017年)临审第(170420-037)号;(2017)药物注册第(41)号],并在开始前获取患儿和/或患儿父母/法定监护人的知情同意书,符合当地法规、国际协调会(ICH)-药物临床试验质量管理规范(GCP)要求以及赫尔辛基宣言的伦理原则。
(1)获得父母/法定监护人提供的已签署知情同意书(ICF)以及患儿提供的同意文件(可能情况下,或根据当地机构审查委员会[IRB]/IEC的要求);(2)患儿以照料者(可能为父母、法定监护人或其他委托照料者)愿意且能够依从所有研究要求,包括持续填写癫痫发作日记;(3)患儿被诊断为伴局灶性发作的癫痫病。至少1次既往脑电图(EEG)以及1次磁共振成像/计算机断层扫描结果应与上述诊断结果一致;(4)患儿年龄4~17岁;(5)在足疗程且至少使用2种ASMs(同期或序贯)治疗后,观察到患儿局灶性癫痫仍然控制不佳;(6)在筛选前的4周期间,观察到患儿至少出现2次可计数的癫痫发作;(7)患儿正在接受1~3种ASMs治疗,且筛选前1周该治疗方案不变[迷走神经刺激不计为医学疗法;但是,在筛选前至少1周,迷走神经刺激术(VNS)背景治疗必须保持稳定];(8)患儿可行静脉穿刺。
(1)研究者认为存在可能危害患儿或影响患儿参与本研究能力的任何医学或精神状况;(2)患儿已知对试验用药品的任何成分存在超敏反应;(3)患儿的肌酐清除率低于30 mL/min;(4)患儿存在具有临床意义的心电图异常(例如,静息时二度或三度心脏传导阻滞或QT间期延长大于450 ms),或患有具有血流动力学意义的心脏疾病(例如心力衰竭),或存在需要医学治疗的心律失常性心脏疾病;(5)患儿存在重度速发型过敏反应或严重恶病质病史;(6)患儿发生非癫痫事件,包括可能与癫痫发作产生混淆的心因性发作。如果癫痫事件和非癫痫事件均出现,则应该区分癫痫事件与非癫痫现象;(7)患儿具有原发性全身性癫痫发作病史;(8)患儿正在使用单胺氧化酶抑制剂-A(MAOI-A)或麻醉镇痛药;(9)患儿的癫痫发作继发于进行性脑部疾病或任何其他进行性神经退行性疾病(例如Rasmussen综合征);(10)患儿存在钠离子通道相关心脏疾病,例如Brugada综合征。
研究者及患儿/照料者(包括父母/法定监护人)共同选择接受LCM口服溶液(糖浆)给药或片剂给药。每日口服给药2次,等分给药(约间隔12 h,早晚各1次)。通过取药器量取口服溶液(糖浆)的给药剂量,并进行口服给药。
剂量选择、剂量调整方案以及减量速率均基于成人研究,对应调整至相应mg/kg水平的1.4倍[即70 kg成人LCM剂量为600 mg/d,对应儿童LCM为(600 mg/70 kg)×1.4=12 mg/(kg·d)]。本研究中的剂量选择,基于前期探索剂量的Ⅱ期临床研究中获得的最大推荐剂量[15]。研究者可调整LCM剂量,最低水平为2 mg/(kg·d)(糖浆)或100 mg/d(片剂);最高水平为12 mg/(kg·d)(糖浆或片剂),但基于体重计算后不应超过600 mg/d,即使研究参加者体重超过50 kg也不应超过上述剂量。SP848中最大允许LCM剂量为12 mg/(kg·d)或600 mg/d,选择较低剂量。
疗效判断和安全性监测的周期为从LCM第1次给药之日开始的第4、8、12、20、28、36、44、52、60、72、84、96周。
筛选访视时,通过询问患儿或照料者(父母/法定监护人)获得患儿在既往4周内的癫痫发作次数,并将此数据作为历史基线值。患儿入组后,由患儿或照料者(父母/法定监护人)记录癫痫发作日记,作为治疗期间的癫痫发作数据,包括发作计数、发作类型和发作频率。每28 d的癫痫发作频率(SF)基于提供癫痫信息的天数(D):SF=癫痫发作次数×(28/D)。治疗期从LCM第1次给药之日开始。
有效性指标为自基线期至末次访视每28 d局灶性癫痫的发作频率及中位变化百分比,50%应答率(治疗期每28 d局灶性癫痫发作频率相对基线期下降至少50%)及75%应答率(治疗期每28 d局灶性癫痫发作频率相对基线期下降至少75%)。
(1)患儿和/或照料者自发报告的或研究者观察到的不良事件(AE);(2)因AE而退出研究;(3)血液学、血液生化、内分泌和尿液分析结果;(4)12导联心电图;(5)生命体征测量(血压和脉率);(6)体格检查和神经系统检查(精神状态、感觉系统、运动系统、颅神经、反射及小脑功能)结果;(7)体重、身高和计算的体重指数(BMI)。本研究按国际医学用语词典(MedDRA)系统器官分类(SOC)和首选术语(PT)对AE进行分类。
安全性分析集(SS)包括在本研究中接受了至少1剂LCM给药的入组患儿。安全性分析均基于SS进行。全分析集(FAS)用于有效性指标分析,包括SS中有至少1份已完成基线后癫痫发作日记的所有患儿。
采用SAS 9.1软件对安全性和有效性数据进行描述性分析。计量资料以 ±s、中位数(范围)表示;均数、标准差和中位数的报告比原始数据多保留1位小数位,最小值和最大值的报告与原始数据保留相同的小数位。计数资料以频率和百分比表示,除另有说明外,所有百分比均保留1位小数。
±s、中位数(范围)表示;均数、标准差和中位数的报告比原始数据多保留1位小数位,最小值和最大值的报告与原始数据保留相同的小数位。计数资料以频率和百分比表示,除另有说明外,所有百分比均保留1位小数。
共筛选65例,61例符合入排标准筛选成功,60例接受了至少1剂LCM且至少收集到1次随访信息而纳入分析集,SS和FAS均为60例。截至临床数据截止日期,43例患儿(71.7%)仍在继续参与研究,1例(1.7%)已完成1年随访,14例(23.3%)已完成6个月随访,其余随访还未满6个月。17例患儿(28.3%)提前终止研究。提前终止常见原因为AE(11例,18.3%),疗效缺乏(3例,5.0%),撤回知情同意(2例,3.3%)和其他(1例,1.6%)。
患儿中男39例(65.0%),女21例(35.0%)。患儿平均年龄为9.18(4.00~15.40)岁,平均身高、体重、BMI分别为134.99 cm、35.90 kg、18.50 kg/m2。患儿的平均癫痫发作持续时间为5.04(0.50~15.20)年,疾病诊断时的总体平均年龄为4.15(0~12.50)岁。有3例患儿接受过VNS治疗。32例患儿伴有意识存在的局灶性癫痫发作(53.3%),其次是伴意识障碍的局灶性癫痫发作(29例,48.3%)。既往史及抗癫痫发作用药情况详见表1。

局灶性癫痫患儿基线人口学和癫痫特征
Baseline demographics and epilepsy characteristics of children with partial-onset seizures
局灶性癫痫患儿基线人口学和癫痫特征
Baseline demographics and epilepsy characteristics of children with partial-onset seizures
| 人口学和癫痫基线特征 | 患儿数据(60例) |
|---|---|
| 年龄(岁) | |
 ±s ±s | 9.18±3.31 |
| 中位数(范围) | 8.93(4.00~15.40) |
| 性别[例(%)] | |
| 男 | 39(65.0) |
| 女 | 21(35.0) |
| 体重(kg) | |
 ±s ±s | 35.90±18.21 |
| 中位数(范围) | 31.75(15.80~109.00) |
| 身高(cm) | |
 ±s ±s | 134.99±20.54 |
| 中位数(范围) | 135.5(103.0~175.0) |
| BMI(kg/m2) | |
 ±s ±s | 18.50±4.47 |
| 中位数(范围) | 17.4(12.4~35.6) |
| 确诊时年龄(岁) | |
 ±s ±s | 4.15±3.79 |
| 中位数(范围) | 2.88(0~12.50) |
| 癫痫病程(年) | |
 ±s ±s | 5.04±3.89 |
| 中位数(范围) | 3.79(0.50~15.20) |
| VNS使用情况[例(%)] | |
| 使用 | 3(5.0) |
| 未使用 | 57(95.0) |
| 癫痫发作分类[例(%)] | |
| 任何局灶性癫痫发作(I) | 60(100.0) |
| 伴意识存在的局灶性癫痫发作(IA) | 32(53.3) |
| 伴意识障碍的局灶性癫痫发作(IB) | 29(48.3) |
| 局灶性、继发性全面性发作(IC) | 19(31.7) |
| 伴随疾病[例(%)] | 30(50.0) |
| 各种先天性、家族性、遗传性疾病 | 10(16.7) |
| 脑性瘫痪 | 3(5.0) |
| 胃肠系统疾病 | 2(3.3) |
| 便秘 | 1(1.7) |
| 各类神经系统疾病 | 18(30.0) |
| 智力发育迟缓 | 11(18.3) |
| 精神病类 | 5(8.3) |
| 联合使用的ASMs数量[例(%)] | |
| 1 | 3(5.0) |
| 2 | 20(33.3) |
| 3 | 36(60.0) |
| 4 | 1(1.7) |
| 联合使用的ASMs[例(%)] | |
| 左乙拉西坦 | 24(40.0) |
| 丙戊酸 | 33(55.0) |
| 奥卡西平 | 36(60.0) |
| 托吡酯 | 18(30.0) |
| 拉莫三嗪 | 9(15.0) |
| 卡马西平 | 7(11.7) |
注:BMI:体重指数;VNS:迷走神经刺激术;ASMs:抗癫痫发作药 BMI:body mass index;VNS:vagus nerve stimulation;ASMs:anti-seizure medications
在接受LCM添加治疗后,患儿局灶性癫痫发作频率的绝对值均有所下降[基线:15.97(1.10~338.70),末次随访:10.10(0~330.50)],自基线期至末次访视的每28 d局灶性癫痫发作频率中位变化为-2.91,百分比变化中位数为-25.46%。>3~6个月、>6~12个月的每28 d发作频率减少百分数中位数为43.37%、79.40%。总体患儿中,自基线至末次随访的50%应答率为40.0%,75%应答率为28.3%(表2)。
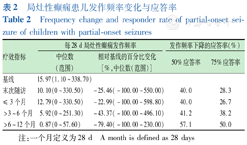
局灶性癫痫患儿发作频率变化与应答率
Frequency change and responder rate of partial-onset seizure of children with partial-onset seizures
局灶性癫痫患儿发作频率变化与应答率
Frequency change and responder rate of partial-onset seizure of children with partial-onset seizures
| 疗效指标 | 每28 d局灶性癫痫发作频率 | 发作频率下降的应答率(%) | ||
|---|---|---|---|---|
| 中位数(范围) | 相对基线的百分比变化[%,中位数(范围)] | 50%应答率 | 75%应答率 | |
| 基线 | 15.97(1.10~338.70) | |||
| 末次随访 | 10.10(0~330.50) | -25.46(-100.00~550.00) | 40.0 | 28.3 |
| ≤ 3个月 | 12.79(0~330.50) | -22.99(-100.00~598.80) | 40.0 | 26.7 |
| >3~6个月 | 5.92(0~251.30) | -43.37(-100.00~496.10) | 41.2 | 38.2 |
| >6~12个月 | 0.87(0~57.60) | -79.40(-100.00~230.00) | 57.1 | 50.0 |
注:一个月定义为28 d A month is defined as 28 days
截至临床数据截止日期,60例患儿(100%)暴露于至少1剂LCM,总暴露量为19.7人·年,总平均暴露持续时间为119.8 d。其中,14例患儿(23.3%)的LCM暴露时间为至少6个月,总暴露量为8.5人·年;1例患儿(1.7%)的LCM暴露时间为至少12个月,总暴露量为0.9人·年。总体患儿的平均最大日剂量为(7.9±2.6) mg/(kg·d),平均众数日剂量为(6.7±2.8) mg/(kg·d)。
共有52例患儿(86.7%)在LCM治疗后发生265起治疗中出现的AE(TEAE)(表3),其中轻度29例(48.3%),中度15例(25.0%),重度8例(13.3%)。发生率较高的TEAE按SOC标准包括各类神经系统疾病(37例,61.7%)、感染及侵染类疾病(29例,48.3%)以及胃肠系统疾病(26例,43.3%)。而依据PT分类标准,发生率较高的TEAE包括上呼吸道感染(20例,33.3%)、嗜睡(16例,26.7%)、头晕(15例,25.0%)和呕吐(13例,21.7%)。

局灶性癫痫患儿拉考沙胺治疗期间TEAE发生率
Incidence of TEAE during treatment period of children with partial-onset seizures treated with Lacosamide
局灶性癫痫患儿拉考沙胺治疗期间TEAE发生率
Incidence of TEAE during treatment period of children with partial-onset seizures treated with Lacosamide
| 事件 | 患儿数据[60例,例(%)] |
|---|---|
| 任何TEAE | 52(86.7) |
| 严重TEAE | 11(18.3) |
| 因TEAE终止研究 | 11(18.3) |
| 药物相关TEAE | 37(61.7) |
| 药物相关的严重TEAE | 4(6.7) |
| 重度TEAE | 8(13.3) |
| 最常见的TEAE(见于≥5%的患儿中) | |
| 上呼吸道感染 | 20(33.3) |
| 嗜睡 | 16(26.7) |
| 头晕 | 15(25.0) |
| 呕吐 | 13(21.7) |
| 支气管炎 | 6(10.0) |
| 食欲下降 | 5(8.3) |
| 发热 | 4(6.7) |
| 腹泻 | 4(6.7) |
| 咳嗽 | 4(6.7) |
| 复视 | 3(5.0) |
| 头痛 | 3(5.0) |
| 最常见导致停药的TEAE(见于≥2例患儿) | |
| 嗜睡 | 3(5.0) |
| 最常见药物相关TEAE | |
| 嗜睡 | 15(25.0) |
| 头晕 | 15(25.0) |
| 呕吐 | 8(13.3) |
| 一度房室传导阻滞 | 2(3.5) |
| 复视 | 2(3.5) |
| 跌倒 | 2(3.5) |
| 食欲下降 | 2(3.5) |
| 头痛 | 2(3.5) |
注:TEAE:治疗期间发生的不良事件 TEAE:treatment emergent adverse event
有37例(61.7%)中国患儿发生127起研究者认为与药物相关的TEAE。最常见的药物相关TEAE为嗜睡(15例,25.0%)、头晕(15例,25.0%)和呕吐(8例,13.3%)。
严重TEAE在11例(18.3%)患儿中发生19起,最常见的为感染及侵染疾病(6例,10.0%),其中包括扁桃体炎和支气管炎各2例(3.3%)。无任何死亡事件发生。
有11例(18.3%)患儿发生16起导致终止治疗的TEAE,其中嗜睡3例(5.0%)。另外,基于LCM临床研究安全性数据和一般安全性考虑而特别关注的其他TEAE被称为"其他重要TEAE",主要包括肝脏毒性相关、心脏和心电图相关、自杀倾向相关、晕厥和意识丧失。研究期间有1例患儿发生了自杀意念事件,未观察到其他重要TEAE。
治疗期间,体重、身高和BMI从基线至末次访视时的平均变化分别为0.65 kg、1.23 cm和0.01 kg/m2,均未出现具有临床意义的异常变化。收缩压、体温和脉率的明显异常发生率较低(≤6.7%),舒张压(≤21.7%)和体重(≤16.7%)的异常发生率略高,只有1例患儿(1.7%)报告了与生命体征异常值相关的TEAE。
基线期神经系统检查结果为正常值,到末次访视时神经系统临床显著异常AE发生率低于5.0%。
血液学指标出现显著异常的发生率整体较低(≤1.7%),各有1例发生粒细胞减少症和红细胞计数升高,均为轻度,且研究者认为与研究药物无关。临床生化或内分泌数值的显著异常发生率较低(≤8.6%),包括13例患者的20起事件;其平均值或中位数也未发生具有临床意义的治疗相关变化。
研究期间,患儿12导联心电图显示从基线期至末次访视的平均变化,QT持续时间(-3.14~4.18 ms)、QTcF持续时间(-4.45~2.07 ms)、QTcB持续时间(-5.82~2.65 ms)、PR持续时间(2.25~12.21 ms)、QRS持续时间(1.04~2.82 ms)和心率(-4.11~1.06次/min)均较小,没有临床意义上的异常。访视时进行12导联心电图测量且无遗漏的56例患儿中心电图异常发生率较低:4例患儿发生PR间期持续时间异常(7.1%)、1例患儿发生QRS持续时间异常(1.8%)、2例患儿发生心率异常(3.6%)。其中,5例患儿存在心电图异常(4例一度房室传导阻滞,1例心室内传导阻滞),均被研究者认为可能与研究药物相关。其中,1例患儿因癫痫不良反应而终止研究,其余4例患儿未因心电图异常而调整LCM剂量或采取其他医疗措施,仍在参与研究并维持治疗。
本文对一项全球前瞻性多中心单臂研究中的中国患儿数据进行期中分析,以评估LCM添加治疗局灶性癫痫儿童的安全性和有效性。结果提示在≥4岁中国患儿中,LCM作为添加治疗药物有效、安全,耐受性良好。
在接受LCM治疗后,受试患儿的SF有所降低,>3~6个月、>6~12个月、末次随访的每28 d发作频率减少百分比的中位数分别为43.37%、79.40%、25.46%;至末次随访时,总体50%及75%应答者比例分别为40.0%与28.3%。在同一试验的非中国患儿中,分析结果显示>3~6个月、>6~12个月、末次随访的每28 d发作频率减少百分数中位数分别为57.5%、64.02%、53.97%,至末次随访时50%与75%应答率分别为52.2%、35.3%。中国患儿与非中国患儿基线时每28 d的局灶性癫痫发作频率中位数接近(15.97比17.68),因此这个差异可能与非中国患儿的LCM暴露剂量较高有关[平均最大日剂量:(9.6±2.7) mg/(kg·d)比(7.9±2.6) mg/(kg·d);平均众数日剂量:(8.3±2.8) mg/(kg·d)比(6.7±2.8) mg/(kg·d)]。SP0969研究是一项在全球114个中心进行的随机、双盲、安慰剂对照试验,结果显示LCM组患儿每28 d局灶性癫痫发作频率从基线期到维持期的中位数降低百分比为51.7%;维持期间50%和75%应答者比例分别为52.9%、31.2%[7]。一项伊朗的单中心前瞻性研究表明难治性局灶性癫痫患儿接受LCM的添加治疗后,癫痫发作频率减少了53.22%,癫痫发作持续时间减少了43.72%[16] 。此外,一项在中国新疆难治性癫痫患儿中的真实世界研究显示LCM添加治疗在3个月、6个月、12个月时,50%应答者比例分别为47.6%、39.2%和31.9%[11]。以上研究结果均提示LCM添加治疗可有效降低癫痫发作频率。未来本研究更长随访时间的结果可减少潜在偏倚,进一步阐明LCM添加治疗在中国患儿中的长期有效性。
在安全性方面,本研究中国患儿TEAE的总发生率低于同试验非中国患儿的TEAE发生率(86.7%比98.5%)。同时,严重TEAE发生率也低于非中国患儿的发生率(18.3%比26.3%),这可能与暴露量差异有关。中国患儿入组时间晚于非中国患儿(平均暴露时间706.2 d),因此LCM暴露时间较短,暴露量较低。研究中观察到的最常见TEAE与非中国患儿中的基本一致(头痛、头晕、嗜睡、发热和呕吐)。同时,与LCM添加治疗在国内外儿童中观察到的不良反应特征也相似[7,15,16]。SP0969研究中67.8%的LCM治疗患儿报告了TEAE,4.7%为严重TEAE。观察到最常见的TEAE(≥10%)为嗜睡(14%,安慰剂5.2%)和头晕(10.5%,安慰剂3.5%)[7]。SP0847研究中则有89.4%的LCM治疗患儿报告了TEAE,12.8%为严重TEAE。研究中最常见的TEAE(≥10%)为呕吐(21.3%)、腹泻(14.9%)、嗜睡(12.8%),以及易怒、头晕和发热(各10.6%)[15]。多项真实世界研究结果均表明,LCM治疗局灶性癫痫患儿具有良好的安全性和耐受性,常见神经系统和胃肠道系统相关不良反应,未发现其他安全性信号[12,17,18,19]。
本研究中最常见药物相关TEAE为嗜睡、头晕及呕吐,与非中国患儿的最常见药物相关TEAE(≥10%)一致(头晕和嗜睡)。另外,与其他LCM添加治疗研究中最常见药物相关TEAE也基本保持一致(头晕、嗜睡、呕吐及疲劳)[15,18,20,21]。前期研究显示LCM与PR间期的延长呈剂量相关,但未导致任何症状,也没有导致QTc延长或影响心率的证据。值得注意的是,在有心脏传导问题、严重心脏疾病(有心肌梗死或心力衰竭病史)的患者中,前期研究显示,静脉注射LCM可引起PR间期轻度延长(是否与剂量有关尚需确认),但并未导致QRS波群变化或QTc延长,心率也未受到影响[22,23],故应谨慎使用LCM。本研究中的心电图随访结果显示随访期间心电图重要指标相对基线变化均不具有临床意义。有5例患儿报告心电图异常TEAE,研究者判断与药物相关,但均未导致剂量调整或退出研究。部分观察到的变化可能是患儿生长发育导致的正常生理学变化。在随访期均未发现LCM引起QT、QTcB或QTcF延长的证据。同时,有研究表明包含芳香环结构的传统钠离子通道阻滞剂会引起较高比例的皮肤过敏反应,甚至会导致包括Stevens-Johnson综合征、药疹伴嗜酸性粒细胞增多和系统症状以及中毒性表皮坏死松解症在内的严重皮肤不良反应[24,25,26,27]。一项综述了5项随机对照试验的分析结果表明,与安慰剂相比,皮疹是无显著意义的AE[风险比(RR)=0.58,99%CI=0.17~1.89][28]。前期中国和日本成人癫痫患者长期观察性研究的结果显示皮疹不良反应发生率较低(12例,2.5%),均为轻度或中度,其中2例研究者判断与LCM相关[20]。此外,多项LCM真实世界研究中未报道皮疹的发生[16,18,29]。在本研究中,也未观察到皮肤组织药物相关不良反应,提示LCM分子结构及作用机制不同于传统钠离子通道阻滞剂,在中国人群中皮肤过敏反应发生率低,安全性良好。
本研究也有一定的局限性。首先,目前只是期中分析,尚待研究结束来获得最终完整的结果。其次,本研究是一个前瞻性的全球多中心单臂研究,癫痫发作以自身作为对照,未设置其他对照组。同时,本研究入组的样本量较小,研究结果可能会造成一些偏倚。不过,本研究结果与同期国外儿童、既往国外研究、甚至成人患者的研究结果基本一致,也支持了本研究结果的可靠性。
此次期中分析的结果显示,LCM在≥4岁中国儿童中的安全性与既往国外儿童研究及成人中的已知安全性特征基本保持一致,未发现新的安全性问题。同时,结果证实了在≥4岁中国儿童中应用LCM能够有效降低局灶性癫痫发作的发作频率。本项研究仍在进行中,长期随访结果将进一步验证对局灶性癫痫发作未得到控制的中国患儿使用LCM作为添加药物进行治疗的疗效与安全性。
美国临床试验注册中心,NCT00938912
U.S.Clinical Trials Registry,NCT00938912
所有作者均声明不存在利益冲突
感谢所有参加SP848的中国患儿及其家人;感谢参与入组和随访的研究者周渊峰、倪燕、胡越、袁萍、李双子、夏庆、李秀娟、夏哲智、袁哲锋、姜丽华、徐璐所做的贡献;感谢胡春辉医师参与文章的审阅与修改;感谢SP848研究团队,尤其是优时比制药global团队成员Floricel Florin、Cleveland Jody和McClung Carrie



























