
评估沙利度胺单药维持治疗肠白塞病的疗效、预测因素及安全性。
回顾性纳入2013年1月至2022年3月于中山大学附属第六医院接受沙利度胺单药维持治疗且规律随访的肠白塞病患者,进行疗效、预测因素及安全性分析。主要观察终点为肠白塞病患者治疗第6个月、12个月的无激素维持缓解率;次要终点为治疗后6个月、12个月的黏膜愈合率、沙利度胺长期无激素维持缓解率、沙利度胺疗效的预测因素及安全性。
共纳入28例患者,沙利度胺治疗第6个月、12个月、第24个月、第36个月无激素维持缓解率分别为85.7%、74.0%、63.5%和50.4%;无激素维持缓解的中位时长为49.5(35.4,63.6)个月。治疗第6个月和12个月的黏膜愈合率为40.0%和35.0%。多因素COX回归分析发现,基线肠白塞病疾病活动指数水平较高(P = 0.014,HR = 1.057,95%CI 1.011 ~ 1.104)是沙利度胺未能维持无激素缓解的独立危险因素。随访期间,14例患者出现不良反应,总体不良反应发生率为50.0%,其中肢体麻木发生率为28.6%,发生中位时长为9.5(5.5,22.5)个月。不良反应导致药物减量率为14.3%,停药率为17.9%,停药中位时长为10.5(23.5,40.3)个月。
沙利度胺能有效长期维持肠白塞病无激素缓解,但不良反应如肢体麻木的发生率较高值得关注。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
白塞病(Behcet′s disease)是一种慢性、全身性的免疫系统疾病,是多系统血管炎的一种,其特征是复发性口腔和生殖器溃疡、眼部疾病和皮肤损伤[1]。白塞病累及胃肠道通常称为肠白塞病,目前诊断大多参考韩国标准,主要表现为消化道症状及内镜下典型的回盲部深大溃疡,容易引起肠穿孔、消化道大出血等严重并发症,给患者造成巨大负担[2,3]。白塞病好发于"丝绸之路"地区,据报道,中国白塞病患病率为14/100 000人·年,且约有16.8%累及胃肠道[1,4]。作为一种罕见病,目前国内外关于肠白塞病的临床研究及疾病管理经验较少,其治疗较为棘手。治疗肠白塞病疗效较好的药物包括氨基水杨酸、糖皮质激素、免疫抑制剂及生物制剂等,但相关临床证据及用药经验较少[5]。
沙利度胺是一种具有抗血管生成及免疫调节功能的药物,其作用机制可能包括抑制肿瘤坏死因子(tumor necrosis factor,TNF)-α和白细胞介素12等炎性因子产生、抑制核转录因子κB的激活及促炎细胞的黏附等,其被广泛应用于自身免疫性疾病及恶性肿瘤等疾病的治疗[6,7]。目前沙利度胺治疗肠白塞病的实际临床研究较少,多以病例报告为主,缺乏大型临床数据及长期疗效观察[8,9,10]。本研究旨在回顾性分析沙利度胺治疗肠白塞病的长期疗效及预测因素,评估沙利度胺的有效性及安全性,为临床决策提供帮助。
回顾性纳入2013年1月至2022年3月在中山大学附属第六医院接受沙利度胺治疗且资料齐全的肠白塞病患者。纳入标准:(1)年龄大于等于18岁;(2)在研究中心随访至少满6个月;(3)根据2009年韩国肠白塞病诊断标准为参考诊断肠白塞病[2];(4)缓解期用沙利度胺单药维持。排除标准:(1)临床资料不完整;(2)维持期合并其他用药;(3)已被诊断患有其他严重脏器疾病的患者。本研究通过中山大学附属第六医院伦理委员会批准(批准号:2020ZSLYEC-317),研究内容均取得患者知情同意。
收集患者的性别、年龄、体质指数(body mass index,BMI)、病程、吸烟史、阑尾切除史、临床症状、内镜表现、初始内镜溃疡大小、疾病活动情况、既往用药史、实验室指标,包括红细胞沉降率、C-反应蛋白、血小板、白蛋白、血红蛋白,以及药物使用情况和药物不良反应。
基线处于活动期的患者在诱导期3个月内使用沙利度胺(反映亭,25 mg/片)联合糖皮质激素(醋酸泼尼松龙片,5 mg/片)治疗,沙利度胺起始用量为100 mg/d,糖皮质激素起始用量为0.75 ~ 1 mg·kg-1·d-1。诱导期患者症状明显改善后,激素以5 mg/周减量至停药;维持期予沙利度胺100 mg/d治疗,治疗期间若出现药物不良反应,经临床医生判断后可予减少剂量或停药处理。所有患者均长期门诊随访,在治疗后第3个月、6个月、12个月返院行血常规、肝肾功能、炎症指标及内镜检查。
临床疾病活动评价采用肠白塞病疾病活动指数(disease activity index for intestinal Behcet′s disease,DAIBD)对疾病活动度进行评分[11]。将DAIBD<20分定义为临床缓解期,20 ~ 39分定义为轻度活动期,40 ~ 74分定义为中度活动期,≥75分定义为重度活动期。临床缓解定义为治疗后DAIBD评分<20分;无激素缓解定义为治疗后患者DAIBD评分<20分且无使用糖皮质激素维持治疗;无激素维持缓解定义为诱导期后患者处于临床缓解期(DAIBD<20分),未使用糖皮质激素维持治疗且持续处于临床缓解状态。内镜下黏膜愈合定义为内镜下未发现溃疡[12]。"深大溃疡"定义为溃疡长径>2 cm或内镜报告描述为"深大溃疡"。
治疗期间出现任何不良反应均予记录,包括急性或迟发性过敏反应、急性或慢性感染、血液系统不良反应、神经系统不良反应和肿瘤等,患者每次返院随访均会询问有无不良反应并进行血液检查,若患者出现肢体麻木等症状时,将建议患者行神经电生理检测。
(1)主要终点为活动期肠白塞病患者治疗第6个月和第12个月的无激素维持缓解率;(2)次要终点为治疗后第6个月和第12个月的黏膜愈合率、第24个月和第36个月无激素维持缓解率;(3)沙利度胺疗效的预测因素;(4)沙利度胺用药过程中的不良事件及发生率。
应用SPSS 25.0软件进行统计分析。符合正态分布计量资料用 ±s表示,进行t检验;符合非正态分布计量资料用M(Q1,Q3)表示,进行Mann-Whitney U检验;率的比较采用χ2检验或Fisher′s确切概率法。计数资料用例数(百分比)表示,进行卡方检验。用Kaplan-Meier生存分析曲线描述沙利度胺长期无激素维持缓解率。采用单因素及多因素COX回归分析影响沙利度胺长期疗效的因素,纳入标准0.05,排除标准0.10。P<0.05为差异有统计学意义。
±s表示,进行t检验;符合非正态分布计量资料用M(Q1,Q3)表示,进行Mann-Whitney U检验;率的比较采用χ2检验或Fisher′s确切概率法。计数资料用例数(百分比)表示,进行卡方检验。用Kaplan-Meier生存分析曲线描述沙利度胺长期无激素维持缓解率。采用单因素及多因素COX回归分析影响沙利度胺长期疗效的因素,纳入标准0.05,排除标准0.10。P<0.05为差异有统计学意义。
纳入患者28例,其中男性20例(71.4%),女性8例(28.6%)。年龄(36.8±10.9)岁,病程78.5(40.5,95.0)个月,BMI(19.5 ± 3.0)kg/m2,患者随访中位时长19.5(13.3,33.3)个月。基线患者DAIBD中位评分35.0(30.0,50.0)分,临床症状为腹痛、腹泻和反复口腔溃疡分别为25例(89.3%)、4例(14.3%)和17例(60.7%)。所有患者(100.0%)完善肠镜检查,14例(50.0%)完善胃镜检查,2例(7.1%)完善小肠镜检查,2例(7.1%)完善胶囊内镜检查,1例(3.6%)完善超声肠镜检查。内镜发现85.7%溃疡发生在回盲部,以单个(64.3%)、深大(67.9%)、圆形或椭圆形(64.3%)溃疡为主。
临床疗效中,Kaplan-Meier生存分析曲线指出,沙利度胺治疗第6个月、第12个月、第24个月和第36个月无激素维持缓解率分别为85.7%、74.0%、63.5%和50.4%。无激素维持缓解的中位时长为49.5(35.4,63.6)个月。内镜疗效中,共有15例患者在治疗前和治疗第6个月均行内镜检查,治疗第6个月黏膜愈合率为40.0%(6/15)。20例患者治疗前和治疗第12个月均行内镜检查,治疗第12个月黏膜愈合率为35.0%(7/20)。
将实际应用中与临床疗效可能相关的临床及内镜特征纳入COX回归分析,单因素COX回归分析指出,基线DAIBD评分差异具有统计学意义(P = 0.001)。将单因素分析中病程(P = 0.064)、BMI(P = 0.070)、DAIBD评分(P = 0.001)纳入多因素COX回归分析(表1)。多因素COX回归分析指出,基线DAIBD评分高(P = 0.014,HR = 1.057,95%CI 1.011 ~ 1.104)是沙利度胺未能维持无激素缓解的独立危险因素。
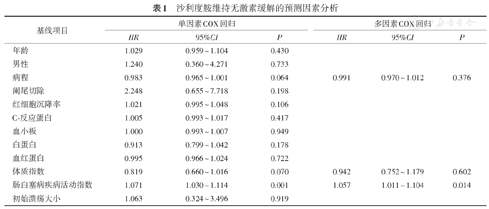
沙利度胺维持无激素缓解的预测因素分析
沙利度胺维持无激素缓解的预测因素分析
| 基线项目 | 单因素COX回归 | 多因素COX回归 | ||||
|---|---|---|---|---|---|---|
| HR | 95%CI | P | HR | 95%CI | P | |
| 年龄 | 1.029 | 0.959 ~ 1.104 | 0.430 | |||
| 男性 | 1.240 | 0.360 ~ 4.271 | 0.733 | |||
| 病程 | 0.983 | 0.965 ~ 1.001 | 0.064 | 0.991 | 0.970 ~ 1.012 | 0.376 |
| 阑尾切除 | 2.248 | 0.655 ~ 7.718 | 0.198 | |||
| 红细胞沉降率 | 1.021 | 0.995 ~ 1.048 | 0.106 | |||
| C-反应蛋白 | 1.005 | 0.993 ~ 1.017 | 0.417 | |||
| 血小板 | 1.000 | 0.993 ~ 1.007 | 0.949 | |||
| 白蛋白 | 0.913 | 0.799 ~ 1.042 | 0.178 | |||
| 血红蛋白 | 0.995 | 0.966 ~ 1.024 | 0.722 | |||
| 体质指数 | 0.819 | 0.660 ~ 1.016 | 0.070 | 0.942 | 0.752 ~ 1.179 | 0.602 |
| 肠白塞病疾病活动指数 | 1.071 | 1.030 ~ 1.114 | 0.001 | 1.057 | 1.011 ~ 1.104 | 0.014 |
| 初始溃疡大小 | 1.063 | 0.324 ~ 3.496 | 0.919 | |||
随访期间,共有14例患者出现不良反应,总体不良反应发生率为50.0%。8例(28.6%)患者出现肢体麻木,发生中位时长为9.5(5.5,22.5)个月,其中3例患者行神经电生理检测,均提示神经轴索损伤。其余不良反应包括肢体局部痉挛2例(7.1%)、嗜睡6例(21.4%)、口干3例(10.7%)、便秘4例(14.3%)、关节疼痛1例(3.6%)、贫血或白细胞减少2例(7.1%)、头晕1例(3.6%)和眼一过性黑朦1例(3.6%)。4例(14.3%)因不良反应不耐受导致药物减量,5例(17.9%)因不良反应而停药,停药中位时长为10.5(23.5,40.3)个月。未发现严重感染、重度骨髓抑制等严重不良反应。
肠白塞病是一种可累及全消化道的血管炎性疾病,病情容易迁延反复。我国《肠型贝赫切特综合征(肠白塞病)诊断和治疗共识意见》[13]指出,沙利度胺可推荐用于中重度和(或)糖皮质激素依赖、无效的肠白塞病患者,但缺乏高质量的证据支持。日本《肠白塞病循证诊断和临床实践指南2020》[5]提出沙利度胺在儿童肠白塞病治疗中可能有效,但并未推荐常规用于成人肠白塞病的治疗,原因可能与沙利度胺疗效临床证据不足相关。沙利度胺作为一种免疫调节药物,其参与调控多条炎症通路,具有治疗肠白塞病的理论依据,若有临床数据的支持,可为肠白塞病的临床决策提供帮助[7]。
关于沙利度胺的疗效分析,国内外研究报道较少,大部分限于病例报告。Yasui等[8]评估沙利度胺对7例严重、复发性肠白塞病的青少年患者的疗效,指出沙利度胺具有较好的短期疗效。Hatemi等[14]分析抗TNF-α生物制剂或沙利度胺治疗13例难治性肠白塞病患者的疗效,其中10例患者(76.9%)获得临床及内镜缓解。病例报告同样提示沙利度胺治疗肠白塞病的有效性[9,10]。
目前同样缺乏沙利度胺治疗肠白塞病的初始和有效剂量的高质量研究。文献表明,沙利度胺用于治疗各类疾病的剂量为50 ~ 1200 mg,初始剂量多为100 ~ 200 mg,特定患者的最佳剂量应为该患者最耐受的剂量[15]。因此,结合文献及本中心的临床经验,沙利度胺治疗肠白塞病采取起始即足量(100 mg/d)的治疗策略,待症状缓解后再根据患者耐受及不良反应等情况酌情调整剂量[8,16]。本研究发现,初始足量沙利度胺具有较好的短期和长期疗效。目前较少研究报道肠白塞病药物的内镜疗效,一项荟萃分析指出,抗TNF-α生物制剂治疗后6个月和12个月的黏膜愈合率合并比例分别为82%和65%[17]。本研究发现,初始足量沙利度胺治疗后6个月和12个月黏膜愈合率为40%和35%,未来需要更大样本量的研究进一步验证,也需要更多研究报道不同药物的内镜疗效以供临床参考。
多因素COX回归分析指出,患者基线DAIBD评分较高是沙利度胺疗效不佳的独立危险因素,提示疾病活动程度与疗效相关。研究指出年龄小(<25岁)及HB水平低(<110 g/L)是硫唑嘌呤疗效不佳的危险因素;CRP高(>15 mg/L)及DAIBD评分高(≥60分)是5-氨基水杨酸和(或)柳氮磺吡啶疗效不佳的独立危险因素[18,19]。我国的一项英夫利西单克隆抗体治疗肠白塞病的研究指出,早期的临床反应和黏膜愈合可能与长期反应相关,基线较低的CRP水平和较好的临床结局相关[12]。本研究中未发现上述的其他因素与沙利度胺疗效相关,未来需要更大样本量分析影响沙利度胺的疗效因素。
沙利度胺的安全性值得注意。本研究发现,沙利度胺总体不良反应发生率为50.0%,其中肢体麻木发生率高达28.6%。文献报道沙利度胺引起神经系统损害的发生率为25% ~ 75%,神经系统损害的发生可能与沙利度胺的抗血管生成特性相关,且其发生率和严重度可能和药物累积剂量和时间依赖相关[20]。沙利度胺引起的周围神经病变为典型对称性病变,其特征是四肢感觉异常,该神经毒性多为不可逆,故在使用沙利度胺前应进行周围神经检测,正在接受治疗的患者需密切关注肢体麻木的症状及定期行神经电生理检测[21]。对于沙利度胺可能引起的神经损害,目前暂无预防药物和预测因子,因此,临床上多采取减量维持或停药的策略[22]。Mlak等[23]发现CRBN基因启动子区多态性是预测神经毒性及嗜睡不良反应的潜在因子,故未来需要更多的研究寻找预测沙利度胺不良反应的潜在基因位点。另外,仍需探索沙利度胺血药浓度监测与疗效及不良反应之间的关系以及探究沙利度胺药物分子结构中引起不良反应的可能基团及改进的可能。
本研究存在以下不足:(1)本研究为真实世界回顾性研究,无法设置对照组,仅能初步探索沙利度胺治疗肠白塞病的有效性及安全性,无法准确与其他药物进行疗效比较;(2)肠白塞病罕见,纳入患者数量有限,故本研究结果及预测因素分析有待大样本研究进一步验证;(3)本研究数据分析得出患者总体DAIBD评分较低,以轻中度活动度为主,故关于沙利度胺治疗重度肠白塞病患者的疗效情况仍有待进一步探究。
关于肠白塞病的研究目前多集中在亚洲发达国家。结合我国国情及本中心治疗经验,选择沙利度胺治疗具有经济负担较低和疗效较好的优势,对其他传统治疗药物不耐受、效果不佳或存在经济问题的患者可考虑使用,基线临床活动较轻的患者对沙利度胺应答更好。但沙利度胺的药物安全性需要注意,如不可逆的神经损害是导致停药的重要原因,用药过程中不良反应的监测成为必要。未来,需要更大样本的研究评估沙利度胺的疗效及安全性,探究血药浓度监测对药物疗效及安全性的应用价值以及寻找不良反应的潜在预测因素和药物结构改进的可能。
所有作者均声明不存在利益冲突



























