
世界卫生组织糖尿病病因学分类系统(1999)是目前应用最广泛的分型系统,如果考虑生物标志物、基因型和遗传风险等因素,应将糖尿病进一步细分为更多类型,现有的糖尿病分型不能完全满足临床需要,需要更加简单有效、对临床治疗有直接指导意义的糖尿病分类方法。该文梳理高血糖的定义及流行病学,对国内外目前已有的各种分型方法进行回顾总结,并在此基础上结合前期的临床研究结果和诊疗经验,提出一个基于现有分型法的“邹氏高血糖精细分型法”,把高血糖分为应激性高血糖、糖尿病前期和糖尿病3种状态,再根据糖尿病的不同特征进行精细分型,以期为后续临床实现精准治疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病已成为全球范围内患者数量增长最迅速的非传染性疾病,对其精确预测、诊断和治疗以达到控制目标一直是医学界共同的心愿。世界卫生组织(World Health Organization,WHO)糖尿病病因学分类系统(1999)是目前应用最广泛的分型系统,如果考虑生物标志物、基因型和遗传风险等因素,应将糖尿病进一步细分为更多类型,以产生可能更有利于确定治疗方案的分类方法。2型糖尿病(type 2 diabetes mellitus,T2DM)患者是糖尿病患者中最主要的群体(超过90%),在临床特征、进展和并发症风险方面具有高度异质性,鉴别诊断往往也具有挑战性,很多不符合其他糖尿病分类标准的糖尿病常常被诊断为T2DM。糖尿病是一种多因素疾病,是遗传和环境风险因素共同作用的结果,现在的糖尿病分型不能完全满足临床需要,因此,我们需要一种简单有效、对临床治疗有直接指导意义的糖尿病分类方法。基于此,我们对国内外目前已有的各种成熟分型方法进行总结和综述,并结合前期的临床研究和诊疗经验,提出一套基于现有分型法的新的高血糖精细分型方法,以期为后续临床实现精准治疗提供依据。
我国成人的正常血糖是指空腹血糖(fasting blood glucose,FBG)<6.1 mmol/L,糖负荷后2 h血糖<7.8 mmol/L[1],糖化血红蛋白(glycated hemoglobin A1c,HbA1c)<6%。而美国糖尿病学会(American Diabetes Association,ADA)最新标准则定义为FBG<5.6 mmol/L(100 mg/dl),糖负荷后2 h血糖<7.8 mmol/L(140 mg/dl),HbA1c<5.7%[2]。两国的血糖值有所差异,这与人种、地域、饮食习惯和环境都密不可分。血糖超过正常值就是高血糖,临床上包括糖尿病前期、应激性高血糖和糖尿病3种状态。
糖尿病前期影响着美国1/3的成年人和全球约7.57亿人[3],每年约5%~10%的糖尿病前期患者会进展为糖尿病。2017年全国流行病学调查数据显示,中国糖尿病总患病人数为1.298亿,患病率达12.8%[4];糖尿病患者的医疗支出约为非糖尿病患者的1.4倍[5]。
糖尿病分型主要包括1999年WHO的分型、2019年WHO的分型、《糖尿病分型诊断中国专家共识》分型和Leif Groop糖尿病分型等(图1),其中国际上广泛使用的糖尿病分型是1999年WHO的分型[6],也有不少学者更倾向于应用2019年WHO的分型[7]。2022年中国学者制定了《糖尿病分型诊断中国专家共识》,提出分型建议[8]。2018年瑞典学者Leif Groop团队打破了原有1型糖尿病(type 1 diabetes mellitus,T1DM)、T2DM和1.5型糖尿病的传统,基于6项指标对初诊糖尿病患者进行聚类分析,将糖尿病分为5种亚型[9]。6项指标分别包括存在谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)、诊断时的年龄、体重指数(body mass index,BMI)、HbA1c、稳态模型2评估β细胞功能(homeostasis model assessment 2-β,HOMA2-β)、稳态模型2评估胰岛素抵抗指数(homeostatic model assessment 2 of insulin resistance,HOMA2-IR)。这个分型方法对临床诊疗有一定的指导意义,但分类过于复杂,参数HOMA2-β、HOMA2-IR需要使用繁琐的计算公式和聚类分析软件对患者进行分类,在临床工作中较难实施,此外,他们对“轻度”和“严重”的界定范围模糊未量化,临床上不好判断,当使用不同的纳入标准、替代变量或较低质量的数据时,这种聚类方法是否可以产生可靠且可比较的结果尚不清楚。
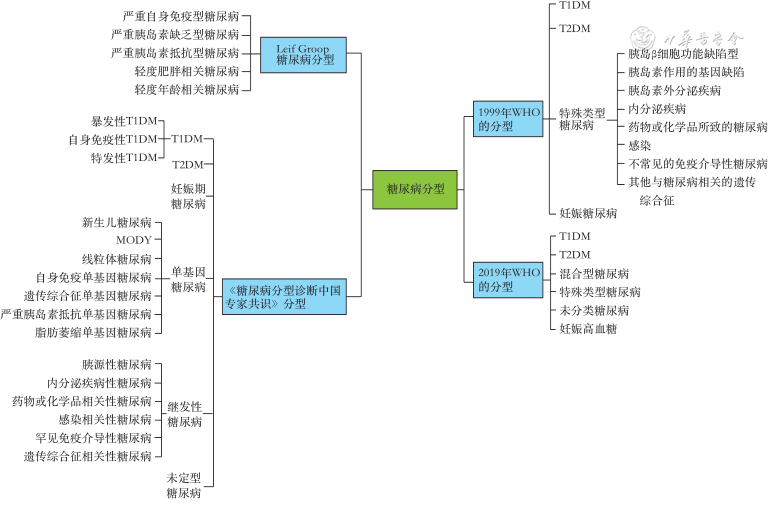

注:WHO为世界卫生组织;T1DM为1型糖尿病;T2DM为2型糖尿病;MODY为青少年发病的成人型糖尿病
WHO分型应用多年,可以指导临床处理高血糖相关性疾病,但以上分型不够精细,不利于对高血糖进行精准治疗,有必要探索出一套高血糖的精细分型,临床医师据此实现精准治疗。因此,我们根据循证医学证据,结合国内外广泛的糖尿病分型系统,提出一种新的高血糖精细分型,命名为“邹氏高血糖精细分型法”,把高血糖分为应激性高血糖、糖尿病前期和糖尿病3种状态(图2)。
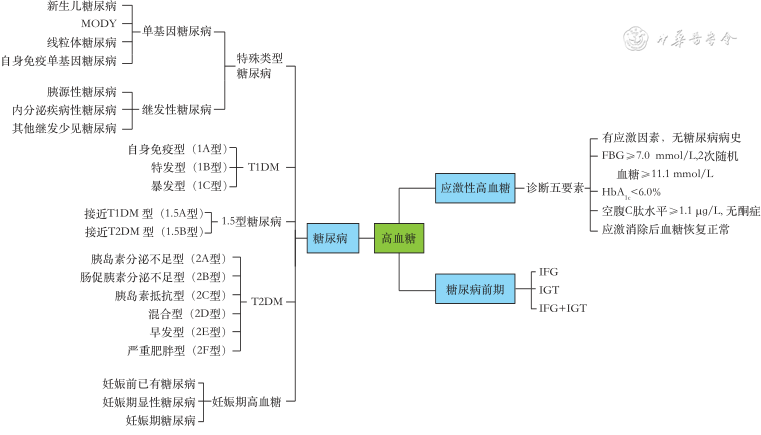

注:T1DM为1型糖尿病;T2DM为2型糖尿病;MODY为青少年发病的成人型糖尿病;FBG为空腹血糖;HbA1c为糖化血红蛋白;IFG为空腹血糖受损;IGT为糖耐量减低
应激性高血糖是指机体在应激状态下(如严重创伤、烧伤、重症感染、心脑血管意外等)血糖一过性升高的一种病理生理现象,一旦急性应激消除后,血糖会恢复正常。诊断五要素包括:(1)有应激因素,无糖尿病病史;(2)FBG≥7.0 mmol/L,2次随机血糖≥11.1 mmol/L;(3)HbA1c<6.0%;(4)空腹C肽水平(fasting C peptide,FCP)≥1.1 μg/L,无酮症;(5)应激消除后血糖恢复正常。至少50%的患者通常在入住重症监护病房后的最初48 h内出现高血糖[10],它的发生与促炎细胞因子密不可分。此时应积极治疗原发病,首选胰岛素治疗。
糖尿病前期是指血糖水平尚未达到糖尿病的诊断标准,但超过正常水平的状态,是糖尿病的危险因素和预警信号。糖尿病前期可能已经有糖尿病并发症的存在,Kirthi等[11]发现,处于糖尿病前期的人群患糖尿病视网膜病变(diabetic retinopathy,DR)的风险远大于糖耐量正常人群。在印度的2个三级糖尿病中心进行的研究中发现,DR存在于约6%的糖尿病前期患者中,糖尿病前期个体中较高的HbA1c值与DR相对风险的2倍相关[12]。因此,糖尿病前期对于糖尿病诊断以及并发症防治具有重要意义。糖尿病前期大致可以分为3种不同类型,即空腹血糖受损(impaired fasting glucose,IFG)、糖耐量减低(impaired glucose tolerance,IGT),以及两种类型并存(IFG+IGT)。美国和中国的标准稍有不同,我们采用中国标准(表1)[2,13]。
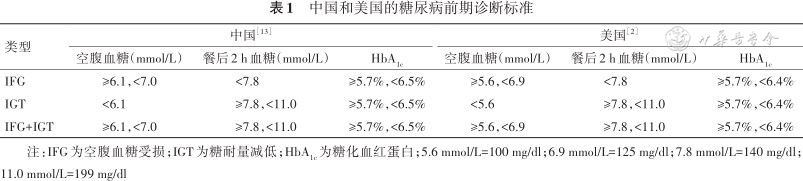
中国和美国的糖尿病前期诊断标准
中国和美国的糖尿病前期诊断标准
| 类型 | 中国[13] | 美国[2] | ||||
|---|---|---|---|---|---|---|
| 空腹血糖(mmol/L) | 餐后2 h血糖(mmol/L) | HbA1c | 空腹血糖(mmol/L) | 餐后2 h血糖(mmol/L) | HbA1c | |
| IFG | ≥6.1,<7.0 | <7.8 | ≥5.7%,<6.5% | ≥5.6,<6.9 | <7.8 | ≥5.7%,<6.4% |
| IGT | <6.1 | ≥7.8,<11.0 | ≥5.7%,<6.5% | <5.6 | ≥7.8,<11.0 | ≥5.7%,<6.4% |
| IFG+IGT | ≥6.1,<7.0 | ≥7.8,<11.0 | ≥5.7%,<6.5% | ≥5.6,<6.9 | ≥7.8,<11.0 | ≥5.7%,<6.4% |
注:IFG为空腹血糖受损;IGT为糖耐量减低;HbA1c为糖化血红蛋白;5.6 mmol/L=100 mg/dl;6.9 mmol/L=125 mg/dl;7.8 mmol/L=140 mg/dl;11.0 mmol/L=199 mg/dl
1. IFG:指单纯的空腹血糖升高。2021年,全球20~79岁成人中IFG患病率为5.8%(2.93亿),到2045年这一数字预计将增加到6.5%(4.14亿)[14]。对于IFG的治疗,特异性针对IFG的方法有许多,如低脂饮食对合并高血压的IFG患者有效[15]。对于这类患者,可以以改变生活方式为主,注意监测血糖水平,而不必急于使用二甲双胍等药物。
2. IGT:指糖耐量减低,其空腹血糖水平正常。2021年,全球20~79岁成人中IGT患病率为9.1%(4.64亿),到2045年这一数字预计将增加到10.0%(6.38亿)[14],远远超过空腹血糖异常的患者。患IGT的比例随年龄增加而增长,IGT患者的治疗方式大部分与IFG患者相似,但是可以适当使用阿卡波糖等药物。
3. IFG+IGT:指患者不仅空腹血糖升高,糖耐量也同时降低,是处于糖尿病极高风险的人群,在短期内发展为糖尿病的可能性非常大。需要尽早、尽快采取措施,必须采用治疗性生活方式的干预,结合二甲双胍、阿卡波糖等药物。Yeung等[16]在改变生活方式的同时加入二甲双胍来改善糖尿病前期,对于IGT、IFG以及IGT+IFG都同样有疗效。一项多中心、随机、对照临床试验也证实二甲双胍对于预防糖尿病有重要作用[17]。此外,地中海饮食有利于逆转糖尿病前期状态。Ivan等[18]证明了极低热量的生酮地中海饮食可以明显改善糖尿病前期、糖尿病和超重/肥胖患者的身体相关参数及代谢指标。α-葡萄糖苷酶抑制剂(如阿卡波糖)也被证实可改善糖尿病前期患者的血糖水平,实现糖尿病前期逆转[19]。因此,包括健康饮食计划、定期体育活动、行为健康实践以及患者的体重减轻等改变生活方式的干预均对糖尿病前期的3种亚型有利,进而在糖尿病的治疗中也同样适用[20]。
糖尿病诊断标准为有多尿、多饮、多食、体重下降等典型症状,且FBG≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L或HbA1c>6.5%;无症状则不同时间2次检测满足上述血糖标准的任一条[7]。
1.特殊类型糖尿病:(1)单基因糖尿病:是由单个基因的1个或多个变异引起的遗传性疾病,约占所有糖尿病的3%,具有广泛的异质性,主要包括胰岛β细胞功能缺陷型和胰岛素作用缺陷型两大类[8],包括新生儿糖尿病、青少年发病的成人型糖尿病(maturity onset diabetes of the young,MODY)、线粒体糖尿病和自身免疫单基因糖尿病。由于具有单个基因变异引起的特点,使得精准医疗成为可能,具有某些特定基因缺陷的患者可能更适合某种特定药物,如MODY和杂合子HNF1A或HNF4A基因突变的患者对磺脲类药物高度敏感[21]。
(2)继发性糖尿病:①胰源性糖尿病:胰腺广泛损伤后可能会引起胰源性糖尿病,包括急性和慢性胰腺炎、胰腺肿瘤、胰腺切除术后等,其中胰腺炎后糖尿病(post-pancreatitis diabetes mellitus,PPDM)是最常见且重要的一类胰源性糖尿病,是成人新发糖尿病的第2大常见原因,仅次于T2DM[22]。PPDM的病理机制十分复杂,目前尚不完全清楚,可能与胰岛细胞数量减少、自身免疫反应、局部或全身炎症反应以及胰岛素-肠促胰岛素轴的改变有关[23],通常可以使用二甲双胍和胰岛素来治疗[24],此外,胰酶补充剂也广泛应用于治疗PPDM[22],胰腺切除术后PPDM患者还可采用自体胰岛移植的方法[25]。
②内分泌疾病性糖尿病:内分泌疾病如皮质醇分泌增多症、嗜铬细胞瘤、甲状腺功能亢进症、肢端肥大症等引起糖皮质激素、肾上腺素、甲状腺激素、生长激素等异常增高,导致血糖升高[26]。库欣病的糖尿病患病率为40%~45%,肢端肥大症人群的糖尿病患病率约为27%[27]。糖皮质激素会降低胰岛素敏感性,减少胰岛素分泌。此类型的继发性糖尿病患者需要首先治疗原发病,随着原发病得以缓解,血糖也会随之下降。
③其他继发少见糖尿病:包括药物或化学品相关性糖尿病、感染相关性糖尿病、罕见免疫介导性糖尿病、遗传综合征相关性糖尿病等。
2. T1DM:多数是自身免疫性疾病,部分为非自身免疫的破坏所致,其特征是由于β细胞破坏导致胰岛素产生绝对不足。T1DM首选胰岛素注射治疗,干细胞和胰岛移植也显现具有一定疗效[28]。
(1)自身免疫型(1A型):β细胞出现自身免疫性破坏,起病时间通常难以发现,是由胰岛细胞、GADA、胰岛素和酪氨酸磷酸酶样蛋白的特异性自身抗体破坏β细胞引起的[29],可采用胰岛素以及免疫调节方法治疗。
(2)特发型(1B型):指那些具有T1DM征象但各种胰岛自身抗体阴性的T1DM,在儿童和青少年中发病率较高。Vipin等[30]报道了110例年龄<18岁的T1DM患者,发现近30%的印度患者在T1DM发病时,胰岛抗体均呈阴性。目前特发型T1DM的机制尚不清楚。此类患者需要注射胰岛素替代治疗或进行胰岛移植。
(3)暴发型(1C型):是T1DM的一种亚型,其β细胞在几天或1周内被破坏,极易引起严重的糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)。暴发型T1DM是包括日本在内的东亚国家T1DM的常见亚型,西方国家很少见[31]。韩国新诊断为T1DM的患者中,暴发型T1DM的患病率为3.2%[29]。诊断标准如下:①DKA症状严重,血pH值<6.9;②空腹血糖≥16 mmol/L,HbA1c<8.7%,空腹C肽<0.3 μg/L;③血清淀粉酶和脂肪酶轻度升高,常伴腹痛。由于胰岛β细胞快速大量被破坏,补充胰岛素是最主要的治疗手段,在DKA的急性发作期,需及时纠正酸中毒并保持水电解质酸碱的平衡,积极预防横纹肌溶解。
3. 1.5型糖尿病:部分患者的临床特点介于T1DM和T2DM之间,这类糖尿病被称为成人隐匿性自身免疫糖尿病(latent autoimmune diabetes of adults,LADA),又被称为1.5型糖尿病。此病早期临床阶段,在没有胰岛素治疗的情况下β细胞进行性缓慢的自身免疫损伤,已被ADA认可是T1DM的一种特殊形式[32]。但其与T1DM并不相同,差异较大。C肽水平和针对β细胞的自身抗体是诊断LADA重要的生物标志物[33]。与其他国家相比,中国的LADA患病率较高,患者数量居世界首位。LADA可分为接近T1DM和接近T2DM的两种亚型。LADA的治疗药物包括胰岛素、噻唑烷二酮(thiazolidinedione,TZD)、二肽基肽酶Ⅳ抑制剂(dipeptidyl peptidase-4 inhibitor,DPP-4i)和维生素D等。
(1)接近T1DM型(1.5A型):表现与T1DM类似的LADA,占全国新诊断T1DM患者的65%[34],存在针对胰岛β细胞的抗体,抗体滴度高,破坏胰岛β细胞,进而引发高血糖。这类患者启用胰岛素时间较1.5B型更早[35]。
(2)接近T2DM型(1.5B型):大多数表现与T2DM相似,病情一般不如T1DM严重,容易被误诊为T2DM,LADA患者占中国30岁以上新诊断T2DM患者的5.9%[34],虽然也存在针对胰岛β细胞的抗体,但是滴度低,与经典T1DM相比,其免疫破坏的进展速度要慢得多,并且具有胰岛素抵抗(insulin resistance,IR)的特征。治疗采用胰岛素联合口服降糖药可以控制血糖[35],并可以延缓β细胞功能下降的速度。
4. T2DM:T2DM是一种慢性代谢性疾病,其主要特征是胰岛β细胞功能缺陷、肠促胰素不足和外周IR,从而导致血糖升高。它是患病率最高的糖尿病类型,约占全部糖尿病的90%[36]。
(1)胰岛素分泌不足型(2A型):指空腹C肽≤1.0 μg/L,占25.21%[37],胰岛素分泌不足主要是由于胰岛功能缺陷所致。一般使用胰岛素联合二甲双胍或α-葡萄糖苷酶抑制剂治疗有效[38]。
(2)肠促胰素分泌不足型(2B型):占51.63%[37],空腹C肽在1.1~2.5 μg/L范围内,肠促胰素包括葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic peptide,GIP)和肠内分泌L细胞分泌的胰高糖素样肽-1(glucagon-like peptide-1,GLP-1),介导胰岛素分泌,提高胰岛素的敏感性,肠促胰素分泌不足易造成β细胞功能不全和IR[39]。治疗首选GLP-1受体激动剂或DPP-4i,除此之外,二甲双胍和钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)也是重要的联合治疗药物。
(3)胰岛素抵抗型(2C型):虽然IR是所有T2DM共同的病理生理基础,此处胰岛素抵抗型T2DM是指空腹C肽≥2.5 μg/L,占23.16%[37],多数患者有胰岛素抵抗综合征表现[40],通常为超重/肥胖所诱导,常伴有非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)。这一类型常使用二甲双胍、TZD、泛过氧化物酶体增殖物激活受体激动剂、SGLT2i、GLP-1受体激动剂治疗,并强化体重管理。
目前临床尚无评估IR的统一标准,我们结合前期研究总结归纳评估方法如下:①代谢综合征(metabolic syndrome,MS)评估[5,41]:MS是多重代谢紊乱因素在同一患者身上的聚集现象,病理生理基础是IR与稳态模型评估的胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)评估有95%的一致性。MS的组成包含“一胖伴三高”。“一胖”指腹型肥胖,男性腰围>90 cm,女性腰围>85 cm;BMI>24 kg/m2;过多脂肪导致游离脂肪酸增加,影响胰岛素受体的信号传导,导致IR。腰围越大,游离脂肪酸浓度越高,IR越严重。“三高”指高血糖、高甘油三酯(triglyceride,TG)或高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)降低、临界高血压。高血糖或己诊断为T2DM的患者中有83%存在IR。TG升高是游离脂肪酸浓度升高的标志,并且加速HDL-C的分解代谢,是IR的临床标志,与IR的一致性为88%。临界高血压指血压超过130/85 mmHg(1 mmHg=0.133 kPa),或已经诊断为高血压正在服药,与IR的一致性达58%。
②CAT评估[5,41]:A.空腹C肽>1.1 μg/L,表明体内并不缺少胰岛素;B.脂肪过多(adiposity):超重、肥胖或NAFLD;C.TG/HDL-C比值:男性>1.7,女性>2.8。
③三高一低评估[5,41]:A.高胰岛素血症:空腹胰岛素>15 mU/L,餐后2 h胰岛素>80 mU/L;T2DM中有60%表现为高胰岛素血症。B.高血糖:糖尿病前期中有66%存在IR。C.高TG:切点与意义同上。D.低HDL-C血症:88%存在IR。
④其他评估指标[8,41]:A.体脂肪率增加:男性>25%,女性>30%,体脂肪率越增加,IR的风险越大。B.NAFLD:其特征是肝脂肪含量增加超过5%,其中5.0%~10.0%为轻度、10.1%~15.0%为中度、>15.1%为重度;多种肝酶升高;肝脂肪含量越多,肝酶升高幅度越大,IR越严重。C.肌肉含量减少:肌肉占体重比例,男性<40%,女性<35%;肌肉含量越少,IR越严重。
⑤脂联素测定[41]:通过胶乳增强免疫比浊法测定中国人的脂联素正常参考值为男性>3.0 mg/L,女性>3.4 mg/L;低脂联素水平是IR的标志,脂联素水平越低,IR越严重;低脂联素水平可预测未来进展为糖尿病的风险[5]。
(4)混合型(2D型):T2DM本身异质性很大,临床上可能会遇到同时具有上述3种亚型的患者,我们定义为混合型,以下为常见的2种混合方式。①胰岛素分泌不足型(2A型)+胰岛素抵抗型(2C型):这类患者空腹C肽≤1.0 μg/L且同时符合胰岛素抵抗型(2C型)中IR的临床评估。②肠促胰素分泌不足型(2B型)+胰岛素抵抗型(2C型):这类患者空腹C肽在1.1~2.5 μg/L范围内且同时符合胰岛素抵抗型(2C型)中IR的临床评估。以上两种混合型患者的治疗仍以二甲双胍为主,采用胰岛素与GLP-1受体激动剂的复方制剂、TZD、SGLT2i等联合治疗通常有较好的效果,并且需要坚持改善生活方式,强化体重管理,控制好血压、血糖和血脂。
(5)早发型(2E型):早发T2DM是指发病年龄<40岁的T2DM,其中发病年龄<19岁为青少年起病的早发T2DM,19~40岁为成年起病的早发T2DM。中国早发T2DM的患病率在1997年为1.0%,2010年为5.7%。早发T2DM在T2DM人群中所占的比例为13.5%。在世界范围内早发T2DM都在急速增加,中国13年来增长了4倍。早发T2DM在亚洲人群的患病率更高,显著高于西方人群,美国2002至2003年,早发型T2DM的发病率为新增9例/10万人年,这一数字在2009至2010年增加到12.2例/10万人年,2011至2012年增加到12.5例/10万人年,2014至2016年增加到13.8例/10万人年,呈逐年上升的趋势。女性和年长的青少年患病率和发病率的年增长率更大。
早发T2DM患者的临床结局往往更差,呈现以下特点:①与晚发T2DM相比,早发T2DM卒中、心肌梗死的风险更高。②年轻的T2DM患者糖尿病肾脏病(diabetes kidney disease,DKD)、DR和糖尿病周围神经病变的风险高于T1DM,这也提示儿童青少年T2DM并发症风险比T1DM并发症风险更高。③动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的发病率和全因死亡率在50岁以上人群中下降,但在50岁以下人群中没有下降;年轻的T2DM患者有相似的心血管和死亡风险。④新诊断的早发T2DM患者发生心血管疾病和全因死亡比晚发患者上升,临床结局也更差。⑤糖尿病诊断年龄每下降1岁,全因死亡风险增加4%,大血管病变风险增加3%,微血管病变风险增加5%。这种类型的糖尿病更具有侵袭性,其胰岛β细胞的衰竭更为迅速,治疗选择更加有限[42]。探索早发型T2DM的发病影响因素、预防及治疗有着重大的意义[43]。对早发型(2E型)患者进行饮食和运动管理非常重要,美国食品药品监督管理局批准应用的药物包括二甲双胍、基础胰岛素、利拉鲁肽、艾塞那肽[44]。研究发现,达格列净、西格列汀+二甲双胍和沙格列汀+二甲双胍显示出更好的疗效[45]。
(6)严重肥胖型(2F型):BMI>35 kg/m2(亚裔人群BMI>32.5 kg/m2)。肥胖引起的体脂含量过高是IR和T2DM的重要原因[46],对于重度肥胖的糖尿病患者需要采取以减重为目的的各种治疗手段,包括但不限于药物、手术等。包括:①代谢手术:对BMI≥35 kg/m2的T2DM患者的糖尿病缓解有效,减轻体重和糖尿病缓解的疗效似乎因手术类型而异[47]。②肠道菌群:是一个重要的治疗手段,Hosomi等[48]在小鼠模型中应用韦克斯勒芽孢杆菌,发现其可诱导代谢变化和发挥抗炎作用,从而减少高脂肪饮食引起的肥胖和糖尿病。③降糖药物:可以采用二甲双胍、GLP-1受体激动剂、SGLT2i、TZD和α-葡萄糖苷酶抑制剂等药物联合治疗,但一般不使用胰岛素[49]。④替尔泊肽(Tirzepatide):是基于天然GIP序列生成的多功能多肽,它能够同时与GIP和GLP-1受体结合。平均半衰期为5 d,可以每周1次注射。GIP可增强GLP-1在抑制食物摄取和增强能量消耗方面的作用,从而降低患者体重10%~20.2%,腰围降幅为3.8~10.9 cm。与司美格鲁肽1 mg相比,替尔泊肽更多降低TG、极低密度脂蛋白胆固醇水平,升高HDL-C水平。SURPASS 1、2研究显示,与司美格鲁肽相比,5、10和15 mg替尔泊肽均可显著降低T2DM患者的HOMA-IR,改善IR[50]。此外,由GIP、GLP-1和胰高糖素组成的“三重受体激动剂”Retatrutide 12 mg治疗组实现体重减轻≥5%、≥10%和≥15%的比例高达100%、93%和83%,平均减重可达24.2%[51]。
T1DM、1.5型糖尿病、T2DM这3个类型在临床上常见,并在初期诊断时因所有临床特征尚未完全展现,可能会在后续治疗中更正原有诊断,各亚型间不同的临床特征比较详见表2。
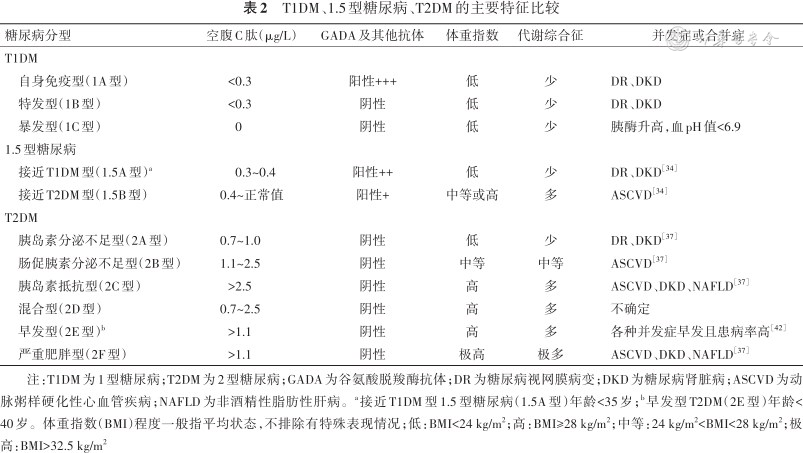
T1DM、1.5型糖尿病、T2DM的主要特征比较
T1DM、1.5型糖尿病、T2DM的主要特征比较
| 糖尿病分型 | 空腹C肽(μg/L) | GADA及其他抗体 | 体重指数 | 代谢综合征 | 并发症或合并症 |
|---|---|---|---|---|---|
| T1DM | |||||
| 自身免疫型(1A型) | <0.3 | 阳性+++ | 低 | 少 | DR、DKD |
| 特发型(1B型) | <0.3 | 阴性 | 低 | 少 | DR、DKD |
| 暴发型(1C型) | 0 | 阴性 | 低 | 少 | 胰酶升高,血pH值<6.9 |
| 1.5型糖尿病 | |||||
| 接近T1DM型(1.5A型)a | 0.3~0.4 | 阳性++ | 低 | 少 | DR、DKD[34] |
| 接近T2DM型(1.5B型) | 0.4~正常值 | 阳性+ | 中等或高 | 多 | ASCVD[34] |
| T2DM | |||||
| 胰岛素分泌不足型(2A型) | 0.7~1.0 | 阴性 | 低 | 少 | DR、DKD[37] |
| 肠促胰素分泌不足型(2B型) | 1.1~2.5 | 阴性 | 中等 | 中等 | ASCVD[37] |
| 胰岛素抵抗型(2C型) | >2.5 | 阴性 | 高 | 多 | ASCVD、DKD、NAFLD[37] |
| 混合型(2D型) | 0.7~2.5 | 阴性 | 高 | 多 | 不确定 |
| 早发型(2E型)b | >1.1 | 阴性 | 高 | 多 | 各种并发症早发且患病率高[42] |
| 严重肥胖型(2F型) | >1.1 | 阴性 | 极高 | 极多 | ASCVD、DKD、NAFLD[37] |
注:T1DM为1型糖尿病;T2DM为2型糖尿病;GADA为谷氨酸脱羧酶抗体;DR为糖尿病视网膜病变;DKD为糖尿病肾脏病;ASCVD为动脉粥样硬化性心血管疾病;NAFLD为非酒精性脂肪性肝病。a接近T1DM型1.5型糖尿病(1.5A型)年龄<35岁;b早发型T2DM(2E型)年龄<40岁。体重指数(BMI)程度一般指平均状态,不排除有特殊表现情况;低:BMI<24 kg/m2;高:BMI≥28 kg/m2;中等:24 kg/m2<BMI<28 kg/m2;极高:BMI>32.5 kg/m2
5.妊娠期高血糖:(1)妊娠期糖尿病(gestational diabetes mellitus,GDM):指妊娠后母体糖代谢异常而首次发生的血糖轻度升高,全球标准患病率为14.0%,不同地区之间的患病率有较大的差异[52],对妇女及其子女的短期和长期健康有不利影响。由单核细胞和巨噬细胞产生的肿瘤坏死因子-α在高浓度下损害胰岛素敏感性,间接发展为高血糖状况,最终成为GDM[53]。有研究显示,GDM与诊断前几个月存在的微生物群诱导炎症有关[54]。
我国GDM的确诊标准如下:FBG≥5.1 mmol/L,糖负荷后1 h血糖≥10.0 mmol/L,糖负荷后2 h血糖≥8.5 mmol/L,这3项标准中符合任何一项即可诊断。一旦被确诊为GDM,有两种方法可以用于治疗。一种是生活方式干预,Huang等[55]报道,怀孕期间和之后提供的生活方式干预可以降低与GDM相关的风险,有可能改善结局;另一种则是药物治疗,主要是应用胰岛素,慎重使用二甲双胍、格列苯脲等。已有研究表明,预防性使用二甲双胍可降低高危孕妇的GDM发病率,早期应用有益处[56]。
(2)妊娠期显性糖尿病:测量2次以上FBG≥7.0 mmol/L,随机血糖≥11.1 mmol/L,HbA1c≥6.5%,这3项标准中符合任何一项即可诊断。这一类糖尿病是指在妊娠期前已经存在,但未被发现。治疗措施同妊娠前已有糖尿病相似。
(3)妊娠前已有糖尿病:T1DM或T2DM在妊娠前发病者占全球所有妊娠妇女的0.5%~2.4%,并且比例正在不断升高[57],发病机制与原发糖尿病一致。治疗方式包括胰岛素及口服降糖药如二甲双胍。ADA在最新指南中提出,对妊娠前已有糖尿病患者无论是患有T1DM还是T2DM,均建议使用胰岛素[58]。
目前,对T2DM精准医学的研究不断深入,针对T2DM的治疗方式也层出不穷,现根据T2DM的精细分型归纳其相应的精准治疗策略,见图3[59]。
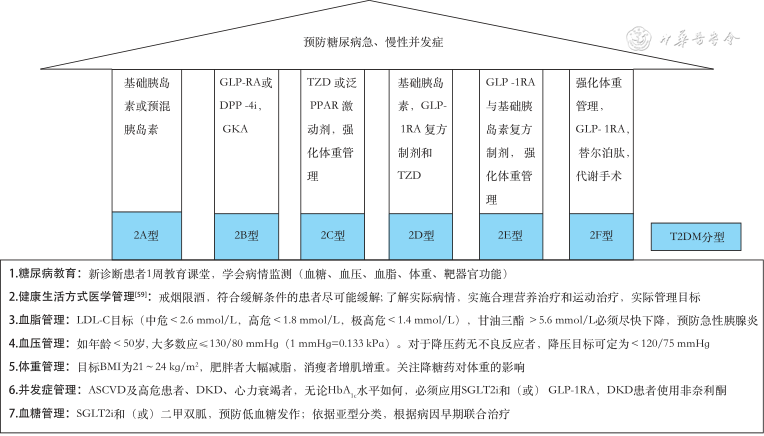

注:T2DM为2型糖尿病。T2DM的分型:2A型为胰岛素分泌不足型;2B型为肠促胰素分泌不足型;2C型为胰岛素抵抗型;2D型为混合型;2E型为早发型;2F型为严重肥胖型。GLP-1RA为胰高糖素样肽-1受体激动剂;DPP-4i为二肽基肽酶Ⅳ抑制剂;GKA为葡萄糖激酶激活剂;TZD为噻唑烷二酮;PPAR为过氧化物酶体增殖物激活受体;LDL-C为低密度脂蛋白胆固醇;BMI为体重指数;ASCVD为动脉粥样硬化性心血管疾病;DKD为糖尿病肾脏病;HbA1c为糖化血红蛋白;SGLT2i为钠-葡萄糖共转运蛋白2抑制剂
糖尿病的发病机制类似于“黑箱方法”,即需要通过对外部行为的分析来探索其本质[60]。对糖尿病进行分型治疗的认知是动态进化的过程,依据不同的指标,可以有不同的分型,目前尚无一个统一的标准,与此同时,高血糖在对糖尿病的认知发展过程中仍具有不可替代的作用[61]。借助大数据驱动等研究方式探索“黑箱模式”,使得糖尿病的精准医疗成为可能,通过个体化医疗方式,提高患者的生存质量。在高血糖患者的鉴别诊断与治疗策略中,我们需要明确患者是否是糖尿病、有无特殊类型糖尿病的线索、糖尿病类型(T1DM、1.5型糖尿病还是T2DM)以及对T2DM亚型的分类、患者的能量代谢状态、患者的心血管危险因素及其风险分层,还需对并发症进行筛查,从而合理运用生活方式干预及用药方案进行精准治疗。
胡静涵, 郭妍, 米稼钰, 等. 探索高血糖的精细分型与精准治疗[J]. 中华糖尿病杂志, 2023, 15(11): 1031-1040. DOI: 10.3760/cma.j.cn115791-20230801-00028.
所有作者声明无利益冲突



























