
该文报告1例青年男性患者,同种异基因造血干细胞移植后出现移植物抗宿主病(graft versus host disease,GVHD)多脏器受累,临床表现多样,急慢性病程重叠发生:急性GVHD表现以高胆红素血症伴或不伴转氨酶升高、血性水样便为主;慢性GVHD以广泛皮肤色素脱失、口腔黏膜溃疡、病甲等表现突出,还有膜性肾病、多浆膜腔积液及肺限制性通气功能不全等慢性GVHD表现。GVHD诊断主要依靠病史和临床表现,鉴别排查感染、药物及肿瘤等因素影响,易漏诊误诊,需多学科诊治。文献回顾提示造血干细胞移植后男性受者女性供者、外周血造血干细胞移植者较骨髓移植者慢性GVHD发生风险高,但移植物抗白血病效应存在。目前糖皮质激素联合或不联合钙调磷酸酶抑制剂是GVHD的一线治疗方案,总体患者预后不佳。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
移植物抗宿主病(graft versus host disease,GVHD)是指同种异基因造血干细胞移植(hematopoietic stem cell transplantation,HSCT)患者在重建供者免疫过程中,异基因供者的免疫细胞识别受者组织抗原并发生免疫介导的临床病理综合征。传统按移植后100 d为节点将其分为急、慢性GVHD,2005年美国国立卫生研究院建议按照临床征象区分急慢性,即急性GVHD[1]常累及皮肤、胃肠道及肝脏,亦可见发热、肺部及中枢神经损伤等,慢性GVHD[2, 3]主要累及皮肤、毛发、指甲、口腔黏膜、眼睛、肝脏、胃肠道、肌肉骨关节及生殖器等。慢性GVHD可进一步分为经典慢性和重叠综合征2个亚类。重叠综合征指在慢性GVHD基础上出现急性GVHD症状,过程往往短暂,受免疫抑制治疗强度影响[3]。本文报告1例长达10年的广泛型慢性GVHD重叠综合征病例,并系统回顾文献以提高临床医师对GVHD的认识。
患者男性,10年前(2012年3月)21岁,在中山大学附属第一医院确诊为急性淋巴细胞白血病(L2型),予VDLP方案(长春新碱+柔红霉素+培门冬酶+泼尼松)化疗,化疗后第40天复查提示完全缓解。
造血干细胞移植及GVHD预防措施:移植前予改良BUCY方案(羟基脲、阿糖胞苷、白消安、环磷酰胺联合司莫司汀)清髓预处理。造血干细胞供者为HLA全相合胞姐。移植前9 d采用环孢素A(cyclosporin A,CsA)50 mg qd(图1),其后联合霉酚酸酯(mycophenolate mofetil,MMF)、甲氨蝶呤、甲泼尼龙(methylprednisolone,MP)预防急性GVHD。造血干细胞移植后20 d获得临床造血重建、30 d短串联重复序列证实完全供者植入。
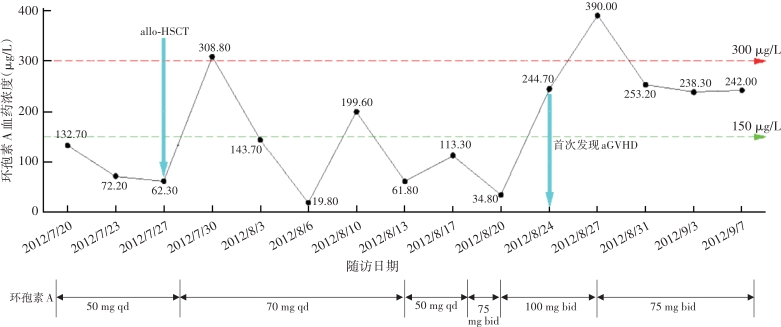

注:allo-HSCT:异基因造血干细胞移植;aGVHD:急性移植物抗宿主病
GVHD的发生及演变(图2):HSCT后28 d,患者出现纳差,肝功能总胆红素24.4 μmol/L,碱性磷酸酶355 U/L,谷丙转氨酶116 U/L,考虑急性GVHD肝损害(肝炎型),予调整CsA剂量(图1)联合MP免疫抑制等治疗后病情好转。HSCT后5个月MP、CsA完全停服,6个月患者再次出现纳差、黄疸,总胆红素最高升至57.3 μmol/L,查肝胆彩超未见肝肿大、胆道扩张及梗阻,不支持肝静脉闭塞性疾病,仍考虑急性GVHD肝损害,再次予强化免疫抑制治疗后好转。1年余患者出现口腔溃疡、皮肤疱疹,伴水肿、尿蛋白3+、血白蛋白23 g/L,血肌酐正常,考虑慢性GVHD累及口腔黏膜和皮肤、HSCT后肾病综合征,停用CsA,改为他克莫司,联合MP免疫抑制治疗后症状改善。3年余患者出现全身皮肤呈白癜风样改变,趾甲如病甲改变(图3)。4年余患者水肿、蛋白尿加重,血肌酐升至293 μmol/L,肾活检病理提示GVHD相关的膜性肾病、肾小管间质病变较重(不排除合并慢性肾小管间质性肾炎可能,图4),遂停用他克莫司,改为MMF联合MP免疫抑制治疗。同年血肌酐升至722 μmol/L,进入腹膜透析治疗。9年余患者气促,先后2次胸部CT提示单侧(右)胸腔中-大量积液,胸水检查排除感染及肿瘤,结合患者无右颈内静脉置管病史,无上腔静脉阻塞体征,考虑为GVHD浆膜积液可能,予引流等对症并加用MP治疗后胸腔积液未再复发。此外,HSCT后2年始患者反复出现腹痛、排血性水样便,每次均在予MP免疫抑制治疗后好转,考虑为急性GVHD胃肠道受累。近1年来患者再次发作性血性水样便(图5),胃管引流出血性液体,胃镜(图6)及全腹部CT平扫未见明确占位病变等(图7),不排除胃肠道GVHD症状,经抑酸、护胃等对症治疗后好转。自此截至2022年5月,患者未再使用糖皮质激素及免疫抑制剂,目前处于维持性血液透析、长生存状态。
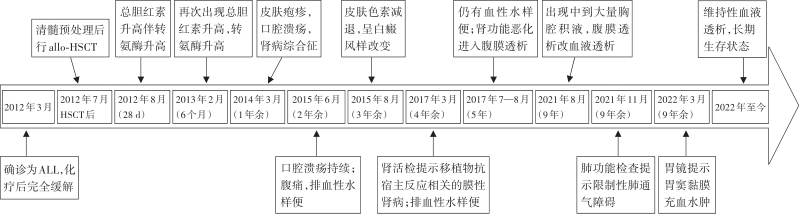

注:ALL:急性淋巴细胞白血病
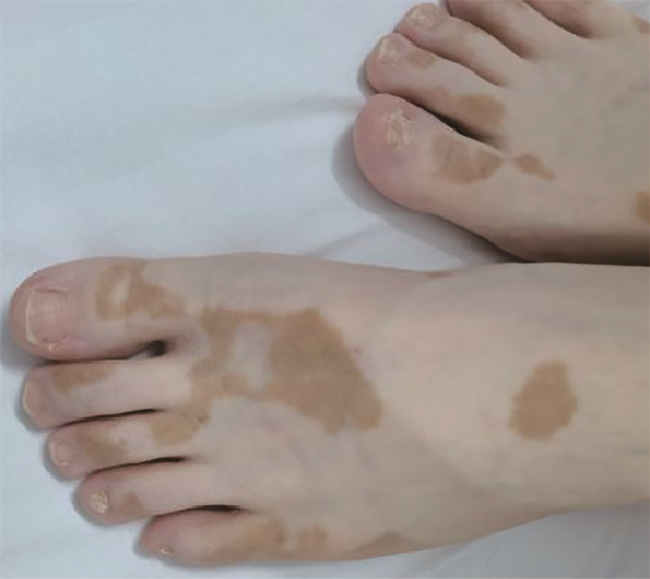

注:趾甲营养不良,甲浊、变黄,失去光泽,类似于甲真菌病样改变。全身皮肤色素减退,如足部皮肤,呈白癜风样改变
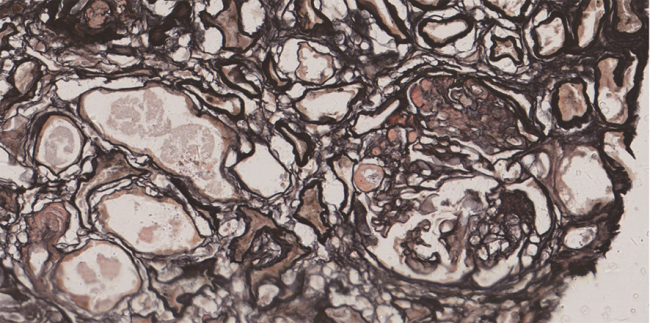

注:肾活检仅穿刺到1条肾组织,光镜提示以髓质为主,仅见1个硬化的肾小球。予冰冻荧光组织石蜡包埋后再次制片(PASM ×200):共见4个肾小球,其中3个球性硬化,1个节段硬化,残存球袢基底膜增厚伴上皮下嗜复红物沉积,可疑钉突形成。肾小管上皮细胞颗粒变性及空泡变性,多灶性及小片状小管萎缩(约60%),部分小管代偿性肥大,管腔扩张。肾间质多灶性及小片状纤维化伴小灶单个核细胞浸润,小动脉及细动脉结构尚好。免疫荧光:6个肾小球中3个球性硬化。IgG+~++(IgG1+、IgG4±),C3+,κ(±)、λ(±)弥漫性球性分布,颗粒状沉积于毛细血管壁;IgA、IgM、C1q、纤维蛋白原、IgG2、IgG3及磷脂酶A2受体均阴性。刚果红染色(-)


注:患者此时已处于尿毒症无尿状态,不支持尿液混入粪便。因患者一般情况较差,未能完善肠镜检查
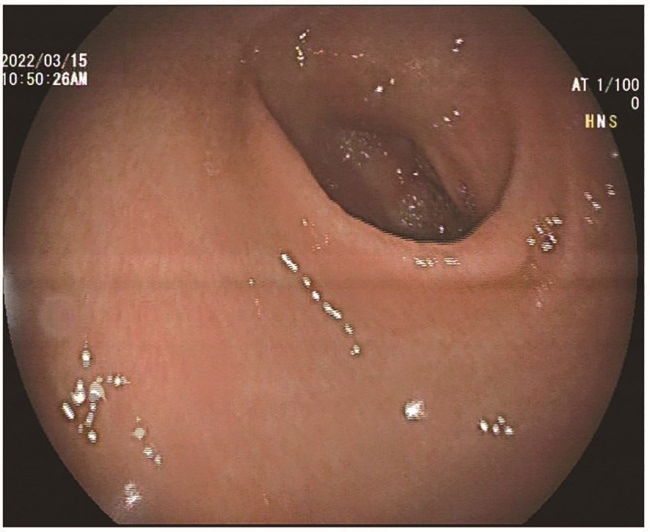

注:胃镜下胃窦黏膜充血水肿,黏膜损伤
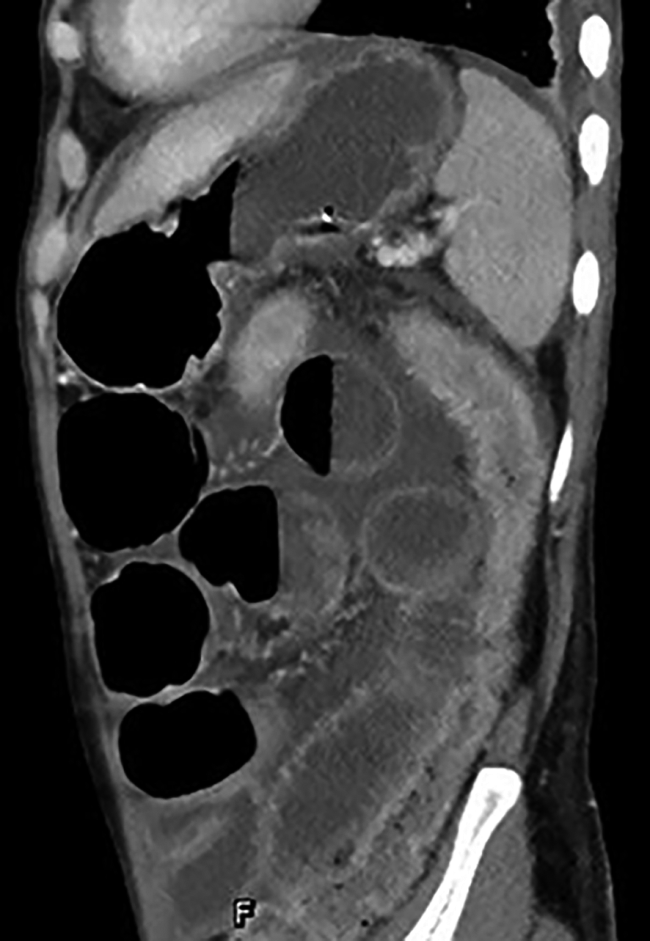

注:全腹部高分辨CT平扫提示,大小肠管肠壁均见增厚,小肠管内可见积气、积液,肠管扩张、多个气液平面,结肠大部分萎陷,类似不完全性肠梗阻表现
我们以GVHD、重叠综合征为关键词在PubMed、中国知网及中华医学期刊等数据库搜索中英文相关文献[4, 5, 6, 7, 8]并系统地复习及汇总,见表1。总结慢性GVHD重叠综合征特点如下:(1)以HSCT男受者女供者多见;HLA全相合HSCT后慢性GVHD的发病率也高。(2)在皮肤、口腔黏膜及眼睛受累等慢性GVHD症状基础上,出现高胆红素血症、墨绿色或血性水样便等急性GVHD症状,多出现在免疫抑制剂减停过程中,经强化免疫抑制后病情可控。GVHD急慢性症状可在同一器官中重叠存在。(3)GVHD肾损害表现为膜性肾病者也非少见。(4)预后方面:GVHD患者易合并感染,重症病例感染及死亡风险均高,预后不良。
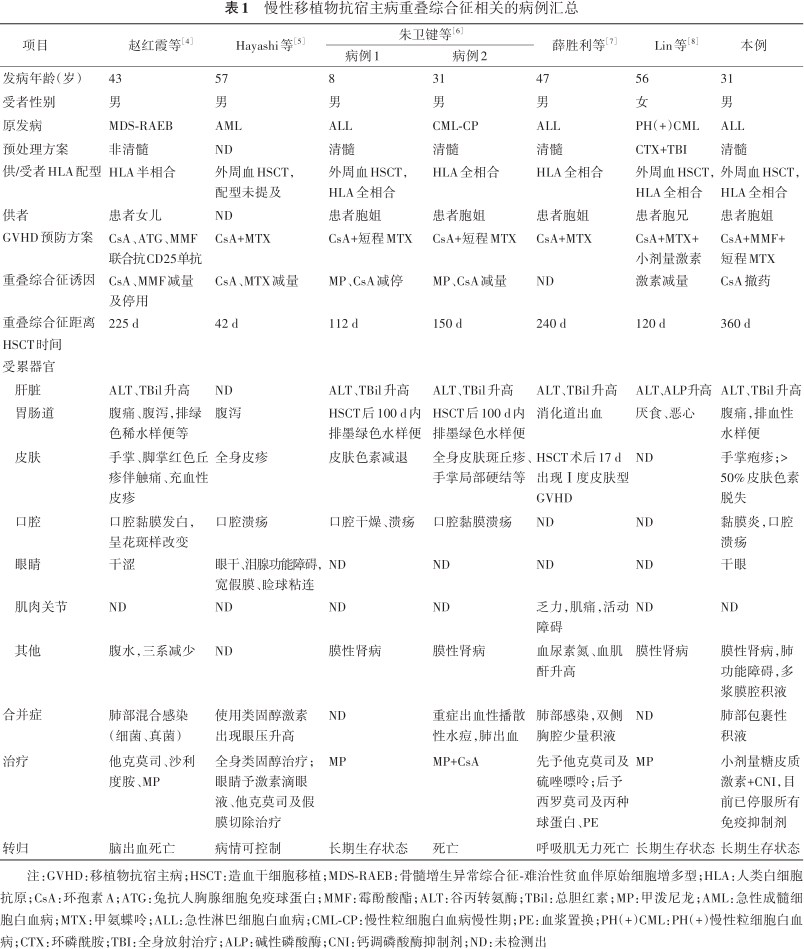
慢性移植物抗宿主病重叠综合征相关的病例汇总
慢性移植物抗宿主病重叠综合征相关的病例汇总
| 项目 | 赵红霞等[4] | Hayashi等[5] | 朱卫键等[6] | 薛胜利等[7] | Lin等[8] | 本例 | |
|---|---|---|---|---|---|---|---|
| 病例1 | 病例2 | ||||||
| 发病年龄(岁) | 43 | 57 | 8 | 31 | 47 | 56 | 31 |
| 受者性别 | 男 | 男 | 男 | 男 | 男 | 女 | 男 |
| 原发病 | MDS-RAEB | AML | ALL | CML-CP | ALL | PH(+)CML | ALL |
| 预处理方案 | 非清髓 | ND | 清髓 | 清髓 | 清髓 | CTX+TBI | 清髓 |
| 供/受者HLA配型 | HLA半相合 | 外周血HSCT, 配型未提及 | 外周血HSCT,HLA全相合 | HLA全相合 | HLA全相合 | 外周血HSCT, HLA全相合 | 外周血HSCT,HLA全相合 |
| 供者 | 患者女儿 | ND | 患者胞姐 | 患者胞姐 | 患者胞姐 | 患者胞兄 | 患者胞姐 |
| GVHD预防方案 | CsA、ATG、MMF 联合抗CD25单抗 | CsA+MTX | CsA+短程MTX | CsA+短程MTX | CsA+MTX | CsA+MTX+ 小剂量激素 | CsA+MMF+ 短程MTX |
| 重叠综合征诱因 | CsA、MMF减量 及停用 | CsA、MTX减量 | MP、CsA减停 | MP、CsA减量 | ND | 激素减量 | CsA撤药 |
| 重叠综合征距离HSCT时间 | 225 d | 42 d | 112 d | 150 d | 240 d | 120 d | 360 d |
| 受累器官 | |||||||
| 肝脏 | ALT、TBil升高 | ND | ALT、TBil升高 | ALT、TBil升高 | ALT、TBil升高 | ALT、ALP升高 | ALT、TBil升高 |
| 胃肠道 | 腹痛、腹泻,排绿 色稀水样便等 | 腹泻 | HSCT后100 d内排墨绿色水样便 | HSCT后100 d内排墨绿色水样便 | 消化道出血 | 厌食、恶心 | 腹痛,排血性水样便 |
皮肤 | 手掌、脚掌红色丘 疹伴触痛、充血性 皮疹 | 全身皮疹 | 皮肤色素减退 | 全身皮肤斑丘疹、手掌局部硬结等 | HSCT术后17 d 出现Ⅰ度皮肤型GVHD | ND | 手掌疱疹;>50%皮肤色素脱失 |
| 口腔 | 口腔黏膜发白, 呈花斑样改变 | 口腔溃疡 | 口腔干燥、溃疡 | 口腔黏膜溃疡 | ND | ND | 黏膜炎,口腔 溃疡 |
| 眼睛 | 干涩 | 眼干、泪腺功能障碍, 宽假膜、睑球粘连 | ND | ND | ND | ND | 干眼 |
| 肌肉关节 | ND | ND | ND | ND | 乏力,肌痛,活动 障碍 | ND | ND |
其他 | 腹水,三系减少 | ND | 膜性肾病 | 膜性肾病 | 血尿素氮、血肌 酐升高 | 膜性肾病 | 膜性肾病,肺功能障碍,多浆膜腔积液 |
| 合并症 | 肺部混合感染 (细菌、真菌) | 使用类固醇激素 出现眼压升高 | ND | 重症出血性播散性水痘,肺出血 | 肺部感染,双侧 胸腔少量积液 | ND | 肺部包裹性 积液 |
治疗 | 他克莫司、沙利 度胺、MP | 全身类固醇治疗; 眼睛予激素滴眼液、他克莫司及假膜切除治疗 | MP | MP+CsA | 先予他克莫司及 硫唑嘌呤;后予 西罗莫司及丙种 球蛋白、PE | MP | 小剂量糖皮质激素+CNI,目前已停服所有免疫抑制剂 |
| 转归 | 脑出血死亡 | 病情可控制 | 长期生存状态 | 死亡 | 呼吸肌无力死亡 | 长期生存状态 | 长期生存状态 |
注:GVHD:移植物抗宿主病;HSCT:造血干细胞移植;MDS-RAEB:骨髓增生异常综合征-难治性贫血伴原始细胞增多型;HLA:人类白细胞抗原;CsA:环孢素A;ATG:兔抗人胸腺细胞免疫球蛋白;MMF:霉酚酸酯;ALT:谷丙转氨酶;TBil:总胆红素;MP:甲泼尼龙;AML:急性成髓细胞白血病;MTX:甲氨蝶呤;ALL:急性淋巴细胞白血病;CML-CP:慢性粒细胞白血病慢性期;PE:血浆置换;PH(+)CML:PH(+)慢性粒细胞白血病;CTX:环磷酰胺;TBI:全身放射治疗;ALP:碱性磷酸酶;CNI:钙调磷酸酶抑制剂;ND:未检测出
慢性GVHD的诊断主要依靠临床征象,诊断标准[2]是异基因HSCT后至少1项慢性GVHD诊断性征象,或至少1项慢性GVHD的区分性征象伴同一或其他器官支持慢性GVHD的组织病理、实验室检查及肺功能检查等结果阳性。患者HSCT后出现皮肤色素脱失、病甲、口腔溃疡、口唇红白斑(图8)等多种慢性GVHD区分性征象,以及肺限制性通气功能不全、多浆膜腔积液、膜性肾病等,在慢性GVHD病程中反复出现高胆红素血症、血性水样便等急性GVHD表现,符合慢性GVHD重叠综合征诊断。


注:口唇有弥漫性、白色区域,上下唇均有红斑区域
慢性GVHD诊断的同时,尚需鉴别排除感染、药物及肿瘤等因素,必要时需行病理诊断[2]。第一,排除感染因素是诊断GVHD的首要条件。移植后患者一直处于免疫抑制状态,尤其在HSCT后1年内免疫抑制治疗强度高,严重感染风险增加。患者出现口腔黏膜炎时,需排查白色念珠菌和疱疹病毒等感染;出现血性水样便时,除排查常规感染外,注意排查艰难梭菌及巨细胞病毒等感染;进入腹膜透析后需排查腹膜透析相关感染。此外,患者HSCT后2年后丙型肝炎病毒抗体由阴性转阳性,该现象也见于Fujii等[9]的报道,肝炎病毒可能也参与了肝脏纤维化等发生。第二,药物因素影响。患者病情复杂,用药多样,需鉴别药物性肝损害、糖皮质激素相关消化道出血,MMF引起的腹泻、抗生素相关肠道菌群失调等。第三,肿瘤排查。患者先后多次行骨髓穿刺及胸水微小残留病灶检测以排查白血病复发,行口腔黏膜活检排查口腔癌,腹部CT提示肠道狭窄及肠壁增厚等慢性GVHD表现[10],行肿瘤标志物检测、内镜及全身PET-CT检查等排查肿瘤。
本例患者同时表现出多种发病率低的慢性GVHD临床征象,包括浆膜腔积液、膜性肾病、限制性肺通气障碍。患者在停用糖皮质激素后反复出现单侧胸腔积液,胸水微小残留病灶检测提示CD7+细胞占76.2%,CD7+ CD45+淋巴细胞占有核细胞75.7%,CD4∶CD8=71.0∶24.8。CD7+细胞是提示T细胞系分化成熟的早期标志,多表达于胸腺细胞、原始或幼稚淋巴细胞及多数成熟淋巴细胞,符合T细胞克隆,与文献报道[11, 12]的以CD8+ T细胞为主表现不一致;其伴血白细胞介素6进行性升高,与王清云等[11]的报道一致;在加强免疫抑制等治疗后胸腔积液未再复发,故考虑GVHD相关。另外,据Brukamp等[13]报道,GVHD相关肾损害中膜性肾病约占2/3,微小病变约占1/4,其发生与免疫抑制剂撤药密切相关。也有报道[14, 15]显示肾损害发生与干细胞来源有关,外周血干细胞移植者(24%)较骨髓移植者(3%)发病率高21%。患者大量蛋白尿与继发性膜性肾病相关,但其快速恶化的肾功能考虑是严重肾间质病变导致,与大剂量钙调磷酸酶抑制剂类药物的肾毒性相关。再有患者肺功能提示限制性通气功能障碍,胸部CT未见小气道增厚、小结节、支气管扩张及肺气肿等改变,考虑为非典型阻塞性肺缺损[16],属于闭塞性细支气管炎综合征的一种类型[17],其发生可能与CD4+ T细胞的寡克隆扩增、调节性T细胞减少以及白细胞介素17和白细胞介素8升高等有关[17]。
目前认为GVHD的发病机制[18]与早期炎性反应和组织、脏器内皮损伤相关,慢性GVHD靶器官损害与炎症、纤维化有关。本例患者存在的GVHD高危因素:男受者女供者、外周血造血干细胞移植及Ⅱ类HLA-DPB1(6号染色体的基因)不合。其中,前者与Randolph等[19]的研究结果一致,原因可能与针对Y染色体基因编码的受体次要组织相容性抗原的供体T细胞、GVHD不同的选择性抗白血病效应等有关。慢性GVHD是HSCT后的严重并发症,与晚期死亡密切相关,重叠综合征占慢性GVHD发病率的中位数为35.45%[20, 21, 22, 23],其5年GVHD相关生存率约为70.2%[22]。
对于GVHD的认识和诊疗尚需进一步深入理解。美国国立卫生研究院在2014年修订了GVHD的诊断标准[3]、严重程度评估以及疾病分类,探讨了其生物标志物[24]及亟需的临床研究设计[25]。2020年发布GVHD的高度病态表现形式报告[17],提出其表现可多样化及不典型,并且难以在有限的患者人群中开展临床试验。同时发布了目前临床实施如对高发病器官的发病率、预后因素、器官损害机制、临床演变,早期识别与治疗及干预时间点等提出要求。早期诊断的报告[26]提出抢先治疗的意义,但可能带来过度治疗风险及减弱移植物抗肿瘤效应等问题[27]。糖皮质激素联合或不联合钙调磷酸酶抑制剂类药物仍然是GVHD的一线治疗方案[2],但慢性GVHD的治疗重点将从广泛的免疫抑制转移到疾病病理生理学相关途径的靶向治疗等[28]。
综上所述,慢性GVHD重叠综合征临床表现多样,可典型或少见,易漏诊误诊,鉴别诊断很重要,必要时联合多学科诊治。本例患者提示HSCT后2年内表现为急性GVHD时糖皮质激素治疗效果好,2年后效果欠佳,加强免疫抑制治疗时需衡量获益及感染风险,加强随诊管理具有重要意义。
周燕霞, 罗升惠, 覃蔚璇, 等. 广泛型慢性移植物抗宿主病重叠综合征1例暨文献复习[J]. 中华肾脏病杂志, 2023, 39(11): 851-857. DOI: 10.3760/cma.j.cn441217-20230308-00313.
所有作者声明不存在利益冲突



























