
近年来,新生儿Fc受体(FcRn)抑制剂等新型生物制剂开始用于治疗自身免疫疾病,相较于传统免疫抑制剂,其具有起效快、高度选择性、不良反应少等优点,这使得自身免疫疾病患者有了更多、更好的选择。FcRn与IgG结合能够延长IgG半衰期,FcRn抑制剂通过靶向阻断二者结合,使得致病性IgG得以快速清除,达到减轻免疫损伤,缓解病情的效果。多个临床研究已证实了FcRn抑制剂对自身免疫疾病的疗效,但长期疗效尚待于更多的临床研究加以观察和验证。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自身免疫疾病是机体免疫系统功能异常导致自身组织被攻击损害的疾病,以免疫细胞活化和自身抗体过度产生为主要特征,该类疾病严重影响人类的身心健康,并带来了沉重的医疗负担。致病性IgG在该类疾病的发生、发展中发挥着重要作用,清除致病性IgG将对控制病情进展、改善预后方面产生重要影响[1],因此,靶向阻断新生儿Fc受体(neonatal Fc receptor,FcRn)介导的IgG再循环,加速致病性IgG降解将为该类疾病的治疗提供新选择。本文对FcRn抑制剂在自身免疫疾病中的临床研究进行梳理,以供临床医生参考。
以“自身免疫疾病”“免疫球蛋白G”“新生儿Fc受体”“FcRn抑制剂”“临床研究”“临床试验”“autoimmune diseases”“immunoglobulin G”“IgG”“FcRn”“FcRn inhibitors”“clinical trial”等作为主题/关键词/摘要,通过中国知网、万方、维普及 PubMed、Web of Science、Google Scholar数据库,检索国内外2023年6月前已发表的相关文献和资料,检索语种限定为中文和英文。根据已找到的资料总结FcRn抑制剂在多个学科自身免疫相关疾病治疗中的研究,并综述如下。
FcRn是一种位于细胞膜表面的Fc受体,主要在内皮上表达[2],发挥保护IgG免受溶酶体降解、延长其半衰期的功能。血液中的IgG通过胞吞作用进入细胞,并进入内体,在内体的酸性环境(pH<6)中与FcRn结合成复合物,然后被输送至细胞表面,在细胞外中性环境(pH≈7.2)中,IgG与FcRn解离,并进入血液中,如此反复循环,使得IgG具有超长的半衰期;在此过程中,那些未与FcRn结合的IgG将被转运至溶酶体中降解[2]。FcRn抑制剂通过特异性阻断内源性IgG与FcRn的结合,可使大量的致病性IgG被溶酶体降解清除,并消除了补体活化、内化等终末效应,从而达到治疗效果[3]。
FcRn抑制剂是近年来新兴并快速发展的新型生物制剂,主要包括工程化Fc片段、抗FcRn单克隆抗体和蛋白肽类等,CSL730是一种重组Fc多聚体,但因Ⅰ期研究缺乏临床可行性而终止;ABY039是一种肽模拟物,以pH依赖方式特异性结合FcRn,并融合到白蛋白结合域以延长半衰期,但考虑到可能存在的免疫原性而使得Ⅰ期研究提前终止。目前在研的FcRn抑制剂主要包括一种工程Fc受体和四种单克隆抗体,其中efgartigimod是人源化IgG1 Fc片段,在生理和酸性环境下对FcRn均具有较高的亲和力,同时保留了其特征性的pH依赖性结合;巴托利单抗(batoclimab,HBM9161)和nipocalimab是全人源化IgG1型单克隆抗体;rozanolixizumab和SYNT001(ALXN1830)是人源化IgG4型单克隆抗体。上述FcRn抑制剂在酸性和中性环境下对FcRn均具有高亲和力,特异性地与FcRn上的IgG结合位点结合,进而阻断FcRn与内源性IgG结合,加快内源性IgG的清除。
目前,FcRn抑制剂已在神经系统、血液系统、皮肤病等系统相关自身免疫疾病中开展临床研究[4],其中efgartigimod和rozanolixizumab已被FDA批准用于治疗成人全身型重症肌无力患者[5, 6]。本课题组已发表了FcRn抑制剂在神经系统自身免疫性疾病中研究的相关文章[7, 8]。因此,本文在此主要介绍FcRn抑制剂在原发免疫性血小板减少性紫癜、天疱疮等非神经系统自身免疫疾病中的临床研究进展(表1、2)。
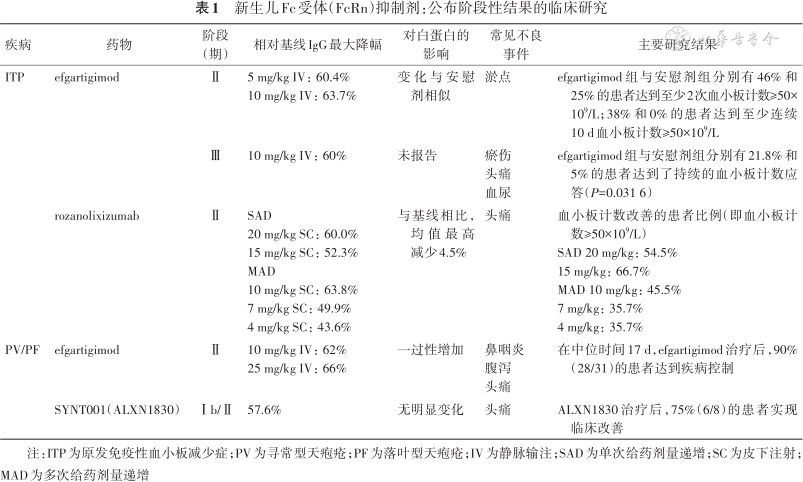
新生儿Fc受体(FcRn)抑制剂:公布阶段性结果的临床研究
新生儿Fc受体(FcRn)抑制剂:公布阶段性结果的临床研究
| 疾病 | 药物 | 阶段(期) | 相对基线IgG最大降幅 | 对白蛋白的影响 | 常见不良事件 | 主要研究结果 |
|---|---|---|---|---|---|---|
| ITP | efgartigimod | Ⅱ | 5 mg/kg IV:60.4%10 mg/kg IV:63.7% | 变化与安慰剂相似 | 淤点 | efgartigimod组与安慰剂组分别有46%和25%的患者达到至少2次血小板计数≥50×109/L;38%和0%的患者达到至少连续10 d血小板计数≥50×109/L |
| Ⅲ | 10 mg/kg IV:60% | 未报告 | 瘀伤头痛血尿 | efgartigimod组与安慰剂组分别有21.8%和5%的患者达到了持续的血小板计数应答(P=0.031 6) | ||
| rozanolixizumab | Ⅱ | SAD 20 mg/kg SC:60.0%15 mg/kg SC:52.3%MAD10 mg/kg SC:63.8%7 mg/kg SC:49.9%4 mg/kg SC:43.6% | 与基线相比,均值最高减少4.5% | 头痛 | 血小板计数改善的患者比例(即血小板计数≥50×109/L) SAD 20 mg/kg:54.5% 15 mg/kg:66.7% MAD 10 mg/kg:45.5% 7 mg/kg:35.7% 4 mg/kg:35.7% | |
| PV/PF | efgartigimod | Ⅱ | 10 mg/kg IV:62%25 mg/kg IV:66% | 一过性增加 | 鼻咽炎腹泻头痛 | 在中位时间17 d,efgartigimod治疗后,90%(28/31)的患者达到疾病控制 |
| SYNT001(ALXN1830) | Ⅰb/Ⅱ | 57.6% | 无明显变化 | 头痛 | ALXN1830治疗后,75%(6/8)的患者实现临床改善 |
注:ITP为原发免疫性血小板减少症;PV为寻常型天疱疮;PF为落叶型天疱疮;IV为静脉输注;SAD为单次给药剂量递增;SC为皮下注射;MAD为多次给药剂量递增
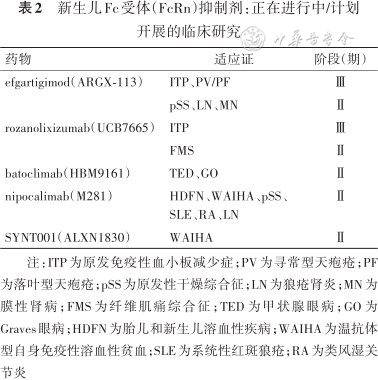
新生儿Fc受体(FcRn)抑制剂:正在进行中/计划开展的临床研究
新生儿Fc受体(FcRn)抑制剂:正在进行中/计划开展的临床研究
| 药物 | 适应证 | 阶段(期) |
|---|---|---|
| efgartigimod(ARGX-113) | ITP、PV/PF | Ⅲ |
| pSS、LN、MN | Ⅱ | |
| rozanolixizumab(UCB7665) | ITP | Ⅲ |
| FMS | Ⅱ | |
| batoclimab(HBM9161) | TED、GO | Ⅱ |
| nipocalimab(M281) | HDFN、WAIHA、pSS、SLE、RA、LN | Ⅱ |
| SYNT001(ALXN1830) | WAIHA | Ⅱ |
注:ITP为原发免疫性血小板减少症;PV为寻常型天疱疮;PF为落叶型天疱疮;pSS为原发性干燥综合征;LN为狼疮肾炎;MN为膜性肾病;FMS为纤维肌痛综合征;TED为甲状腺眼病;GO为Graves眼病;HDFN为胎儿和新生儿溶血性疾病;WAIHA为温抗体型自身免疫性溶血性贫血;SLE为系统性红斑狼疮;RA为类风湿关节炎
1.原发免疫性血小板减少性紫癜(primary immune thrombocytopenic,ITP):ITP是由抗体介导的血小板破坏、合并血小板生成障碍引起的疾病,是儿童和成人血小板减少的一个罕见原因,特征是血小板计数低(<100 × 109/L),临床表现通常为出血和(或)瘀伤[9]。ITP的发病机制主要是自身抗体和细胞毒性T细胞(CD8+T细胞)介导抗血小板反应,导致血小板清除加快及CD8+T细胞靶向骨髓巨核细胞抑制血小板生成[9, 10],导致体内血小板含量降低。(1)efgartigimod:Ⅰ期临床研究中,单次输注efgartigimod可使健康志愿者的IgG水平降低50%,而多次给药可使IgG降低75%,在末次给药后约8周,受试者IgG水平才恢复到基线水平[11]。一项efgartigimod治疗ITP安全性和有效性的随机、双盲、安慰剂对照的Ⅱ期临床研究结果显示:efgartigimod可诱导总IgG水平快速降低,与基线水平相比,5 mg/kg组和10 mg/kg组中IgG水平最大降低值分别为60.4%和63.7%,而安慰剂组没有明显改变[12]。血小板计数增加与IgG水平降低具有临床相关性,在至少连续10 d内,efgartigimod组中38%患者达到血小板计数≥50×109/L,而安慰剂组为0%。同时,efgartigimod降低了患者的出血事件发生率,其安全性和耐受性与之前的Ⅰ期研究结果相似[12]。efgartigimod是全球首个获批临床应用的FcRn抑制剂,在第64届美国血液学学会年会上以口头报告的形式公布了其治疗ITP的全球Ⅲ期研究结果。研究达到了主要终点,efgartigimod组21.8%的患者达到了持续的血小板计数应答,而安慰剂组仅为5%(P=0.031 6)[13],其中持续血小板计数应答被定义为:在第19~24周的6次随访中至少有4次血小板计数达到≥50×109/L。此外,该研究也达到了相关的次要研究终点;观察到的安全性和耐受性数据与Ⅰ期和Ⅱ期研究一致。一项评估皮下注射(subcutaneous,SC)efgartigimod治疗原发性ITP安全性和有效性的Ⅲ期临床研究(NCT04687072)已经启动。上述研究结果将为efgartigimod用于ITP患者的治疗开启希望之门,拓宽其应用范围和领域。(2)rozanolixizumab:在Ⅰ期临床研究中rozanolixizumab可降低健康志愿者的血清IgG水平[14];治疗ITP的Ⅱ期临床研究也取得了积极的阳性结果,该研究是一项多中心、随机、双盲、安慰剂对照研究,共纳入66例持续性或慢性原发性ITP患者,随机分为单剂量组(20 mg/kg和15 mg/kg)和多剂量组(2×10 mg/kg、3×7 mg/kg和5×4 mg/kg),来评价rozanolixizumab的安全性、耐受性及疗效[15]。结果显示,单剂量组和多剂量组均观察到血小板计数的改善(血小板计数≥50×109/L)和IgG水平的显著降低。相较于多剂量组而言,单剂量组在改善血小板效应方面有几个优势:首先,单剂量组中更多患者血小板计数得以改善,在15 mg/kg组和20 mg/kg组中分别有66.7%和54.5%的患者血小板计数得以改善,而在10 mg/kg组、7 mg/kg组和4 mg/kg组分别是45.5%、35.7%和35.7%;其次,单剂量组的血小板计数上升速度较多剂量组更快,达到最大平均血小板计数,单剂量组需要8 d,而多剂量组则至少需要11 d。然而,虽然单剂量组起效更快,但反应持续时间却不如多剂量组持久,20 mg/kg组和15 mg/kg组的反应持续中位时间分别为10 d和12 d;4 mg/kg组则为35 d[15],可能是重复给药不仅减少了血小板破坏,同时还增加了血小板生成。如果未来的研究能够证明重复输注rozanolixizumab可安全地维持血小板计数,这种治疗方法将来可能会用于针对不同阶段ITP患者。研究中未观察到IgA、IgM、IgE和白蛋白水平有临床意义的变化。rozanolixizumab的安全性和耐受性良好,不良事件(adverse event,AE)一般为轻至中度,最常见的AE是头痛,这与Ⅰ期研究结果一致[14]。单剂量组在血小板计数增加和IgG减少方面都显示出较短的起效时间,这为其在ITP中的针对性应用提供了可能,比如,用于急需在1周内升高血小板的ITP患者。这些安全性、耐受性、疗效和药效学数据为正在进行的原发性ITP患者维持治疗的Ⅲ期临床研究(NCT04596995)提供了强有力的支撑。
2.胎儿及新生儿溶血性疾病(hemolytic disease of the fetus and newborn,HDFN):HDFN是因母婴血型不合引起母体IgG型同种免疫性红细胞抗体进入胎儿体内,作用于胎儿及新生儿红细胞,导致胎儿及新生儿溶血[16]。研究证实,FcRn介导了IgG的胎盘转运过程[17]。因此,FcRn抑制剂既可以抑制致病性IgG转运至胎儿体内,还可以清除IgG,进一步降低母体循环中致病性抗体的浓度。Ⅰ期临床研究结果显示,nipocalimab可降低健康志愿者的血清IgG水平,同时具有良好的安全性和耐受性[18]。旨在评估nipocalimab的安全性和有效性的Ⅱ期临床研究(NCT03842189)正在HDFN高风险孕妇中招募受试者。
3.温抗体型自身免疫性溶血性贫血(warm antibody autoimmune hemolytic anemia,WAIHA):自身免疫性溶血性贫血主要是因为机体免疫功能紊乱形成自身红细胞抗体,并和红细胞表面相应抗原结合,伴或不伴补体激活,导致红细胞过早被破坏所致[19]。临床表现主要为贫血、黄疸和脾大。其中WAIHA约占80%以上,是最常见的类型[19],FcRn抑制剂在WAIHA中的临床研究尚处于起步阶段,评估SYNT001在WAIHA患者中的安全性和耐受性的Ⅰb期临床研究(NCT03075878)已经完成,结果尚未公布。nipocalimab在成人WAIHA中开展的一项多中心、随机、双盲、安慰剂对照、长期开放标签扩展的Ⅱ期临床研究(NCT04119050)已经启动,旨在评价nipocalimab在WAIHA的疗效和安全性。研究主要终点是达到血红蛋白持久改善的参与者的百分比,该研究目前处于招募状态。
Graves眼病(Graves ophthalmopathy,GO)是一种自身免疫疾病,其特征是眼眶炎症和眶后组织增生。促甲状腺激素受体抗体,与眼眶组织中的免疫应答有关,另外T细胞通过产生各种细胞因子与眼眶成纤维细胞相互作用,导致眼眶炎症的持续存在[20, 21]。巴托利单抗在健康中国受试者的Ⅰ期临床研究中显示了良好的安全性、耐受性,而且血清IgG呈持续的、剂量依赖性的降低[22]。但一项评估不同剂量巴托利单抗治疗GO患者安全性和有效性的Ⅱb期临床研究中,低密度脂蛋白在680 mg组中平均升高了约65%,在340 mg组中平均升高了约40%,在对照组中没有升高。虽然出于安全考虑,2021年2月研究方宣布自愿中止巴托利单抗在GO中的临床研究[23],但是,2021年6月研究方又开始进行低剂量的巴托利单抗在GO中的临床研究(NCT03922321)。巴托利单抗在GO的安全性和有效性还需在后续的临床研究中加以探索。
1.类风湿关节炎(rheumatoid arthritis,RA):RA是一种慢性、炎症性的自身免疫性关节疾病,主要临床表现是多发性、对称性、侵袭性关节内炎症。RA的主要病理特征表现为关节腔滑膜增生、衬里层增厚、血管翳形成以及多种炎症细胞的浸润,继而引起软骨和骨组织的破坏,最终导致关节畸形和功能的丧失[24]。RA的确切病因尚不清楚,但目前认为抗瓜氨酸蛋白抗体和类风湿因子在诱发免疫反应中发挥着重要作用[24, 25]。一项评价nipocalimab在中度至重度活动性RA患者中的疗效和安全性的Ⅱ期临床研究(NCT04991753)已经完成,目前正在进行数据分析和结果评估,相关结果尚未发布。
2.系统性红斑狼疮(systemic lupus erythematosus,SLE):SLE是一种以多系统受累的慢性自身免疫疾病,临床表现复杂,从轻微的皮肤黏膜受损到多器官和严重的中枢神经系统受累都可能发生。主要致病机制是患者体内产生自身抗体,形成抗原抗体免疫复合物,沉积于皮肤、血管、肾脏、神经系统等处,进而引起多脏器损伤[26]。我国SLE的发病率为(30~37)/10万[26],发病率呈逐年上升趋势。评价nipocalimab在活动性SLE患者中的疗效和安全性的Ⅱ期临床研究(NCT04882878)正在进行相关的招募工作。主要研究终点是第24周SLE应答指数4(systemic lupus erythematosus responder index 4,SRI-4)的应答率。
3.原发性干燥综合征(primary Sjögren′s syndrome,pSS):pSS是一种以淋巴细胞增殖及进行性外分泌腺体损伤为特征的慢性炎症性自身免疫疾病,患者血清中存在多种自身抗体,如抗核抗体、抗SSA抗体、抗Ro52抗体等[27]。主要临床表现口干、眼干,也可能伴有皮肤、肌肉、呼吸、消化等系统受累的全身症状。在我国人群的患病率为0.33%~0.77%[27]。efgartigimod、nipocalimab在pSS患者中开展的Ⅱ期临床研究(NCT05817669、NCT04968912)仍处于招募阶段,研究旨在评价上述FcRn抑制剂在pSS治疗中的疗效和安全性。
4.纤维肌痛综合征(fibromyalgia syndrome,FMS):FMS又称纤维肌痛症,是以慢性弥漫性疼痛、睡眠障碍、疲劳和认知障碍为核心症状,常伴有身体僵硬、感觉异常等躯体症状和焦虑、抑郁等心理症状的一种疾病[28]。本病目前尚无明确的发病机制,但多数研究认为,FMS发病可能与氧化应激、中枢神经致敏、NMDA受体过度激活、炎症介导、遗传等因素有关。FMS的发病率为1.3%~8%,是第二大风湿性疾病,严重影响患者的生活质量[29]。一项旨在评价rozanolixizumab在严重FMS患者的有效性和安全性的Ⅱa期临床研究(NCT05643794)正在进行相关招募工作,主要研究终点是治疗12周后简明疼痛评估量表平均干扰评分。
1.狼疮肾炎(lupus nephritis,LN):LN是SLE的一种常见并发症,约有50%的SLE患者会发生肾脏损伤,主要表现为蛋白尿、镜下血尿、管型尿和肾功能受损等[30]。LN主要是由于免疫复合物沉积于肾小球毛细血管襻,免疫复合物通过激活补体而引起炎症反应和肾脏损伤[30]。一项旨在评价efgartigimod在中国活动性LN患者的疗效和安全性的Ⅱ期临床研究(NCT05810948)正在进行相关招募工作,主要研究终点是第24周的尿蛋白肌酐比值(urine protein creatinine ratio,UPCR)较基线的变化。此外,评估nipocalimab在活动性LN患者中的疗效的Ⅱ期临床研究(NCT04883619)拟启动,主要研究终点是第52周达到完全肾反应(complete renal response,CRR)的受试者百分比。
2.膜性肾病(membranous nephropathy,MN):MN是一种自身免疫疾病,其特征是免疫复合物在肾小球基底膜沉积并伴随有肾小球基底膜的增厚,主要表现为蛋白尿、低白蛋白血症、高脂血症和水肿等[31]。致病机制主要由自身抗体驱动,这些自身抗体与足细胞膜表面的一种或多种抗原结合后激活补体,导致足细胞损伤,破坏肾小球滤过屏障,引起蛋白尿等临床表现,其中磷脂酶A2受体(phospholipase A2 receptor,PLA2R)是主要的靶抗原[31, 32]。一项旨在评价efgartigimod在中国原发性MN患者的疗效和安全性的Ⅱ期临床研究(NCT05810961)正在进行相关招募工作,主要研究终点是第24周抗PLA2R抗体阳性人群的UPCR较基线的变化情况。
寻常型天疱疮(pemphigus vulgaris,PV)和落叶型天疱疮(pemphigus foliaceus,PF)是一组由致病性自身抗体介导的罕见的自身免疫性水疱性皮肤病,主要由两种抗桥粒芯糖蛋白(desmoglein,Dsg)1、3抗体导致表皮细胞间的连接破坏,出现水疱、大疱[33, 34]。PV主要由抗Dsg-3抗体引起,该蛋白与黏膜损伤相关,一部分病例也与抗Dsg-1抗体有关,该蛋白和皮肤损伤相关。PF是由抗Dsg-1抗体引起的,病变仅限于皮肤[33]。
1.efgartigimod:一项纳入34例轻、中度PV或PF患者的多中心Ⅱ期研究,静脉给予10 mg/kg或25 mg/kg efgartigimod与泼尼松联合治疗,长达34周的研究显示,efgartigimod在保持良好安全性和耐受性的同时也具有持久的临床益处[35]。efgartigimod可以显著降低血浆IgG水平和致病性抗体水平,在第29天,10 mg/kg和25 mg/kg组血浆IgG水平下降的中位百分比分别是62%和66%;在诱导期结束时,血浆抗Dsg-1抗体和抗Dsg-3抗体水平下降的中位百分比分别是61%和49%[35]。值得注意的是,与总IgG水平相比,致病性抗体被抑制时间更长,在无治疗随访期,IgG水平恢复正常,但抗Dsg-1抗体和抗Dsg-3抗体水平较基线水平下降的中位百分比分别是70%、42%。efgartigimod在控制疾病活动和改善预后方面有积极影响,在诱导期结束时,10 mg/kg组和25 mg/kg组的天疱疮面积指数评分(pemphigus disease area index,PDAI)下降的中位百分比分别是75%和52%;在中位时间17 d,90%(28/31)患者实现了疾病控制(没有新的病变和已有的病变开始愈合)[35]。efgartigimod不仅可实现天疱疮的早期疾病控制,也为激素早期减量提供了条件。efgartigimod联合泼尼松治疗,泼尼松的中位剂量为0.26 mg/kg时,64%的患者在2~41周内获得临床完全缓解[35]。此外,在二次分析中发现,接受efgartigimod治疗的天疱疮患者体内观察到持续的免疫应答、自身抗体和循环免疫复合物抑制及Dsg-1和Dsg-3抗原特异性B淋巴细胞减少,说明efgartigimod除直接清除致病性抗体外,还具有免疫调节功能、促进免疫稳态恢复的作用[36]。研究表明,efgartigimod是治疗天疱疮的一种极具潜力的药物。然而,该研究具有一定的局限性,比如样本量小、缺乏安慰剂对照和事后分析,治疗期和治疗后随访均比较短,今后还需要样本量更大的随机对照研究来进一步探索其疗效和安全性。efgartigimod用于治疗天疱疮的Ⅲ期临床研究(NCT04598451)正在进行中,其结果将会提供更多的研究证据。
2.SYNT001(ALXN1830):Ⅰ期临床研究中可降低健康志愿者血浆中的IgG和抗原抗体复合物(IgG immune complex,IgG-IC)水平[37]。研究ALXN1830在天疱疮患者中的安全性、耐受性以及疗效的Ⅰb/Ⅱ期临床研究中纳入了8例患者,静脉注射ALXN1830 10 mg/kg,只有4例患者完成了112 d的随访期,另外4例患者在完成治疗后因病情原因退出,该研究已经终止[38]。研究结果显示,ALXN1830降低了血浆IgG和IgG-IC水平,与基线相比,总IgG和IgG-IC水平下降的中位百分比分别是57.6%和55.6%。同时也降低了致病性抗体水平,在第33天,抗Dsg-1抗体和抗Dsg-3抗体水平下降的中位百分比分别是26.3%和5.7%,且抗Dsg-1抗体的减少与PDAI的改善相关(r=0.787 1,P=0.037 5)[38]。ALXN1830在控制疾病活动、改善临床症状方面也有一定的作用,8例患者中有6例出现了临床改善,在这6例改善患者中,第33天的PDAI较基线水平下降的中位百分比是39.64%,其中有4例患者在长达84 d的随访期中保持了疗效,表明ALXN1830在维持治疗方面有很大潜力。最常见的AE是头痛,一般为轻至中度,且未观察到白蛋白、IgA、IgM水平下降[38]。然而,该研究存在样本量太小、缺乏安慰剂对照等局限性,未来还需要在较大群体中开展进一步的研究来探索ALXN1830治疗天疱疮的疗效和安全性。
FcRn抑制剂具有安全性及耐受性良好、起效快速、疗效确切、不良反应少等特点,在自身免疫疾病中的治疗中有着良好的治疗潜力和广阔的应用前景。然而,作为新型生物制剂的FcRn抑制剂在使用过程中仍存在一些亟待关注的问题。
1.感染风险:虽然在FcRn抑制剂应用过程中未报道过与药物治疗相关的严重感染事件,但是,目前开展的研究样本量相对较小,研究持续的时间相对较短,因此,今后还需在更大群体中进行长期观察研究加以验证。
2.白蛋白水平变化:多数FcRn抑制剂会造成血清白蛋白水平轻度至中度降低,虽然这种无症状的降低在停药后可自行恢复,但这一变化可能会影响白蛋白结合率高的药物的血清水平以及血脂水平等[39]。由此可能造成的影响尚需在今后的研究中加以关注和明确。
3.复发:efgartigimod用于治疗天疱疮的Ⅱ期临床研究中,39%的患者出现复发,其中主要在≥2周的延长给药间隔期间观察到,而每周接受efgartigimod给药的患者未观察到复发[35],提示每周给药的维持治疗可能有助于防止复发,今后尚需探索FcRn抑制剂治疗过程中关于最佳的给药间隔和停药时机。
4.长期疗效:目前的Ⅱ期/Ⅲ期临床研究结果存在样本量小、治疗期短、随访期短等局限性,FcRn抑制剂长期疗效和安全性还需要在长期的临床研究中加以探究和验证。
5.应用领域的扩展:近年来在肿瘤等疾病的治疗中,靶向免疫治疗成为一种新的趋势。在此治疗过程中,IgG抗体长时间作用导致的免疫损伤不可避免,FcRn抑制剂可用于清除多余的IgG抗体,减少机体的免疫损伤。这将是又一个很有意义和值得关注的研究方向。
总之,现有的研究显示,FcRn抑制剂在自身免疫疾病的治疗中显示了良好的疗效和安全性,相信随着更多临床研究证据的获得,FcRn抑制剂治疗有望成为一种强有力自身免疫性疾病的治疗手段。另外,随着越来越多的疾病开始应用靶向免疫治疗,随之而来的免疫损伤将不可避免。清除多余的IgG抗体,减少相关的免疫损伤,FcRn抑制剂也将大有用武之地。
朱丽娜, 唐窈, 王赛, 等. FcRn抑制剂在自身免疫疾病中的临床研究进展[J]. 中华医学杂志, 2023, 103(43): 3501-3506. DOI: 10.3760/cma.j.cn112137-20231005-00635.
所有作者声明不存在利益冲突



























