
评价四价流感病毒亚单位疫苗在≥3岁人群中接种后的免疫原性和安全性。
采用随机、盲法、阳性对照的设计开展Ⅲ期临床试验,于2020年5月至2021年8月,在河南省开封市祥符区和濮阳县招募符合标准的≥3岁健康居民为受试者,共3 000名,按1∶1比例随机接种四价流感病毒亚单位疫苗(试验组)或已上市的四价流感病毒裂解疫苗(对照组),≥9岁受试者全程接种1剂,3~8岁受试者全程接种2剂(间隔28 d)。所有受试者采集首剂免疫前及免疫后28 d的血样进行流感病毒血凝抑制抗体(HI)检测,计算抗体几何平均滴度(GMT)、几何平均增长倍数(GMI)、阳性率、阳转率,并对试验组和对照组各型抗体GMT比值和阳转率率差进行非劣效比较。收集接种后30 d内的不良反应和6个月内的严重不良事件,比较两组间差异。
3 000名受试者中男性为1 504名(50.13%)。所有受试者接种1剂流感疫苗免疫后28 d,试验组与对照组H1N1、H3N2、BV和BY 4种血清型抗体GMT(95%CI)分别为400.54(377.27~425.25)比333.39(315.47~352.33)、438.38(412.57~465.81)比385.00(362.13~409.32)、77.31(73.06~81.82)比67.62(63.94~71.51)、266.52(250.99~283.01)比180.26(169.99~191.17)(均P<0.05),4种血清型抗体阳转率(95%CI)分别为82.73%(80.70%~84.62%)比78.56%(76.39%~80.62%)、91.23%(89.67%~92.62%)比89.25%(87.56%~90.78%)、84.89%(82.96%~86.67%)比80.98%(78.89%~82.95%)、88.33%(86.58%~89.92%)比81.92%(79.87%~83.85%),除H3N2外,差异均有统计学意义(均P<0.05)。试验组和和对照组4种血清型抗体GMT比值的95%CI下限均>2/3、阳转率率差的95%CI下限均>-10%,与对照疫苗相比,试验疫苗免疫原性达到了非劣效标准。试验组阳转率95%CI的下限均>40%,阳性率95%CI下限均>70%、GMI均>2.5,试验疫苗免疫原性达到了绝对标准。所有受试者接种1剂流感疫苗免疫后30 d内,试验组和对照组总不良反应发生率分别为10.67%(160例)和11.21%(168例),其中18~64岁受试者试验组和对照组总不良反应发生率分别为6.29%(22例)和10.86%(38例)(P<0.05);不良反应主要症状包括疫苗接种部位疼痛和发热,不良反应严重程度以1、2级为主,试验组和对照组均未发生严重不良反应。
四价流感病毒亚单位疫苗应用于≥3岁人群具有更好的免疫原性和较好的安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
流感是由流感病毒引起的呼吸道传染病,流感病毒的抗原具有易变性,且传播迅速,季节性流感每年都会发生,根据世界卫生组织(World Health Organization,WHO)估计,流感在全球每年可导致300万~500万的重症和29万~65万呼吸道疾病相关死亡[1],对人类健康危害较为严重。流感病毒可分为A、B、C、D等4个类型,引起季节性流感的类型是A 型中的H1N1和H3N2亚型和B型中的Victoria和Yamagata系[2]。每年接种流感疫苗可以有效预防流感,自2001—2002流行季以来,2种不同的B型流感一直合并流行,出现疫苗成分与流行毒株不匹配的情况,原有的三价流感疫苗的有效性显著下降[3],鉴于此,自2013—2014年北半球流感流行季起,WHO开始推荐四价疫苗组合以期达到更好的保护效果[4]。我国现已批准上市的四价流感疫苗均为裂解疫苗,亚单位疫苗与之相比,抗原纯度更高,具有更好的安全性[5]。江苏中慧元通生物科技股份有限公司研制的四价流感病毒亚单位疫苗的上市申请,首个获得国家药品监督管理局批准,本研究就四价流感病毒亚单位疫苗在3岁及以上人群接种的免疫原性和安全性的研究结果报告如下。
1. 样本量计算:采用随机、盲法、同类疫苗阳性对照的设计,符合条件的受试者采用随机数字表法按1∶1分入试验组和对照组。
假定试验组首剂免疫后28 d 4种型别HI抗体阳转率为55%~79%,抗体滴度的标准差为0.40~0.65(对数尺度),且抗体阳转率和几何平均滴度(geometric mean titer,GMT)均达到非劣效。对两个假设分别检验,抗体阳转率和GMT均达到非劣效即认为研究假设成立,此时对α进行校正,校正后的α=0.025/2=0.012 5,由于有4个血清型,对β进行校正,β=(1-0.9)/4=0.025,Δ=-0.10(非劣效性界值),使用NCSS-PASS软件计算样本量。取两种算法中较大者,同时考虑免疫前抗体对免疫后抗体阳转率的影响以及可能存在的失访,计划试验组和对照组各入组1 500名,共需入组3 000名。老年人和儿童预期免疫反应弱于青少年和成人,≥65和3~8岁试验组和对照组各入组400名,9~17和18~64岁试验组和对照组各入组350名。
2. 研究对象:2020年5月至2021年8月,在河南省开封市祥符区和濮阳县招募符合标准的健康居民为受试者。纳入标准:(1)≥3岁常住健康人群;(2)本人、监护人、被委托人知情同意,自愿参加并签署知情同意书。排除标准:(1)接种前腋下体温>37.0 ℃;(2)3~8岁人群接种过流感疫苗;(3)≥9岁人群过去1年内接种过流感疫苗;(4)过去1年内有流感病毒感染史;(5)先天畸形或发育障碍、遗传缺陷、严重营养不良等。本研究共筛查4 058名受试者,最终纳入3 000名受试者。
本研究经河南省疾病预防控制中心医学伦理委员会批准(批号:2019-YM-003-02),以知情同意、自愿参加为原则,由受试者本人、监护人、被委托人签署书面知情同意书。
1. 接种疫苗:试验组疫苗为中慧元通生物科技股份有限公司生产的四价流感病毒亚单位疫苗,对照组疫苗为华兰生物疫苗股份有限公司生产的四价流感病毒裂解疫苗。每支疫苗0.5 ml,含各型流感病毒株血凝素为15 μg。以上疫苗均经中国食品药品检定研究院检定合格,均在2~8 ℃条件下运输和保存,在有效期内使用。
2. 接种方法及免疫程序:于上臂外侧三角肌附着处皮肤,消毒后肌肉注射1剂试验疫苗或对照疫苗。疫苗使用前应充分摇混匀。≥9岁各年龄组受试者全程接种1剂,3~8岁组受试者全程接种2剂(间隔28 d)。
3. 免疫原性观察:所有受试者采集接种前、接种后28 d的血样,每次约3.0 ml,分离血清,送中国食品药品检定研究院,采用微量血凝抑制试验方法进行各亚型流感病毒HI抗体检测。计算抗体阳性率、阳转率、GMT和几何平均增长倍数(geometric mean increase,GMI)。以1∶10血清为最低稀释度,接种前HI抗体<1∶10、接种后HI抗体滴度≥1∶40为阳转,或接种前HI抗体≥1∶10、接种后HI抗体滴度4倍增长为阳转;接种后HI抗体滴度≥1∶40即视为阳性。
4. 安全性观察:所有受试者接种疫苗后采用定期随访与主动报告相结合的方式,将接种后30 min内、0~28(或30)d内不良事件发生率及接种后6个月内严重不良事件(severe adverse event,SAE)发生情况作为安全性终点。疫苗接种后所有不良事件按《预防用疫苗临床试验不良反应分级标准指导原则(2019年版)》进行分级判定,并评估与疫苗的相关性。本文安全性主要讨论与疫苗相关的不良事件,即不良反应。
5. 相对标准[6]:如果1剂接种后4种型别HI抗体试验组GMT/对照组GMT的95%CI下限≥2/3且试验组和对照组阳转率差值的95%CI下限≥-10%,则认为试验疫苗非劣效于对照疫苗。免疫原性绝对标准[7]:1剂接种后:(1)抗体阳转率95%CI下限≥40%;(2)抗体阳性率95%CI下限≥70%;(3)GMI≥2.5。
病例报告表录入到电子数据捕获系统(electronic data capture,EDC),导出数据库,采用SAS 9.4软件进行统计学分析。符合正态分布的数据采用或(95%CI)表示,采用独立样本t检验比较试验组和对照组受试者免疫后4种型别HI抗体GMT差异;采用χ2检验比较试验组和对照组受试者免疫后4种型别HI抗体阳转率差异以及不良反应发生率差异。双侧检验,检验水准α=0.05。
3 000名受试者中男性为1 504名(50.13%);其中,≥65岁和18~64岁组分别为 800和700名,均完成疫苗接种;9~17岁组为700名,698名完成疫苗接种;3~8岁为800名,799名完成第一剂疫苗接种,787名完成第二剂疫苗接种。不同年龄试验组和对照组受试者年龄、性别构成差异均无统计学意义(均P>0.05),见表 1。
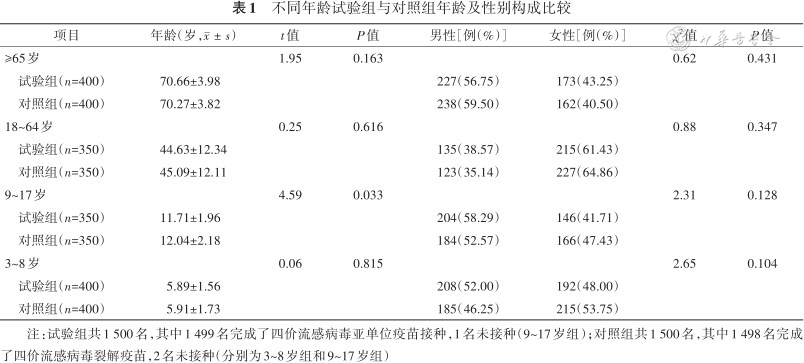
不同年龄试验组与对照组年龄及性别构成比较
不同年龄试验组与对照组年龄及性别构成比较
| 项目 | 年龄(岁,) | t值 | P值 | 男性[例(%)] | 女性[例(%)] | χ2值 | P值 |
|---|---|---|---|---|---|---|---|
| ≥65岁 | 1.95 | 0.163 | 0.62 | 0.431 | |||
| 试验组(n=400) | 70.66±3.98 | 227(56.75) | 173(43.25) | ||||
| 对照组(n=400) | 70.27±3.82 | 238(59.50) | 162(40.50) | ||||
| 18~64岁 | 0.25 | 0.616 | 0.88 | 0.347 | |||
| 试验组(n=350) | 44.63±12.34 | 135(38.57) | 215(61.43) | ||||
| 对照组(n=350) | 45.09±12.11 | 123(35.14) | 227(64.86) | ||||
| 9~17岁 | 4.59 | 0.033 | 2.31 | 0.128 | |||
| 试验组(n=350) | 11.71±1.96 | 204(58.29) | 146(41.71) | ||||
| 对照组(n=350) | 12.04±2.18 | 184(52.57) | 166(47.43) | ||||
| 3~8岁 | 0.06 | 0.815 | 2.65 | 0.104 | |||
| 试验组(n=400) | 5.89±1.56 | 208(52.00) | 192(48.00) | ||||
| 对照组(n=400) | 5.91±1.73 | 185(46.25) | 215(53.75) |
注:试验组共1 500名,其中1 499名完成了四价流感病毒亚单位疫苗接种,1名未接种(9~17岁组);对照组共1 500名,其中1 498名完成了四价流感病毒裂解疫苗,2名未接种(分别为3~8岁组和9~17岁组)
1. 基线抗体水平:所有受试者中,试验组和对照组间H1N1、H3N2、BV和BY血清型免疫前抗体GMT和阳性率差异无统计学意义(均P>0.05)。见表 2。
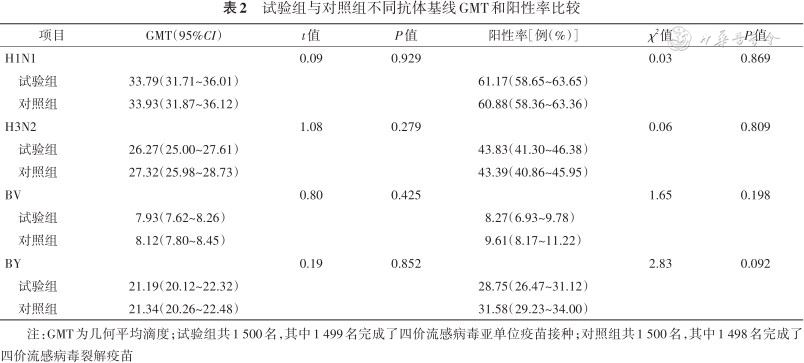
试验组与对照组不同抗体基线GMT和阳性率比较
试验组与对照组不同抗体基线GMT和阳性率比较
| 项目 | GMT(95%CI) | t值 | P值 | 阳性率[例(%)] | χ2值 | P值 |
|---|---|---|---|---|---|---|
| H1N1 | 0.09 | 0.929 | 0.03 | 0.869 | ||
| 试验组 | 33.79(31.71~36.01) | 61.17(58.65~63.65) | ||||
| 对照组 | 33.93(31.87~36.12) | 60.88(58.36~63.36) | ||||
| H3N2 | 1.08 | 0.279 | 0.06 | 0.809 | ||
| 试验组 | 26.27(25.00~27.61) | 43.83(41.30~46.38) | ||||
| 对照组 | 27.32(25.98~28.73) | 43.39(40.86~45.95) | ||||
| BV | 0.80 | 0.425 | 1.65 | 0.198 | ||
| 试验组 | 7.93(7.62~8.26) | 8.27(6.93~9.78) | ||||
| 对照组 | 8.12(7.80~8.45) | 9.61(8.17~11.22) | ||||
| BY | 0.19 | 0.852 | 2.83 | 0.092 | ||
| 试验组 | 21.19(20.12~22.32) | 28.75(26.47~31.12) | ||||
| 对照组 | 21.34(20.26~22.48) | 31.58(29.23~34.00) |
注:GMT为几何平均滴度;试验组共1 500名,其中1 499名完成了四价流感病毒亚单位疫苗接种;对照组共1 500名,其中1 498名完成了四价流感病毒裂解疫苗
2. 抗体GMT和GMI:所有受试者中,H1N1、H3N2、BV和BY抗体GMT(95%CI)试验组均高于对照组,分别为400.54(377.27~425.25)比333.39(315.47~352.33)、438.38(412.57~465.81)比385.00(362.13~409.32)、77.31(73.06~81.82)比67.62(63.94~71.51)、266.52(250.99~283.01)比180.26(169.99~191.17)(均P<0.05)。接种1剂流感疫苗免疫后H1N1、H3N2、BV和BY血清型抗体GMT试验组/GMT对照组比值95%CI的下限均>1(相对标准:≥2/3)[6]。试验组4种血清型抗体GMI分别为11.86、16.75、9.71、12.52,均>9(绝对标准:≥2.5)[7]。见表3。
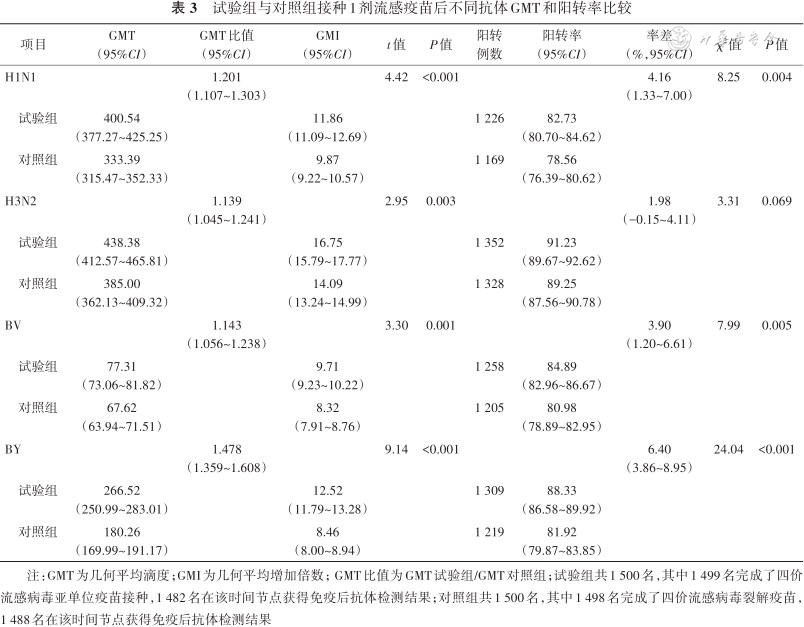
试验组与对照组接种1剂流感疫苗后不同抗体GMT和阳转率比较
试验组与对照组接种1剂流感疫苗后不同抗体GMT和阳转率比较
| 项目 | GMT(95%CI) | GMT比值(95%CI) | GMI(95%CI) | t值 | P值 | 阳转例数 | 阳转率(95%CI) | 率差(%,95%CI) | χ2值 | P值 |
|---|---|---|---|---|---|---|---|---|---|---|
| H1N1 | 1.201(1.107~1.303) | 4.42 | <0.001 | 4.16(1.33~7.00) | 8.25 | 0.004 | ||||
| 试验组 | 400.54(377.27~425.25) | 11.86(11.09~12.69) | 1 226 | 82.73(80.70~84.62) | ||||||
| 对照组 | 333.39(315.47~352.33) | 9.87(9.22~10.57) | 1 169 | 78.56(76.39~80.62) | ||||||
| H3N2 | 1.139(1.045~1.241) | 2.95 | 0.003 | 1.98(-0.15~4.11) | 3.31 | 0.069 | ||||
| 试验组 | 438.38(412.57~465.81) | 16.75(15.79~17.77) | 1 352 | 91.23(89.67~92.62) | ||||||
| 对照组 | 385.00(362.13~409.32) | 14.09(13.24~14.99) | 1 328 | 89.25(87.56~90.78) | ||||||
| BV | 1.143(1.056~1.238) | 3.30 | 0.001 | 3.90(1.20~6.61) | 7.99 | 0.005 | ||||
| 试验组 | 77.31(73.06~81.82) | 9.71(9.23~10.22) | 1 258 | 84.89(82.96~86.67) | ||||||
| 对照组 | 67.62(63.94~71.51) | 8.32(7.91~8.76) | 1 205 | 80.98(78.89~82.95) | ||||||
| BY | 1.478(1.359~1.608) | 9.14 | <0.001 | 6.40(3.86~8.95) | 24.04 | <0.001 | ||||
| 试验组 | 266.52(250.99~283.01) | 12.52(11.79~13.28) | 1 309 | 88.33(86.58~89.92) | ||||||
| 对照组 | 180.26(169.99~191.17) | 8.46(8.00~8.94) | 1 219 | 81.92(79.87~83.85) |
注:GMT为几何平均滴度;GMI为几何平均增加倍数;GMT比值为GMT试验组/GMT对照组;试验组共1 500名,其中1 499名完成了四价流感病毒亚单位疫苗接种,1 482名在该时间节点获得免疫后抗体检测结果;对照组共1 500名,其中1 498名完成了四价流感病毒裂解疫苗,1 488名在该时间节点获得免疫后抗体检测结果
3. 抗体阳转率:所有受试者中,H1N1、H3N2、BV和BY抗体阳转率(95%CI)试验组均高于对照组,分别为82.73%(80.70%~84.62%)比78.56%(76.39%~80.62%)、91.23%(89.67%~92.62%)比89.25%(87.56%~90.78%)、84.89%(82.96%~86.67%)比80.98%(78.89%~82.95%)、88.33%(86.58%~89.92%)比81.92%(79.87%~83.85%),除H3N2外,差异均有统计学意义。接种1剂流感疫苗后试验组和对照组各型别抗体阳转率率差均达到非劣效标准,其中H1N1、BV、BY抗体阳转率率差(95%CI)的下限均>1%(相对标准:≥-10%)[6],且4种血清型抗体阳转率(95%CI)的下限均>80%(绝对标准:≥40%)[7]。见表3。
4. 抗体阳性率:所有受试者中,接种1剂流感疫苗后试验组H1N1、H3N2、BV和BY血清型抗体阳性率(95%CI)分别为96.56%(95.50%~97.43%)、97.98%(97.12%~98.63%)、89.41%(87.73%~90.93%)和95.88%(94.74%~96.84%),抗体阳性率(95%CI)的下限均>85%(绝对标准:≥70%)[7]。
1. 全程接种后30 d内不良反应:所有受试者中试验组和对照组总不良反应发生率分别为10.67%(160例)和11.21%(168例)(P=0.635);全身不良反应发生率分别为5.80%(87例)和5.87%(88例)(P>0.05);局部不良反应发生率分别为5.87(88例)和5.87%(88例)(P>0.05)。18~64岁试验组与对照组总不良反应发生率分别为6.29(22例)和10.86(38例)(P=0.031),其他年龄试验组与对照组总不良反应发生率差异均无统计学意义。见表4。
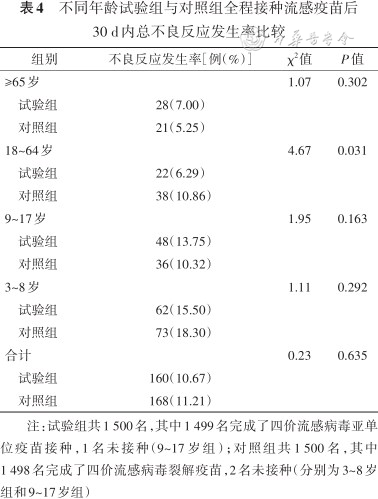
不同年龄试验组与对照组全程接种流感疫苗后30 d内总不良反应发生率比较
不同年龄试验组与对照组全程接种流感疫苗后30 d内总不良反应发生率比较
| 组别 | 不良反应发生率[例(%)] | χ2值 | P值 |
|---|---|---|---|
| ≥65岁 | 1.07 | 0.302 | |
| 试验组 | 28(7.00) | ||
| 对照组 | 21(5.25) | ||
| 18~64岁 | 4.67 | 0.031 | |
| 试验组 | 22(6.29) | ||
| 对照组 | 38(10.86) | ||
| 9~17岁 | 1.95 | 0.163 | |
| 试验组 | 48(13.75) | ||
| 对照组 | 36(10.32) | ||
| 3~8岁 | 1.11 | 0.292 | |
| 试验组 | 62(15.50) | ||
| 对照组 | 73(18.30) | ||
| 合计 | 0.23 | 0.635 | |
| 试验组 | 160(10.67) | ||
| 对照组 | 168(11.21) |
注:试验组共1 500名,其中1 499名完成了四价流感病毒亚单位疫苗接种,1名未接种(9~17岁组);对照组共1 500名,其中1 498名完成了四价流感病毒裂解疫苗,2名未接种(分别为3~8岁组和9~17岁组)
2. 全程接种后30 d内不良反应症状分布:所有受试者中试验组与对照组疫苗接种部位疼痛发生率分别为4.60%(69例)和4.94%(74例),发热发生率分别为2.13%(32例)和2.74%(41例)。3~8岁试验组与对照组发热发生率分别为2.75%(11例)和6.02%(24例),差异有统计学意义(P=0.02),咳嗽、疫苗接种部位肿胀发生率分别为1.60%(24例)比1.27%(19例)、1.00%(15例)比0.53%(8例),差异无统计学意义(P>0.05)。见表5。
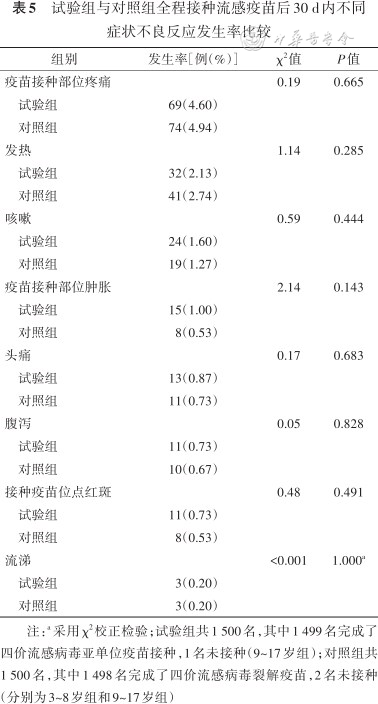
试验组与对照组全程接种流感疫苗后30 d内不同症状不良反应发生率比较
试验组与对照组全程接种流感疫苗后30 d内不同症状不良反应发生率比较
| 组别 | 发生率[例(%)] | χ2值 | P值 |
|---|---|---|---|
| 疫苗接种部位疼痛 | 0.19 | 0.665 | |
| 试验组 | 69(4.60) | ||
| 对照组 | 74(4.94) | ||
| 发热 | 1.14 | 0.285 | |
| 试验组 | 32(2.13) | ||
| 对照组 | 41(2.74) | ||
| 咳嗽 | 0.59 | 0.444 | |
| 试验组 | 24(1.60) | ||
| 对照组 | 19(1.27) | ||
| 疫苗接种部位肿胀 | 2.14 | 0.143 | |
| 试验组 | 15(1.00) | ||
| 对照组 | 8(0.53) | ||
| 头痛 | 0.17 | 0.683 | |
| 试验组 | 13(0.87) | ||
| 对照组 | 11(0.73) | ||
| 腹泻 | 0.05 | 0.828 | |
| 试验组 | 11(0.73) | ||
| 对照组 | 10(0.67) | ||
| 接种疫苗位点红斑 | 0.48 | 0.491 | |
| 试验组 | 11(0.73) | ||
| 对照组 | 8(0.53) | ||
| 流涕 | <0.001 | 1.000a | |
| 试验组 | 3(0.20) | ||
| 对照组 | 3(0.20) |
注:a 采用χ2校正检验;试验组共1 500名,其中1 499名完成了四价流感病毒亚单位疫苗接种,1名未接种(9~17岁组);对照组共1 500名,其中1 498名完成了四价流感病毒裂解疫苗,2名未接种(分别为3~8岁组和9~17岁组)
所有受试者中试验组与对照组分别发生227和216例次不良反应。其中,1级不良反应分别发生175和167例次,2级不良反应分别发生51和48例次,3级不良反应发生2例次(试验组与对照组各1例次,均为发热,均发生在≥65岁组中);各年龄组均未发生4或5级不良反应。所有受试者中试验组与对照组均未发生与疫苗相关的SAE。
全球诸多研究已证实,四价流感疫苗可预防更多的流感感染,有效降低由流感导致的住院率。美国一项使用动态传播模型的研究表明,未来20年以四价流感疫苗替代三价流感疫苗接种后,乙型流感病例数将减少27.2%(1 600万例);且与三价流感疫苗相比,采用四价流感疫苗将节省58亿美元[8]。与裂解疫苗相比,亚单位流感疫苗具有相对更好的安全性[9],2017年美国食品药品管理局和欧洲药监局即批准了一种基于细胞培养的亚单位四价流感疫苗Flucelvax用于2岁人群[10, 11],2020年批准了一种基于鸡胚培养的亚单位四价流感疫苗Fluad用于65岁的成年人[12, 13]。本研究中试验疫苗的生产工艺与Fluad类似,均基于鸡胚进行病毒培养,但未添加佐剂成分。
免疫原性方面,在≥3岁人群中,H1N1、H3N2、BV和 BY 4种血清型抗体GMT试验组均高于对照组,差异有统计学意义;4种血清型抗体阳转率均高于对照组,除H3N2外,差异均有统计学意义;试验组和对照组GMT比值均≥2/3、阳转率率差均≥-10%,两者同时达到非劣效标准。此外,试验组4种血清型的阳转率、阳性率和GMI也均达到了绝对标准。一项四价亚单位流感疫苗Fluad的约2 500名的Ⅲ期临床研究结果表明,在≥65岁人群中,其首剂免疫后针对H1N1、H3N2的抗体阳转率分别为35.21%和39.33%,针对BV和BY的阳转率分别为13.42%和16.40%,低于本研究的试验疫苗[14]。
安全性方面,临床试验结果与Ⅰ期基本一致[15]。≥3岁人群试验组和对照组总不良反应发生率相当,分别为10.67%和11.21%,其中,18~64岁亚组总不良反应发生率分别为6.29%和10.86%,试验组低于对照组,差异有统计学意义。≥3岁人群发生的不良反应程度较轻,主要症状包括疫苗接种部位疼痛和发热,其中3~8岁试验组低于对照组,差异有统计学意义,试验组和对照组均未发生严重不良反应。四价流感亚单位疫苗Flucelvax的临床试验结果显示,在9~65岁人群中,征集性不良反应发生率为61%~72%,主要症状为疫苗接种部位疼痛和头痛,均高于本研究的试验疫苗[16]。
本研究的受试者存在一定水平免疫前抗体,可能对免疫后抗体阳性率造成一定影响;此外,研究并未对疫苗的保护效力进行验证,这是本研究的局限性。
本项研究的试验疫苗为目前首个国产上市的四价流感亚单位疫苗,Ⅲ期临床研究结果显示,亚单位疫苗的4种血清型抗体GMT、阳转率均高于裂解疫苗且均达到非劣效标准和绝对标准,表明其具有较好的免疫原性;安全性方面,18~64岁人群的总不良反应发生率以及3~8岁人群与疫苗相关的发热发生率均低于裂解疫苗,显示出亚单位疫苗具有安全性优势。本研究中试验疫苗已在6~35月龄儿童中开展Ⅲ期临床试验,将在后续文章中进行报道。
王彦霞, 张伟, 谭洁冰, 等. 四价流感病毒亚单位疫苗在≥3岁健康人群中的免疫原性和安全性:一项随机、盲法、阳性对照设计的Ⅲ期临床试验[J]. 中华医学杂志, 2023, 103(44): 3575-3581. DOI: 10.3760/cma.j.cn112137-20231009-00687.
所有作者声明不存在利益冲突



























