
57岁女性患者,因“反复咳嗽2个月”诊断为晚期非小细胞肺癌,既往程序性细胞死亡配体1(PD-L1)抑制剂联合化疗、程序性细胞死亡受体1(PD-1)抑制剂联合放疗。2020年9月17日至苏州大学附属第二医院就诊,入组“布拉格治疗”临床试验[单臂大分割放疗联合PD-1/PD-L1抑制剂及粒细胞-巨噬细胞集落刺激因子(GM-CSF)免疫治疗晚期多发性转移实体瘤的Ⅰ/Ⅱ期临床研究],采用大分割放疗联合PD-1抑制剂及GM-CSF三联治疗6个周期后,血清癌胚抗原(CEA)和糖类抗原125(CA125)水平降至正常范围,疗效评估达完全缓解(CR),随后免疫巩固和维持治疗8周期后定期随访,无进展生存期(PFS)达26个月。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,57岁,因“反复咳嗽2个月”于2017年3月至外院就诊,既往“甲状腺瘤切除术”史数十年余,否认肿瘤相关家族遗传病史,查体未见明显异常。入院先后完善胸部CT示右肺中叶占位;气管镜活检病理示腺癌;PET-CT示右肺中叶肿块,大小约6.5 cm×5.5 cm,合并左侧锁骨上、左颈部、左腋窝、右肺肺门及纵隔多发淋巴结转移,右侧胸腔积液;初步诊断为:右肺中叶腺癌cT3N3M1c Ⅳ期[国际抗癌联盟(UICC)第8版],美国东部肿瘤协作组(ECOG)评分0分。组织样本二代基因测序(NGS)结果示:表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)、c-ros肉瘤致癌因子-受体酪氨酸激酶(ROS1)均为野生型、BRAF V600E突变、微卫星稳定(MSS)、肿瘤突变负荷低(TMB-L);免疫组化示:程序性细胞死亡配体1(PD-L1)(+)。
2017年4月于外院行“阿替利珠单抗1 200 mg 第1天(d1)+培美曲塞800 mg d2+卡铂700 mg d2,每3周1次(q3w)”一线治疗后部分缓解(PR);后予“阿特珠单抗1 200 mg d1,q3w”单药维持,但2周期后出现胸壁、腹壁转移;无进展生存期(PFS)为6个月。2017年10月予以“帕博利珠单抗100 mg d1+贝伐珠单抗400 mg d1,q3w”二线治疗共2周期;期间予右肺原发灶同步立体定向放射治疗,具体剂量50 Gy连续10次,疗效评估疾病稳定(SD);PFS为2个月。2017年12月予以治疗“帕博利珠单抗100 mg d1 q3w+曲美替尼2 mg每天1次+达拉非尼150 mg每天2次”三线治疗2周期后胸壁、腹壁病灶消失,疗效达完全缓解(CR);期间出现放射性肺炎及严重皮疹故予以停用免疫治疗;2018年2月继续口服“曲美替尼+达拉非尼”双靶向治疗,至2020年8月PET-CT评估纵隔淋巴结(2L、4R、8区)及腋窝淋巴结多发转移且肿瘤指标升高;PFS为32个月。
2020年9月17日至苏州大学附属第二医院就诊,入组“布拉格治疗”临床试验[单臂大分割放疗联合程序性细胞死亡受体1(PD-1)/PD-L1抑制剂及粒细胞-巨噬细胞集落刺激因子(GM-CSF)免疫治疗晚期多发性转移实体瘤的Ⅰ/Ⅱ期临床研究,注册号:ChiCTR1900020175],该患者治疗过程见图1。
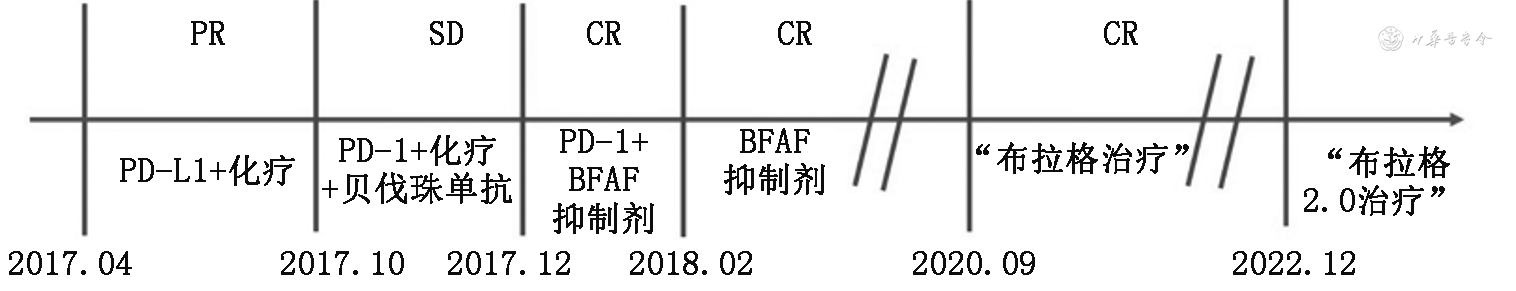

注:PR为部分缓解;SD为疾病稳定;CR为完全缓解;PD-L1为程序性细胞死亡配体1;PD-1为程序性细胞死亡受体1
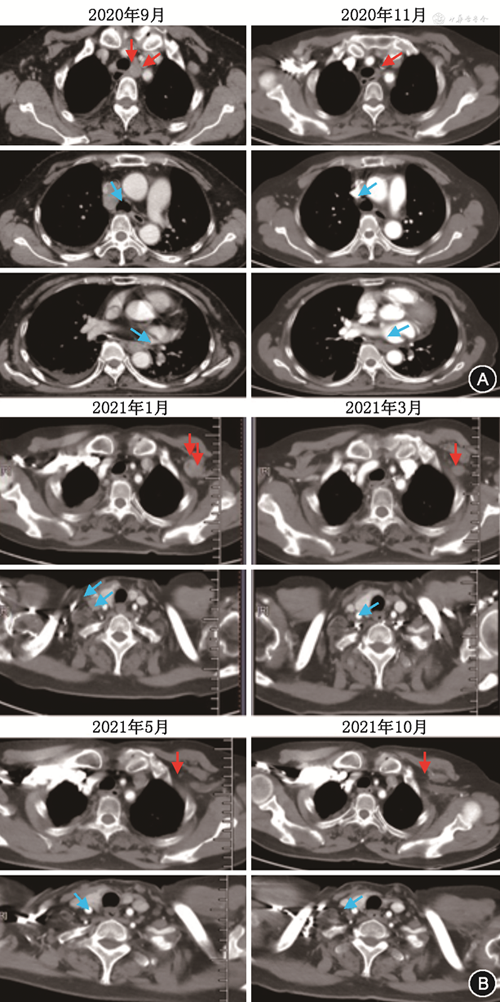
该患者“布拉格治疗”分为4个阶段:免疫激活(治疗模式:放疗+PD-1抑制剂+GM-CSF)、免疫巩固(治疗模式:PD-1抑制剂+GM-CSF)、免疫维持(治疗模式:PD-1抑制剂)、随访观察。第1、2周期分别给予纵隔(2 L)转移淋巴结大分割放疗(5 Gy照射连续3 d,每天1次),皮下注射GM-CSF(200 μg,指第4天至第17天,每天1次),静脉注射PD-1抑制剂(信迪利单抗200 mg,d4),该三联治疗方案每3周重复1次,每2个周期进行1次影像学评估,第3周和第4周期给予GM-CSF和PD-1抑制剂维持2周期;第5、6周期分别给予左腋窝转移淋巴结大分割放疗(5 Gy照射连续3 d,每天1次),并联合GM-CSF和PD-1抑制剂治疗(治疗同上),后续按治疗计划进入免疫巩固、维持、随访阶段。经过6周期“布拉格治疗”后,根据实体肿瘤反应评价标准(RECIST 1.1),该患者影像学评估为CR(图2)。此外,血清癌胚抗原(CEA)和糖类抗原125(CA125)水平降至正常范围。2022年12月患者出现双侧颈部淋巴结转移,PFS达26个月。后续该患者继续接受“布拉格治疗”2.0方案治疗[大分割放疗联合PD-1抑制剂序贯GM-CSF及白细胞介素-2(IL-2)治疗晚期难治性实体瘤的前瞻性多中心临床研究,注册号:NCT 04892498]。经1个治疗周期,患者于2023年2月1日再获评估疗效CR,截至2023年9月,该患者治疗仍在进行,疗效保持CR。治疗过程中出现了2级发热和短暂低氧血症,评估与GM-CSF治疗相关,经口服塞来昔布(200 mg,每天2次)和吸氧治疗后自行缓解。2020年11月10日被诊断为2级免疫相关性葡萄膜炎和1级甲状腺功能减退,予以小剂量糖皮质激素和甲状腺素替代治疗后恢复正常。不良事件均未明显降低患者的生活质量。

PD-1/L1抑制剂等免疫检查点抑制剂(ICI)已成为驱动基因阴性晚期非小细胞肺癌(NSCLC)的标准治疗方案[1],然而PD-1/L1抑制剂耐药后,尚缺乏有效挽救治疗措施[2]。对于PD-1/L1抑制剂耐药后的NSCLC患者,有不少团队尝试使用抗PD-1/L1药物再挑战治疗,但疗效欠佳。一项法国的回顾性研究分析了144例晚期NSCLC患者ICI再挑战结果,发现58例因疾病进展停止第1次ICI治疗的患者,通过再挑战治疗获得了较短的PFS[2.9个月(95%CI:2.0~4.4个月)]和总生存期[1年(95%CI:0.5~1.6年)][3]。一项试图通过加入曲美木单抗逆转度伐利尤单抗耐药性的Ⅱ期研究中,30例获得性耐药的患者中,其客观缓解率(ORR)为0,中位PFS和总生存期分别为2.1个月(95%CI:1.6~3.2个月)和7.6个月(95%CI:5.3~10.2个月)[4]。
“布拉格治疗”是本课题组自主设计的一项注册临床试验(注册号:ChiCTR1900026175),其通过PD-1抑制剂、放射治疗(Radiotherapy)和GM-CSF的联合应用来进行晚期后线肿瘤患者的救治,因该治疗方案中的三要素PD-1/L1 inhibitor,Radiotherapy and GM-CSF的首字母组合为“PRaG”,故命名为“布拉格治疗”。“布拉格治疗”本质上与肿瘤免疫循环的理论相符,即放疗造成肿瘤抗原暴露,GM-CSF促进抗原递呈细胞激活及增殖,PD-1抑制剂激活特异性的CD8+T淋巴细胞杀瘤能力,协同配合可形成有效的肿瘤免疫应答[5]。“布拉格治疗”研究初步的探索招募了54例终末期肿瘤患者,ORR达16.7%,中位PFS为4.0个月(95%CI:3.3~4.8个月)[6],于金明院士称“布拉格治疗”为放射远隔效应的量变到质变[7]。
在本例中,患者既往出现PD-1/L1耐药后,采用“布拉格治疗”方案再挑战后肿瘤完全退缩,PFS长达26个月,该例患者短期疗效评价结果显著优于既往的文献报道。基于本例的启示,本课题组正在开展布拉格7.0研究(“布拉格治疗再挑战PD-1/PD-L1治疗失败/耐药后的晚期难治性实体恶性肿瘤的前瞻性多中心临床研究”,NCT05530200),期望为“布拉格治疗”再挑战PD-1/L1耐药的治疗理念提供循证医学证据。
徐美玲, 张辰阳, 邢鹏飞, 等. “布拉格治疗”PD-1及PD-L1抑制剂耐药的晚期难治性非小细胞肺癌1例[J]. 中华医学杂志, 2023, 103(44): 3584-3586. DOI: 10.3760/cma.j.cn112137-20230704-01146.
所有作者声明不存在利益冲突































