
急性髓系白血病(AML)是异质性的血液系统恶性肿瘤,除疾病本身因素外,年龄是影响预后的重要因素[1,2],研究显示,60岁以上AML患者4年总生存(OS)率显著低于60岁以下患者(16%对37%)[3]。本研究我们对本中心采用阿扎胞苷(AZA)+维奈克拉(VEN)方案与AZA+ HAG方案诱导治疗老年AML患者的疗效、安全性及治疗费用进行比较,从而为我国老年初诊AML患者诱导治疗的选择提供经验。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是异质性的血液系统恶性肿瘤,除疾病本身因素外,年龄是影响预后的重要因素[1,2],研究显示,60岁以上AML患者4年总生存(OS)率显著低于60岁以下患者(16%对37%)[3]。本研究我们对本中心采用阿扎胞苷(AZA)+维奈克拉(VEN)方案与AZA+ HAG方案诱导治疗老年AML患者的疗效、安全性及治疗费用进行比较,从而为我国老年初诊AML患者诱导治疗的选择提供经验。
回顾性分析天津市人民医院2020年6月至2022年10月收治的初治老年(≥60岁)AML患者临床资料,所有患者均参照WHO诊断标准[4,5]明确诊断为AML。所有患者根据情况均采用AZA+VEN或AZA+HAG诱导治疗。
①AZA+VEN组:诱导化疗:AZA 75 mg·m-2·d-1,第1~7天;VEN 100 mg第1天、200 mg第2天、400 mg第3~28天。诱导缓解后,患者巩固及维持化疗同诱导化疗,直至疾病进展。②AZA+HAG组:诱导化疗:AZA 75 mg·m-2·d-1,第1~7天;高三尖杉酯碱(HHT)2 mg/d,第1~7天;阿糖胞苷(Ara-C)100 mg/d,第1~7天;G-CSF 300 μg/d皮下注射,直至WBC>10 × 109/L时停用。巩固化疗:Ara-C 0.5 g,每12 h 1次,第1~3天,3个周期。维持化疗:AZA 75 mg·m-2·d-1,第1~7天,28 d为1个周期,直至疾病进展。
疗效判定参照血液病诊断及疗效标准(第四版)[6]。复合缓解率为完全缓解(CR)率和伴血细胞未完全恢复的CR(CRi)率之和。不良反应(AE)标准参考CTCAE 5.0。粒细胞缺乏恢复时间、血小板恢复时间定义为脱离血制品输注,中性粒细胞>0.5×109/L,PLT>20×109/L。
以查阅住院、门诊病历及电话、微信等方式进行随访,随访截至2022年12月1日。
应用SPSS 23.0软件进行统计学分析。计数资料组间比较采用Fisher确切概率法,计量资料组间比较采用独立样本t检验;OS及无复发生存(RFS)率根据Kaplan-Meier法计算,并描绘生存曲线;P<0.05为差异有统计学意义。
共36例初治老年AML患者纳入研究,中位年龄为63(60~75)岁,中位WBC 15.2(0.7~373.0)×109/L,中位PLT 49.5(5~240)×109/L,参考2017年欧洲白血病网(ELN)预后分层,高危组14例(38.9%),中危组12例(33.3%),低危组7例(19.4%);采用AZA+VEN诱导治疗22例,AZA+HAG诱导治疗14例。AZA+VEN组中位年龄及高危患者比例均高于AZA+HAG组,两组其他基线特征差异无统计学意义(表1)。
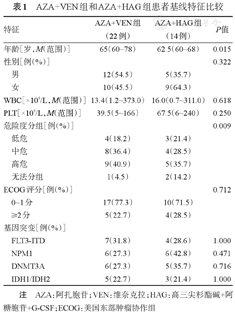
AZA+VEN组和AZA+HAG组患者基线特征比较
AZA+VEN组和AZA+HAG组患者基线特征比较
| 特征 | AZA+VEN组(22例) | AZA+HAG组(14例) | P值 |
|---|---|---|---|
| 年龄[岁,M(范围)] | 65(60~78) | 62.5(60~68) | 0.015 |
| 性别[例(%)] | 0.322 | ||
| 男 | 12(54.5) | 5(35.7) | |
| 女 | 10(45.5) | 9(64.3) | |
| WBC[×109/L,M(范围)] | 13.4(1.2~373.0) | 16.0(0.7~311.0) | 0.618 |
| PLT[×109/L,M(范围)] | 39.5(5~166) | 67.5(6~240) | 0.250 |
| 危险度分组[例(%)] | 0.009 | ||
| 低危 | 4(18.2) | 3(21.4) | |
| 中危 | 8(36.4) | 4(28.5) | |
| 高危 | 9(40.9) | 5(35.7) | |
| 无法分组 | 1(4.5) | 2(14.2) | |
| ECOG评分[例(%)] | 0.712 | ||
| 0~1分 | 17(77.3) | 10(71.5) | |
| ≥2分 | 5(22.7) | 4(28.5) | |
| 基因突变[例(%)] | |||
| FLT3-ITD | 7(31.8) | 4(28.6) | 1.000 |
| NPM1 | 6(27.3) | 6(42.8) | 0.471 |
| DNMT3A | 6(27.3) | 5(35.7) | 0.716 |
| IDH1/IDH2 | 5(22.7) | 3(21.4) | 1.000 |
注 AZA:阿扎胞苷;VEN:维奈克拉;HAG:高三尖杉酯碱+阿糖胞苷+G-CSF;ECOG:美国东部肿瘤协作组
AZA+VEN组总体复合缓解率为86.4%(19/22),1个疗程复合缓解率为81.8%(18/22),1个疗程微小残留病(MRD)阴性率77.3%(17/22);AZA+HAG组总体复合缓解率为85.7%(12/14),1个疗程复合缓解率为71.4%(10/14),1个疗程MRD阴性率64.2% (9/14)。两组比较,总体复合缓解率、1个疗程复合缓解率及1个疗程MRD阴性率差异均无统计学意义(P值分别为1.000、0.683、0.462)。
截至2022年12月,所有患者中位随访时间为13(2~26)个月。AZA+VEN组中位随访时间为13(2~25)个月,随访期内中位OS时间未达到,中位RFS时间为17个月,1年OS率为75.8%,1年RFS率为69.0%;AZA+HAG组中位随访时间为14(6~26)个月,随访期内中位OS时间未达到,中位RFS时间为8个月,1年OS率为53.6%,1年RFS率为52.0%。两组OS及RFS差异均无统计学意义(图1)。
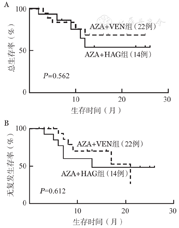

注 AZA:阿扎胞苷;VEN:维奈克拉;HAG:高三尖杉酯碱+阿糖胞苷+G-CSF
(1)血液学AE:两种治疗方案最常见的AE均为血液学AE。部分患者在治疗开始前已处于不同程度的血细胞减少,应归因于血液学疾病本身所致。两组患者的严重血小板减少比例、粒细胞缺乏比例、粒细胞缺乏恢复时间及血小板恢复时间见表2,AZA+HAG组严重血小板减少比例高于AZA+VEN组(P=0.020)。
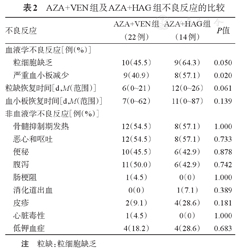
AZA+VEN组及AZA+HAG组不良反应的比较
AZA+VEN组及AZA+HAG组不良反应的比较
| 不良反应 | AZA+VEN组(22例) | AZA+HAG组(14例) | P值 |
|---|---|---|---|
| 血液学不良反应[例(%)] | |||
| 粒细胞缺乏 | 10(45.5) | 9(64.3) | 0.050 |
| 严重血小板减少 | 9(40.9) | 8(57.1) | 0.020 |
| 粒缺恢复时间[d,M(范围)] | 6(0~21) | 12(0~26) | 0.061 |
| 血小板恢复时间[d,M(范围)] | 7(0~62) | 11(0~87) | 0.139 |
| 非血液学不良反应[例(%)] | |||
| 骨髓抑制期发热 | 12(54.5) | 8(57.1) | 1.000 |
| 恶心和呕吐 | 12(54.5) | 8(57.1) | 0.733 |
| 便秘 | 10(45.5) | 6(42.9) | 0.878 |
| 腹泻 | 11(50.0) | 6(42.9) | 0.742 |
| 肠梗阻 | 1(4.5) | 0(0) | 1.000 |
| 消化道出血 | 0(0) | 1(7.1) | 0.389 |
| 皮疹 | 2(9.1) | 4(28.6) | 0.181 |
| 心脏毒性 | 1(4.5) | 0(0) | 1.000 |
| 低钾血症 | 4(18.2) | 4(28.6) | 0.683 |
注 粒缺:粒细胞缺乏
(2)非血液学AE:两组患者最常见的非血液学AE主要为骨髓抑制期发热、胃肠道不良反应、低钾血症及皮疹,两组非血液学AE发生率差异均无统计学意义。AZA+VEN组1例患者在治疗过程中出现急性冠脉综合征,予停用VEN,经吸氧、抗血小板聚集、扩冠等治疗后患者症状好转。两组患者治疗过程中均未观察到肿瘤溶解综合征的发生(表2)。
(3)治疗相关死亡(定义:诱导治疗30 d内死亡):AZA+VEN组2例死亡,死亡率9.1%,死因分别为败血症和多器官功能障碍;AZA+HAG组1例死亡,死亡率为7.1%,死因为呼吸衰竭。两组患者治疗相关死亡率差异无统计学意义(P=1.000)。
AZA+VEN组诱导化疗中位住院费用为132 468.85(71 068.18~21 695.74)元,AZA+HAG组诱导化疗中位住院费用为98 724.63(46 475.7~15 3721.26)元,与AZA+HAG组比较,AZA+VEN组住院费用明显升高(P=0.027)。
AML在老年人中发病率高,治疗效果差,不适合强化疗的老年AML患者较难从传统化疗中受益[7]。去甲基化药物是老年AML常用的治疗药物之一,该药物在提高患者缓解率的同时,能够一定程度改善患者的远期预后,但缓解率的提高相对有限[8];研究发现,如能获得缓解,老年AML的生存时间可获得显著延长。因此,目前老年AML治疗方案改进的热点之一是在去甲基化药物的基础上,联合应用其他化疗药物或靶向药物,以期在具有良好耐受性的同时,进一步提高老年AML患者的缓解率及远期生存。目前研究较多的是BCL-2抑制剂VEN,多项研究显示:VEN联合去甲基化药物治疗老年初诊AML患者缓解率高,安全性良好[9,10,11]。该治疗方案已经写入美国国立综合癌症网络(NCCN)及中国AML治疗指南,成为老年不适合强化疗初诊AML患者的一线选择之一。但由于经济情况等因素,部分患者无法应用VEN为基础的治疗方案,其他可替代方案成为目前老年AML研究的方向之一。除新型靶向药物外,传统化疗药物HHT是一种细胞周期非特异性药物,可导致白血病细胞停滞在细胞周期的G1/G2期,Ara-C则作用于细胞周期的S期发挥诱导细胞凋亡的作用,HHT与Ara-C可协同诱导白血病细胞发生凋亡,而G-CSF可促使G0期细胞进入G1期,能够更有效地发挥HHT与Ara-C的协同作用[12]。此外,HHT与AZA也具有协同作用,且小剂量HHT不良反应较其他化疗药物相对较小。因此,AZA联合小剂量HHT有望进一步改善老年AML的预后。中国医学科学院血液病医院侯降雪等[13]已证实了AZA+HHT+Ara-C方案治疗AML的有效性,我科结合中国老年AML患者的实际情况,采用AZA+HAG及AZA+VEN为基础的方案诱导化疗,以期为初治老年AML患者选择更优的治疗方案提供临床依据。
我们对两种方案的疗效进行了观察,两种方案的诱导缓解率较高,AZA+VEN组患者的中位年龄及高危患者比例均高于AZA+HAG组,是影响患者预后的主要因素。AZA+VEN组1年OS率为75.8%,1年RFS率为69.0%;AZA+HAG组1年OS率为53.6%,1年RFS率为52.0%。AZA+HAG组生存较AZA+VEN组差,但差异无统计学意义,考虑可能与随访时间较短,病例偏少有关。AZA+HAG组生存相对较差主要与其复发率较高相关,AZA+HAG的高初始治疗反应率并未转化为OS的优势,可能与巩固化疗方案较弱、未持续应用AZA+HAG巩固化疗、因化疗后骨髓抑制期较长致化疗周期延长等因素相关。AZA+VEN组生存更具优势,血液学不良反应更少,说明AZA+VEN较化疗方案仍存在一定优势。本研究发现,AZA+HAG组与AZA+VEN组在总CR/CRi率、1个疗程CR/CRi率、1个疗程MRD阴性率及早期死亡率方面相似,同时不良反应均可耐受。目前AZA+VEN仍为老年AML优选治疗方案,但由于AZA+VEN治疗费用相对较高,许多患者无法负担,如患者存在经济因素或不愿意选用VEN,可考虑疗效接近的AZA+HAG方案,实际工作中,对于老年AML需根据患者年龄、身体状况、经济情况等综合考虑从而选择更适合的治疗方案。
所有作者声明不存在利益冲突


























