干燥综合征(SS)是一种慢性炎症性自身免疫性疾病,可分为原发性干燥综合征(pSS)、继发性干燥综合征(sSS)。儿童pSS与sSS具有相似临床特点,可用同一分类标准。与成人SS相比,儿童SS少发,起病隐匿,缺乏典型口、眼干燥的临床表现。故成人SS分类标准并不完全适用于儿童SS患者,但目前尚无广泛应用及得以验证的适用于儿童的分类标准,值得进一步探讨和研究。现就儿童SS的临床特点、分类诊断标准相关进展进行综述,并对儿童pSS与sSS进行比较。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
干燥综合征(Sjögren′s syndrome,SS)是一种慢性炎症性、系统性自身免疫性疾病,以淋巴细胞增殖、进行性外分泌腺体损伤为特征,临床常累及涎腺、泪腺,引起其功能损伤(表现为口干、眼干)[1,2],常累及多系统多脏器[3]。SS常合并其他自身免疫性疾病,如类风湿性关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、硬皮病等,称为继发性干燥综合征(secondary Sjögren′s syndrome,sSS)或重叠综合征;而不合并其他结缔组织疾病者,称为原发性干燥综合征(primary Sjögren′s syndrome,pSS)。虽然临床上sSS相对pSS多见,但关于sSS研究很少。临床关于SS的研究绝大部分来源于pSS。sSS临床症状易被同时合并的自身免疫病所覆盖,导致其诊断困难。事实上,由于各种自身免疫性疾病均可累及多系统多脏器,临床表型多有重叠,故pSS与sSS临床表现相似,相关实验室检查及诊断性检查也相同,甚至部分临床分类标准同时适用于pSS和sSS。pSS高发于中老年女性[4],儿童罕见[5]。儿童pSS起病隐匿,临床特征与成人pSS有所不同,往往无明显口干、眼干等症状,因此,成人pSS的分类标准并不完全适用于儿童。有报道至少1/4~1/2的儿童pSS不符合目前成人pSS分类标准[6,7,8]。由于儿童SS发病率低、样本量小、异质性大等原因难以统计分析,关于儿童SS的流行病学、病因、病理生理机制、临床特征、诊疗规范等均少见报道。但是作为慢性长期性疾病,为获得更理想的预后,儿童SS早期诊断、治疗及长期规范化管理显得尤为重要。因此,现围绕儿童SS的临床特点、分类诊断标准相关进展进行综述,并对儿童pSS与sSS进行比较,为小儿风湿科医师临床工作提供一定诊疗规范及依据。
儿童SS根据是否伴有其他自身免疫性疾病,亦可分为pSS与sSS。儿童pSS由多种不同因素导致,包括基因遗传背景因素、环境因素如感染、激素水平等综合因素;同时自身抗体、抗原抗体复合物以及各种免疫细胞(T、B细胞)等共同参与其中[8]。pSS在30~60岁女性患者中多见,女性发病是男性的9~20倍[2],其发生率为0.10%~0.72%[4]。与成人相比,儿童pSS属于罕见病,但仍以女童多见,男女发病比例为1.0∶6.7。儿童pSS流行病学资料相对缺乏,来自日本的一项长达7年的研究数据显示,儿童pSS发生率为0.53/10万人,男女比例为1.0∶4.7,平均发病年龄为11.0岁(1.1~17.9岁),而日本最新数据表明儿童起病的pSS发生率为1.3%[5]。目前国内仍缺乏儿童pSS相关流行病学资料。关于儿童sSS的研究及报道更为少见。成人sSS多继发于RA等,儿童sSS则更多继发于SLE[9]。
儿童pSS临床特征与成人不尽相同。pSS儿童患者外分泌腺淋巴细胞浸润、高球蛋白血症、红细胞沉降率(ESR)增快、抗SSA/SSB抗体阳性率与成人患者相似,但儿童pSS起病更为隐匿,缺乏典型口干、眼干症状,较少累及肺部[10]。
98%的成人患者有口、眼等明显干燥症状,而儿童患者却很少主诉类似症状[6,11]。30%的pSS患儿干燥症状往往通过详细询问病史或检查而发现[12]。相关询问如吃干性食物是否需要水、是否有口气、是否有腮腺肿痛、是否有牙痛/胃痛/舌下囊肿、是否有味觉改变等,有助于发现pSS患儿口腔干燥问题;相对于哭时是否有泪,眼睛干涩、红、异物感、疼痛、瘙痒等在儿童患者中更需引起关注。Ramos-Casals等[5]报道pSS患儿均未主诉口干、眼干等症状,而通过询问或检查80%的儿童患者在诊断时存在口干,70%存在干眼。另有研究报道,腮腺增大是儿童pSS的早期症状[11]。pSS患儿反复腮腺肿胀(94%比49%)较成人患者更常见;而口腔干燥(52%比79%),尤其是眼部干燥(26%比72%)症状较成人少见[13]。更有学者通过回顾性研究发现因舌下囊肿行舌下腺磁共振成像者中,有20%以上患者很可能存在SS症状,目前二者关系尚不明确;猜测SS引起舌下腺的改变可能是导致舌下囊肿的一个原因[14]。
儿童pSS患者腺体外的全身系统表现较局部腺体症状更为常见。Legger等[13]发现儿童pSS最常见症状为反复腮腺肿胀,此外,全身系统症状,如关节痛、乏力、口干、发热、雷诺现象常见。68%的pSS患儿出现不同程度的发热;淋巴结大(不超过2 cm)也是常见症状之一;关节痛是44%~65% pSS患儿的首发症状,但一般无滑膜炎表现;25%以上患儿具有皮肤表现[6,11];红斑是pSS典型皮肤表现,也可见多形性红斑、荨麻疹性血管炎、雷诺现象、伴有高丙种球蛋白血症的紫癜及冻疮样皮疹等。约9%的pSS患儿伴发间质性肾炎,并引起肾小管浓缩障碍和肾小管酸中毒[15]。神经系统并发症可有无菌性脑膜炎、脊髓炎、中枢及外周神经病变等;血液系统并发症可有自身免疫性贫血、自身免疫性血小板减少性紫癜等,且易并发淋巴瘤;纤维肌痛、自身免疫性肝炎、胰淀粉酶升高、慢性胰腺炎、间质性肺炎等均可在儿童pSS中表现[8]。而非特异性症状,如头痛、恶心、眩晕、腹痛、骨骼肌肉疼痛、胸痛、不适感等也可能是pSS患儿首发症状。约50%以非特异性症状为主诉的患儿抗核抗体(ANA)阳性,其中10%可伴有抗SSA/Ro抗体阳性[16]。
与成人患者一样,儿童sSS临床表现与pSS类似。儿童sSS临床表现往往介于pSS与其所伴发自身免疫性疾病的中间状态,可能更偏向于pSS或伴发疾病。例如,伴发于SLE的SS(SLE/SS)和pSS患者相比,出现口干眼干、抗SSA抗体、抗SSB抗体阳性概率相近,唇腺活检灶性指数评分相近[17];SLE/SS患者狼疮症状轻,具有独特临床症状、血清学检查和免疫学特征,更接近pSS表现[18]。
儿童pSS往往因为不明原因发热或其他症状行自身抗体检查时才发现,在诊断及治疗过程中需对各器官进行评估,按检查目的可分为筛查、诊断、鉴别诊断及评估相关检查[8]。儿童sSS的实验室检查与诊断性试验与pSS相同。具体如下:(1)筛查:血尿粪常规、C反应蛋白(CRP)、ESR、肝肾功能、免疫球蛋白、补体、自身抗体、类风湿因子(RF)等。(2)诊断:特异性抗体如抗SSA/Ro抗体,抗SSB/La抗体;唾液腺检查:唾液流率、腮腺同位素造影、B超、磁共振成像等辅助检查;唇腺活检;泪腺检查:Schirmer试验、泪膜破碎时间、角膜染色、泪腺活检等。(3)鉴别诊断:病毒、细菌、结核、人类免疫缺陷病毒(HIV)等病原学;其他自身抗体检测。(4)器官评估相关项目:甲状腺功能、肾功能检查如尿系列微量蛋白等。
最早1965年Bloch标准认为具有口干症、干燥性角结膜炎、RA或其他结缔组织疾病中的2项即可诊断SS。随后有1971年Shearn标准、1981年哥本哈根标准、1996年欧洲标准、1999年日本标准等。而2002年欧美共识小组(American-European Consensus Group,AECG)标准是目前临床应用最为广泛的分类标准。
(1)口腔症状。至少满足1项:①每日感到口干持续≥3个月;②成年后腮腺反复或持续肿大;③吞咽干性食物需用水帮助。
(2)眼部症状。至少满足1项:①每日感到不能忍受的眼干,持续≥3个月;②有反复的砂子进眼或磨砂感;③每日需用人工泪液≥3次。
(3)眼部体征。至少满足1项:①Schirmer试验<5 mm/5 min;②角膜染色评分(van Bijsterveld评分)>4分/眼。
(4)唇腺活检。唇腺活检淋巴细胞灶≥1。
(5)唾液腺受累。至少符合1项:①静态唾液流率<1.5 mL/15 min;②腮腺造影检测阳性;③涎腺放射性核素检测阳性。
(6)SS抗体。SS抗体SSA和/或SSB阳性。
满足以下2条中的任意1条即可诊断pSS:(1)符合上述4条或4条以上,但同时必须符合第4条和/或第6条;(2)第3、4、5、6条满足任意3条。合并其他结缔组织病,满足第1条或第2条,同时符合第3、4、5条任意2条即分类为sSS。该分类标准融合了临床表现、实验室及辅助检查、病理及特异性抗体,具有良好的诊断敏感性和特异性,但较为繁复。为进一步提高pSS诊断效能,2016年欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)/美国风湿病协会(American College of Rheumatology,ACR)提出了新的分类标准。
至少有眼干或口干症状之一者,下述至少1项为阳性:(1)每日感到不能忍受的眼干,持续3个月以上;(2)眼中反复砂砾感;(3)每日需用人工泪液≥3次;(4)每日感到口干,持续3个月以上;(5)吞咽干性食物需频繁饮水帮助,或EULAR的SS疾病活动度指数(EULAR Sjögren′s syndrome disease activity index,ESSDAI)问卷中出现至少1个系统阳性的可疑SS者。
(1)头颈部放疗史;(2)活动性丙型肝炎病毒感染;(3)获得性免疫缺陷综合征;(4)结节病;(5)淀粉样变性;(6)移植物抗宿主病;(7)IgG相关性疾病。
满足上述纳入标准且除外排除标准者,下述5项评分总和≥4分者诊断为pSS:(1)唇腺灶性淋巴细胞浸润,且灶性指数>1灶/4 mm2,3分;(2)血清抗SSA抗体阳性,3分;(3)至少单眼角膜染色计分(OSS)≥5分或van Bijsterveld评分≥4分,1分;(4)至少单眼泪液分泌试验(Schirmer试验)≤5 mm/5 min,1分;(5)未刺激的全唾液流率≤0.1 mL/min(Navazesh和Kumar测定法),1分。
常规使用抗胆碱能药物者应充分停药后再行相关检查评估口眼干燥。
从以上成人SS各个分类标准中可以看出,除了1965年Bloch标准包含了pSS和sSS外,其余几乎所有分类标准(除1999年日本标准)均仅适用于pSS。而儿童SS有其独特临床特点,且唇腺活检开展并不容易,很难适用成人标准。因此,1999年Bartu。,nková等[19]提出了儿童pSS诊断标准,共分为四大部分,包括临床症状、免疫学指标、其他实验室检查,并排除其他自身免疫性疾病,在前三部分中共有12条项目,符合4条以上即可诊断儿童pSS。
(1)口腔:复发性腮腺炎或腮腺肿大;(2)眼部:复发性结膜炎没有明确过敏或感染因素;干燥性角膜结膜炎;(3)其他黏膜表现:复发性阴道炎;(4)系统性症状:不明原因发热、非炎症性关节痛、低钾麻痹、腹痛。
以下4项中至少1项阳性:抗SSA、抗SSB、高滴度ANA(斑点型)、RF。
(1)生化检查:血清淀粉酶升高;(2)血液系统:白细胞降低、ESR增快;(3)免疫学指标:高球蛋白血症(多克隆性);(4)肾脏:肾小管酸中毒;(5)组织病理学证据提示唾液腺/其他器官(如肝脏)淋巴细胞浸润;(6)客观记录有眼干症状(如孟加拉红染色阳性或Schirmer试验阳性);(7)客观记录有腮腺受累(涎管造影术)。
该标准排除了sSS,未得到广泛应用。近期有学者对成人pSS分类诊断标准及该儿童分类诊断标准敏感性进行了验证,发现仅30%的儿童符合成人pSS诊断标准(包括AECG、ACR及日本标准),按照儿童特点进行校正,即必须符合腮腺炎和唇腺淋巴灶浸润>0,符合率才达62%~85%;却仍有1/4的患儿会被漏诊[10]。
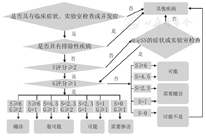
为了更早期、精确地诊断儿童SS,2021年日本更新发表了针对儿童SS诊断的评分和流程(最早版本于2018年发布),但其诊断精确性尚有待于进一步验证。该分类标准适用于儿童pSS和sSS。全文罗列了儿童SS可疑症状、临床指标和鉴别疾病,并对血清学指标、唾液腺、泪腺进行评分(S评分、G评分)。具有"儿童SS可疑症状"者应二次筛查抗体(抗SSA、抗SSB抗体),同时根据"儿童SS鉴别诊断"进行鉴别。当2次抗SSA、SSB抗体结果均提示SS可能时,根据"儿童SS实验室检查"完善诊断性检查以评估外分泌腺体的受累情况(流程图见图1),最终明确诊断:确诊(Definte)、很可能(Probable)、可能(Possible);对于不满足者则分为"随访(needs follow-up)"和"可能不是(possibly non-SS)"[9]。
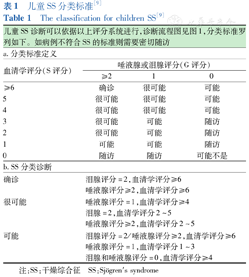
| 儿童SS诊断可以依据以上评分系统进行,诊断流程图见图1,分类标准罗列如下。如病例不符合SS的标准则需要密切随访 | |||
| a.分类标准定义 | |||
| 血清学评分(S评分) | 唾液腺或泪腺评分(G评分) | ||
| ≥2 | 1 | 0 | |
| ≥6 | 确诊 | 很可能 | 可能 |
| 5 | 很可能 | 很可能 | 可能 |
| 4 | 很可能 | 很可能 | 可能 |
| 3 | 很可能 | 可能 | 随访 |
| 2 | 很可能 | 可能 | 随访 |
| 1 | 可能 | 可能 | 随访 |
| 0 | 随访 | 随访 | 可能不是 |
| b.SS分类诊断 | |||
| 确诊 | 泪腺评分=2,血清学评分≥6 | ||
| 唾液腺评分≥2,血清学评分≥6 | |||
| 很可能 | 唾液腺评分=1,血清学评分≥4 | ||
| 泪腺=2,血清学评分2~5 | |||
| 唾液腺评分≥2,血清学评分2~5 | |||
| 可能 | 泪腺评分=2/唾液腺评分≥2,血清学评分≥6 | ||
| 唾液腺评分=1,血清学评分1~3 | |||
| 泪腺和唾液腺评分=0,血清学评分≥4 | |||
注:SS:干燥综合征 SS:Sjögren′s syndrome
(1)全身症状:发热、全身不适、淋巴结大、晨僵、不明原因的肢体疼痛等;(2)腺外表现:关节疼痛或关节炎、皮疹(如环形红斑)、紫癜、甲状腺腺瘤,雷诺现象等;(3)外分泌腺症状:复发性腮腺肿大、频繁龋齿、口腔疼痛、口疮、舌下囊肿、复发性红眼、眼内异物感、眼部发痒等;(4)干燥症状:进食时需大量饮水、口臭、无泪及其他类似表现。
(1)唾液淀粉酶升高,而唾液腺未见明显肿胀;(2)IgG水平高于相应年龄组第97.5百分位,或存在高丙种球蛋白血症;(3)白细胞减少或淋巴细胞减少;(4)ESR增快及其他类似问题。
(1)桥本氏甲状腺炎、无菌性脑膜炎、间质性肾炎、血小板减少性紫癜、葡萄膜炎;(2)其他结缔组织病,尤其是SLE、混合性结缔组织病和多关节型幼年特发性关节炎;(3)纤维肌痛综合征、慢性疲劳综合征和其他类似疾病。
病毒性疾病[如流行性腮腺炎,丙型肝炎病毒(HCV)、HIV、EB病毒感染等]、恶性肿瘤、结节病、移植物抗宿主病、头颈部放射治疗史、Stevens-Johnson综合征后遗症等。
其他结缔组织病、自身炎症性疾病、IgG4相关疾病、人类T细胞白血病病毒-1(HTLV-1)感染、复发性腮腺炎、纤维肌痛综合征、慢性疲劳综合征等。
血常规、ESR、血清淀粉酶、IgG、ANA、RF、尿常规检查(蛋白、潜血、pH值)等。
(1)血清学检查:抗SSA/Ro抗体、抗SSB/La抗体;(2)外分泌腺体功能障碍相关检查包括:唾液腺相关检查[唾液分泌:未刺激全唾液流率、刺激后唾液流率(如Saxon试验、口香糖试验等);病理学检查:唇腺活检;影像学检查:腮腺造影(常规造影或磁共振造影)、唾液腺显像、超声检查等]、泪腺相关检查[泪液分泌:Schirmer Ⅰ试验;结膜和角膜上皮损伤:眼部染色(荧光素,玫瑰红,丽丝胺绿);病理学检查:泪腺活检]。
(1)病毒抗体:如腮腺炎、HCV、HIV、HTLV-1相关抗体等;(2)自身抗体:如抗dsDNA、抗Sm、抗U1-RNP、抗CCP抗体、抗着丝粒抗体等。
(1)尿β2微球蛋白、N-乙酰氨基葡萄糖酶;(2)甲状腺功能[促甲状腺激素(TSH)、游离T3、游离T4],抗甲状腺过氧化物酶抗体、抗甲状腺球蛋白抗体、促甲状腺激素受体抗体/结合抑制免疫球蛋白(TRAb/TBII)、促TSH抗体、IgA、IgM等。
包括S评分和G评分两部分。
(1)血清IgG水平:高于相应年龄组的第97.5百分位,计1分(注:间隔至少3个月,对2次或2次以上符合标准的异常值进行评分);(2)ANA滴度:1∶40~1∶80,计1分;滴度为1∶160,计2分;滴度≥1∶320,计3分;(3)RF水平≥15.0 U/L,计3分(注:由于RF阳性不具有特异性,仅在ANA阳性的前提下计入评分);(4)抗SSA/Ro抗体或抗SSB/La抗体阳性:Ouchterlony法测量值≥l∶l或酶联免疫吸附法测量值高于参考值,计6分。
(1)唾液腺评分包括:唇腺活检:细胞浸润明显,但每4 mm2<1个灶(导管周围单个核细胞浸润超过50个),计1分;细胞浸润明显,且每4 mm2≥1个灶,计2分;腮腺造影:Rubin-Holt分级≥l级,计2分;唾液腺显像:4个主要唾液腺中的任何一个腺体显像结果提示摄取或分泌减少,计1分;唾液分泌:3项试验(Saxon测试结果≤2.0 g/2 min、静息唾液产生速率≤1.5 mL/15 min、口香糖测试结果≤10 mL/10 min)中任一项阳性,计1分;单纯唾液分泌减少不计分,只有在其他几项唾液腺评分项目也存在异常时,该项才计分。(2)泪腺评分:以下三项中满足任一项,计2分:Schirmer试验≤5 mm/5 min,且玫瑰红试验阳性(即van Bijsterveld评分≥3分);Schirmer试验≤5 mm/5 min,且角膜荧光染色阳性;ACR评分(角膜和结膜染色)>13分。
SS尚无满意的治疗方案,缺乏循证医学论证的有效药物。现使用的药物多为医师的经验性治疗,或者根据类似病变来进行诊治。儿童SS患者的治疗参照成人SS的治疗。针对局部症状和系统症状可以分为局部治疗、系统治疗[20]。局部治疗主要指针对口干燥症、眼干燥症治疗。儿童患者口眼干燥症状不明显,局部治疗较少应用,预防更为重要。口干燥症:注意口腔卫生,预防口腔疾病;根据唾液腺腺体功能受损程度不同使用不同药物刺激唾液腺分泌,重度无残留腺体功能者使用人工涎液。眼干燥症:注意用眼卫生,避免使用减少泪液的药物;根据不同严重程度和对各种治疗的反应进行调整。一般建议使用人工泪液,难治者或严重者可使用免疫抑制剂的滴眼液或经处理后的小牛血清或血清替代物;或在眼科医师指导下,糖皮质激素滴眼液可短期应用(不超过2~4周)。而系统治疗主要原则是:(1)根据SS疾病活动度指数评分进行综合评估后针对性治疗器官损伤;(2)尽量以最小剂量、合适的疗程控制活动性全身疾病状态;(3)免疫抑制剂需联合激素治疗;(4)B细胞靶向治疗用于重症、复发性全身疾病状态;(5)激素作为一线治疗药物,免疫抑制剂及生物制剂可作为二、三线治疗药物;(6)并发症B细胞淋巴瘤应根据病理及疾病严重程度进行个体化治疗[3]。常用免疫抑制剂有羟氯喹、甲氨蝶呤、柳氮磺胺吡啶、霉酚酸酯、环孢霉素、环磷酰胺等。生物制剂肿瘤坏死因子α抑制剂用于治疗pSS合并关节炎或其他重叠综合征;利妥昔单抗用于治疗pSS严重口干、眼干等症状及难治性全身治疗,需注意药物不良反应[21]。儿童sSS的治疗则以治疗原发疾病为主,原发病缓解后干燥相关症状即可获得缓解。
儿童pSS可能是成人pSS发病前的亚临床状态,是成人患者的最佳治疗窗口期。建立适合于儿童pSS早期诊断且具有高敏感性和特异性的诊断标准至关重要,以期在儿童期即进行诊断和干预,防止器官损伤,预防淋巴瘤发生。早期诊断除了依赖于良好分类标准外,生物学标志有助于早期发现pSS及其并发症。
目前已应用于pSS诊断的生物学标志有抗SSA、抗SSB抗体、RF等,但均不能兼顾敏感性及特异性。抗SSA抗体诊断pSS敏感性较高,其阳性率可达68.2%~89.3%,抗SSB抗体的阳性率达47.5%[22]。抗SSA及抗SSB抗体还可用于评估pSS并发症。抗SSA/SSB抗体阳性的pSS患者更易发生高血压、高胆固醇血症、静脉血栓栓塞、脑血管疾病及多发性骨髓瘤[23,24,25]。抗SSA抗体阳性患者较阴性患者更易发生肺部毛玻璃样变和肺功能损害[26]。IgA-RF在pSS患者中升高,诊断pSS具有一定的敏感性和特异性[27,28],但均为单中心研究,但尚需更大样本研究以进一步证实。但RF浓度高的pSS患者更易并发淋巴瘤[29],可用于pSS预后的预测因素。最新研究发现microRNA及趋化因子参与了pSS及其并发症的发病机制[30];microRNA-146a联合抗SSA/SSB抗体可提高pSS的诊断率[31]。CXCL10、CXCR3也可作为pSS诊断的有效生物学标志[32]。抗α-fordrin抗体是pSS独有的自身免疫性抗体,联合抗SSA和SSB抗体诊断pSS准确率达92.31%[33]。
综上所述,儿童pSS或sSS的临床表现、实验室及诊断性检查均相似,二者可采用同一评分标准。儿童sSS临床表现介于SS与原发病之间,治疗则需针对原发病积极治疗。儿童SS患者较成人患者有其独特性,诊断与治疗除了借鉴成人患者经验外,更需结合最新研究进展,不断探索适用于儿童SS更完善的方法,以期改善儿童SS甚至是所有SS患者群体的预后。
所有作者均声明不存在利益冲突