本指南由肾脏病学、心血管病学、重症医学、循证医学等多学科专家组成的编写委员会共同撰写,针对心肾综合征的预测、诊断和病情评估、预防、治疗药物及其选择、器械循环辅助装置和血液净化治疗、心脏和(或)肾脏移植、主要并发症治疗、多学科联合治疗以及儿童与妊娠女性诊疗特殊性8个临床问题,主要基于心肾综合征、心力衰竭及慢性肾脏病的循证证据,同时借鉴和参考了相关领域的国内外临床指南,提出推荐/建议意见。目的在于指导、规范心肾综合征的诊断、预防、治疗与管理的临床实践,同时推动临床试验的开展,提高疾病防治和科研水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
依据2008年急性透析质量倡议(ADQI)发布的CRS共识,CRS定义为心脏或肾脏疾病引发的其中一个器官的急性或慢性功能障碍诱发另一个器官的急性或慢性功能障碍的临床综合征[1]。因此,CRS是心脏和肾脏的功能诊断,而非疾病诊断;多种心脏或肾脏疾病均可引起CRS。ADQI共识根据CRS启动因素,将CRS分为5型(表1)[2]。

ADQI共识的心肾综合征分型[2]
ADQI共识的心肾综合征分型[2]
| 分型 | 全称 | 描述 | 举例 |
|---|---|---|---|
| 1型 | 急性心肾综合征 | 急性心力衰竭导致肾功能障碍 | 心源性休克或急性心力衰竭引起AKI |
| 2型 | 慢性心肾综合征 | 慢性心力衰竭导致肾功能障碍 | 慢性心力衰竭引起慢性肾衰竭 |
| 3型 | 急性肾心综合征 | AKI导致心功能障碍 | AKI引起急性心力衰竭 |
| 4型 | 慢性肾心综合征 | 慢性肾衰竭导致心脏疾病 | 慢性肾衰竭引起的心肌病变和慢性心力衰竭 |
| 5型 | 继发性心肾综合征 | 系统性疾病同时导致心脏和肾脏功能障碍 | 脓毒症、淀粉样变性等引起的AKI、慢性心力衰竭和急、慢性肾衰竭 |
注:ADQI为急性透析质量倡议;AKI为急性肾损伤
尽管Hatamizadeh等[2]提出了一种基于CRS病理生理和临床表现的CRS分型方案;中国学者亦在ADQI共识CRS分型基础上提出了CRS的6型分型方案,将ADQI共识CRS分型中的5型再分为急性继发性CRS(5型)和慢性继发性CRS(6型)[3];但是,基于CRS病理生理和临床表现的CRS分型中,同一种CRS分型的病因复杂,不利于指导临床实践,CRS的6型分型方案中慢性全身性疾病患者多数情况下发生慢性心力衰竭(心衰)或慢性肾衰竭存在时间间隔,难以与2型或4型CRS鉴别;因此,本指南采用ADQI共识的CRS分型方案。
CRS是一种常见的临床综合征。西班牙巴伦西亚社区30 529例急性心衰患者3.2年随访研究中,14.3%的患者发生1次1型CRS,4.5%的患者发生≥2次1型CRS[4]。美国社区动脉粥样硬化风险研究与心血管健康研究(ARCSCH)中13 826例慢性心衰患者个体数据汇总分析结果显示,随访9年期间2型CRS发生率为34%[5]。丹麦多中心21 556例重症监护病房(ICU)患者3年随访中3型CRS发生率为5.0%[6]。1998年和1999年1 091 201例美国联邦医疗保险人群中,慢性肾脏病(CKD)不合并糖尿病患者4型CRS发生率为30.7/100患者年,合并糖尿病患者4型CRS发生率为52.3/100患者年[7]。合并严重脓毒症和感染性休克ICU患者的5型CRS发生率67%~76%[8]。
尽管在2008年ADQI首次就CRS定义、分型、诊断和治疗达成了专家共识[1],且近年来CRS领域取得了许多进展,国外CRS专家共识也进行了更新[9]。然而,中国CRS临床诊疗中还存在许多问题,主要表现为:(1)临床医师的认识不足,CRS诊断率低下;(2)CRS治疗不规范;(3)基于中国患者的CRS临床研究较少。因此,为更好地指导我国医师的临床实践和临床研究,中国医师协会肾脏内科医师分会组织我国多学科专家共同制订《心肾综合征诊疗的临床实践指南(2023版)》(本指南),旨在规范我国CRS的诊断与治疗。
本指南制订遵循世界卫生组织(WHO)发布的《世界卫生组织指南制订手册》(第二版)及中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》,并依据国际实践指南报告标准和指南研究与评价工具撰写[10, 11, 12, 13]。中国医师协会肾脏内科医师分会组织肾脏病学、心血管病学、重症医学、循证医学等多学科专家建立指南撰写专家工作组,重点针对CRS的预测、诊断和病情评估、预防、治疗药物及其选择、器械循环辅助装置和血液净化治疗、心脏和(或)肾脏移植、主要并发症治疗、多学科联合治疗以及儿童与妊娠女性CRS诊疗特殊性8个临床问题,检索Medline、Embase、Web of Science、Cochrane Library、Epistemonikos、中国生物医学文献数据库、万方数据库和中国知网,并通过医脉通、UpToDate、百度学术搜索等进行补充检索,形成指南撰写的循证医学证据。采用2009版牛津大学循证医学中心的证据分级和推荐强度标准对推荐意见的证据水平和推荐级别进行分级(表2)。

2009版牛津大学循证医学中心的证据水平与推荐级别
2009版牛津大学循证医学中心的证据水平与推荐级别
| 推荐级别 | 证据水平 | 临床问题 |
|---|---|---|
| A | 1a | 同质性良好的随机对照试验的系统综述 |
| 1b | 单个随机对照试验(可信区间窄) | |
| 1c | “全或无”的系列病例报告 | |
| B | 2a | 同质性良好的队列研究的系统综述 |
| 2b | 单个队列研究或低质量随机对照试验如随访率<80% | |
| 2c | 结局研究 | |
| 3a | 同质性良好的病例-对照研究的系统评价 | |
| 3b | 单个病例-对照研究 | |
| C | 4 | 系列病例研究(包括低质量队列或病例-对照研究) |
| D | 5 | 基于经验的专家意见或病理生理基础上的意见 |
注:A级为证据极有效,推荐;B级为证据有效,可推荐,也可能在将来更高质量的新证据出现而改变;C级为证据在一定条件下有效,应谨慎应用研究结果;D级为证据的有效性局限,只在较窄的范围内有效
本指南已在国际实践指南注册平台注册(注册号:IPGRP-2021CN418)。本指南的推荐意见采用专家一致性原则,存在不同专家意见时,采用投票超过 2/3的专家意见。2021—2022年经过4次专家讨论会进行修改,共同编制了本指南。此后广泛征求了心血管、肾脏病、重症医学等专业医护人员的意见,进行修订与完善,完成定稿。本指南推荐意见的目标人群是中国CRS患者,供内科(肾脏病科、心血管病科、呼吸内科等)、外科(心外科、胸外科等)、重症医学科、急诊科、临床检验科、影像科、药剂科及其他与CRS诊疗和管理相关学科的专业人员使用。本指南不具备强制性,不作为医疗事故鉴定和医学责任认定依据;计划在3~5年内按照国内外指南更新要求进行更新。
【推荐意见】
·急性心衰患者,建议动态、及时检测尿金属蛋白酶组织抑制剂2(TIMP-2)与胰岛素样生长因子结合蛋白7(IGFBP7)、血液与尿液的中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、胱抑素C及估算肾小球滤过率(eGFR)等急性肾损伤(AKI)预警指标,预测1型CRS发生。(2c,B)
·慢性心衰患者,应明确是否合并CKD,建议定期评估心衰程度、尿蛋白与eGFR变化,预测2型CRS发生。(2c,B)
·AKI和慢性肾衰竭患者建议依据病情及时检测尿白蛋白/尿肌酐比值(ACR)与eGFR,以及B型利钠肽(BNP)与N末端B型利钠肽前体(NT-proBNP)、心肌肌钙蛋白T(cTnT)和(或)心肌肌钙蛋白I(cTnI)及超声心动图等心功能和心肌损伤指标,预测3、4型CRS发生。(2c,B)
·建议全身系统性疾病患者依据病情及时检测血清C反应蛋白(CRP)与白细胞介素(IL)-6等炎症指标以及AKI预警和心功能与心肌损伤指标,预测5型CRS发生。(2c,B)
1. 急性心衰患者发生1型CRS的危险因素:1 709例急性心衰患者的回顾性分析结果显示,1型CRS发生率为32.2%;年龄≥70岁、反复心衰史、收缩压<90 mmHg(1 mmHg=0.133 kPa)、血钠<130 mmol/L、心功能分级、蛋白尿、基线血肌酐≥104 μmol/L及静脉注射呋塞米最大日剂量≥80 mg/d是1型CRS发生的独立危险因素[14]。1 058例急性心衰患者的回顾性分析结果显示,CRP>29.9 mg/L、血尿酸>479 μmol/L、血清白蛋白<30 g/L、血红蛋白(Hb)<110 g/L、入院后48 h 内使用利尿剂和血管活性药物是1型CRS发生的独立危险因素[15]。
2. 急性心衰患者预测1型CRS发生的生物学标志物
(1)TIMP-2与IGFBP7组合:400例急性失代偿性心衰患者中,尿液TIMP-2×IGFBP7>2.0(ng/ml)2/1 000预测24 h内AKI 2~3级发生的特异度为95%[16]。
(2)NGAL:231例急性心衰患者的前瞻性、随机、单中心试验研究亚组分析中,以入院血清NGAL水平134 ng/ml作为临界值,预测AKI发生的灵敏度85%、特异度80%、受试者工作特征(ROC)曲线的曲线下面积(AUC)为0.81[17]。
(3)尿沉渣:249例AKI患者前瞻性队列研究结果显示,基于肾小管上皮细胞和颗粒管型数量建立的尿沉渣评分系统可作为预测住院期间急性肾小管坏死或肾前性AKI恶化的有用工具[18]。
(4)胱抑素C:200名健康受试者和130例AKI患者2年的队列研究结果显示,56.2%的AKI患者早期血肌酐水平正常,但全部AKI患者血胱抑素C水平升高[19]。包括79例急性和慢性CRS患者及35名志愿者的比较多个CRS生物学标志物的研究结果显示,血胱抑素C水平对识别急性CRS最有价值[20]。
(5)eGFR:基于肾脏病膳食改良试验(MDRD)方程计算的eGFR是急性CRS的独立危险因素[20]。
(6)多种生物学标志物联合:2 094例急性心肌梗死患者的回顾性分析证实联合NT-proBNP、eGFR和高敏CRP有助于对急性心肌梗死患者院内发生1型CRS进行危险分层[21]。
(7)心脏和肾脏多普勒超声:90例急性失代偿性心衰住院患者中,住院后24 h时肾脏阻力指数、左心室(左室)射血分数(LVEF)和血胱抑素C是肾功能恶化的独立预测因素,24 h时肾脏阻力指数≥57.8 ms预测肾功能恶化的灵敏度为89%,特异度为70%[22]。
1. 慢性心衰患者发生2型CRS的危险因素:1 275例慢性心脏病住院患者的回顾性分析中,年龄、白蛋白和尿酸水平是2型CRS的独立危险因素[23]。
2. 慢性心衰患者预测2型CRS发生的生物学标志物:目前缺乏预测慢性心衰患者发生2型CRS的生物学标志物。合并检测CKD进展[尿蛋白转阳/持续增加和(或)eGFR持续降低]及心脏功能持续恶化[BNP或NT-proBNP持续升高和(或)LVEF持续降低]指标,有助于预测慢性心衰患者发生2型CRS。
1. AKI患者发生3型CRS的危险因素:135 例患者AKI的回顾性分析中,3 型CRS发生率为27.4%;年龄、左室舒张功能减退、CKD病史、胆固醇升高是 AKI 患者发生 3 型CRS的独立危险因素[24]。
2. 慢性肾衰竭患者发生4型CRS的危险因素及预测指标:27个队列40 112例CKD患者的荟萃分析结果显示,ACR是预测心衰的最重要因素,并且ACR与eGFR组合预测心衰优于糖尿病、收缩压、胆固醇、高密度脂蛋白及吸烟等心血管疾病的传统危险因素[25]。
883例CKD患者的观察性队列研究中,调整人口统计学、心血管疾病风险因素和肾功能后,血清生长分化因子-15(GDF-15)每增加1个标准差,心衰事件风险增加56%[26]。3 860例2~4期CKD患者的前瞻性队列中位随访3.7年结果显示,血清成纤维细胞生长因子23(FGF-23)水平倍增,充血性心衰风险增加45%(95%CI:1.28~1.65)[27]。
3.预测心衰的生物学标志物
(1)BNP和NT-proBNP:452例急性呼吸困难患者前瞻性、随机、对照研究结果显示,快速测定BNP可改善急性呼吸困难患者的评估和治疗[28]。3 483例无心衰的慢性肾衰竭前瞻性队列(CRIC)研究中,调整混杂因素后,与NT-proBNP<47.6 ng/L患者相比,NT-proBNP>433.0 ng/L患者心衰发生率明显升高[29]。
(2)cTnT或cTnI:肌钙蛋白水平可指导心衰的风险分层和决策制定[30]。3 483例无心衰的慢性肾衰竭前瞻性队列研究中,调整混杂因素后,与未检测到cTnT的患者相比,cTnT>26.5 ng/L患者的心衰发生率显著升高[29]。
4.预测心衰的影像学指标
(1)超声心动图:是评估心脏结构和功能的首选影像学检测方法[31]。30 681例至少接受过1次超声心动图检查患者10年回顾性队列研究结果显示,LVEF降低、肺动脉压升高和右室内径增大与CRS发生率升高独立相关[32]。
(2)胸部X线与肺部超声:胸部X线是确诊左心衰肺水肿的主要依据及鉴别肺源性呼吸困难与心源性呼吸困难的重要手段。24例充血性心衰患者和31例无充血性心衰患者的前瞻性、盲法研究中,胸部X线识别充血性心衰的灵敏度59%、特异度96%;阳性似然比14.6,阴性似然比0.43 [33]。25项研究4 241例实施肺部超声检测的肺炎、急性心衰和慢性阻塞性肺疾病/哮喘患者的荟萃分析中,肺部超声诊断急性心衰的ROC曲线AUC为0.914,灵敏度90%,特异度93%[34]。
(3)心脏MRI:是测量左右心室容量、质量和射血分数的“金标准”,对于超声心动图未能明确诊断的疑似充血性心衰患者可选择性应用[35, 36]。此外,心脏MRI具有无创诊断心肌纤维化和坏死的能力[37, 38]。
(4)心电图:虽然心衰无特异心电图表现,但对判断患者是否存在心肌缺血或(和)梗死以及心动过速、心房颤动、传导阻滞等心律失常具有重要价值,并且对心衰的病因具有诊断价值[39]。
(5)其他心脏影像学:可依据患者病情选择应用冠状动脉造影、负荷超声心动图、核素心肌灌注和(或)代谢显像等检查评估冠状动脉情况及心肌缺血情况。
【推荐意见】
· CRS诊断应首先明确急、慢性心衰和(或)AKI与慢性肾衰竭的诊断,进而依据急、慢性心衰与AKI及慢性肾衰竭的发生顺序进行CRS分型诊断。(5,D)
· 推荐BNP和NT-proBNP作为诊断心衰的首选血清标志物。(1a,A)
· 单纯血肌酐水平不能诊断肾功能不全,需要综合eGFR、血肌酐、血尿素氮和血胱抑素C水平,才能诊断肾功能不全。(5,D)
· 心脏或肾脏的影像学检查是CRS诊断所必须。(5,D)
· CRS患者应进一步诊断并发症与原发疾病。(5,D)
1. 明确心衰的诊断:心衰的诊断依赖于患者的症状、体征、实验室检测和心脏影像学检查,但心衰的症状和体征的特异性不足,仅凭症状和体征进行诊断,灵敏度和特异度均不佳[40]。多部国内外临床实践指南推荐BNP和NT-proBNP作为心衰首选血清标志物[35, 36,41]。此外,NT-proBNP国际专家共识建议NT-proBNP≥300 ng/L诊断急性心衰的准确率优于临床诊断;NT-proBNP<125 ng/L可排除慢性心衰,但NT-proBNP≥125 ng/L不适合作为慢性心衰的诊断标准[42]。需要注意的是,由于肾功能可影响BNP与NT-proBNP的代谢,因此肾衰竭患者诊断心衰的NT-proBNP界值需要依据肾功能水平进行校正。中国心衰诊断和治疗指南建议eGFR<60 ml·min-1·(1.73 m2)-1、NT-proBNP>1 200 ng/L时才可能诊断急性心衰[36]。评估心衰的BNP和NT-proBNP界值见表3。
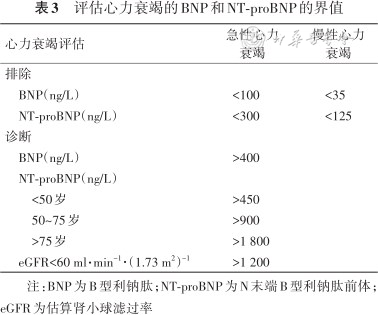
评估心力衰竭的BNP和NT-proBNP的界值
评估心力衰竭的BNP和NT-proBNP的界值
| 心力衰竭评估 | 急性心力衰竭 | 慢性心力衰竭 |
|---|---|---|
| 排除 | ||
| BNP(ng/L) | <100 | <35 |
| NT-proBNP(ng/L) | <300 | <125 |
| 诊断 | ||
| BNP(ng/L) | >400 | |
| NT-proBNP(ng/L) | ||
| <50岁 | >450 | |
| 50~75岁 | >900 | |
| >75岁 | >1 800 | |
| eGFR<60 ml·min-1·(1.73 m2)-1 | >1 200 |
注:BNP为B型利钠肽;NT-proBNP为N末端B型利钠肽前体;eGFR为估算肾小球滤过率
超声心动图有助于诊断心功能障碍,但心衰包括心脏收缩功能衰竭和心脏舒张功能障碍,因此不能单纯依据LVEF降低诊断心衰。
2021年美国心脏协会/美国心脏病学会/美国心衰学会(AHA/ACC/HFSA)心衰管理指南建议,依据LVEF水平将心衰分为:(1)射血分数降低型心衰(HFrEF):LVEF≤40%;(2)射血分数改善型心衰(HFimpEF):既往LVEF≤40%且随访LVEF>40%;(3)射血分数轻度降低型心衰(HFmrEF):LVEF 41%~49%;(4)射血分数保留型心衰(HFpEF):LVEF≥50%[43]。
超声心动图是临床上最常用的诊断心脏舒张功能不全的影像技术[36]。LVEF正常患者左室舒张功能异常的评估标准:(1)二尖瓣环e′速度(室间隔e′<7 cm/s或侧壁e′<10 cm/s);(2)平均E/e′>14;(3)左心房(左房)容量指数(LAVI)>34 ml/m2;(4)三尖瓣最大反流速度(TR)>2.8 m/s。满足4项标准中>2项提示左室舒张功能异常,满足4项标准中<2项提示左室舒张功能正常,满足4项标准中的2项则不能确定,需要结合其他临床信息判定;同时存在收缩期心房整体纵向应变减低提示左室充盈压增高,左室舒张功能异常[31]。心脏MRI适用于超声心动图未能诊断的疑似心衰患者[35, 36]。
2. 明确肾功能不全的诊断:一般而言肾功能快速降低或eGFR<60 ml·min-1·(1.73 m2)-1、血肌酐>133 μmol/L、血尿素氮>20 mmol/L及血胱抑素C升高(不同检测方法正常范围值不同),可以诊断肾功能不全。但需要注意的是,血肌酐受种族、性别、年龄、营养状态、肝功能及多种药物等因素影响,并且在慢性肾衰竭时,因肾小管分泌肌酐的增多而降低了其反映肾功能状态的灵敏度;因此单纯血肌酐升高不能诊断肾功能不全,血肌酐值正常也不能排除肾功能不全。需要综合eGFR、血尿素氮和血胱抑素C的水平才能诊断是否存在肾功能不全。
1. 急性心衰的诊断标准:(1)起病急骤,可在数分钟或数小时内突然呈现,也可在数日内逐渐加重;(2)出现端坐呼吸、烦躁不安、呼吸频率可达30~40次/min及咯粉红色泡沫样痰等典型症状;(3)具有两肺广泛的水泡音和(或)哮鸣音及舒张期奔马律等典型体征;(4)BNP和NT-proBNP水平达到急性心衰的诊断阈值(表3);(5)胸部X线检查显示肺门血管影模糊、肺纹理增粗和肺小叶间隔增厚等。
2. 慢性心衰的诊断标准:(1)出现劳力性呼吸困难、夜间阵发性呼吸困难或端坐呼吸、咳嗽、咳痰和咯血、体力下降、倦怠乏力等症状;(2)具有水肿、胸腹腔积液、双侧肺底细湿啰音、颈静脉充盈、肝脏肿大等症状;(3)BNP≥35 ng/L和(或)NT-proBNP≥125 ng/L(单项指标不能诊断);(4)超声心动图检查提示心脏结构或功能疾病,如左室肥厚、心肌搏动减弱、瓣膜钙化、瓣膜狭窄或关闭不全、心包积液或缩窄等。
1. AKI诊断标准:48 h内血肌酐增加≥26.5 μmol/L、7 d内血肌酐增加≥1.5倍或尿量<0.5 ml·kg-1·h-1超过6 h[44]。但是,对于那些不知道既往血肌酐水平或不伴有少尿的AKI患者该标准则不能诊断。检测患者尿肌酐排泄量对于早期发现AKI具有重要意义,无论尿量是否减少,如果尿肌酐排泄量明显或进行性减少,则应高度警惕AKI发生[45]。
2. 慢性肾衰竭诊断标准:具有CKD病史、长期夜尿增多、在无失血的情况下发生中重度贫血、明显的高磷血症和低钙血症伴有全段甲状旁腺激素(iPTH)升高以及超声显示双侧肾脏缩小等支持慢性肾衰竭的诊断。需要注意的是,溶血尿毒综合征、淋巴瘤、白血病性肾损害、免疫球蛋白沉积性肾病、肾脏淀粉样变性、多囊肾及糖尿病肾病引起的慢性肾衰竭,肾脏无明显缩小或增大[46]。
依据急、慢性心衰与AKI及慢性肾衰竭的发生顺序进行CRS分型诊断:(1)先发生急性心衰,后发生AKI的患者诊断为1型CRS;(2)先发生慢性心衰,后发生慢性肾衰竭或AKI的患者诊断为2型CRS;(3)先发生AKI,后发生急性心衰的患者诊断为3型CRS;(4)先发生慢性肾衰竭,后发生急、慢性心衰或左室肥厚的患者诊断为4型CRS;(5)继发于系统性疾病或感染等全身性疾病,同时发生急性心衰与AKI,或同时发生慢性心衰与慢性肾衰竭的患者诊断为5型CRS。诊断5型CRS需注意:(1)心肾功能不全是为急性全身性疾病所致,具有明确因果关系;(2)新发的心肾功能不全;(3)或是既往存在心肾功能不全,且急性全身性疾病引起心肾功能不全急性加重。脓毒症引起的5型CRS可按照《中国严重脓毒症/脓毒性休克治疗指南(2014)》进行诊断[47]。
CRS常见的急性并发症包括低血压或心源性休克、心律失常、猝死、感染、急性肺损伤或肺功能障碍、消化道应激性溃疡以及水电解质与酸碱平衡紊乱等,慢性并发症包括高血压、贫血、CKD-矿物质和骨代谢紊乱(CKD-MBD)、营养不良、肝硬化及神经精神病变等。应常规检测血常规、便潜血、血生化(肝功能、电解质、血糖、血脂等)、血气分析、iPTH及心电图、胸部X线、超声心动图等检查明确诊断。
1. 引起心衰的常见疾病:心肌损害是引起心衰的主要病因,识别病因有助于尽早采取特异性和针对性心衰治疗,预防CRS发生。通过原发或继发心脏病的病史、cTnT或cTnI等心肌损伤标志物的检测以及心电图、胸部X线、超声心动图、心脏CT或MRI、心脏血管造影及心肌组织病理等检查明确诊断。
2. 引起AKI的常见疾病
(1)肾前性AKI:各种病因引起的循环血容量和肾脏灌流量不足导致的AKI。下列检查结果支持肾前性AKI诊断:①尿相对密度>1.015;②尿渗透浓度>500 mOsm/L;③尿钠浓度<20 mmol/L;④血尿素氮(mmol/L)/血肌酐(μmol/L)的比值乘以248>10;⑤钠排泄分数<1[45]。
(2)肾后性AKI:肾结石、膀胱肿瘤、前列腺肥大、腹膜后纤维化以及免疫球蛋白沉积性肾病导致肾小管阻塞等疾病。通过肾脏超声、CT及磁共振水成像检查进行诊断。
(3)肾性AKI:原发或继发性肾小球肾炎、急性肾小管坏死、急性间质性肾炎、急性肾脏梗死或急性肾静脉血栓以及持续性肾前性AKI或肾后性AKI导致肾实质损伤,发生肾性AKI。常规进行尿常规、尿微量白蛋白及24 h尿蛋白定量检测,并选择性检测上述肾小管损伤标志物;临床上疑诊肾血管性AKI患者,应实施肾动脉和(或)肾静脉血管超声/造影检查,必要时可实施磁共振三维成像检查以明确诊断;疑诊肾小球肾炎、肾小管坏死或急性间质性肾炎患者,应尽早实施肾脏组织活检,以明确原发病诊断、指导治疗。
3. 引起慢性肾衰竭的常见疾病:CKD持续进展均可导致慢性肾衰竭,包括:各种原发或继发性肾小球肾炎、高血压性肾损害、糖尿病肾脏疾病、梗阻性肾病、肾小管间质性疾病以及常染色体显性遗传性多囊肾等遗传性疾病。常规进行尿常规、尿微量白蛋白及24 h尿蛋白定量检测,并选择性检测肾小管损伤标志物以及肾脏超声、CT、MRI等检查,必要时考虑遗传基因检测或肾脏组织活检明确诊断。
CRS诊断流程和推荐的选择检测项目见图1。
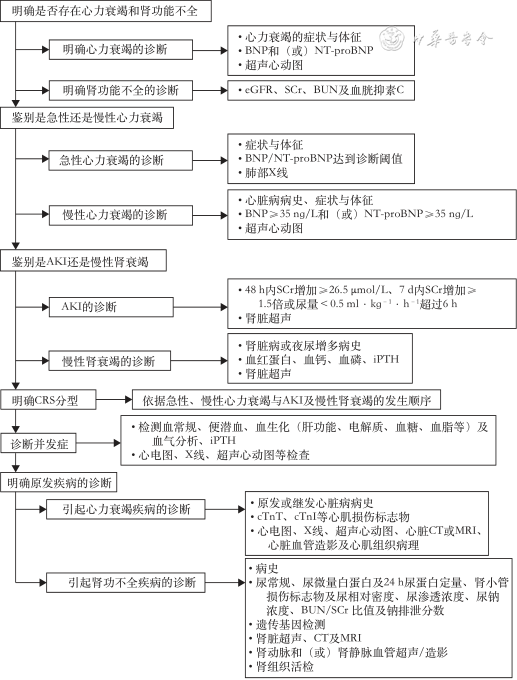

注:CRS为心肾综合征;BNP为B型利钠肽;NT-proBNP为N末端B型利钠肽前体;eGFR为估算肾小球滤过率;SCr为血肌酐;BUN为血尿素氮;AKI为急性肾损伤;iPTH为全段甲状旁腺激素;cTnT为心肌肌钙蛋白T;cTnI为心肌肌钙蛋白I
【推荐意见】
·建议根据纽约心脏协会(NYHA)心功能分级评估患者心功能状态。(5,D)
·推荐CRS患者常规检测BNP和(或)NT-proBNP、cTnT和(或)cTnI、超声心动图和心电图。(1b,A)
·建议1、3、5型CRS患者依据病情随时监测上述指标,2、4型CRS患者至少每3个月检测1次。(5,D)
·建议1、3、5型CRS患者常规进行胸部X线检查,并依据病情随时监测,2、4型CRS患者可依据病情选择性检查。(5,D)
·建议CRS患者依据病情选择性检查心脏MRI、冠状动脉造影,以明确心脏功能状态及原发疾病的诊断。(5,D)
1.心功能分级:NYHA心功能分级(表4)评估患者心功能状态[48]。

NYHA心功能分级
NYHA心功能分级
| 分级 | 症状 |
|---|---|
| Ⅰ | 活动不受限:日常体力活动不引起明显的气促、疲乏或心悸 |
| Ⅱ | 活动轻度受限:休息时无症状,日常活动可引起明显的气促、疲乏或心悸 |
| Ⅲ | 活动明显受限:休息时可无症状,轻于日常活动即引起显著的气促、疲乏、心悸 |
Ⅳ Ⅳa Ⅳb | 休息时也有症状,任何体力活动均会引起不适 无需静脉给药,可在室内或床边活动者 不能下床并需静脉给药支持者 |
注:NYHA为纽约心脏协会
2. 心功能与心肌损伤指标的监测及其频率:(1)诊断CRS患者应定期监测或选择性检测心功能与心肌损伤指标,包括BNP和(或)NT-proBNP、cTnT和(或)cTnI及超声心动图、胸部X线、心脏MRI、心电图、冠状动脉造影等检查。(2)对于1、3、5型CRS患者,应动态、随时评估心功能状态与心肌损伤指标;对于2、4型CRS患者,应依据病情至少每3个月评估1次心功能状态与心肌损伤指标,以指导临床决策和调整治疗方案。CRS患者的各项心功能与心肌损伤指标的选择及其监测频率见表5。
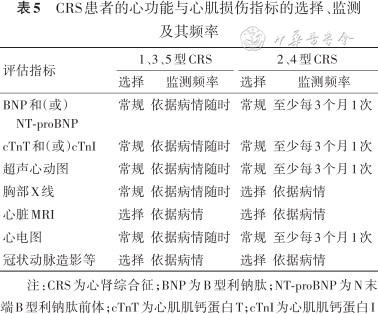
CRS患者的心功能与心肌损伤指标的选择、监测及其频率
CRS患者的心功能与心肌损伤指标的选择、监测及其频率
| 评估指标 | 1、3、5型CRS | 2、4型CRS | ||
|---|---|---|---|---|
| 选择 | 监测频率 | 选择 | 监测频率 | |
| BNP和(或)NT-proBNP | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 |
| cTnT和(或)cTnI | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 |
| 超声心动图 | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 |
| 胸部X线 | 常规 | 依据病情随时 | 选择 | 依据病情 |
| 心脏MRI | 选择 | 依据病情 | 选择 | 依据病情 |
| 心电图 | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 |
| 冠状动脉造影等 | 选择 | 依据病情 | 选择 | 依据病情 |
注:CRS为心肾综合征;BNP为B型利钠肽;NT-proBNP为N末端B型利钠肽前体;cTnT为心肌肌钙蛋白T;cTnI为心肌肌钙蛋白I
【推荐意见】
·推荐根据改善全球肾脏病预后组织(KDIGO)AKI临床实践指南进行AKI分级,评估AKI病情;依据KDIGO CKD评估与管理临床实践指南进行CKD分期,评估慢性肾衰竭病情。(5,D)
·推荐CRS患者常规检测尿常规、尿微量白蛋白、24 h尿蛋白定量以及血肌酐、血胱抑素C和eGFR。(2b,B)
·建议1、3、5型CRS有尿的患者依据病情随时监测上述指标,2、4型CRS患者至少每3个月检测1次。(2c,B)
·建议CRS患者常规进行肾脏超声检测,选择性检查肾脏MRI、肾脏同位素计算机断层扫描(ECT)或同位素肾图,以明确原发疾病的诊断。(5,D)
1. AKI分级:依据2012年KDIGO AKI临床实践指南建议,AKI分级标准见表6[44]。

2012年KDIGO急性肾损伤临床实践指南提出的急性肾损伤分级标准
2012年KDIGO急性肾损伤临床实践指南提出的急性肾损伤分级标准
| 分级 | 血肌酐标准 | 尿量标准 |
|---|---|---|
| 1 | 较基线升高1.5~1.9倍 或较基线升高≥26.5 μmol/L(0.3 mg/dl) | <0.5 ml·kg-1·h-1持续6~12 h |
| 2 | 较基线升高2.0~2.9倍 | <0.5 ml·kg-1·h-1持续≥12 h |
| 3 | (1)较基线升高3.0倍 (2)或血肌酐≥353.6 μmol/L(4.0 mg/dl) (3)或开始接受肾脏替代治疗 (4)或<18岁患者eGFR≤35 ml·min-1·(1.73 m2)-1 | <0.3 ml·kg-1·h-1持续≥24 h,或无尿≥12 h |
注:KDIGO为改善全球肾脏病预后组织;eGFR为估算肾小球滤过率
2. 慢性肾衰竭分期:参照2012 KDIGO CKD评估与管理临床实践指南,依据eGFR≥90、60~<90、45~<60、30~<45、15~<30、<15 ml·min-1·(1.73 m2)-1,CKD分为1、2、3a、3b、4、5期[49];一般而言3期以上的CKD可诊断慢性肾衰竭。
3. 肾脏功能状态与肾损伤的评估
(1)尿液检测:①尿常规:AKI患者的尿相对密度>1.015对肾前性AKI具有诊断价值;尿红细胞数量与形态、尿蛋白及不同的管型对鉴别肾小球疾病与肾间质疾病具有诊断价值;尿白细胞与肾小管上皮细胞对肾间质疾病诊断具有一定价值。基于肾小管上皮细胞和颗粒管型数量的尿沉渣严重程度评分在评估住院期间CRS患者AKI进展方面具有预测价值[18]。②尿微量白蛋白:包括ACR和尿微量白蛋白排泄率(UAER)。慢性心衰患者随机、双盲、安慰剂对照试验(GISSI-HF研究)76个中心2 131例患者的分析结果显示,ACR升高独立于糖尿病、高血压或肾功能,是慢性心衰患者的强有力预后标志物[50]。③24 h尿蛋白定量:是检测尿液中各种蛋白质的总量,包括尿白蛋白、微球蛋白、转铁蛋白、免疫球蛋白及Tatum-Horstall蛋白等,正常值<0.15 g/d。24 h尿蛋白定量有助于肾小球疾病与肾小管间质疾病的鉴别,尿蛋白>1 g/24 h且伴有血尿、水肿、高血压或eGFR下降等,提示肾小球疾病。④肾小管损伤的生物学标志物:尿胱抑素C、N-乙酰基-β-D-氨基葡萄糖苷酶(NAG)、α1微球蛋白、β2微球蛋白、肝脂肪酸结合蛋白(L-FABP)、肾损伤分子-1(Kim-1)、TIMP-2、IGFBP7、NGAL、IL-18等可反映肾小管损伤程度,不仅有助于AKI的早期诊断,而且可评估肾小管损伤的程度与持续状态。
(2)肾功能评估:①血肌酐:是目前临床最常用的肾功能指标,但受年龄、性别、种族、体表面积、营养状况、饮食和药物(如甲氧苄氨嘧啶、西咪替丁、酮酸和头孢菌素)的影响,而且不同的检测方法也影响血肌酐的检测水平[51, 52]。因此,美国肾脏基金会建议不应单独将血肌酐作为反映肾小球滤过率(GFR)的指标[53]。②血胱抑素C:811例急性失代偿性心衰的前瞻性随机对照试验发现,基线血胱抑素C水平与患者30 d不良事件风险增加、24 h后呼吸困难改善不良以及180 d死亡率相关[54]。胱抑素C是住院的1型CRS患者肾功能恶化的独立预测因子[55]。③eGFR:85项研究111余万心衰患者的荟萃分析结果显示,eGFR<60 ml·min-1·(1.73 m2)-1和肾功能恶化是患者死亡的独立预测因子[56]。基于血胱抑素C的Larsson公式计算eGFR比基于血肌酐的Cockcroft-Gault公式计算的eGFR更能反映AKI患者GFR下降和AKI恶化[19]。
(3)肾脏影像学检查:肾脏体积、皮质厚度、皮质/髓质比值等指标可以帮助判断肾脏病程,以鉴别1型与2型CRS,以及3型与4型CRS[57]。肾动脉阻力指数与肾脏实质的损伤程度正相关,对CKD及AKI患者肾损伤程度判断有一定价值[58, 59]。肾内静脉血流特征能比肾动脉阻力指数更好地预测急性心衰患者预后[60]。肾脏超声无法明确诊断的患者可行CT或MRI。肾脏ECT可较血肌酐更早地发现GFR变化,并能评估单侧肾脏滤过率[61]。
4. 肾功能状态与肾损伤程度监测频率:参考KDIGO慢性肾脏疾病管理(2012)指南,eGFR<60 ml·min-1·(1.73 m2)-1的患者每年评估2~4次;CKD 3期以上患者,建议每3个月1次[49]。参考《2016 ESC急慢性心衰的诊断与治疗指南》建议,使用稳定剂量肾素-血管紧张素-醛固酮系统(RAAS)抑制剂治疗的患者,应至少每4个月检测1次血肌酐、尿素氮、eGFR、血钠、血钾;RAAS抑制剂滴定治疗或上调剂量期间,应2周内检测血肌酐和血钾[40]。一般状态下CRS患者各项肾功能状态与肾损伤指标的选择及其监测频率见表7。
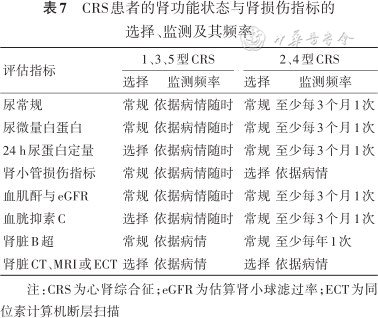
CRS患者的肾功能状态与肾损伤指标的选择、监测及其频率
CRS患者的肾功能状态与肾损伤指标的选择、监测及其频率
| 评估指标 | 1、3、5型CRS | 2、4型CRS | |||
|---|---|---|---|---|---|
| 选择 | 监测频率 | 选择 | 监测频率 | ||
| 尿常规 | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 | |
| 尿微量白蛋白 | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 | |
| 24 h尿蛋白定量 | 选择 | 依据病情随时 | 常规 | 至少每3个月1次 | |
| 肾小管损伤指标 | 常规 | 依据病情随时 | 选择 | 依据病情 | |
| 血肌酐与eGFR | 常规 | 依据病情随时 | 常规 | 至少每3个月1次 | |
| 血胱抑素C | 选择 | 依据病情随时 | 常规 | 至少每3个月1次 | |
| 肾脏B超 | 常规 | 依据病情 | 常规 | 至少每年1次 | |
| 肾脏CT、MRI或ECT | 选择 | 依据病情 | 选择 | 依据病情 | |
注:CRS为心肾综合征;eGFR为估算肾小球滤过率;ECT为同位素计算机断层扫描
【推荐意见】
· 建议依据临床症状、体征、BNP、NT-proBNP及糖类抗原125(CA125)等生物学标志物和实验室指标、生物电阻抗及影像学检查,综合评估容量状态。(2b,B)
· 对于合并血液动力学不稳定的患者,必要时选择中心静脉压、脉搏指示持续心输出量、腹腔内压等有创监测评估容量负荷。(2b,B)
· 容量负荷状态评估应包括总体容量状态、容量分布、血容量增加组分情况。(5,D)
·建议1、3、5型CRS患者依据症状、体征及治疗需求等及时、动态评估容量状态;2、4型CRS患者至少每3个月评估容量状态。(5,D)
容量负荷状态评估是容量管理的基础,应多维度、多层面进行分析评估[62]。
1.容量评估方法
(1)症状与体征:重点观察有无劳力性呼吸困难、夜间阵发性呼吸困难、端坐呼吸、水肿、腹胀等典型淤血症状,并评估有无颈静脉怒张、肝颈静脉回流征、肺部啰音、浆膜腔积液、肝脏肿大及水肿等体征[40]。体重检测是评估容量负荷简单易行的方法,心衰患者通常在出现肺淤血或体循环淤血症状之前已出现体重增加[63]。出入量的记录是容量评估的基础,CRS患者需精确记录患者出入量。
(2)实验室指标:BNP与NT-proBNP是目前临床最常用的反映容量负荷的生物学标志物,但其血液水平受肾功能影响。CA125可反映心衰患者浆膜腔积液和(或)炎症刺激的存在[64]。尿相对密度和血液红细胞压积也可反映容量状态,但分别受尿蛋白、尿糖等尿液成分以及贫血程度的影响;血尿素氮/血肌酐比值、尿钠浓度也可反映容量状态,但受饮食与肝肾功能影响;因此临床采用上述指标评估容量状态时应对相应的影响因素进行校正。
(3)生物电阻抗向量分析(BIVA):是一种无创容量检测方法,能有效鉴别心衰和非心衰导致的呼吸困难;BIVA结合BNP检测指导心衰患者利尿治疗能减少AKI的发生[65]。
(4)影像学检查:利用胸部X线、心血管超声测量心脏腔室大小、心胸比值、下腔静脉直径、心包腔和胸腔积液等,可一定程度评估容量状态。肺部超声诊断急性血流动力学改变造成的肺水肿,灵敏度95%,特异度97%[66]。
(5)血液动力学有创监测:中心静脉压水平可反映静脉回流极限和所有胸腔外器官后向回流压力,中心静脉压急剧增加时需考虑严重心脏功能障碍,特别是右心衰竭[67];但是中心静脉压受到胸腔、心包和腹腔压力的影响,外周水肿、腹水、肾脏和肝脏损伤与中心静脉压绝对数值密切相关,因此解读中心静脉压需兼顾上述因素。利用脉搏指示持续心输出量监测装置检测脉搏变异(PPV)和每搏变异(SVV)等可分析患者容量反应性、全心舒张末期容积、胸腔内血容积、血管外肺水及肺血管通透性指数,有助于系统、整体评价容量状态和血流动力学;但当患者自主呼吸驱动过强、存在心律失常、合并严重瓣膜疾病、潮气量过低(<8 ml/kg)、右心功能障碍、呼吸系统顺应性差等情况时,PPV和SVV需谨慎解读[68]。
(6)腹腔内压:持续或反复升高>12 mmHg,可引起肾静脉压升高和肾淤血;能够独立于容量监测指标(毛细血管渗漏、液体超负荷和组织水肿)之外预测AKI进展和急性心衰进展[69]。持续腹腔内压>20 mmHg与器官功能障碍及不良预后密切相关[70]。
2. 容量评估内容:容量状态的评估,不仅应评估总体容量的多少,还应评估个体容量分布(血管内容量、肺水等组织液容量)以及血容量增加组分(液体、血清蛋白与电解质等溶质及红细胞等细胞数量)情况,从而制定相应的治疗策略。
3. 容量评估频率:1、3、5型CRS患者应依据症状、体征及治疗需求等及时、动态评估容量状态;对于合并血液动力学不稳定的患者,建议进行血液动力学有创监测,必要时进行腹腔内压检查。2、4型CRS患者应至少每3个月进行症状与体征、实验室指标和影像学检查评估容量状态,必要时进行生物电阻抗检查。
【推荐意见】
· 建议CRS患者常规检测CRP、IL-6、CA125等炎症标志物,评估炎症状态。(2c,B)
· 建议1、3、5型CRS患者依据病情变化,及时动态监测炎症状态;2、4型CRS患者至少每3个月评估炎症状态。(5,D)
炎症状态是CRS发生进展的重要病理生理学基础,炎症指标监测有助于患者预后的判断。465例连续住院的急性心衰患者中,严重心肾双器官功能障碍患者的IL-6和TNF-α水平最高,IL-6高于中位数可独立预测患者1年死亡率[71]。4 269例急性心衰患者中,与出院时CRP≤1.1 mg/L患者比较,CRP≥9.6 mg/L的患者出院后120 d内全因死亡率显著增加;与CRP≤1.1 mg/L相比,CRP 1.2~3.1 mg/L和3.2~9.5 mg/L与患者120 d较差的生存率独立相关[72]。125例2~5D期CKD患者的血浆IL-6水平可独立预测CKD不同阶段患者的总体死亡率和心血管死亡率[73]。血清CA125水平也可反映心衰患者的炎症状态。132例急性心衰患者前瞻性队列研究中,CA125水平>60 U/ml与较高水平的TNF-α、IL-6和IL-1β水平明显相关[74]。
因此,指南专家组建议:对于伴有急性炎症反应的1、3、5型CRS患者依据病情变化,及时动态监测炎症状态;2、4型CRS患者至少每3个月评估炎症状态;评估患者的预后,并指导治疗策略和方案。
【推荐意见】
· 建议CRS患者评估急、慢性并发症发生的风险及程度。(5,D)
· 建议1、3、5型CRS患者及时诊断和治疗各种急性并发症;2、4型CRS患者每3~6个月评估各种慢性并发症的发生和进展,并给予积极治疗。(5,D)
CRS常见的急性并发症包括低血压或心源性休克、心肌梗死、脑卒中、心律失常、猝死、感染、急性肺损伤或肺功能障碍、消化道应激性溃疡以及水电解质与酸碱平衡紊乱等,慢性并发症包括高血压、贫血、CKD-MBD、营养不良、肝硬化及神经精神病变等。对于1、3、5型CRS患者应及时诊断和治疗各种急性并发症,以降低患者的死亡风险;对于2、4型CRS患者应每3~6个月评估各种慢性并发症的发生和进展,并给予积极治疗,以延缓CRS进展,降低患者的死亡风险。
【推荐意见】
· CRS进展包括患者心、肾功能及结构持续恶化,慢性CRS(2型或4型)发生急性CRS(1型或3型),或AKI向CKD进展以及急性心衰转变为慢性心衰。(5,D)
· 建议及时识别、诊断影响CRS进展与预后的危险因素。(2a,B)
· CRS进展与预后评估应包括心功能、肾功能及心肌损伤/纤维化、肾损伤、炎症与容量负荷,以及并发症的发生与进展。(2c,B)
· 推荐使用呋塞米应激试验评估AKI预后。(2a,B)
CRS进展主要指心、肾功能及结构持续恶化,慢性CRS(2型或4型)发生急性CRS(1型或3型),或AKI向CKD进展以及急性心衰转变为慢性心衰。
1.CRS进展的定义与诊断标准
(1)心衰的进展/恶化定义与诊断标准:①NYHA心功能分级进展;②因心衰加重需要增加药物剂量或增加新药治疗;③因心衰或其他原因需住院治疗;④BNP水平持续升高、LVEF<40%;⑤心衰进展为难治性终末期心衰[36,75]。
(2)AKI进展至CKD的定义与诊断标准:AKI后肾功能不能完全恢复持续时间≥3个月[76]。
(3)CKD进展的定义与诊断标准:eGFR较基线水平持续下降超过25%,或CKD分期进展,或每年eGFR下降≥5 ml·min-1·(1.73 m2)-1[49]。
2. 影响CRS进展与预后的危险因素:影响CRS进展与预后的危险因素包括年龄、性别、肾功能、心功能、感染与糖尿病等并发症和合并疾病以及药物治疗等。
CKD和(或)肾功能恶化导致心衰患者死亡风险的荟萃分析结果显示,CKD与全因死亡率相关,肾功能恶化与不良预后相关,中度肾功能损害、重度肾功能损害及肾功能恶化都是死亡的独立预测因子[56]。30项队列研究39 372例心衰患者的荟萃分析筛选出的13个独立预测死亡因子的预测强度顺序为年龄、较低LVEF、NYHA分级、血肌酐、糖尿病、未使用β受体阻滞剂、收缩压较低、体重较轻、诊断后的时间、当前吸烟、慢性阻塞性肺疾病、男性、未使用血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体阻断剂(ARB)[77]。CHARM研究7 599例心衰患者的二次分析结果显示,与LVEF≤40%的心衰患者比较,因糖尿病导致心血管死亡或心衰住院的相对风险,LVEF>40%的患者显著升高[78]。12 833例终末期肾病(ESRD)患者2年随访结果显示,血磷>2.1 mmol/L的患者因冠心病、猝死、感染和不明原因死亡的风险显著增加;钙磷乘积升高和血清iPTH>495 ng/L显著增加猝死风险[79]。
3.CRS进展与预后的评估
(1)心功能进展/恶化:定期评估NYHA心功能分级,动态监测BNP和(或)NT-proBNP的变化,以及定期进行超声心动图等心脏影像学检查评估心功能变化。
7个急性失代偿性心衰队列1 301例患者的研究结果显示,出院时NT-proBNP浓度是急性心衰患者1年死亡或再次住院的最佳预测指标[80, 81]。220个中心7 039例≥65岁心衰住院患者中,出院时BNP水平可预测1年死亡率以及死亡或再住院,并且改善了风险重新分类和区分[82]。9 134例心衰患者前瞻性、观察性研究中,LVEF<40%、40%~50%和>50%的患者,1年死亡率分别为8.8%、7.6%和6.3%[83]。
(2)心肌损伤与心肌纤维化:动态监测cTnT和(或)cTnI等心肌损伤标志物变化,定期检测血可溶性生长刺激表达基因2(ST2)或血半乳糖凝集素-3等心肌纤维化标志物,以及定期进行心电图、心脏MRI等影像学检查。
10项研究平均随访时间13.5个月的4 835例急性心衰患者数据的荟萃分析结果显示,ST2水平可预测全因死亡、心血管死亡、心衰再次住院以及全因死亡或心衰住院的风险[84]。883例CKD患者观察性队列研究中,调整人口统计学特征、心血管疾病风险因素和肾功能后,血清半乳糖凝集素-3或ST2水平每增加1个标准差,患者死亡风险比分别为1.51(95%CI:1.36~1.78)或1.36(95%CI:1.17~1.58)[26]。CORONA队列研究的1 329例慢性心衰患者和COACH队列研究的324例急性失代偿性心衰患者的分析结果显示,与半乳糖凝集素-3水平稳定或降低(增加≤15%)患者比较,半乳糖凝集素-3水平增加>15%患者的心衰住院率和死亡率显著增加[85]。
(3)肾功能进展/恶化:动态监测或定期检测血肌酐、血胱抑素C及eGFR,评估肾功能进展;推荐使用呋塞米应激试验评估AKI的进展。
85项研究111余万心衰患者的荟萃分析结果显示,eGFR<60 ml·min-1·(1.73 m2)-1和肾功能恶化是患者死亡的独立预测因子[56]。
呋塞米应激试验:针对AKI早期(1、2期)患者,既往没有使用过呋塞米者给予呋塞米1.0 mg/kg静脉注射,既往使用过呋塞米者给予呋塞米1.5 mg/kg静脉注射;呋塞米应激试验后2 h尿量<200 ml(100 ml/h)是预测进展至3期AKI的理想临界值,灵敏度87.1%,特异度84.1%[86]。11项试验1 366例AKI患者的荟萃分析结果显示,呋塞米应激试验预测AKI进展的灵敏度81%,特异度88%,合并诊断优势比(DOR)29.69(95%CI:17.00~51.85);预测肾脏替代治疗(RRT)的灵敏度84%、特异度77%,DOR 13.59(95%CI:5.74~32.17),呋塞米应激试验在1~2期AKI患者预测RRT的诊断性能优于3期AKI[87]。
(4)肾脏损伤:定期检测尿常规、尿微量白蛋白、24 h尿蛋白定量,尿钠、尿NAG、NGAL、α1微球蛋白、β2微球蛋白、L-FABP、Kim-1、TIMP-2、IGFBP7、IL-18等肾小管损伤的生物学标志物,以及肾脏超声等影像学检查。
GISSI心衰试验中2 131例患者的研究结果显示,每增加1个对数的ACR,患者全因死亡风险增加12%(HR=1.12,95%CI:1.05~1.18)[50]。多中心、开放标签、随机对照的EXPERFORT-HF试验中160例1型CRS患者事后分析结果显示,单次早期测定尿钠≤50 mmol/L与全因死亡和再入院风险显著相关[88]。10项研究2 000例AKI患者的荟萃分析结果显示,早期血清和尿液NGAL测定可作为透析和死亡的预测指标[89]。收缩压干预试验(SPRINT)2 377例非糖尿病的CKD患者中位随访3.8年结果显示,尿α1微球蛋白的基线浓度高出两倍显著增加心血管疾病和死亡风险[90]。肾内静脉血流特征可以比肾动脉阻力指数更有效地预测急性心衰患者的预后[60]。
(5)炎症状态:持续炎症状态是影响CRS进展与预后的重要危险因素,应动态监测或定期检测血清CRP以及IL-6等炎症因子。
4 269例急性心衰患者前瞻性队列研究结果显示,出院时CRP水平与患者出院后120 d不良生存率独立相关[72]。IL-6水平可独立预测CKD不同阶段患者的总体死亡率和心血管死亡率[73],以及急性心衰患者1年死亡率[71]。
(6)容量状态:容量超负荷或容量不足是心功能或肾功能恶化的主要危险因素,评估CRS患者容量负荷有助于判断CRS进展与预后。
292例急性心衰患者多中心、前瞻性、观察性研究结果显示,出院时BIVA参数对90 d心血管死亡率有显著的预测价值;入院时BNP和出院时BIVA参数联合应用对心血管死亡率的预测能力更强[91]。2 557例心衰患者中位随访时间10.7年的回顾性队列研究结果显示,中心静脉压是患者生存率降低的独立预测因子[92]。
(7)并发症评估:动态及时评估各种急性并发症,定期评估各种慢性并发症(详见CRS的二级和三级预防)。
CRS一级预防是针对急、慢性心衰患者预防1、2型CRS发生,针对AKI、慢性肾衰竭患者预防3、4型CRS发生,以及预防全身系统性疾病患者发生5型CRS;二级预防是延缓CRS进展;三级预防是减少并发症发生,降低死亡风险。
【推荐意见】
· 建议积极治疗心脏或肾脏疾病患者原发疾病,改善心功能和肾功能,识别和干预CRS危险因素。(2c,B)
· 建议保障急、慢性心衰患者肾脏血液灌注,减轻静脉淤血,禁用/慎用肾毒性药物。(5,D)
· 应用肾素-血管紧张素系统(RAS)阻断剂和利尿剂治疗心衰时,建议密切监测AKI发生。(2b,B)
· 建议加强AKI患者容量与血压管理。(2c,B)
· 推荐有效控制慢性肾衰竭患者蛋白尿,改善肾功能;加强容量管理,控制脂代谢紊乱、炎症等心脏疾病危险因素,有效防治贫血、CKD-MBD等慢性并发症。(2a~2c,B)
· 推荐使用RAS阻断剂治疗慢性肾衰竭患者。(1a,A)
· 建议积极治疗全身系统性疾病患者原发疾病,有效防控感染,加强炎症和容量控制,维持心血管状态稳定,避免/慎用肾毒性药物。(5,D)
1. 预防急、慢性心衰患者发生1、2型CRS:应积极治疗原发心脏疾病,改善心功能,保障肾脏血液灌注;有效容量管理,减轻静脉淤血,但应避免发生脱水;应密切监测RAS阻断剂和利尿剂诱发的AKI发生,并禁用/慎用肾毒性药物。
中国回顾性队列分析结果显示,年龄、反复心衰史、既往肾脏病史、低/高血压、心功能Ⅳ级、贫血及利尿剂使用等是急性心衰患者发生1型CRS的独立危险因素[14, 15]。慢性心脏病患者回顾性分析中,年龄、白蛋白和尿酸水平是2型CRS的独立危险因素[23];心衰引发心脏低输出量与肾脏低血液灌注的恶性循环,是CRS发生的重要机制[93]。51例心衰患者观察性研究结果显示,肾血流量水平较低的患者中静脉淤血是肾功能的重要决定因素[94]。3项研究94例因心衰、AKI或容量超负荷输注布美他尼患者的系统评价和荟萃分析结果显示,布美他尼剂量增加与AKI发生率增加显著相关[95]。
2. 预防AKI发生3型CRS:中国AKI回顾性分析结果显示,年龄、左室舒张功能减退、CKD病史、胆固醇升高是AKI 患者发生 3 型CRS的独立危险因素[24]。AKI患者肾衰竭引发的容量负荷增加和高血压导致心脏负荷增加是3型CRS的重要病理生理基础;因此AKI患者应加强容量与血压管理,预防AKI 3型CRS发生。
3. 预防慢性肾衰竭患者发生4型CRS:应积极治疗肾脏疾病,有效控制蛋白尿,改善肾功能;加强容量管理,管理脂代谢紊乱、炎症等心脏疾病危险因素,有效防治贫血、高磷血症等急慢性并发症;合理使用RAS阻断剂;但目前缺乏控制血压降低CKD患者发生心衰风险的证据。
7个队列40 112例CKD患者分析结果显示,ACR是心衰发生的最重要的因素,eGFR也是心衰发生的危险因素;并且ACR与eGFR组合预测心衰优于糖尿病、收缩压、胆固醇、高密度脂蛋白及吸烟等心血管疾病的传统危险因素[25]。3 483例无心衰的慢性肾衰竭前瞻性队列研究结果证实,cTnT>26.5 ng/L或NT-proBNP>433.0 ng/L患者的心衰发生率显著升高[29],提示心肌损伤和容量负荷是4型CRS发生的重要因素。322例非透析CKD患者前瞻性随机对照研究数据的二次分析结果提示,有效纠正贫血能更好地保护非透析CKD患者的心功能[96]。
25项随机对照试验45 758例合并蛋白尿的CKD患者的荟萃分析结果显示,RAS阻断剂可显著降低心衰的风险(HR=0.74,95%CI:0.58~0.95)[97]。123项研究613 815例参与者的荟萃分析结果显示,收缩压每降低10 mmHg,心衰风险降低28%(RR=0.72,95%CI:0.67~0.78),但在CKD患者亚组中没有明显降低心衰风险[98]。多中心、前瞻性、随机对照SPRINT试验的亚组分析结果显示,2 646例无糖尿病CKD和高血压患者中,强化干预(目标收缩压<120 mmHg)与标准干预(目标收缩压<140 mmHg)的心衰发生风险无明显差别[99]。
4. 全身系统性疾病患者发生5型CRS的预防:感染引发的严重脓毒症和感染性休克是5型CRS的重要病因[8]。29 269例ICU危重患者的前瞻性观察性研究中,导致AKI最常见的因素是感染性休克;感染性休克和心源性休克是医院死亡的重要危险因素[100]。TNF-α、IL-1、IL-6等炎性因子可加重AKI和心衰[36]。因此,对于全身系统性疾病患者,应积极治疗原发疾病,有效防控感染和脓毒症的发生;加强炎症和容量控制,维持心血管状态稳定,避免/慎用肾毒性药物。
【推荐意见】
· 建议对于急性CRS(1、3、5型)患者进行有效容量管理;积极治疗急性心衰,防治心肌纤维化及肾功能进展;控制炎症反应。(2b,B)
· 建议急性CRS患者合并2期AKI开始RRT。(1b,A)
· 建议积极防治急性CRS患者感染、电解质酸碱平衡紊乱及心律失常等并发症,减少AKI进展至CKD,降低患者死亡风险。(5,D)
· 建议积极改善慢性CRS患者心脏功能,延缓肾功能进展,管理血压,防治贫血、骨矿物质代谢紊乱等并发症,降低患者死亡风险。(2a~2b,B)
1.有效容量管理:24个欧洲国家198个ICU 3 147例患者的观察性队列研究证实,24 h容量增加1 L,患者60 d死亡风险增加21%(HR=1.21,95%CI:1.13~1.28)[101]。618例AKI患者前瞻性多中心观察性研究中,透析开始时液体超载(体重较基线增加>10%)显著增加患者60 d内死亡率,血肌酐达到峰值时液体超载显著降低肾脏功能恢复率[102]。
2.积极治疗急性心衰,防治心肌纤维化及肾功能进展:10项研究4 835例急性心衰患者数据的荟萃分析结果显示,心肌纤维化指标(可溶性ST2)水平与全因死亡、心血管死亡、心衰再次住院风险密切相关[84]。482项研究2 017 437例参与者荟萃分析结果显示,伴随AKI进展显著增加新发或进展性CKD、ESRD和死亡风险[103]。18项队列研究459 558例患者中位随访时间3年的荟萃分析结果证实,AKI持续时间与长期死亡率、心衰和进展至CKD独立相关[104]。
3.控制炎症反应:急性心衰患者队列研究结果显示,CRP和IL-6水平与患者死亡率独立相关[71, 72]。前瞻性随机对照PROWESS研究中,安慰剂组547例AKI患者数据分析结果显示,IL-6水平和APACHE Ⅱ评分升高是严重脓毒症患者发生AKI的重要危险因素[105]。
4. 2期AKI开始RRT:虽然2 927例重症AKI患者多国随机对照试验中,早期RRT(诊断AKI后12 h内开始治疗)与标准治疗(AKI持续超过72 h开始治疗)的90 d全因死亡风险无明显差别,并且90 d存活者中持续依赖RRT风险显著增加,不良事件发生率显著增加[106]。但是,230例危重AKI患者前瞻性随机对照研究结果显示,早期RRT(2期AKI启动)与延迟RRT(3期AKI启动)的AKI后1年主要不良肾脏事件(持续性肾功能不全、透析依赖性和死亡率)显著减少,1年全因死亡率显著降低,肾功能未能恢复率显著降低[107]。鉴于AKI进展速度存在个体差异,AKI分期较AKI发生后时间作为治疗时机更为合理;并且及时RRT更有利于急性CRS患者的容量控制和心衰治疗,因此指南制订专家组建议急性CRS患者在2期AKI开始RRT。
5.防治急性并发症:感染、电解质酸碱平衡紊乱及心律失常等是急性心衰和AKI的常见并发症和重要死亡原因,因此指南制订专家组建议进行积极防治。
1.改善心脏功能:30项队列研究39 372例心衰患者的荟萃分析结果显示,较低的LVEF和NYHA分级是患者死亡的独立危险因素[77]。
2.延缓肾功能进展:149例LVEF<45%的收缩性心衰患者观察性研究中,调整传统心血管危险因素后,肾功能水平与心脏整体纵向应变受损、E/e′增加、左房增大以及NT-proBNP和cTnI水平升高密切相关[108]。28项研究49 890例肾功能不全患者的荟萃分析结果显示,中度肾功能损害、重度肾功能损害及肾功能恶化均为死亡率的独立预测因子[56]。
3.管理血压:7个中心3 708例慢性肾衰竭患者中位随访5.7年的前瞻性队列研究结果显示,与收缩压<120 mmHg比较,收缩压 130~139 mmHg和收缩压≥140 mmHg显著增加ESRD的风险[109]。多中心、前瞻性、随机对照SPRINT试验的亚组分析结果显示,2 646例无糖尿病CKD和高血压患者中,强化干预(目标收缩压<120 mmHg)较标准干预(目标收缩压<140 mmHg)显著降低全因死亡风险;但主要心血管事件(急性冠脉综合征、心衰和卒中)及肾脏终点事件(eGFR降低>50%或ESRD)无明显差别[99]。血压管理方案详见“第四部分CRS治疗”的“八、控制CRS的主要并发症”。
4.纠正贫血:34项研究153 180例慢性心衰患者的荟萃分析结果显示,6个月以上随访后贫血较非贫血患者的死亡率显著增加[110]。5 885例CKD患者回顾性队列研究中,与非贫血患者相比,Hb<105 g/L患者的死亡率、心血管住院率和ESRD风险显著增加[111]。
5.防治骨矿物质代谢紊乱:2 312例受试者心血管健康研究中eGFR<60 ml·min-1·(1.73 m2)-1的患者分析结果显示,校正全部混杂因素后,与血清iPTH<65 ng/L比较,血清iPTH≥65 ng/L患者的血清cTnT和左室质量显著增加[112]。3 860例CKD 2~4期患者前瞻性队列中位随访3.7年的结果显示,校正人口统计学特征、肾功能、传统心血管风险因素和药物因素后,血清FGF-23水平倍增,充血性心衰风险增加45%[27]。3 490例CKD患者队列研究结果显示,校正年龄、肾功能、共病情况、种族、性别、Hb、血钙和药物摄入的元素钙后,血磷每增加0.323 mmol/L死亡风险增加23%(RR=1.23,95%CI:1.12~1.36)[113]。
6.防治感染与脓毒症:1 802例LVEF≤45%的慢性心衰患者0.3年随访的前瞻性队列研究中,23.5%患者死于脓毒症,其中呼吸道感染占69.9%[114]。
1. 急性CRS(1、3、5型):积极控制心衰,维持水电解质和酸碱平衡,避免/减少肾脏低灌注、肾毒性药物及感染等对肾脏的二次打击,防治急性并发症,降低死亡率,预防心和(或)肾功能衰竭慢性化。
2. 慢性CRS(2、4型):积极治疗原发疾病,改善心功能,延缓肾功能进展,防治慢性并发症,避免/减少CRS复发,提高生存率和生存质量。
【推荐意见】
· 建议及时识别和处理感染/脓毒血症、高血压、水电解质与酸碱平衡紊乱、心律失常、心脏和(或)肾脏毒性药物使用以及贫血、骨矿物质代谢紊乱、糖尿病等诱发或加重心、肾功能障碍/进展的危险因素。(5,D)
· 建议积极治疗1、2型CRS患者的缺血性心脏病、高血压、心脏瓣膜病、心律失常、先天性心脏病等引起心衰的心脏疾病;积极治疗3、4型CRS患者的原发/继发性肾脏疾病,有效降低尿蛋白;积极治疗5型CRS患者的系统性疾病,控制炎症反应。(5,D)
1型和2型CRS的肾功能恶化的危险因素包括CKD、高血压、糖尿病、冠心病、缺血性心肌病、肺水肿、肺动脉高压、老年、心衰病史、AKI病史,肥胖和恶液质也是危险因素[5]。AKI引起的容量超负荷、代谢性酸中毒、电解质紊乱(如高钾血症和低钙血症)等导致急性心功能不全[115]。4型CRS常见的诱因包括容量超负荷、电解质紊乱、感染,以及CKD引发的贫血、晚期糖基化终产物、骨矿物质代谢紊乱(血钙、血磷、iPTH、维生素D及FGF-23异常)[116]。5型CRS常见病因包括脓毒症、肝硬化、系统性红斑狼疮、结节病、系统性硬化症、淀粉样变性和毒素[117]。
【推荐意见】
· 建议在评估容量负荷基础上使用利尿剂。(5,D)
· 首选袢利尿剂,推荐托拉塞米,间歇性静脉注射不增加AKI严重不良事件风险,持续静脉输注利尿效果优于静脉注射。(1a,A)
· 推荐使用高渗盐水联合呋塞米治疗利尿剂抵抗,可增加利尿效果,减少肾功能恶化和死亡风险。(1a,A)
· 袢利尿剂与静脉输注血清白蛋白、美托拉宗、氢氯噻嗪、托伐普坦或乙酰唑胺联合使用,可改善袢利尿剂抵抗,提高利尿效果。(2a,B)
· 建议采用基于CA125水平指导的优化利尿剂策略,增加利尿效果,减少全因死亡和心衰再住院风险。(1b,A)
1. 利尿剂的选择:首选袢利尿剂,其中托拉塞米综合作用最佳:12项随机对照研究1 956例急、慢性心衰患者的网络荟萃分析中,呋塞米的不良反应发生率最低,依次为阿佐塞米、托伐普坦和托拉塞米;托伐普坦的患者死亡率最低,依次为托拉塞米、阿佐塞米和呋塞米;托拉塞米改善BNP和LVEF疗效最佳,依次为阿佐塞米和呋塞米;考虑综合疗效,托拉塞米可能是心衰患者的最佳利尿剂[118]。
2. 利尿剂给药方式
(1)间歇性静脉注射不增加AKI患者严重不良事件:28项随机对照试验3 228例AKI或具有AKI风险患者的荟萃分析结果显示,间歇性呋塞米治疗对患者死亡率、AKI新发/恶化、RRT、住院时间以及血肌酐峰值均无明显影响[119]。
(2)静脉持续输注较静脉注射利尿效果更佳:10项随机对照试验735例急性心衰患者的荟萃分析中,静脉注射与持续静脉输注的每日呋塞米总剂量没有差别,但呋塞米持续静脉输注较静脉注射显著增加尿量和减轻体重,而住院时间、血肌酐、血钠和血钾无明显差异[120]。
3.增强袢利尿剂疗效、减少袢利尿剂抵抗的方法
(1)静脉输注血清白蛋白:8项交叉设计试验96例低白蛋白血症患者的荟萃分析结果显示,与单纯呋塞米比较,呋塞米联合白蛋白静脉输注显著增加尿量和钠排泄量[121]。
(2)与高渗盐水联合使用:11项随机对照试验2 987例急性失代偿性心衰患者的荟萃分析结果表明,与单纯静脉注射呋塞米相比,高渗盐水和静脉注射呋塞米显著增加每日尿量、体重减轻及24 h尿钠排泄量,降低血肌酐、全因死亡率和心衰再入院率,显著缩短住院时间[122]。
(3)与其他利尿剂联用:长期阻断Na-K-2Cl共转运蛋白可引起远端肾小管细胞肥大及钠再摄取增强,降低袢利尿剂疗效,而袢利尿剂与噻嗪类合用可以阻断远端肾小管钠再摄取增强的效果。34例容量超负荷且服用袢利尿剂的急性心衰患者前瞻性随机对照试验结果显示,与增加袢利尿剂剂量相比,联用乙酰唑胺可增加袢利尿剂的利钠反应[123]。
(4)基于CA125水平指导利尿剂应用:160例1型CRS患者多中心、开放、随机对照研究结果显示,基于CA125指导的利尿剂治疗,72 h内显著增加了呋塞米使用剂量和尿量,并改善了eGFR[124]。380例急性心衰患者前瞻性多中心随机试验中,与标准治疗比较,基于CA125优化利尿剂剂量策略显著降低全因死亡或急性心衰再住院复合率、急性心衰复发和全因再住院复合风险、急性心衰住院率、全因住院率以及患者急诊就诊次数;急性肾衰竭、高钾血症或低钾血症的住院率无明显差别[125]。
【推荐意见】
·托伐普坦改善心衰患者呼吸困难,减轻CKD患者容量负荷,推荐用于CRS治疗。(1a,A)
·大剂量托伐普坦增加肾功能恶化风险,应避免使用。(1a,A)
12项随机对照试验5 577例急性心衰住院患者的荟萃分析结果显示,与单独使用传统利尿剂相比,添加托伐普坦可显著缓解短期呼吸困难,显著减轻水肿和体重;低剂量(7.5~15.0 mg/d)托伐普坦显著降低肾功能恶化(血肌酐比基线增加26.5 mmol/L)发生率,而高剂量(30 mg/d)托伐普坦显著增加肾功能恶化发生率[126]。14项随机对照试验5 945例心衰住院患者的荟萃分析中,托伐普坦显著改善呼吸困难和降低体重,显著升高血钠,但血肌酐、住院时间、死亡率或再住院率无明显差别[127]。
【推荐意见】
· 对于合并严重容量超负荷的1期AKI的急性CRS或未达到血液透析(HD)/腹膜透析(PD)治疗指征的慢性CRS患者,推荐采用超滤治疗,而非作为利尿治疗失败后的替代治疗。(1a,A)
· 对于合并严重容量超负荷的2、3期AKI的急性CRS或具有HD/PD治疗指征的慢性CRS患者,建议采用HD/血液滤过或PD清除过多的容量负荷。(2b,B)
· 建议CRS患者采用缓慢持续超滤治疗模式。(5,D)
超滤治疗是在不改变血浆成分构成的基础上排除循环中液体的体外循环治疗技术,超滤与利尿剂是互补的治疗选择,而不是替代策略[128]。
1. 超滤治疗效果优于利尿剂:8项随机对照试验608例合并失代偿性心衰的CRS患者系统综述和荟萃分析中,与利尿剂比较,超滤治疗显著增加体重减轻和液体净清除量,显著降低心衰恶化风险和再入院率,肾功能恶化和全因死亡率无明显差异[129]。
2. 提前的血液净化治疗效果优于单纯超滤治疗:120例1型和2型CRS患者24个月的前瞻性纵向随访研究结果显示,与缓慢持续超滤(SCUF)比较,连续性静脉-静脉血液滤过(CVVH)患者的平均生存时间显著增加,特别是尿量<10 ml/h患者平均生存时间增加更显著[130]。88例1型CRS患者前瞻性随机对照研究结果显示,与超滤治疗比较,潮式PD治疗后120 h血肌酐明显降低,显著增加72 h和120 h的LVEF、体重降低和净超滤量,显著减少出院后90 d心衰再住院率和不良事件发生率[131]。
3. 建议CRS患者采用SCUF治疗模式:63例急性失代偿性心衰患者的回顾性分析表明,SCUF显著改善血流动力学参数,包括显著降低平均肺动脉压、中心静脉压、平均肺毛细血管楔压以及改善心脏指数,且不影响血肌酐和血尿素氮水平[132]。
改善心脏和肾脏功能是有效治疗CRS,改善患者预后的关键。对于急性CRS(1、3、5型)患者,由于目前缺乏改善AKI的特异性治疗手段,治疗的重点是改善患者心脏功能,降低死亡率;对于慢性CRS(2、4型)患者,肾功能恶化显著增加患者死亡风险,因此,延缓肾功能进展与改善心脏功能同为重要。
改善CRS患者的心脏功能,基本上可参照2021年欧洲心脏病学会(ESC)[43]以及2022 AHA/ACC/HFSA心衰管理指南[133]的建议;但应考虑肾衰竭对抗心衰药物体内代谢的影响,以及抗心衰药物的肾损伤作用,特别是对急性CRS(1、2、3型)患者的治疗。
【推荐意见】
· ACEI或ARB具有心肾保护作用,推荐治疗伴有HFrEF的慢性CRS。(1a,A)
· ACEI或ARB增加AKI风险,急性CRS应慎用。(1a,A)
· ACEI与ARB的疗效无差别;ACEI联用ARB不影响肾脏和心血管结局,且增加高钾血症风险,不建议用于伴有HFrEF的慢性CRS治疗。(1a,A)
· 血管紧张素受体-脑啡肽酶抑制剂(ARNI)改善心脏和肾脏结局,但缺乏AKI和ESRD患者使用的临床证据;推荐治疗伴有HFrEF的慢性CRS,但是GFR<30 ml·min-1·(1.73 m2)-1患者慎用,不建议应用于ESRD患者。(1a,A)
· 盐皮质激素受体拮抗剂(MRA)改善心血管结局,降低蛋白尿;非奈利酮联合ACEI/ARB增加心脏保护作用,并改善肾功能;但MRA增加高钾血症风险;推荐治疗伴有HFrEF的慢性CRS,但不应在eGFR<25 ml·min-1·(1.73 m2)-1患者开始治疗;急性CRS应慎用。(1a,A)
· 阿利吉仑不改变心血管结局,增加肾功能恶化和高钾血症风险;不建议阿利吉仑或阿利吉仑联合ACEI/ARB治疗伴有HFrEF的CRS。(1b,A)
· β受体阻滞剂(本章节简称BB)改善伴有/不伴有CKD的心衰患者的心功能,不影响肾功能,改善患者心脏结局;推荐治疗伴有HFrEF的急、慢性CRS。(1a,A)
· RAS阻断剂、MRA和BB的联合治疗改善心脏重构和心脏功能,推荐ARNI+BB或ARB+BB双联疗法以及ARNI+BB+MRA和ARB+BB+MRA三联疗法治疗伴有HFrEF的慢性CRS,其中ARNI+BB+MRA疗效最佳。(1a,A)
· 钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂改善AKI预后以及心衰或CKD患者的肾脏功能和心脏与肾脏结局,推荐治疗伴有HFrEF的急、慢性CRS,但是GFR<30 ml·min-1·(1.73 m2)-1、ESRD或透析患者禁用。(1a,A)
· 左西孟旦改善心脏和肾脏结局,减少AKI发生风险;推荐用于伴有HFrEF的急、慢性CRS治疗,但GFR<30 ml·min-1·(1.73 m2)-1患者禁用。(1a,A)
· 米力农改善心功能和肾功能,但不影响心脏和肾脏结局;推荐用于伴有HFrEF的急、慢性CRS短期治疗。(1b,A)
· 多巴酚丁胺改善心功能和肾功能,对心脏和肾脏结局影响与左西孟旦和米力农无明显差别,推荐用于伴有HFrEF的急、慢性CRS短期治疗。(1a,A)
· 洋地黄类药物减少心衰患者的住院率,但不影响心脏结局;改善心衰患者的肾功能,但应避免洋地黄类药物中毒;推荐用于伴有HFrEF的急、慢性CRS短期治疗。(1a~1b,A)
· 奈西立肽改善循环淤血,但不影响全因死亡率,高剂量增加肾功能恶化风险,不推荐治疗急性CRS。(1a~1b,A)
· 维立西呱降低慢性心衰住院风险,但对NT-proBNP>8 000 ng/L或心房颤动患者无明显疗效,不影响肾脏功能;推荐用于伴有HFrEF的慢性CRS。(1b,A)
· 硝酸盐制剂可改善心衰患者的血流动力学,但不影响心脏结局;推荐用于伴有HFrEF的急性CRS短期治疗。(1b,A)
· 低剂量多巴胺增加尿量和改善肾功能,但不降低AKI发生、全因死亡和再住院风险;推荐用于利尿效果不佳的急性CRS短期治疗。(1a,A)
· 乌拉地尔降低血压,改善心功能,推荐用于合并高血压的急性CRS。(1a,A)
· 伊伐布雷定改善慢性心衰患者的心肺功能,降低死亡率和住院风险,但不改善急性心衰患者的心脏结局;推荐用于伴有HFrEF的慢性CRS。(1a,A)
1.RAAS抑制剂
(1)RAAS阻断剂
①RAAS阻断剂治疗心衰的作用:可以改善急、慢性心衰,显著减少心衰患者死亡率及住院风险。402例急性失代偿性心衰患者的ESCAPE试验中,与持续使用RAAS阻断剂比较,未使用或停止使用RAAS阻断剂患者的180 d全因死亡率、心脏移植或全因住院的复合事件均显著增加;并且上述结果在253例急性失代偿性心衰患者的独立队列中得到验证[134]。
②RAAS阻断剂治疗CRS的作用:与单纯慢性心衰患者比较,RAAS阻断剂对2型CRS患者具有更大的治疗获益,有效降低2型CRS患者死亡风险;并且,RAAS阻断剂具有降低蛋白尿、延缓肾功能进展,防治4型CRS的作用。5项大型随机对照试验20 573例伴有左室收缩功能障碍的心衰患者的荟萃分析结果显示,与安慰剂相比,RAAS阻断剂显著降低合并肾功能恶化患者的全因死亡率[135]。9项随机对照试验9 797例3~5期CKD患者的荟萃分析结果显示,与对照组比较,RAAS阻断剂显著降低RRT和血肌酐倍增和非致命性心血管事件风险;但全因死亡率、心血管死亡率和不良事件无明显差异[136]。
③ACEI与ARB疗效无明显差别:ACEI与ARB降低心衰患者死亡率以及降低CKD患者蛋白尿和肾脏、心血管结局无明显差别。38项随机对照试验47 662例心衰荟萃分析结果显示,ACEI与ARB的全因死亡率和心血管死亡率无明显差别[137]。17项随机对照试验17 951例CKD患者汇总分析表明,ACEI与ARB降低尿蛋白效果无明显差异[138]。71项试验103 120例糖尿病患者的系统综述和网络荟萃分析结果显示,ACEI与ARB治疗患者的心血管死亡、心肌梗死和脑卒中的主要心血管结局风险和肾脏疾病进展(血肌酐倍增或ESRD)风险无明显差别[139]。
④ACEI联合ARB治疗的作用:可增加降低尿蛋白和降低血压的作用,但对肾脏和心血管结局无影响,且增加高钾血症风险。72项随机对照试验10 296例患者的荟萃分析表明,与ACEI或ARB比较,ACEI联合ARB显著降低尿白蛋白排泄量和尿蛋白排泄量以及eGFR水平,但血肌酐倍增、AKI、ESRD、死亡率和住院率的风险无明显差别;显著降低收缩压和舒张压;显著增加血钾水平和高钾血症发生率[140]。
⑤RAAS阻断剂诱发肾功能恶化和AKI的危险因素:增龄、利尿剂使用、脱水状态、心血管手术和炎症状态以及ACEI和ARB联用,是RAAS阻断剂治疗过程中发生肾功能恶化和AKI的主要危险因素。依那普利治疗充血性心衰的随机、双盲、安慰剂对照试验数据的时间-事件分析结果显示,依那普利显著增加增龄引起肾功能下降的风险,合用利尿剂可进一步增加肾功能恶化风险[141]。312例接受RAAS阻断剂治疗的心衰患儿队列分析结果显示,安体舒通使用是AKI的独立危险因素,发生AKI患儿37.3%存在脱水[142]。33项随机对照试验68 405例患者的荟萃分析中,与单药ACEI或ARB比较,ACEI联合ARB显著增加肾衰竭以及高钾血症、低血压和因不良事件而停药的风险[143]。
(2)ARNI——沙库巴曲/缬沙坦
①ARNI治疗心衰的作用:改善心脏重构和心脏功能,减少心血管事件发生,改善心脏结局。20项研究10 175例心衰患者的荟萃分析结果证实,与ACEI/ARB比较,ARNI显著改善HFrEF患者NYHA心功能分级,显著增加6 min步行距离和LVEF,显著减少左室收缩末期容积、左室舒张末期容积、左室收缩末期内径、左室舒张末期内径、左房容积和左室质量指数;显著改善HFpEF患者NYHA心功能分级,显著减少左室收缩末期容积、左室舒张末期容积和左室质量指数[144]。
②ARNI的疗效优势:与ACEI或ARB比较,ARNI延缓肾功能进展,减少血钾升高和心血管事件风险,以及显著增强改善心脏预后的疗效。8 399例NYHA Ⅱ~Ⅳ级合并LVEF≤40%心衰患者的前瞻性随机对照试验(PARADIGM-HF)中,与依那普利比较,ARNI显著减少eGFR下降率、ESRD或血肌酐下降>50%的肾脏复合终点、心血管死亡或心衰住院以及全因死亡的风险[145]。PARADIGM-HF研究二次分析结果显示,依那普利较ARNI显著升高严重高钾血症发生率,并且在包括试验期间新开始服用MRA患者的分析中,这种风险进一步增加[146]。但是ARNI是否诱发或加重AKI目前尚不清,缺乏临床试验证据。同样ARNI治疗ESRD的临床证据明显不足,并且可能加重ESRD并发症[147];并且ARNI药品说明书明确eGFR<30 ml·min-1·(1.73 m2)-1患者慎用,不建议ESRD患者应用。
(3)MRA
MRA有效治疗心衰,减少心血管事件,改善心血管结局;但增加高钾血症风险。15项研究16 321例心衰患者的荟萃分析结果显示,MRA显著降低HFrEF患者的心血管死亡、全因死亡和心血管住院风险,显著增加高钾血症风险[148]。MRA治疗急性心衰的有效性和安全性,目前缺乏临床试验证据。
非奈利酮有效降低CKD患者蛋白尿,改善肾功能,减少心血管事件风险;但增加高钾血症和血钾升高的风险。5项随机对照试验13 078例CKD患者的荟萃分析结果显示,与安慰剂组相比,非奈利酮显著降低ACR和eGFR下降、ESRD和心血管事件的风险;显著增加血钾水平和高钾血症发生风险[149]。但是非奈利酮是否具有改善AKI的作用目前尚不清楚,缺乏临床试验证据;并且,非奈利酮药品说明书明确不应在eGFR<25 ml·min-1·(1.73 m2)-1 患者开始治疗,进展至eGFR<15 ml·min-1·(1.73 m2)-1 患者应停止治疗。
其他MRA:有效降低CKD患者蛋白尿,减少CKD患者心血管事件风险;但对肾功能进展无明显影响,并且具有诱发高钾血症、AKI、男性乳房发育和妇科肿瘤的风险。44项随机/准随机对照试验5 745例伴有蛋白尿CKD患者的荟萃分析结果显示,与安慰剂或标准治疗比较,MRA对肾衰竭、死亡、心血管事件无明显影响,显著减少蛋白尿和收缩压;显著增加高钾血症、AKI和妇科肿瘤的风险[150]。14项随机对照试验1 309例透析治疗患者的系统综述和荟萃分析结果显示,与安慰剂或未治疗比较,MRA显著降低心血管死亡和全因死亡风险[151]。9项随机对照试验829例HD/PD患者的系统综述和荟萃分析结果显示,与安慰剂或标准治疗比较,螺内酯或依普利酮显著降低心血管死亡和全因死亡的风险,但显著增加高钾血症风险和男性乳房发育风险[152]。
(4)肾素抑制剂——阿利吉仑
阿利吉仑不改变心衰患者和CKD患者的肾脏和心血管结局,并且增加肾功能恶化和高钾血症的风险。1 639例LVEF≤40%的心衰患者多中心、随机、双盲、安慰剂对照试验中,与安慰剂比较,阿利吉仑治疗6个月和12个月的心血管死亡或心衰再住院复合终点均无明显差别;低血压和肾损害/肾衰竭发生率显著增加[153]。8 561例接受ACEI或ARB治疗的糖尿病肾脏疾病和(或)心血管疾病患者的多中心、前瞻、双盲、随机对照研究中,与安慰剂比较,阿利吉仑的肾脏结局终点(终末期肾病、肾衰竭死亡、非透析/移植的RRT或血肌酐倍增)无明显差别,显著降低收缩压、舒张压、ACR,显著增加eGFR下降值、不良事件停止治疗率、高钾血症发生率和低血压发生率[154]。
(5)RAAS的多重阻断效果
①ACEI/ARB联合MRA的作用:ACEI/ARB联合非奈利酮改善糖尿病肾病患者的肾功能,减少心血管事件风险,但增加高钾血症的风险。7 437例2型糖尿病合并中重度蛋白尿患者的多中心、前瞻、随机、双盲、安慰剂对照研究结果显示,与最大耐受剂量RAAS阻断剂比较,添加非奈利酮显著降低心血管原因死亡、非致命性心肌梗死、非致命性脑卒中或因心衰住院的复合风险以及肾衰竭、eGFR下降>57%或因肾病死亡的复合风险[155]。4项随机对照试验13 945例糖尿病肾病患者的荟萃分析结果表明,与RAAS阻断剂比较,RAAS阻断剂联合非奈利酮显著降低ACR和eGFR降低≥40%的患者比例,显著增加高钾血症发生率[156]。ACEI/ARB联合其他MRA增加改善心衰患者的心脏功能和心肌重塑、降低死亡风险的疗效;但增加血肌酐升高和高钾血症的风险。8项随机对照试验3 929例NYHA Ⅰ~Ⅱ级且LVEF≤45%的慢性心衰患者的荟萃分析结果显示,与标准治疗(ACEI和ARB或BB)比较,标准治疗联合MRA(安体舒通、依普利酮或坎利酮)显著降低全因死亡和心衰再住院的风险,改善LVEF,显著降低左室收缩末期容积、左室舒张末期容积和左室质量;显著降低BNP浓度,但显著增加血肌酐浓度和高钾血症发生风险[157]。
②ACEI/ARB联合阿利吉仑:减少心衰住院风险,但增加肾功能损害和高钾血症的风险。12项随机临床试验34 131例心衰患者系统综述和荟萃分析中,与单纯ACEI或ARB比较,阿利吉伦联合ACEI/ARB对全因死亡风险无明显影响,显著降低心血管死亡或心衰住院风险;但增加总体不良反应事件风险40%、肾功能损害风险40%、高钾血症风险44%和低血压风险42%[158]。
2.BB
(1)BB改善慢性心衰患者的心脏功能和预后:11项随机、双盲、安慰剂对照试验的18 637例心衰患者个体数据荟萃分析结果显示,BB显著增加LVEF<50%患者的LVEF,降低窦性心律患者的全因死亡和心血管死亡风险,但对LVEF≥50%患者和(或)心房颤动患者无明显作用[159]。
(2)BB改善CKD患者的心脏功能,减少心血管事件,降低死亡率:8项随机对照试验6 949例3~5期CKD患者的荟萃分析中,对伴有心衰CKD患者的分析结果显示:BB显著降低了全因死亡、心血管死亡率和猝死的风险[160]。4项随机对照试验和2项观察性研究的2 998例维持性HD患者的荟萃分析结果显示,与非卡维地洛治疗比较,卡维地洛显著降低全因死亡率、心血管事件和住院率,显著增加LVEF[161]。
(3)卡维地洛较选择性β1受体阻滞剂的优势:卡维地洛降低心衰患者全因死亡风险的作用更强。11项卡维地洛与选择性β1受体阻滞剂的随机、对照、直接比较试验的系统综述和荟萃分析中,与选择性β1受体阻滞剂(阿替洛尔、比索洛尔、美托洛尔和奈比洛尔)比较,卡维地洛显著降低收缩期心衰患者全因死亡率;卡维地洛较美托洛尔显著降低全因死亡率,但与比索洛尔或奈比洛尔比较,全因死亡率无明显差别[162]。
3. RAAS阻断剂、MRA和BB的联合治疗:ARNI+BB、ARB+BB、ARNI+BB+MRA分别是改善LVEF最有效的双联和三联疗法,ARNI+BB+MRA降低全因死亡率效果最强。55项随机对照试验12 727例HFrEF心衰患者的贝叶斯网络荟萃分析结果显示,改善LVEF的疗效,ARB+BB和ARNI+BB是前两个有效双联疗法,ARNI+BB+MRA优于单联、双联和其他三联疗法;改善NYHA分级的疗效,ACEI+ARB+BB、ARB+BB和ACEI+BB显著优于ACEI[163]。57项随机对照试验NYHA≥Ⅱ级心衰患者的随机效应网络荟萃分析结果表明,ARNI+BB+MRA降低全因死亡率效果最强,其次是ACEI+BB+MRA[164]。
4. SGLT-2抑制剂
(1)SGLT-2抑制剂改善心血管结局和肾功能:DAPA-HF和EMPEROR-Reduced Trial合并的8 474例HFrEF患者系统综述和荟萃分析结果显示,SGLT-2抑制剂显著减少全因死亡、心血管死亡、首次心衰住院以及首次eGFR下降≥50%、ESRD或透析治疗的肾脏复合事件的风险,显著增加eGFR水平[165]。
(2)SGLT-2抑制剂改善AKI患者预后,降低CKD患者蛋白尿,改善肾功能和肾脏结局,减少心血管事件的风险:4 401例2型糖尿病、CKD和ACR 300~5 000 mg/g参与者的多中心、随机、双盲、安慰剂对照试验中,与安慰剂相比,卡格列净显著增加AKI后30 d内肾功能完全恢复率,降低肾功能未恢复率[166]。CREDENCE试验3 836例患者数据的事后分析结果显示,与安慰剂相比,卡格列净组平均ACR降低 31%(95%CI:27%~36%),且ACR每降低30%,ESRD、血肌酐倍增或肾死亡的风险降低29%(HR=0.71,95%CI:0.67~0.76),心血管死亡、非致命性心肌梗死或非致命性卒中的风险降低8%(HR=0.92,95%CI:0.88~0.96)以及因心衰或心血管疾病死亡住院风险降低14%(HR=0.86,95%CI:0.81~0.90)[167]。但依据SGLT-2抑制剂的药品说明书,重度肾损害[eGFR<30 ml·min-1·(1.73 m2)-1]、ESRD或透析患者禁用SGLT-2抑制剂。
5.心肌正性肌力药物
(1)钙增敏剂——左西孟旦:静脉注射左西孟旦适用于短期改善心衰,并可治疗心源性、感染性休克;依据药品说明书禁用于严重肝功能障碍和eGFR<30 ml·min-1·(1.73 m2)-1患者,严重低血压、心动过速、心房颤动或致命性心律失常的患者慎用,并降低血钾和Hb。①左西孟旦具有确切的抗心衰作用,降低死亡率。25项随机对照试验5 349例失代偿性心衰患者的荟萃分析结果显示,左西孟旦显著降低长期死亡率、收缩压、全身血管阻力、左室收缩末期内径和E/A比值,显著增加LVEF[168]。8项随机对照试验424例晚期慢性心衰患者的荟萃分析中,与安慰剂比较,左西孟旦显著降低死亡率,显著改善LVEF[169]。②左西孟旦减少心衰患者AKI风险,改善肾功能。33项随机对照试验3 879例心衰患者的荟萃分析中,左西孟旦显著降低RRT和AKI的风险,显著增加eGFR[170]。
(2)磷酸二酯酶(PDE)-3抑制剂——米力农:米力农改善急性心衰患者的心肌收缩功能,但降低死亡率作用不确切。4项随机试验303例急性心肌梗死后急性心衰患者的荟萃分析结果显示,米力农显著增加LVEF和心输出量,但死亡率、心率、血压、室性早搏、胃肠道反应、室性心动过速或室颤均无明显差别[171]。28项随机对照试验1 806例心源性休克患者的网络荟萃分析结果显示,降低病死率的能力:米力农>左西孟旦>去甲肾上腺素>重组人脑利钠肽>多巴酚丁胺>肾上腺素>多巴胺>常规治疗[172]。
米力农改善慢性心衰患者的肾功能,但不改善心血管和肾脏结局。951例慢性心衰急性加重期患者治疗策略的多中心、随机、双盲、安慰剂对照(OPTIME CHF)试验结果显示,与安慰剂比较,米力农组的平均心血管疾病住院天数、住院死亡率、60 d死亡率以及死亡或再入院复合事件发生率均无明显差别[173]。949例OPTIME CHF试验患者的回顾性分析结果显示,与安慰剂比较,米力农显著减少住院期间血尿素氮增加值和eGFR下降值,但肾功能恶化患者比例以及60 d内心血管住院天数和死亡率无明显差别[174]。
(3)肾上腺素能受体激动剂——多巴酚丁胺:多巴酚丁胺改善急、慢性心衰的心功能,并且不影响肾功能。122例接受标准心衰治疗后LVEF≤35%的急性失代偿性心衰患者的回顾性研究中,多巴酚丁胺显著降低NT-proBNP和平均肺动脉压,显著增加LVEF和6 min步行距离[175]。32例慢性心衰(LVEF<40%)和肾功能受损[eGFR<80 ml·min-1·(1.73 m2)-1]患者的随机、双盲、平行对照试验中,多巴酚丁胺显著增加心输出量、心脏指数、全身供氧量、中心静脉血氧饱和度、动脉血氧饱和度及心率,显著降低中心静脉压和肺毛细血管楔压及全身血管阻力指数;显著增加肾血浆流量,显著降低肾血管阻力和肾小球滤过分数,eGFR无明显变化[176]。
(4)洋地黄类药物:①洋地黄类药物可减少心衰患者的住院率,但不影响心脏结局。52项临床试验621 845例患者系统综述中,7项心衰患者的随机对照试验结果显示,与对照组比较,地高辛的全因死亡风险无明显差别;在心衰和(或)心房颤动患者中地高辛与心血管死亡率无明显关联,但在其他患者中地高辛显著增加心血管死亡风险;在全部患者中地高辛显著降低全因住院风险[177]。②洋地黄类药物可改善心衰患者的肾功能,并且肾功能恶化与地高辛中毒密切相关。DIG试验中980例具有1年中心实验室检测血肌酐结果的患者分析中,与安慰剂比较,地高辛显著增加肾功能改善率;显著降低肾功能改善患者的无住院生存率[178]。DIG试验事后分析结果显示,地高辛中毒患者的血肌酐浓度均显著升高[179]。
(5)不同种类正性肌力药物的比较:①多巴酚丁胺与左西孟旦的比较:与多巴酚丁胺比较,左西孟旦改善心脏功能和死亡风险的疗效无明显差别,但改善心衰患者的肾功能。19项随机对照试验2 385例心源性休克和低心排出量综合征患者的荟萃分析中,左西孟旦与多巴酚丁胺的短期死亡率和长期死亡率无明显差别[180]。32例慢性心衰(LVEF<40%)和肾功能受损[GFR<80 ml·min-1·(1.73 m2)-1]患者的随机、双盲、平行对照试验结果显示,左西孟旦显著增加eGFR,而多巴酚丁胺无明显变化,多巴酚丁胺显著降低肾小球滤过分数,而左西孟旦无明显变化[176]。②米力农与多巴酚丁胺的比较:改善心衰患者心脏和肾脏结局无明显差别。192例心源性休克患者随机、双盲、平行对照试验(DOREMI试验)结果显示,米力农与多巴酚丁胺治疗后的全因住院死亡、复苏性心脏骤停、心脏移植或机械循环支持、非致命性心肌梗死、短暂性脑缺血发作或卒中以及RRT的复合终点事件、全因住院死亡、复苏性心脏骤停、机械循环支持或RRT均无明显差别[181]。③左西孟旦与米力农的比较:改善心衰的疗效无明显差别。31例左室功能正常、主动脉瓣置换术后患者的随机、盲法研究中,左西孟旦与米力农治疗后中心静脉压、肺毛细血管楔压、收缩压和心率均无明显变化;2种药物最高输注率下增加的心脏指数、心输出量指数、左室应变及收缩应变率无明显差别,均改善早期左室舒张,但2组间无明显差别[182]。
6.血管扩张剂
(1)重组人脑利钠肽——奈西立肽:奈西立肽可改善循环淤血,降低全身血管阻力和肺毛细血管楔压,有效治疗心衰,但不影响全因死亡率;并且高剂量增加肾功能恶化风险。22项随机试验38 064例失代偿性心衰患者的荟萃分析中,高剂量奈西立肽显著降低全身血管阻力和收缩压;低剂量奈西立肽显著降低全身血管阻力、肺毛细血管楔压和右心房压,对血肌酐和血尿素氮无明显影响;显著降低室性心动过速和心脏骤停风险,但显著增加低血压和心动过缓风险[183]。15项随机对照试验9 623例急性失代偿性心衰患者的荟萃分析结果显示,高剂量奈西立肽增加肾功能恶化风险,但标准剂量和低剂量对肾功能没有影响[184]。
(2)可溶性鸟苷酸环化酶(sGC)刺激剂——维立西呱:维立西呱降低慢性心衰住院风险,但NT-proBNP>8 000 ng/L或心房颤动患者无明显疗效,不影响肾脏功能。VICTORIA试验中4 133例NT-proBNP≤8 000 ng/L患者中维立西呱治疗显著降低心衰住院或心血管死亡复合、心衰住院及心血管死亡风险;而672例NT-proBNP>8 000 ng/L患者中心衰住院或心血管死亡复合风险无明显差别[185];维立西呱显著降低无心房颤动患者的首次心衰住院或心血管死亡复合风险、心衰住院以及心衰住院和全因死亡复合风险,但心血管死亡或全因死亡无明显差别[186];与安慰剂比较,维立西呱的eGFR和血肌酐变化轨迹无明显差别,并且维立西呱改善心衰住院或心血管死亡复合风险的作用不受基线eGFR和肾功能恶化的影响[187]。
(3)硝酸盐制剂:硝酸盐制剂可明显改善心衰患者的血流动力学和临床症状,可能有助于改善患者长期生存;但对患者短期再住院和死亡率无明显影响,并缺少对肾脏血液动力学和肾功能影响的临床证据。45例HFrEF患者多中心、随机、双盲、交叉试验中,与安慰剂比较,西米拉诺或硝酸甘油干预后的心搏量指数、E波速度、E/E′和E/A比率明显降低,血压降低程度明显增加[188]。106例急性心衰综合征患者前瞻性随机对照试验中,与标准治疗比较,标准治疗基础上静脉注射尼可地尔可显著改善呼吸困难和E/E′,但60 d全因死亡率和再入院率无明显差别[189]。
硝普钠改善急性心衰的血液动力学,但降低死亡率的作用不确切。50例急性心肌梗死患者随机对照试验中,与呋塞米比较,硝普钠显著降低肺毛细血管楔压和全身血管阻力,显著增加心脏指数,但全因死亡率无明显差别[190]。
(4)低剂量多巴胺:低剂量多巴胺(剂量<5 μg·kg-1·min-1,一般为2~4 μg·kg-1·min-1)增加尿量,改善肾功能,但不影响心血管事件和死亡率。6项随机对照试验和1项回顾性研究587例心衰患者的荟萃分析结果显示,低剂量多巴胺显著增加eGFR和尿量,显著降低血肌酐和血尿素氮,但不影响死亡率和再入院率[191]。
(5)乌拉地尔:乌拉地尔有效改善合并高血压的急性心衰患者的心脏功能。7项随机对照试验1 028例合并高血压的急性心衰患者的荟萃分析结果显示,与硝酸甘油比较,乌拉地尔治疗7 d显著增加LVEF和心脏指数,显著降低收缩压、NT-proBNP和左室舒张末期容积,显著减少并发症[192]。
7.伊伐布雷定
在抗心衰标准治疗的基础上添加伊伐布雷定,可改善慢性心衰患者的心肺功能和左室重塑,但是无明显减少心血管事件和降低死亡率的作用。22项随机、安慰剂对照试验24 562例慢性心衰患者的系统综述和荟萃分析结果显示,与标准心衰治疗比较,添加伊伐布雷定可显著降低心率,显著增加LVEF,并改善NYHA分级;显著减少每分钟通气量/二氧化碳生成量比值,显著增加最大摄氧量;显著降低心血管死亡或心衰恶化、心衰、心衰死亡和住院治疗的风险,但全因死亡和心血管死亡风险无明显差别;运动能力无明显差别,但显著增加6 min步行距离[193]。
8.新型抗心衰药物的优势
(1)SGLT2、ARNI和维立西呱:与标准抗心衰治疗(ACEI/ARB、MRA和BB)比较,SGLT-2、ARNI和维立西呱减少心血管死亡与心衰住院风险-综合疗效SGLT-2最佳。6项随机对照试验22 820例HFrEF患者的网络荟萃分析结果显示,与标准治疗比较,ARNI、维立西呱和SGLT-2抑制剂显著减少心血管死亡或心衰住院的复合风险-网络分析结果显示,SGLT-2抑制剂改善心血管死亡或心衰住院的复合风险以及心衰住院风险的作用最强,ARNI改善心血管死亡风险的作用最强;而维立西呱在所有结果中均排名第三[194]。
(2)奈西立肽:与多巴酚丁胺比较,奈西立肽改善心脏功能无明显差别,但增加患者生存率,减少再住院率。122例接受标准心衰治疗后LVEF≤35%的急性失代偿性心衰患者的回顾性研究中,左西孟旦和多巴酚丁胺改善LVEF、NT-proBNP、平均肺动脉压、6 min步行距离及cTnI的疗效无明显差别[175]。7项队列研究2 707例急性失代偿性心衰患者的荟萃分析结果显示,与奈西立肽比较,多巴酚丁胺显著降低生存率,但亚洲人群中无明显关联;多巴酚丁胺显著增加再入院率[195]。
(3)左西孟旦:与多巴酚丁胺比较,左西孟旦降低患者短期死亡率,但长期死亡率无明显差别。19项随机对照试验2 385例心源性休克或低心排出量综合征患者的荟萃分析中,与多巴酚丁胺比较,左西孟旦降低短期死亡率,但长期死亡率无明显差别;显著增加心脏指数,显著降低肺毛细血管楔压,平均动脉压(MAP)无明显变化[180]。
【推荐意见】
· SGLT-2抑制剂降低心衰及其住院风险,降低3期以上CKD患者的心血管结局和死亡风险,改善蛋白尿进展,推荐用于伴有HFmrEF或HFpEF的CRS治疗;但是eGFR<30 ml·min-1·(1.73 m2)-1、ESRD或透析患者禁用。(1a,A)
· ACEI/ARB降低蛋白尿,但不改善心脏结局,可用于伴有HFmrEF或HFpEF的慢性CRS治疗。(1a,A)
· ARNI减少心衰住院风险,降低蛋白尿,改善肾功能,但不改善心脏结局,可用于伴有HFmrEF或HFpEF的CRS治疗;但eGFR<30 ml·min-1·(1.73 m2)-1 患者慎用,不建议应用于ESRD患者。(1a,A)
· MRA改善心肌重塑,减少心衰住院风险,但不改善心脏结局;减少蛋白尿,但增加AKI和高钾血症风险;可用于慢性CRS治疗,但不推荐用于伴有HFmrEF或HFpEF的急性CRS治疗。(1a,A)
· β受体阻滞剂降低心血管死亡率,推荐用于伴有HFmrEF或HFpEF的CRS治疗。(1a,A)
· sGC刺激剂无明显疗效,不推荐应用于伴有HFmrEF或HFpEF的CRS治疗。(1a,A)
· 伊伐布雷定降低静息心率,增加E/E′比值,推荐应用于伴有HFmrEF或HFpEF的CRS治疗。(1a,A)
1.抗心衰治疗
(1)抗心衰标准治疗(ACEI/ARB、β受体阻滞剂和MRA以及ARNI)的治疗效果:ARNI和MRA减少心衰住院风险,MRA改善心肌重塑,β受体阻滞剂降低心血管死亡率,ARB和MRA增加高钾血症风险;ACEI、ARB、ARNI和MRA对全因死亡或心血管死亡无明显影响。41项随机对照试验23 492例LVEF>40%的心衰患者的荟萃分析中,β受体阻滞剂显著降低心血管死亡率,但全因死亡率无明显变化;MRA减少心衰住院率,但全因死亡率和心血管死亡率以及生活质量指标无明显变化,且显著增加高钾血症风险;ACEI和ARB对心血管死亡率、全因死亡率、心衰住院或生活质量指标均无明显影响,ARB显著增加高钾血症风险;ARNI减少心衰住院风险,但对心血管死亡率、全因死亡率或生活质量无明显影响[196]。肾衰竭患者的ARNI和MRA使用注意事项同上。
(2)SGLT-2抑制剂的治疗效果:12项随机安慰剂对照试验荟萃分析中,SGLT-2抑制剂降低HFpEF患者心衰引起的心源性死亡或再住院的复合终点和心衰风险,但没有降低心源性死亡率[197]。19项随机临床试验20 633例HFpEF和HFmrEF(LVEF≥40%)患者的荟萃分析结果表明,与安慰剂比较,SGLT-2抑制剂、ARNI和MRA 显著降低心衰住院风险,其中SGLT-2抑制剂效果最佳;但没有任何治疗显著降低全因死亡或心血管死亡风险[198]。肾衰竭患者的SGLT-2抑制剂使用注意事项同上。
(3)心肌正性肌力药物的治疗效果:米力农具有部分改善生活质量的效果,但维立西呱、Praliciguat、米力农和地高辛均不改善心脏功能和死亡率。789例LVEF≥45%的慢性HFpEF患者多中心、随机、双盲、安慰剂对照试验结果显示,维立西呱治疗24周的堪萨斯城心肌病问卷(KCCQ)身体限制评分和6 min步行距离无明显差别[199]。988例LVEF>45%心衰患者的随机、安慰剂对照试验结果显示,地高辛治疗后的全因死亡和心衰恶化或死亡风险无明显差别[200]。23例HFpEF患者的前瞻性、随机、双盲、安慰剂对照试验结果显示,米力农治疗后生活质量KCCQ评分和自我报告呼吸困难量表评分显著改善;心率、血压以及E/E′、左室大小、左室收缩功能、左房容积指数和NT-proBNP变化无明显差别[201]。
(4)血管扩张剂的治疗效果:7项随机对照试验7 190例心衰(5 707例HFrEF和1 483例HFpEF)患者的荟萃分析中4项HFpEF的分析结果显示,与对照组比较,sGC刺激剂的KCCQ临床总结得分、6 min步行距离以及全因死亡率无明显差别[202]。
(5)伊伐布雷定的治疗效果:4项随机对照试验395例HFpEF心衰患者的荟萃分析结果显示,与安慰剂比较,伊伐布雷定显著降低静息心率,显著增加E/E′比值,但运动能力无明显差别[203]。
2. 减少蛋白尿,延缓肾功能进展:RAAS阻断剂、MRA和SGLT-2降低CKD患者蛋白尿、延缓肾功能进展的疗效及其受肾功能的影响,同前述的HFrEF治疗。
ARNI降低HFpEF患者的蛋白尿、改善肾功能的疗效优于缬沙坦。4 822例HFpEF患者随机、双盲、事件驱动试验中,与缬沙坦比较,ARNI显著改善eGFR降低>50%、ESRD或肾病死亡的肾脏复合事件风险,并且基线eGFR对结果无明显影响;ARNI组的eGFR下降速度较缬沙坦组显著降低[204]。
【推荐意见】
· 推荐符合ICD适应证的CKD患者植入ICD,但eGFR<30 ml·min-1·(1.73 m2)-1患者疗效降低;不建议应用于合并心房颤动的心衰患者。(1b,A)
· 全皮下ICD(S-ICD)长期使用并发症低,建议使用S-ICD。(1a,A)
ICD是目前预防心源性猝死(SCD)最有效的治疗措施,分为经静脉ICD(TV-ICD)和S-ICD[205]。
26项试验119 263例接受心脏再同步治疗(CRT)或ICD治疗的CKD患者的荟萃分析结果显示,与非ICD比较,ICD显著降低全因死亡率[206]。26 286例符合ICD或CRT条件的心衰患者中,与未ICD治疗患者比较,ICD治疗显著减少eGFR≥30 ml·min-1·(1.73 m2)-1患者的1年死亡率,但eGFR<30 ml·min-1·(1.73 m2)-1或透析患者的1年死亡率无明显差别[207]。62项随机对照试验或观察性研究227 998例心衰患者的荟萃分析结果显示,与无心房颤动患者比较,具有心房颤动病史的ICD治疗患者全因死亡率显著增加42%,心房颤动患者发生ICD适当放电和ICD不适当放电风险更高[208]。
TV-ICD与S-ICD治疗后患者生存率无明显差别,TV-ICD增加设备相关并发症风险;但透析患者中S-ICD较TV-ICD增加心脏骤停风险。7项试验1 666例接受ICD治疗患者的荟萃分析结果显示,与S-ICD比较,TV-ICD组器械相关感染风险和1年随访期内无任何并发症的生存率无明显差别;但随访40个月时显著增加并发症发生率[209]。但是,23 136例透析患者回顾性研究结果显示,符合条件首次植入ICD的3 327例患者的倾向评分加权分析显示,与TV-ICD比较,S-ICD显著增加心脏骤停风险,但任何住院不良事件、全因死亡、需要抗生素治疗的感染或住院时间无明显差别[210]。
【推荐意见】
· CRT改善CRS患者的心功能和肾功能,推荐符合CRT适应证的CRS患者实施CRT。(1b,A)
· eGFR<60 ml·min-1·(1.73 m2)-1患者的CRT应答率降低,CRT降低死亡率的疗效减少。(2a,B)
· 降低患者死亡率,CRT除颤器(CRT-D)优于CRT起搏器(CRT-P),四极左室导联优于双极导联;建议选择CRT-D和四极左室导联的治疗模式。(2a,B)
· 推荐影像引导下实施CRT。(2a,B)
CRT包括CRT-P和CRT-D,可增加左室起搏,恢复左、右室间和左室室内运动同步性,提高心脏排血效率,长期应用可逆转心肌重构、降低心衰住院率和死亡率[211]。
1. CRT联合最佳药物治疗:有效改善左室收缩功能衰竭患者的心脏功能和生活质量,降低心衰住院和死亡风险,是抗心衰最佳治疗方案。209项研究23 306例LVEF≤35%且QRS持续时间延长的NYHA Ⅲ/Ⅳ级心衰患者的荟萃分析结果显示,与最佳药物治疗比较,CRT联合最佳药物治疗显著增加至少1个NYHA分级改善的患者比例、LVEF、6 min步行距离和明尼苏达州心衰患者生活问卷评分,显著降低心衰住院率、全因死亡率和心衰死亡风险[212]。
2. CRT治疗CRS:改善心功能和肾功能,减少肾功能恶化风险;但eGFR<60 ml·min-1·(1.73 m2)-1 患者的CRT应答率和改善死亡率效果降低。453例LVEF≤35%且QRS间期≥130 ms中重度心衰患者的多中心、双盲、随机、安慰剂对照试验(MIRACLE)中,无论基线eGFR≥90、60~90或30~60 ml·min-1·(1.73 m2)-1患者,CRT较对照组显著增加LVEF,显著降低NYHA分级、左室舒张/收缩末期容积和二尖瓣反流面积;对于基线eGFR 30~60 ml·min-1·(1.73 m2)-1的患者,CRT较对照组显著增加eGFR,显著降低血肌酐、血尿素氮和肾功能恶化患者比例[213]。190例接受CRT治疗的心衰患者回顾性分析结果显示,与eGFR≥60 ml·min-1·(1.73 m2)-1患者比较,eGFR<60 ml·min-1·(1.73 m2)-1患者的LVEF增加值和左室舒张末期内径降低值显著减少,左室质量指数无明显差别,并且CRT应答率显著降低[214]。26项试验119 263接受CRT或ICD治疗的CKD患者的荟萃分析结果显示,与3期CKD患者比较,4~5期CKD患者显著增加全因死亡率;与非透析比较,透析显著增加全因死亡率[206]。
3. CRT-D与CRT-P的疗效差别:CRT-D降低患者死亡率优于CRT-P。21项研究69 919例接受CRT患者的荟萃分析结果显示,与CRT-P比较,CRT-D显著降低全因死亡率以及用于一级预防时患者死亡率[215]。
4. CRT技术改进可提高CRT疗效:(1)超声心动图、MRI成像可以优化左室导联放置,增强CRT应答。8项试验(4项随机对照和4项观察性)1 075例接受CRT治疗的心衰患者的荟萃分析结果显示,与常规CRT比较,影像引导下CRT显著增加CRT应答率、目标左室导联放置率、左室收缩末期容积降低值及LVEF改善幅度;但心衰再住院率和死亡率无明显差别[216]。(2)四极左室导联优于双极导联。12项试验31 403例接受CRT的心衰患者的荟萃分析结果显示,与双极左室导联比较,四极左室导联显著降低死亡率,改善NYHA分级和住院率,减少导联失活或需要更换/重新定位的左室导联移位[217]。(3)对于伴有左束支传导阻滞(LBBB)的心衰患者,左束支起搏(LBBP)疗效优于双室起搏。6项试验(4项对照和2项单臂)177例伴有LBBB心衰患者的荟萃分析结果显示,与双室起搏比较,LBBP显著缩短QRS持续时间,显著增加LVEF,显著降低左室舒张末期内径和NYHA分级[218]。
5. 常规起搏器或植入除颤器后升级至CRT,与起始CRT的疗效无明显差别,但CRT降低全因死亡率优于ICD:16项试验489 568例接受CRT的心衰患者的荟萃分析结果显示,与起始CRT比较,常规起搏器或植入除颤器后升级至CRT的全因死亡和心衰风险、改善LVEF和NYHA分级以及减少QRS无明显差别[219]。但是,26项试验119 263接受CRT或ICD治疗的CKD患者的荟萃分析结果显示,与ICD比较,CRT显著降低全因死亡率[206]。
【推荐意见】
· MCS改善心功能和肾功能,建议重症CRS患者及时实施MCS。(2b,B)
· MCS增加AKI风险,治疗急性CRS时应评估风险和获益。(2a,B)
· 建议体外膜氧合(ECMO)联合左室卸载装置治疗。(2a,B)
· 左室辅助装置(LVAD)联合CRT或ICD不增加疗效,不建议联合使用。(2a,B)
MCS能够维持重要器官灌注,降低心腔充盈压,减少肺充血、心肌壁压力和心肌耗氧量,并增加冠状动脉灌注,从而提高心衰患者的心肌恢复时间或决定治疗策略时间[220]。
1.MCS种类与应用
(1)短期MCS:包括①右室辅助装置:Impella® RP、TandemHeart™ RA-PA及ECMO;②左室辅助治疗:主动脉内球囊反搏(IABP)、左房-股动脉旁路泵(TandemHeart)、轴流泵(Impella、HeartMate Ⅱ等)及ECMO。短期MCS主要用于治疗急性心源性休克,提供心衰患者的心肌恢复时间,桥接长久LVAD、全人工心脏或心脏移植,以及提供决定治疗策略(姑息治疗、器官捐献)时间。
(2)长期MCS:包括①LVAD、HeartMateⅢ等;②全人工心脏。长期MCS主要用于治疗慢性心衰,桥接心脏移植或作为慢性心衰的目的治疗。第三代离心流LVAD显示出更好地改善生存率的疗效。1 028例晚期心衰患者随机对照试验结果显示,与轴流LVAD(HeartMate Ⅱ)比较,全磁悬浮离心流LVAD(HeartMate Ⅲ)显著增加2年无致残性脑卒中或无更换或移除故障设备的生存率,显著减少心泵更换率以及心泵血栓、脑卒中、胃肠道出血和心律失常发生率,显著降低全因再住院风险[221]。
2. MCS治疗CRS:虽然重度肾衰竭影响CRS患者LVAD术后生存率,但肾功能降低不是LVAD禁忌证,并且LVAD改善肾功能不全患者的肾功能。机构间机械辅助循环支持登记系统(INTERMACS)中4 917例连续性LVAD治疗的患者分析结果显示,与eGFR≥30 ml·min-1·(1.73 m2)-1患者比较,eGFR<30 ml·min-1·(1.73 m2)-1或透析患者的2年生存率降低近20%;但LVAD术后不同等级肾功能不全患者的肾功能均有所改善,并且eGFR<30 ml·min-1·(1.73 m2)-1患者更为明显[222]。139例LVAD置入患者队列研究中,与eGFR≥60 ml·min-1·(1.73 m2)-1 患者比较,eGFR<60 ml·min-1·(1.73 m2)-1患者全因死亡风险无明显差别;LVAD置入3个月后eGFR<60 ml·min-1·(1.73 m2)-1患者的肾功能显著改善,并保持稳定至12个月[223]。
MCS增加AKI发生风险,而AKI增加死亡率。56项队列研究63 663例LVAD治疗患者的荟萃分析结果显示,LVAD术后AKI发生率36.9%,需要RRT的重症AKI发生率12.6%,不同LVAD类型和LVAD适应证的AKI发生率无明显差别;AKI和RRT显著增加30 d和1年的死亡率[224]。
3.不同心脏辅助器械的联合应用
(1)静动脉ECMO(VA-ECMO)联合左室卸载策略:可进一步增加改善生存率。17项观察性研究3 997例难治性心源性休克患者的荟萃分析中,与单纯VA-ECMO比较,VA-ECMO联合左室卸载策略(91.7% IABP,5.5%经皮心室辅助装置,2.8%肺静脉或经间隔左房插管)显著降低全因死亡率[225]。
(2)LVAD联合CRT或ICD:不增加LVAD的疗效。7项试验1 157例心衰患者的荟萃分析结果显示,与非联合CRT比较,LVAD联合CRT的室性心律失常发生率、全因死亡率、ICD电击发生率及住院率无明显差别[226]。9项观察性研究7 074例接受连续流动左室辅助装置(CF-LVAD)患者的荟萃分析结果显示,与非联合ICD比较,CF-LVAD联合ICD的全因死亡率、心血管死亡率、右心衰竭或严重感染风险无明显差别[227]。
【推荐意见】
· 诊断2期AKI后启动血液净化治疗显著减少全因死亡率和肾功能未恢复率,推荐合并2期AKI的急性CRS开始血液净化治疗。(1b,A)
· 对于不伴有血流动力学异常的急性CRS患者,可以选择任何血液净化治疗模式。(1a,A)
· 对于伴有血流动力学异常的急性CRS患者,建议选择连续性RRT(CRRT)或杂合RRT。(5,D)
· 对于伴有脓毒症的5型CRS,建议在血液滤过治疗基础上,联合血浆吸附、多黏菌素B吸附、连续性血浆滤过吸附及血液灌流等治疗。(1a,A)。
· 高剂量血液净化治疗不改善AKI患者结局,推荐采用常规剂量。(1a,A)
· 腹透液的灌注量影响心脏功能,应用PD治疗CRS时应减少每次腹透液灌注量。(1b,A)
1. RRT时机:急性CRS患者的RRT时机目前缺少临床证据,参考AKI的RRT时机,建议急性CRS患者在2期AKI开始RRT。
虽然10项随机试验2 143例严重AKI患者的系统综述和个体患者数据荟萃分析中,各项试验的早期与延迟RRT的定义存在较大差异;与早期RRT比较,延迟RRT的28 d或90 d死亡率、脱离血液净化时间、出院时RRT依赖率、脱离机械通气时间以及脱离升压药物时间均无明显差别[228]。但是,230例危重AKI患者前瞻性随机对照研究结果显示,与诊断3期AKI启动RRT比较,诊断2期AKI后启动RRT显著减少1年主要不良肾脏事件(持续性肾功能不全、透析依赖性和死亡率)、全因死亡率和肾功能未能恢复率[107]。231例危重AKI患者的单中心随机临床试验中,与诊断3期AKI启动RRT比较,诊断2期AKI后启动RRT显著降低了90 d死亡率,显著增加肾功能恢复率,显著减少RRT持续时间和住院时间[229]。
由于荟萃分析中的早期与延迟RRT的标准不一致,难以说明合适的RRT时机;而且鉴于AKI进展速度存在个体差异,AKI分期较AKI发生后时间作为治疗时机更为合理;并且及时RRT更有利于急性CRS患者的容量控制和心衰治疗,因此指南制订专家组建议急性CRS患者在2期AKI开始RRT。
2.治疗模式的选择
(1)不同血液净化模式治疗AKI疗效无明显差别:23项随机对照试验2 720例AKI患者的网络荟萃分析结果显示,CRRT、杂合RRT(缓慢低效HD、延长每日HD和长时间间歇性RRT)与间断性RRT的短期死亡、肾功能恢复、液体清除、感染并发症、低血压、ICU住院时间及住院时间的风险无明显差别;网络分析显示3种血液净化模式的短期死亡率呈现类似效应[230]。但是,15项随机对照试验1 550例ICU住院急性肾衰竭患者的荟萃分析结果显示,与间断RRT[任何24 h内持续<24 h的HD、血液滤过、血液透析滤过(HDF)及超滤治疗等]比较,CRRT显著增加MAP,并且间断RRT转为CRRT的患者显著增加[231]。
需要注意的是,PD治疗时每次灌注腹透液的剂量影响心脏功能。15例稳定PD患者的随机、开放标签、交叉对照研究结果显示,灌注3 L腹透液显著降低患者仰卧位和立位的每搏输出量和心输出量,显著增加外周血管阻力;而灌注2 L腹透液不影响患者仰卧位的每搏输出量、心输出量和外周血管阻力,但显著降低患者立位的每搏输出量和心输出量,显著增加外周血管阻力[232]。
(2)伴有脓毒症的AKI选择多种血液净化技术组合模式:39项随机对照试验2 729例脓毒症患者的荟萃分析和试验序列分析结果显示,常规荟萃分析中,血液滤过、内毒素清除装置和非特异性吸附装置显著降低死亡率;但试验序列分析显示根据现有患者数量,血液滤过、内毒素清除装置和非特异性吸附装置不能证实具有降低死亡率的益处[233]。
3. 高剂量RRT不改善AKI患者结局:8项前瞻性随机对照试验中3 682例AKI患者的个体患者数据的荟萃分析结果显示,与标准剂量RRT比较,高剂量RRT的28 d和90 d全因死亡率无明显差别;显著增加28 d的RRT依赖率,但90 d的RRT依赖率无明显差别[234]。
【推荐意见】
· 早期启动RRT不改善心血管结局,推荐血液动力学稳定的慢性CRS患者满足RRT适应证时开始RRT。(1a,A)
· 晚期慢性心衰患者在无透析指征下提前RRT可有效减轻液体超载,改善心功能、心血管事件和生存率;建议合并难以控制液体超载的慢性心衰患者适当提前RRT。(2b,B)
· 高通量HD、血液滤过、HDF和血液灌流(HP)联合HD治疗增加尿毒症毒素清除,降低死亡率,推荐用于慢性CRS治疗。(1a,A)
· PD与HD的全因死亡风险无明显差别,推荐参考医疗机构条件和患者意愿选择PD或HD治疗。(1a,A)
· PD增加年龄≥50岁或透析龄>36个月患者的心脑血管疾病发病率,但减少移植肾失功风险,建议依据患者病情和意愿选择性应用。(2b,B)
慢性CRS患者是否实施血液净化治疗,应对患者的症状、体征以及代谢异常、容量状态、营养和药物干预效果进行综合评估后判断;特别要关注患者的心功能状态,严重心衰的患者可适当提前导入透析治疗。
1. RRT时机:5期CKD患者早期启动RRT无获益。唯一一项828例5期CKD患者的随机对照试验中,与晚期启动透析[eGFR 5~7 ml·min-1·(1.73 m2)-1]比较,早期启动透析[eGFR 10~14 ml·min-1·(1.73 m2)-1]的死亡率以及复合心血管事件、心血管死亡、非致命性卒中、复合感染事件以及透析并发症无明显差别[235]。
透析时机不影响心脏功能和心肌重塑。182例5期CKD患者的随机对照试验结果显示,早期透析[eGFR 10~14 ml·min-1·(1.73 m2)-1]与晚期透析[eGFR 5~7 ml·min-1·(1.73 m2)-1]患者12个月随访期间的LVEF、左室重量指数、左室收缩环速度、E/Ea比值和左房容积指数无明显差别[236]。
但是,观察性研究结果显示,晚期慢性心衰患者在无透析指征下提前透析治疗可有效减轻液体超载,改善心功能、心血管事件和生存率。159例eGFR(24.0±11.3)ml·min-1·(1.73 m2)-1难治性心衰患者的回顾性研究中,PD显著减轻体重,显著改善NYHA分级,显著降低1年住院率和总住院天数[237]。单中心小样本观察性研究中,42例伴有左室收缩功能障碍和中度肾功能不全[血肌酐(176.8±70.7)mmol/L]的晚期慢性心衰患者在最佳抗心衰治疗基础上,随访6个月期间,与利尿剂应答且使用正性肌力药物的患者比较,因利尿剂抵抗而进行间断性CVVH治疗患者的心衰再住院风险以及死亡或LVAD置入的复合事件发生率显著降低,无死亡/LVAD置入的平均生存期显著增加[238]。
因此,推荐血液动力学稳定的慢性CRS患者满足RRT适应证时开始RRT,而伴有严重心衰且液体超载的慢性CRS患者可适当提前RRT。
2.治疗模式选择
(1)选择高通量HD:与低通量HD比较,高通量HD降低全因和心血管死亡率,并具有保护残余肾功能效果。7项随机临床试验4 412例维持性HD患者的荟萃分析结果显示,高通量较低通量HD显著降低全因死亡率和心血管死亡率[239]。11项随机对照试验和1项队列研究的1 224例维持性HD患者的荟萃分析中,高通量较低通量HD显著减少残余肾功能降低[240]。
(2)增加HD频次或延长HD时间:可改善心脏结构重塑和功能,降低透析前血压。46项试验(38项单臂研究、5项交叉试验和3项随机对照)1 515例HD患者的荟萃分析结果显示,频繁(2~8 h/次,每周>3次)或延长(每次>4 h,每周3次)HD显著降低左室质量指数、左室收缩末期内径、左室舒张末期内径、左室后壁厚度、室间隔厚度、左房舒张末期直径以及收缩压、舒张压、MAP和降压药物数量;显著增加LVEF,但全因死亡率无明显差别[241]。
(3)选择血液滤过或HDF:选择HD比较,血液滤过和HDF降低全因和心血管死亡风险。6项随机对照试验2 972例维持性HD患者的荟萃分析结果显示,血液滤过/HDF较HD显著降低全因死亡和心血管死亡风险[242]。
(4)选择HD联合HP:与HD比较,HD联合HP增加患者生存率。12项试验(7项随机对照,5项队列研究)1 331例维持性HD患者的荟萃分析结果显示,HD联合HP较单纯HD显著增加1、2、5年生存率[243]。
(5)HD与PD的比较:HD与PD患者的全因死亡风险无明显差别,HD增加充血性心衰和心房颤动风险,但降低心血管死亡风险;PD增加年龄≥50岁或透析龄>36个月患者的心血管疾病、心衰、缺血性心脏病或脑卒中的发生率。17项采用倾向评分匹配比较的队列研究113 578例透析患者的荟萃分析结果显示,PD与HD的全因死亡风险无明显差别[244]。28项研究521 474例HD和64 753例PD患者的荟萃分析结果显示,与PD比较,HD显著增加充血性心衰、外周血管疾病、心房颤动患病率,但显著减少心血管死亡率[245]。中国不合并心血管疾病[缺血性心脏病、心衰、外周血管疾病和(或)脑卒中]的1 775例HD患者和613例PD患者前瞻性队列研究中,年龄≥50岁或透析龄>36个月患者的心血管疾病、心衰、缺血性心脏病或脑卒中的发生率,PD显著高于HD;全因死亡率和心血管死亡/全因死亡比值无明显差别[246]。
【推荐意见】
· 心脏移植是治疗终末期心衰的最佳方法,建议晚期CRS患者在充分评估适应证与禁忌证的基础上决定是否心脏移植。(5,D)
· 移植前肾功能不影响心脏移植后AKI和慢性肾衰竭的发生以及患者生存率,CRS患者是否心脏移植取决于心衰的程度。(2b,B)
心脏移植是治疗终末期心衰的最佳方法,心脏移植可改善患者的运动耐量和生活质量,显著增加患者的生存率。但由于心脏供体不足和高昂医疗成本,因此,应在充分评估适应证与禁忌证的基础上决定是否心脏移植[247]。
移植前肾功能不影响心脏移植后AKI和慢性肾衰竭的发生以及患者生存率。18 307例移植前长期LVAD治疗的首次心脏或心肾移植患者的多因素logistic回归分析结果显示,移植术前肾功能不全与移植后发生肾衰竭无明显关联(aOR=1.40,95%CI:0.91~2.18)[248]。
【推荐意见】
· GFR<30 ml·min-1·(1.73 m2)-1且预期进展至ESRD的慢性CRS患者,建议透析前实施活体肾移植。(5,D)
· 肾移植增加心血管事件和心衰风险,移植前严重心功能障碍增加肾移植患者死亡风险;不建议合并NYHA Ⅲ/Ⅳ级或LVEF≤40%的CRS患者实施单独肾移植。(2b,B)
对于4~5期CKD[GFR<30 ml·min-1·(1.73 m2)-1]预期进展至ESRD的患者,透析前实施活体肾移植是首选治疗方案,但不可逆NYHA Ⅲ/Ⅳ级心脏病是肾移植的绝对禁忌证[249]。
肾移植不改善左室结构和功能,增加新发心衰发生率和患者死亡风险;并且移植前心脏收缩功能障碍减少患者生存时间,增加死亡风险。26项试验1 998例肾移植受者的荟萃分析结果显示,肾移植后的左室质量指数、LVEF和左室舒张末期容积无明显变化[250]。48 771例肾移植患者回顾性观察队列研究中,14.9%患者肾移植后3年内发生新发性心衰,中位心衰时间0.76年[251]。1 288例尸体肾移植和812例活体肾移植患者的回顾性研究结果显示,尸体肾移植患者中,心衰、脑血管疾病和慢性肝病显著增加死亡风险;而心衰和糖尿病显著增加尸体肾移植患者的死亡风险[252]。2 718例肾移植患者的回顾性分析结果显示,与LVEF>40%比较,LVEF≤40%显著减少生存时间,显著增加全因死亡和心源性死亡的风险[253]。
【推荐意见】
·对于GFR<30 ml·min-1·(1.73 m2)-1且合并终末期心衰的CRS患者,建议实施心肾联合移植。(2b,B)
·对于GFR≥30 ml·min-1·(1.73 m2)-1且合并终末期心衰的CRS患者,建议实施心肾序贯移植。(2b,B)
心肾联合移植治疗效果优于单纯心脏移植。心肾联合移植增加移植前透析或eGFR<60 ml·min-1·(1.73 m2)-1患者生存率以及移植心脏存活时间,降低急性排斥反应治疗率和移植后新发透析依赖率,并增加新发透析依赖患者生存时间。61 410例单独心脏移植患者和1 507例心肾联合移植患者回顾性队列研究结果显示,与单独心脏移植患者比较,心肾联合移植显著增加移植前透析或eGFR<30、30~44、45~59 ml·min-1·(1.73 m2)-1以及糖尿病和机械心脏支持患者生存率;显著增加移植心脏中位存活时间,显著降低移植后第1年急性排斥反应治疗率和移植后新发透析依赖率;显著增加新发透析依赖患者中位生存时间[254]。
与心肾序贯移植(心脏移植后肾脏移植)比较,心肾联合移植增加死亡风险,但增加移植前eGFR<30 ml·min-1·(1.73 m2)-1或依赖透析患者的生存率。715例心肾联合移植和130例心肾序贯移植患者的回顾性分析结果显示,与心肾序贯移植比较,心肾联合移植显著增加死亡风险(HR=4.7,95%CI:2.4~9.4)[255]。但是,652例心肾联合移植和192例心肾序贯移植患者的回顾性分析中,心肾联合移植较心肾序贯移植显著增加移植前eGFR<30 ml·min-1·(1.73 m2)-1或依赖透析患者的生存率;但eGFR 30~44 ml·min-1·(1.73 m2)-1患者中,心肾联合移植与心肾序贯移植患者的生存率无明显差别[256]。
【推荐意见】
· 推荐合并低血压或休克CRS患者恢复MAP≥65 mmHg。(1b,A)
· 推荐使用平衡晶体液、生理盐水或白蛋白溶液进行液体复苏,禁用羟乙基淀粉。(1a,A)
· 使用生理盐水时应防治高氯性代谢性碱中毒。(1b,A)
· 推荐基于液体反应性评估的目标导向液体复苏。(1a,A)
· 首选去甲肾上腺素,肾上腺素和多巴胺不作为一线药物。(1b,A)
· 建议在去甲肾上腺素基础上选择应用正性肌力药物。(5,D)
· 左西孟旦改善心功能,但左西孟旦、多巴酚丁胺与米力农治疗的全因死亡率无明显差别,且eGFR<30 ml·min-1·(1.73 m2)-1患者禁用。(1a~1b,A)
· 对严重心源性休克患者,建议实施ECMO特别是VA-ECMO联合IABP治疗(2a,B),Impella疗效不确切(2a,B),但不推荐实施单独IABP治疗。(1a,A)
1. 治疗原则和血压控制靶目标:(1)治疗原则:合并低血压或休克的CRS患者,应暂停利尿剂、降压药物和血管扩张剂的使用;积极治疗原发疾病,包括缺血性心脏病的血运重建及脓毒症的抗感染治疗等;在监测血流动力学状态和容量负荷的基础上,有效纠正低容量状态,给予升压药物和正性肌力药物,及时放置MCS。(2)血压控制靶目标:法国心脏病学会建议MAP≥65 mmHg[257]。6项随机对照试验3 690例休克患者的荟萃分析结果显示,与低MAP(60~70 mmHg)比较,高MAP(75~85 mmHg)患者的最长时间随访死亡率、28~30 d死亡率、接受RRT、ICU住院时间、住院时间、升压治疗时间、液体治疗总量及心律失常发生率均无明显差别[258]。因此,建议合并低血压或休克的CRS患者,控制MAP≥65 mmHg。
2. 复苏液体选择:推荐选择平衡晶体液、生理盐水或白蛋白溶液进行液体复苏,禁用羟乙基淀粉。生理盐水与平衡晶体液的患者死亡率、严重AKI或RRT风险无差别,但大剂量输注生理盐水可引起高氯性代谢性酸中毒。9项随机对照试验20 526例危重患者的荟萃分析结果显示,平衡晶体组和生理盐水组之间的死亡率、AKI发生率、RRT使用率及ICU住院时间无明显差别[259]。但是,47例接受开放手术的老年患者前瞻性、随机、双盲和对照临床试验结果显示,与7 ml·kg-1·h-1输注6%羟乙基淀粉比较,7 ml·kg-1·h-1输注生理盐水显著增加血氯升高值、剩余碱下降值以及高氯性代谢性酸中毒发生率[260]。
羟乙基淀粉增加肾脏不良结局和死亡风险。28项随机对照试验10 290例危重患者的荟萃分析结果显示,与晶体、白蛋白或明胶比较,羟乙基淀粉增加全因死亡率、AKI发生率、RRT率及输血治疗率,显著减少尿量[261]。
与晶体溶液比较,淀粉溶液显著增加RRT风险,而白蛋白溶液或明胶溶液无明显差别。10项随机对照试验研究6 664例脓毒症患者网络荟萃分析结果显示,与晶体液体比较,淀粉溶液显著增加RRT的风险,而白蛋白溶液或明胶溶液无明显差别;平衡晶体与生理盐水、平衡晶体与白蛋白无明显差别[262]。
明胶溶液增加过敏反应。30项随机对照试验3 629例危重患者的荟萃分析结果显示,与晶体白蛋白溶液比较,明胶溶液的全因死亡率、输血治疗率和AKI发生率无明显差别,但显著增加过敏反应发生率[263]。
3. 目标导向液体复苏:以液体反应性评估为指导的目标导向治疗改善需要急性容量复苏的危重患者预后。13项随机试验1 652例需要急性容量复苏的危重症患者的荟萃分析结果显示,基于液体反应性评估(心脏搏出量、脉压变化和被动抬腿/液体应激的心脏搏出量变化)的目标导向液体复苏,显著降低全因死亡风险、ICU住院时间和机械通气时间,但肾脏并发症发生风险无明显差别[264]。
4. 升压药物的选择:(1)心源性休克的升压药物选择:首选去甲肾上腺素,肾上腺素和多巴胺不作为一线药物[265]。57例急性心肌梗死后心源性休克患者的多中心、前瞻性、双盲、随机对照试验结果显示,与去甲肾上腺素比较,肾上腺素显著增加难治性心源性休克发生率以及心肌耗氧量、乳酸酸中毒和心率[266]。1 679例使用升压药物治疗的休克患者多中心随机对照试验中,与去甲肾上腺素(0.19 μg·kg-1·min-1)比较,多巴胺(20 μg·kg-1·min-1)治疗显著增加心源性休克患者28 d死亡率和心律失常事件发生率[267]。(2)感染性休克的升压药物选择:首选去甲肾上腺素。32项随机对照试验3 544例感染性休克患者的荟萃分析结果显示,与多巴胺比较,去甲肾上腺素显著降低全因死亡率、主要不良事件和心律失常发生风险,显著增加尿量,但去甲肾上腺素与肾上腺素、苯肾上腺素及血管加压素/特利加压素的死亡风险无明显差别[268]。26个中心27 835例感染性休克患者的回顾性队列研究结果显示,当因去甲肾上腺素短缺而使用苯肾上腺素替代期间,显著增加患者住院死亡率[269]。4项随机对照试验1 453例感染性休克患者的个体数据荟萃分析结果显示,与对照组比较,血管加压素治疗后的28 d死亡和严重不良事件风险无明显差别,显著降低RRT需求和心律失常发生率,显著增加指端缺血发生率[270]。
5. 正性肌力药物的选择:合并低血压的心源性休克患者应首先考虑去甲肾上腺素,而不是选择正性肌力药物[271];合并低血压/心源性休克的CRS患者可在应用去甲肾上腺素基础上选择多巴酚丁胺、米力农及左西孟旦,并且左西孟旦改善心功能。
192例心源性休克患者随机双盲对照试验结果显示,与多巴酚丁胺比较,米力农的全因住院死亡、复苏性心脏骤停、接受心脏移植或机械循环支持、非致命性心肌梗死、短暂性脑缺血发作或卒中或RRT的主要转归事件、全因住院死亡率、复苏性心脏骤停发生率、机械循环支持治疗率或RRT率均无明显差别[181]。19项随机对照试验2 385例心源性休克或低心排综合征患者的荟萃分析中,与多巴酚丁胺比较,左西孟旦显著增加心脏指数,显著降低肺毛细血管楔压,但MAP和患者死亡率无明显差别[180]。需要注意的是,依据药品说明书,左西孟旦禁用于eGFR<30 ml·min-1·(1.73 m2)-1患者。
6. MCS的应用:ECMO及其联合IABP改善心源性休克患者生存率;单纯IABP具有血液动力学的作用,但无明显改善生存率的疗效;Impella影响心源性休克患者生存率的疗效需要进一步验证。
13项队列研究3 098例心脏骤停和235例急性心肌梗死后心源性休克患者的荟萃分析结果显示,与未ECMO治疗比较,ECMO显著增加心脏骤停患者30 d和长期生存率;ECMO较IABP显著增加心源性休克患者的30 d存活率[272]。17项观察性研究3 997例难治性心源性休克患者的荟萃分析结果显示,与单纯ECMO比较,ECMO联合以IABP为主的左室卸载策略显著降低全因死亡率[225]。7项随机对照试验790例急性心肌梗死合并心源性休克患者的荟萃分析结果显示,与标准治疗比较,IABP显著降低心脏指数,显著增加肺毛细血管楔压以及出血、肢体缺血的发生率,但住院死亡率和全因死亡率无明显差别[273]。17项观察性回顾性研究3 933例心源性休克患者的荟萃分析结果显示,Impella 5.0和Impella CP显著降低死亡率[274]。但是,28 304例合并心源性休克的接受经皮冠状动脉介入治疗的急性心肌梗死患者中,1 680对倾向匹配分析结果显示,与IABP比较,Impella显著增加院内死亡率和院内大出血发生率[275]。因此,Impella的应用价值还需要进一步临床试验验证。
【推荐意见】
· 推荐高血压控制的靶目标为<140/90 mmHg且≥120/70 mmHg。(1a,A)
· 推荐优先选择ARNI,但是GFR<30 ml·min-1·(1.73 m2)-1患者慎用,不建议应用于ESRD患者;ACEI、ARB、β受体阻滞剂、第二代二氢吡啶类钙通道阻滞剂(CCB)及利尿剂疗效无明显差别,均可选择性应用。(1a,A)
· 推荐睡前至少服用1种降压药物。(1b,A)
1. 治疗靶目标和治疗原则:(1)治疗靶目标:建议CRS患者的血压控制靶目标为<140/90 mmHg且≥120/70 mmHg。ONTARGET试验和TRANSCEND试验的合并数据分析结果显示,与治疗过程中平均收缩压 120~140 mmHg比较,收缩压≥140 mmHg或<120 mmHg的复合心血管结局、心血管死亡和全因死亡风险显著增加;与治疗过程中平均舒张压 70~80 mmHg比较,舒张压<70 mmHg或≥90 mmHg的复合心血管结局、心血管死亡、心肌梗死、心衰住院和全因死亡风险显著增加[276]。(2)治疗原则:对于慢性CRS(2、4型)患者,选择口服降压药物控制血压达标;而对于急性CRS(1、3、5型)患者,选择血管扩张剂迅速降低血压,防止心衰的进一步恶化。
2. 降压药物的选择:对于合并高血压的CRS患者降压药物的选择,应优先选择具有心脏和肾脏保护作用的降压药物,并应注意肾脏功能对降压药物使用的影响,以及降压药物对肾脏功能影响和发生高钾血症等不良事件的风险。
ARNI改善心肌重塑、心功能和肾功能的疗效优于ACEI/ARB,推荐优先选择ARNI。20项研究(随机对照研究4项)10 175例心衰患者的荟萃分析结果证实,与ACEI/ARB比较,ARNI显著改善HFrEF患者NYHA分级,显著增加心衰患者的LVEF,降低左室收缩末期容积、左室舒张末期容积、左室收缩末期内径、左室舒张末期内径、左房容积和左室质量指数;在HFpEF患者中,ARNI同样显著改善左室收缩末期容积、左室舒张末期容积、左室质量指数[144]。11项随机对照试验21 716例CKD患者的荟萃分析显示,与ACEI或ARB比较,ARNI显著改善肾功能不全、eGFR下降和血钾水平升高以及ACR的风险[277]。需要注意的是,如前述所述,eGFR<30 ml·min-1·(1.73 m2)-1患者慎用ARNI,不建议ESRD患者应用ARNI。
ACEI、ARB、β受体阻滞剂、CCB及利尿剂降低心血管事件和死亡率的疗效无明显差别。11项随机对照试验1 856例接受透析治疗患者的荟萃分析结果显示,与安慰剂或其他血管活性药物比较,ARB显著降低心衰风险,但心肌梗死、脑卒中、心血管死亡和全因死亡率无明显差异[278]。26项随机对照试验152 290例CKD患者的荟萃分析结果显示,ACEI与利尿剂或β受体阻滞剂、CCB与利尿剂或β受体阻滞剂以及ACEI与CCB之间的主要心血管事件无明显差别[279]。
尽管2022 AHA/ACC/HFSA心衰管理指南不推荐二氢吡啶类CCB治疗心衰[133];但是18项随机、双盲、安慰剂对照试验荟萃分析结果显示,第二代二氢吡啶类CCB轻微但显著增加慢性心衰患者的心脏指数、LVEF和运动平板试验时间,不增加去甲肾上腺素水平和患者死亡率,可以安全地用于心衰患者[280]。
3. 降压药物的服用方式:建议睡前至少服用1种降压药物。661例CKD患者5.4年中位随访的随机开放标签试验中,与觉醒时服用所有降压药物比较,睡前服用至少1种降压药物显著降低包括死亡、心肌梗死、心绞痛、血运重建、心衰、下肢动脉阻塞、视网膜动脉阻塞和脑卒中的复合心血管事件以及心血管死亡、心肌梗死和脑卒中的主要终点事件的风险,显著降低心衰发生率,显著增加动态血压控制率和尿白蛋白排泄率降低的患者比例[281]。
4. 血管扩张剂:详见“四、改善心脏功能,延缓肾脏功能进展”中的“6. 血管扩张剂”。
【推荐意见】
· 铁缺乏增加心衰患者死亡风险,静脉铁剂治疗可改善心功能,但口服铁剂无疗效;推荐合并铁缺乏的CRS患者给予静脉铁剂治疗。(1a~1b,A)
· 不建议对于Hb≥90 g/L的CRS患者给予红细胞生成刺激素(ESAs)治疗。(1b,A)
· 低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)减少主要心血管事件不优于ESAs,并且缺乏心衰患者的临床应用证据,建议选择性应用。(1a,A)
1. 铁缺乏:(1)铁缺乏不仅是CKD患者也是心衰患者的常见合并疾病,增加死亡风险。1 506例慢性心衰患者队列中,铁缺乏(铁蛋白<100 μg/L或铁蛋白100~299 μg/L且转铁蛋白饱和度<20%)患病率50%;校正各种混杂因素后,铁缺乏显著增加全部患者、贫血患者和非贫血患者的全因死亡风险,而贫血与全因死亡风险无显著相关[282]。(2)静脉注射铁剂显著增加贫血治疗效果,显著改善心衰,降低心血管住院风险,而口服铁剂不改善心衰,但全因死亡率无明显获益。24项随机对照试验3 187例3~5D期CKD患者的荟萃分析结果显示,与口服铁剂比较,静脉注射铁剂显著增加3~5期CKD和5D期CKD的Hb升高>10 g/L患者比例;全因死亡率和严重不良反应发生率无明显差别[283]。15项随机安慰剂对照试验1 627例慢性心衰患者的荟萃分析结果显示,与安慰剂比较,补充铁剂显著降低心血管住院风险以及NYHA分级和明尼苏达州心衰患者生活问卷评分,显著增加LVEF、6 min步行距离、EQ-5D生活质量评分和患者整体评估(PGA)量表评分,但全因死亡或心血管死亡以及不良事件或严重不良事件无明显差别[284]。225例合并铁缺乏的LVEF<40%的HFrEF患者的双盲、安慰剂对照随机临床试验结果显示,与安慰剂比较口服多糖铁16周时峰值摄氧量(V̇O2)变化、6 min步行距离、NT-proBNP水平以及KCCQ评分无明显差别[285]。2021 ESC急性和慢性心衰诊断和治疗指南建议:LVEF≤50%合并铁缺乏(血清铁蛋白<100 ng/ml或血清铁蛋白100~299 ng/ml,且TSAT<20%)的患者应考虑静脉补充铁剂,以降低心衰住院的风险[43]。
2. 贫血治疗:(1)EASs:虽然13项随机对照试验3 172例心衰患者的荟萃分析结果显示,与对照组比较,ESAs显著改善NYHA分级和明尼苏达生活质量评分,但显著增加血栓栓塞事件风险[286]。但是,中国肾性贫血诊治临床实践指南不建议Hb≥90 g/L合并心衰CKD 患者使用ESAs治疗[287]。2021 ESC急性和慢性心衰诊断和治疗指南建议:无其他适应证的情况下,不推荐使用ESAs治疗心衰贫血[43]。319例LVEF≤40%伴有心衰症状、Hb≥90 g/L且≤125 g/L患者的随机、双盲、安慰剂对照试验结果显示,与安慰剂比较,达贝泊汀α显著增加Hb水平,但运动持续时间、NYHA分级或生活质量评分以及全因死亡率或首次心衰住院风险无明显差别[288]。(2)HIF-PHI:HIF-PHI减少主要心血管事件不优于ESAs。4项随机对照研究4 714例维持性透析患者的数据汇总分析结果显示,与ESAs比较,罗沙司他的主要心血管不良事件(MACE)和MACE+事件的风险无明显差别[289]。2项随机对照试验3 476例非透析CKD患者的汇总数据分析结果显示,与达依泊汀α比较,伐度司他显著增加MACE风险[290]。2项随机对照试验3 923例透析患者的汇总数据分析结果显示,与达依泊汀α比较,伐度司他治疗新导入透析患者和维持性透析患者的首次MACE风险无明显差别[291]。目前缺乏HIF-PHI治疗心衰患者贫血的临床证据。
【推荐意见】
· 维生素D改善心衰患者的心功能,降低CKD患者尿蛋白和死亡风险;推荐用于合并CKD-MBD的CRS患者治疗。(1a,A)
· 司维拉姆有效降低血磷和高钙血症风险,并且较钙剂降低死亡风险;推荐用于合并高磷血症的CRS患者治疗。(1a,A)
· 碳酸镧较钙剂有效降低血磷和高钙血症风险,但增加心血管死亡率和继发性甲状旁腺功能亢进发生率,CRS患者应谨慎应用。(1a~1b,A)
· 口服枸橼酸铁有效降低血磷和血钙水平,并且改善贫血和增加血清碳酸氢盐水平,推荐用于合并高磷血症的CRS患者治疗。(1a,A)
· 拟钙剂有效降低血清iPTH和FGF-23水平,但不改善心血管结局,合并CKD-MBD的CRS患者可选择应用。(1a,A)
· 与药物治疗比较,甲状旁腺切除显著降低全因死亡和心血管死亡风险,推荐合并CKD-MBD且符合手术适应证的CRS患者实施甲状旁腺切除治疗。(1a,A)
1. 维生素D及其类似物:补充维生素D可降低慢性心衰患者的炎症水平,改善心脏功能,提高生活质量。10项随机对照试验1 125例慢性心衰患者的荟萃分析结果显示,与对照组比较,补充维生素D改善健康相关生活质量,显著降低CRP水平,全因死亡率、NT-proBNP或BNP、6 min步行距离无明显差别[292]。13项试验1 215例慢性心衰患者的荟萃分析结果显示,维生素D显著增加LVEF[293]。
维生素D治疗可减少CKD患者尿蛋白,降低全因死亡和心血管死亡风险。6项随机对照试验688例合并蛋白尿的CKD患者的荟萃分析结果显示,活性维生素D类似物显著减少尿蛋白,显著增加尿蛋白降低≥15%患者比例[294]。20项队列研究491 857例CKD患者的荟萃分析结果显示,活性维生素D显著降低全体患者以及非透析CKD和透析患者的全因死亡和心血管死亡风险[295]。
2. 磷结合剂:77项随机对照试验12 562例CKD患者的荟萃分析结果显示,与安慰剂比较,盐酸/碳酸司维拉姆、碳酸镧、钙剂(碳酸钙、醋酸钙)、铁剂(枸橼酸铁、氢氧化铁等)、碳酸镁及考来替兰、烟酸显著降低血磷水平,但全因死亡率或心血管事件无明显差别;与钙剂比较,司维拉姆显著降低全因死亡风险,而碳酸镧、铁剂和考来替兰无明显差别,司维拉姆和碳酸镧显著降低高钙血症风险[296]。2 309例维持性HD患者的开放标签、随机、平行组临床试验中,与碳酸钙比较,碳酸镧的复合心血管事件发生率、全因死亡率及髋部骨折发生率无明显差别,但显著增加心血管死亡率和继发性甲状旁腺功能亢进发生率[297]。16项试验3 085例CKD患者的荟萃分析结果显示,与其他磷结合剂(醋酸钙、碳酸钙、盐酸/碳酸司维拉姆、碳酸镧)比较,枸橼酸铁显著降低血磷和血钙水平,显著增加Hb和红细胞比积以及血清碳酸氢盐水平[298]。
3. 拟钙剂:拟钙剂有效降低血清甲状旁腺激素(PTH)水平,但不改善心血管结局。36项随机对照试验11 247例合并继发性甲状旁腺功能亢进CKD患者的荟萃分析结果显示,与安慰剂比较,拟钙剂显著增加PTH达标率,但全因死亡率、心血管死亡率、心衰发生率或骨折风险无明显差别[299]。
4. 甲状旁腺切除术:甲状旁腺切除降低继发性甲状旁腺功能亢进CKD患者的全因或心血管死亡风险。13项队列研究22 053例(10 052例甲状旁腺切除,12 001例药物治疗)合并继发性甲状旁腺功能亢进CKD患者的荟萃分析结果显示,与药物治疗比较,甲状旁腺切除显著降低全因死亡和心血管死亡风险[300]。
【推荐意见】
· ACEI、ARB、ARNI和MRA均增加高钾血症的风险;而SGLT-2抑制剂降低严重高钾血症发生率,推荐应用于CRS治疗。(1a,A)
· 推荐聚苯乙烯磺酸钙、环硅酸锆钠或Patiromer治疗合并高钾血症的CRS患者。(1b,A)
· 对于服用RAAS抑制剂且具有高钾血症高危风险的CRS患者,推荐联合服用环硅酸锆钠或Patiromer。(1b,A)
1. 不同抗心衰药物对血钾的影响:ACEI、ARB、ARNI和MRA等抗心衰药物均具有发生高钾血症的风险,且联合应用进一步增加高钾血症风险。11项随机对照试验21 716例CKD患者的荟萃分析显示,与ACEI或ARB比较,ARNI的高钾血症发生风险无明显差异[277]。荟萃分析结果证实MRA显著增加高钾血症风险[148]。多项荟萃分析结果表明,与ACEI或ARB比较,ACEI联合ARB显著增加血钾水平和高钾血症发生率[139, 140];ACEI/ARB联合MRA显著增加血钾水平和高钾血症风险[156];阿利吉伦联合ACEI/ARB显著增加高钾血症风险[158]。
SGLT-2抑制剂降低严重高钾血症的风险。6项随机、双盲、安慰剂对照试验49 875例合并高危心血管风险的2型糖尿病或CKD患者个体数据的荟萃分析结果显示,SGLT-2抑制剂显著降低严重高钾血症(血钾≥6.0 mmol/L)的风险,显著降低eGFR≤60 ml·min-1·(1.73 m2)-1、使用或未使用RAAS抑制剂、使用或未使用利尿剂及未使用MRA患者的严重高钾血症风险,且没有增加低钾血症(血钾≤3.5 mmol/L)风险[301]。因此,对于合并高钾血症及其高危风险的CRS患者,SGLT-2抑制剂是较佳选择。
2. 高钾血症的治疗:(1)常规治疗:①急性高钾血症的治疗:对于存在心电图明显改变和严重肌肉无力的急性高钾血症患者应进行紧急治疗[302],包括:a.缓慢静脉注射钙制剂,但使用洋地黄类药物的患者禁用;b.静脉滴注胰岛素葡萄糖溶液;c.静脉滴注碳酸氢钠溶液;d.静脉注射袢利尿剂;e.血钾≥6.5 mmol/L的患者应紧急HD治疗。②慢性高钾血症的治疗:合并慢性轻中度高钾血症患者,首先应检查患者服用的药物,停用非甾体抗炎药和中草药;其次在控制饮食中钾元素摄入的基础上,服用非保钾利尿剂;如果高钾血症不能及时有效控制,应暂停ACEI、ARB、ARNI及MRA类药物。合并慢性严重高钾血症(血钾≥6.0 mmol/L)患者,应立即停用ACEI、ARB、ARNI及MRA类药物,并参照急性高钾血症进行治疗。(2)钾结合剂:①聚苯乙烯磺酸钠与聚苯乙烯磺酸钙:聚苯乙烯磺酸钠与聚苯乙烯磺酸钙均可有效降低血钾,且聚苯乙烯磺酸钙较聚苯乙烯磺酸钠治疗透析前高钾血症更安全,不引起甲状旁腺功能亢进或容量过载。20例合并高钾血症(血钾>5.0 mmol/L)透析前CKD患者随机交叉对照试验中,聚苯乙烯磺酸钠与聚苯乙烯磺酸钙4周治疗后均显著降低血钾水平,但2组间无明显差别;与聚苯乙烯磺酸钠比较,聚苯乙烯磺酸钙组的血钙和血镁水平显著升高,iPTH水平显著降低;血钠、心房钠尿肽和碳酸氢盐水平显著降低[303]。②环硅酸锆钠:环硅酸锆钠不仅快速降低血钾,而且可有效维持服用RAAS抑制剂的心衰患者的正常血钾水平。753例高钾血症患者的多中心、双盲、随机对照试验结果显示,与安慰剂比较,环硅酸锆钠显著降低服药后48 h的血钾水平;12 d维持治疗期间维持正常血钾水平显著优于安慰剂[304]。87例心衰患者随机安慰剂对照试验中,尽管RAAS抑制剂的剂量保持不变,但服用环硅酸锆钠4周治疗期间的维持正常血钾比例较安慰剂组显著增加[305]。③无钠非吸收钾粘合剂——Patiromer:Patiromer可有效长期维持服用RAAS抑制剂的心衰患者的正常血钾水平,增加RAAS维持治疗率。107例服用1种以上RAAS抑制剂的3~4期CKD患者随机安慰剂对照研究结果显示,8周随访期间Patiromer较安慰剂显著降低高钾血症的复发率,显著增加RAAS抑制剂维持治疗率[306]。
【推荐意见】
· 多学科联合治疗降低心衰、透析和危重患者死亡风险,提高肾移植手术率;推荐组建多学科团队联合治疗CRS。(2b,B)
· 多学科联合治疗团队的关键是专业知识的融会贯通,形成CRS临床诊疗的团队力量。(5,D)
· 应避免不同专业人员各行职责,独自诊疗。(1b,A)
1. 多学科团队的组建:CRS多学科团队包括心脏病学、肾脏病学、重症医学、急诊医学、老年医学、内分泌与代谢学、器官移植学、临床药理/药剂学、护理学、营养学、心理/精神病学、康复医学以及影像医学等多种专业学科,成员包括医师、护士、行政协调人员以及患者及其家属。
2. 多学科团队的职能:多学科团队应集体评估CRS患者病情,提出诊断意见和治疗决策,具体包括:(1)明确CRS及其并发症和合并疾病的诊断;(2)明确CRS病情及其进展;(3)提出CRS及其并发症与合并疾病的个体化最佳治疗方案;(4)评估心脏辅助器械或血液净化治疗的适应证与禁忌证;(5)评估心脏和(或)肾脏移植的适应证与禁忌证;(6)合作完成心脏辅助器械或血液净化治疗;(7)评估与防治药物治疗或医疗器械治疗的并发症;(8)提出CRS患者营养、心理及康复治疗方案;(9)协调CRS患者门诊、急诊与住院治疗;(10)与患者及其家属密切沟通,并完成宣教和培训。
3. 多学科团队力量的形成:多学科联合治疗团队的关键是各专业人员的相互学习和各专业知识的融会贯通,多学科联合治疗团队应定期集中学习各学科相关知识,形成CRS临床诊疗的团队力量;多学科联合治疗团队应避免各专业人员的各行其责,而是提出CRS患者个体化的综合诊疗决策。
4. 多学科联合治疗的临床疗效:(1)多学科联合治疗可减少心衰患者住院率,降低不良事件发生率,提高等待肾移植患者的肾移植率。54项老年心衰患者临床试验荟萃分析中,与常规治疗比较,多学科疾病管理计划显著降低心衰或心血管疾病再入院、全因再住院以及再住院或死亡合并事件的风险[307]。207例合并高危心血管风险等待肾移植患者的观察性研究中,接受心肾多学科诊疗模式患者的肾移植手术率显著增加[308]。(2)多学科联合治疗改善透析患者的生存。288例接受肾脏病专科治疗时间超过3个月的CKD患者观察性队列研究中,与标准治疗比较,多学科联合治疗显著增加透析导入时Hb、血清白蛋白及血钙水平,并且Hb水平增加持续至透析后12个月,显著降低全因死亡风险[309]。
【推荐意见】
· 补充蛋白质可改善心衰患者的血管功能和运动能力,改善透析患者的营养不良,推荐CRS患者适当补充优质蛋白。(1b~2a,A)
· 补充多不饱和脂肪酸降低心衰患者的微炎症水平,改善心脏功能,降低透析患者的心血管事件,推荐CRS患者适当补充多不饱和脂肪酸。(1a,A)
·补充辅酶Q10、维生素C、维生素B和维生素D改善心衰患者的心血管功能,建议CRS患者适量补充多种维生素。(2b,B)
营养治疗是CRS治疗的重要组成部分。营养治疗可改善心脏功能,延缓肾衰竭进展。
补充蛋白质可改善心衰患者的全身微血管功能和运动能力,改善透析患者的营养不良。15例心衰患者的随机、盲法、安慰剂对照临床试验结果显示,补充乳清蛋白改善内皮依赖性和非依赖性微血管舒张[310]。20例慢性心衰患者随机对照试验中,补充乳清肽和支链氨基酸显著增加峰值VO2和6 min步行距离[311]。22项试验1 278例维持性透析(79% HD,21% PD)患者的荟萃分析结果显示,口服蛋白质营养补充制剂显著增加平均血清白蛋白、血清前白蛋白水平和臂中肌围[312]。
补充多不饱和脂肪酸可降低心衰患者的微炎症水平,改善心脏功能,降低透析患者的心血管事件。7项随机对照试验465例慢性心衰的荟萃分析结果显示,补充鱼油显著降低TNF-α、IL-1和IL-6的水平[313]。7项试验随机对照试验825例慢性心衰的荟萃分析结果显示,补充鱼油显著增加LVEF,显著减少左室收缩末期容积[314]。7项随机对照试验724例透析患者的荟萃分析结果显示,补充多不饱和脂肪酸显著降低心血管事件[315]。
补充辅酶Q10、维生素B、维生素D可以改善心衰患者的心脏功能,补充维生素C显著改善内皮功能。13项随机对照试验395例心衰患者的荟萃分析结果显示,补充辅酶Q10显著增加LVEF,显著降低NYHA分级[316]。2项随机、双盲、安慰剂对照试验38例心衰患者的荟萃分析结果显示,补充硫胺素显著增加LVEF[317]。7项随机对照试验465例心衰患者的荟萃分析结果显示,补充维生素D显著降低左室舒张末期内径,显著增加LVEF[318]。4项随机对照试验95例心衰患者的荟萃分析结果显示,补充维生素C显著改善内皮功能[319]。
【推荐意见】
· 基于运动的心脏康复改善心衰和CKD患者的心脏功能、运动能力、生活质量和抑郁症状,减少ICD电击发生率,推荐慢性CRS(2、4型)患者在康复师参与下进行运动康复。(1a,A)
1.运动康复对心衰患者的疗效
(1)基于运动的心脏康复治疗可以改善心衰患者的运动能力和生活质量,降低死亡率:44项随机对照试验5 783例心衰患者的荟萃分析结果显示,与对照组比较,基于运动的心脏康复改善长期1年以上随访的全因死亡率,显著降低总体住院率和心衰住院率,显著改善明尼苏达心衰生活质量评分和健康相关生活质量评分[320]。
(2)运动可改善接受心脏辅助器械治疗的心衰患者的心脏功能、运动能力和生活质量,减少ICD电击发生率:7个随机对照试验235例接受CRT的心衰患者的荟萃分析结果显示,6个月的轻中度运动锻炼显著增加最大运动负荷、运动持续时间、VO2峰值及LVEF,显著改善明尼苏达州心衰患者生活问卷评分[321]。16项试验(9项随机和7项非随机)2 547例接受ICD或CRT-D治疗的心衰患者的荟萃分析结果显示,运动干预显著降低ICD电击发生率,显著改善VO2峰值[322]。
(3)运动训练能显著降低心衰患者的抑郁症状:19项随机对照试验3 447例合并抑郁症的心衰患者的荟萃分析结果显示,运动训练显著减轻抑郁症状,并且不受患者的年龄、心功能状态和运动形式与运动持续时间的影响[323]。
2. 运动康复对CKD患者的疗效:运动康复改善CKD运动能力、心肺功能和生活质量,并减少抑郁和焦虑症状,且不影响CKD患者的尿蛋白、肾功能和血压。21项随机对照试验727例非透析CKD患者的荟萃分析结果显示,运动干预显著增加峰值VO2、6 min步行距离和二头肌卷曲重复次数;显著改善肾脏疾病生活质量评分和SF-36生活质量评分,而eGFR、蛋白尿、收缩压和舒张压无明显差别[324]。8项随机对照试验376例CKD患者的荟萃分析结果显示,与常规教育训练的阳性对照组和久坐的阴性对照组比较,运动锻炼组抑郁评分和焦虑评分显著改善[325]。
【推荐意见】
· 认知行为疗法改善心衰和CKD患者的抑郁症状,改善生活质量;推荐认知行为疗法治疗合并抑郁症的CRS患者,而非药物治疗。(1a,A)
21项随机对照试验4 563例合并抑郁症心衰患者的网络荟萃分析结果显示,与安慰剂或常规标准护理比较,运动疗法和认知行为疗法显著减轻抑郁症状,但抗抑郁药无明显疗效[326]。8项随机对照试验540例维持性HD患者的荟萃分析结果显示,与对照组比较,认知行为疗法显著改善抑郁、焦虑和生活质量[327]。
【推荐意见】
· 预定医疗照护计划减少晚期心衰患者抑郁症状,改善生活质量,增加生存时间,减少住院率,推荐临床应用。(1a~2b,A)
安宁缓和医疗是一个多学科的护理提供系统,旨在预测、预防和管理严重疾病患者身体、心理、社会和精神上的痛苦,优化患者及其家属和护理者的生活质量[328]。
预定医疗照护计划(ACP)是目前广泛推荐采用的晚期心衰患者的安宁缓和医疗方案。3项随机对照试验278例晚期心衰患者的荟萃分析结果显示,提前护理计划显著降低改善抑郁症状[329]。14项随机对照试验2 924例晚期心衰患者的荟萃分析结果显示,提前护理计划显著增加心衰患者生活质量、患者对临终关怀满意度和临终沟通质量[330]。540例心衰患者的回顾性队列研究结果显示,临终关怀增加患者生存时间[331]。6项随机对照试验3 306例晚期心衰患者的荟萃分析结果显示,姑息治疗显著减少住院率[332]。
【推荐意见】
· 建议首先区分急性CRS或慢性CRS,然后采取不同的阶梯治疗模式,有序实施上述治疗方案。(5,D)
包括:(1)识别和处理危险因素,积极治疗原发疾病;(2)多学科合作,进行营养治疗、心理治疗与防治急性并发症;(3)使用缓慢持续超滤治疗控制液体超载;(4)应用血管扩张剂、肌力药物和(或)SGLT-2抑制剂;(5)CRRT;(6)置入短期MCS(图2)。
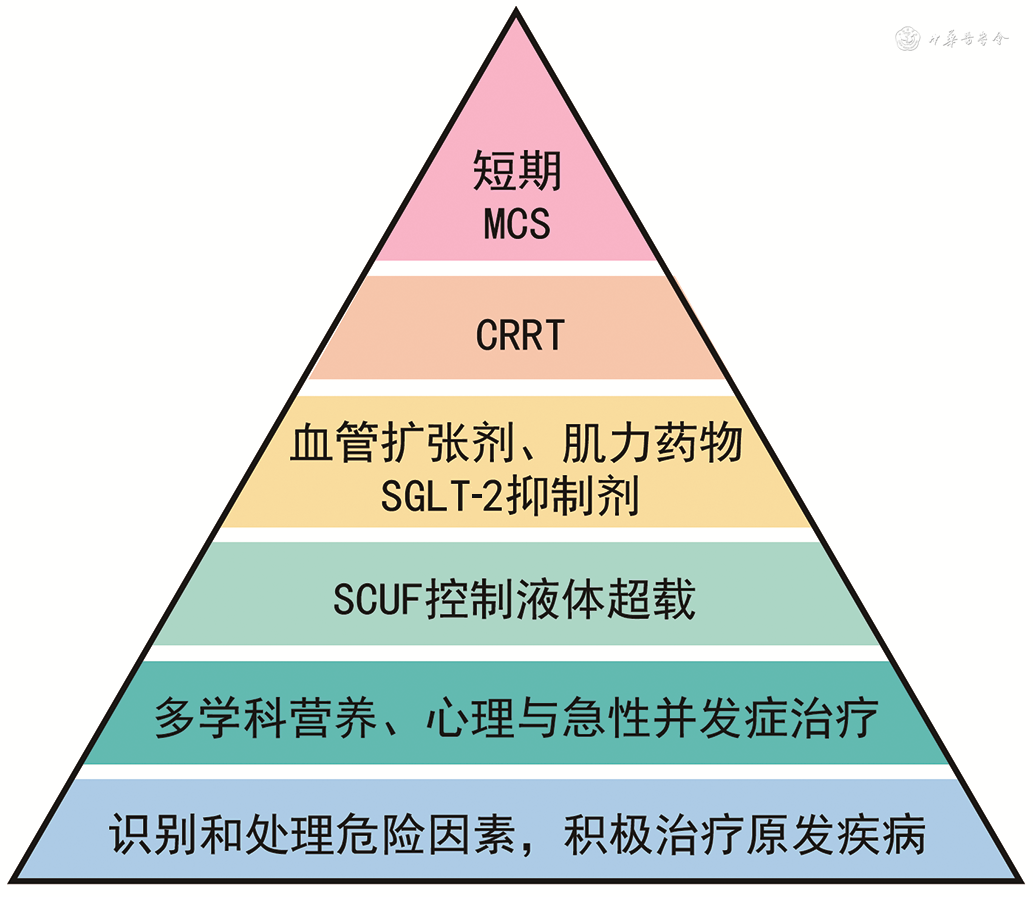

注:CRS为心肾综合征;MCS为机械循环辅助装置;CRRT为连续性肾脏替代治疗;SGLT-2为钠-葡萄糖协同转运蛋白2;SCUF为持续超滤
包括:(1)识别和处理危险因素,积极治疗原发疾病;(2)多学科合作,进行营养治疗、运动康复、心理治疗与防治慢性并发症;(3)应用利尿剂控制液体超载;(4)使用ACEI/ARB/ARNI联合β受体阻滞剂和(或)SGLT-2抑制剂、伊伐布雷定进行心衰治疗;(5)及时植入ICD和(或)CRT;(6)血液净化治疗,依据患者心血管稳定性选择HD、血液滤过、HDF或PD治疗;(7)置入长期MCS;(8)心脏、肾脏移植,心肾序贯或联合移植(图3)。
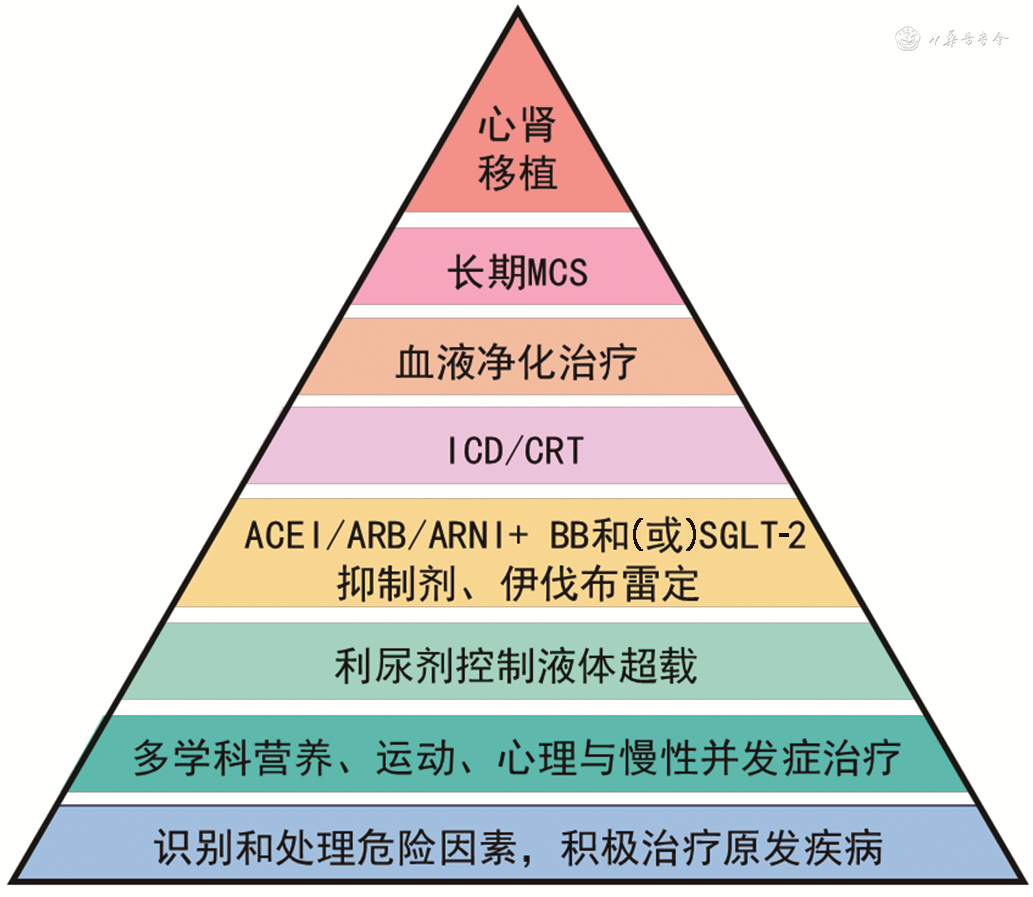

注:CRS为心肾综合征;MCS为机械循环辅助装置;ICD为植入式心律转复除颤器;CRT为心脏再同步治疗;ACEI为血管紧张素转化酶抑制剂;ARB为血管紧张素受体拮抗剂;ARNI为血管紧张素受体-脑啡肽酶抑制剂;BB为β受体阻滞剂;SGLT-2为钠-葡萄糖协同转运蛋白2
引起儿童CRS的原发疾病,与成人CRS存在显著差异。242例前瞻性队列研究中,导致儿童CRS的心脏疾病第1位是心肌炎(40.7%),其次为先天性心脏病(25.9%)、风湿性心脏病(18.5%)和扩张型心肌病(7.4%);与CRS相关的肾脏疾病为急性肾小球肾炎(100%);导致CRS的主要系统性疾病为脓毒症(53.8%)、疟疾(23.1%)、恙虫病(7.7%)和急性胃肠炎(3.8%)[333]。101例AKI患儿的回顾性分析中,70%的3型CRS原发疾病为急性肾小球肾炎,5型CRS主要原发疾病中54.0%为疟疾,29.7%为脓毒症[334]。此外,法布里病、杜氏肌营养不良等遗传性疾病也是儿童5型CRS的病因[335, 336]。
CRS患儿生存时间显著缩短。接受心脏移植患儿CKD患病率在5年时为4%,10年时为10%;10%的心脏移植患者在移植后15年内需要慢性透析或肾移植[337]。与美国普通儿童比较,接受透析治疗的患儿发生全因心血管疾病死亡风险高出10~30倍,比同龄同族的美国普通人群寿命减少40~50岁,而接受移植患儿比同龄同族的美国普通人群寿命减少20~25岁[336]。
【推荐意见】
· 儿童CRS诊断标准和流程同成人CRS。(D,5)
· 建议原因不明的心肌病患儿进行代谢和(或)基因检测。(D,5)
· 建议疑似心衰患儿进行诊断性检测,以评估治疗的需求。(D,5)
心衰患儿可能同时存在结构性先天性心脏病以及同时存在肺循环和全身血循环的灌注不足,并且遗传性和(或)代谢性疾病在心衰患儿中较为常见,因此对原因不明的心肌病患儿应进行代谢和(或)基因检测;并且疑似心衰患儿通常需要进行诊断性检测,以评估治疗的需求(图4)[338]。
【推荐意见】
· 儿童CRS总体治疗原则和治疗药物同成人CRS。(D,5)
· 使用利尿剂治疗时,需要实时/定期评估疗效和不良反应。(D,5)
· 推荐ACEI/ARB及其联合β受体阻滞剂或MRA治疗杜氏肌营养不良导致的5型CRS,但应检测肾功能和血钾。(B,2b)
· 对于合并严重心衰的CRS患儿,推荐使用连续流装置HeartMateⅡ和HeartMate Ⅲ。(B,2a)
· 建议符合心脏移植适应证的患儿应尽早实施心脏移植(5,D);ABO血型不合的婴儿心脏移植不影响心脏移植的预后(2a,B)。
· 生长激素不仅促进生长,而且改善心脏功能,推荐对合并持续性生长衰竭的CRS患儿给予生长激素治疗。(2a,B)
· 早期PD有利于改善CRS患儿预后,建议CRS患儿应用。(2a,B)
· CRRT更有利于实现液体平衡和营养支持,推荐急性CRS患儿实施CRRT。(2a,B)
· 推荐患有不可逆肾衰竭的患儿尽早进行人类白细胞抗原(HLA)匹配肾脏移植。(2a~2c,B)
1. 治疗原则:儿童CRS治疗原则和治疗药物总体上同成人CRS(见第四部分CRS治疗)。但儿童CRS应积极治疗导致CRS的心脏病和肾脏疾病,并且先天性心脏病的患儿应尽快实施心脏手术矫正或心脏移植,出现不可逆性肾衰竭患儿应提前进行肾脏移植。同样,建议组建包括儿童肾脏科、心脏科、重症医学科、遗传代谢科等多学科诊疗团队[339]。
2. 儿童心衰药物治疗:(1)儿童抗心衰治疗的特殊性:准确评估儿童容量超载较为困难:①婴幼儿难以准确测量尿量;②全身静脉压升高时儿童可能不会出现颈静脉扩张,特别是上腔静脉与肺动脉直接吻合的先天性心脏病患儿;③单心室或全身右室先天性心脏病患儿的BNP和NT-proBNP的诊断标准尚不明确[340]。因此,利尿剂疗效和不良反应需要实时/定期评估。杜氏肌营养不良导致的5型CRS治疗:推荐ACEI/ARB及其联合β受体阻滞剂或MRA治疗。668例8~13岁左室功能正常的杜氏肌营养不良患儿注册研究中,ACEI预防性治疗显著降低全因死亡率和心衰住院率[341]。104例杜氏肌营养不良患者回顾性分析结果显示,与治疗前4年间LVEF平均下降率1.5%/年比较,ACEI联合β受体阻滞剂治疗后4年间LVEF平均下降率为0.9%/年(P=0.01)[342]。(2)心衰患儿的辅助循环装置治疗:目前心衰患儿常用的心脏辅助装置是BerlinEXCOR脉动流装置以及连续流装置HeartMate Ⅱ和HeartMate Ⅲ;推荐使用连续流装置HeartMate Ⅱ和HeartMate Ⅲ。12项试验荟萃分析结果显示,与HeartMate Ⅱ和HeartMate Ⅲ比较,BerlinEXCOR显著增加血栓形成和死亡风险[343]。(3)儿童心脏移植:符合心脏移植适应证的患儿应尽早实施心脏移植,并且ABO血型不合的婴儿心脏移植不影响移植后存活率、排斥反应发生率或术后住院时间。1 368例年龄<1岁的心脏移植患儿的贝叶斯加性回归树分析结果显示,与ABO血型匹配比较,ABO血型不匹配的累积生存率和移植物存活率以及心脏移植后1、5和10年生存率无明显差别;急性排斥反应发生率和平均住院时间无明显差别[344]。
3. 儿童肾衰竭治疗的特殊性:治疗儿童肾脏疾病的药物与成人无明显差别,但应关注药物对儿童生长发育的影响;3~5期CKD、接受透析或肾脏移植的儿童,充分治疗解决其他影响肾脏衰竭风险因素后,并且评估儿童具有生长潜力,应给予生长激素治疗[345]。12项试验(4项开放研究,8项盲法、随机、安慰剂对照试验)195例慢性心衰患者的荟萃分析结果显示,生长激素显著增加室间隔厚度、左室后壁厚度、LVEF、运动时间和VO2,显著降低左室舒张末期内径、左室收缩末期内径、左室收缩末期腔室压力、全身血管阻力和NYHA分级[346]。
由于血管通路和医疗器械的限制,PD在儿童急性CRS中应用更为普遍;早期PD有利于改善CRS患儿预后。146例心脏手术后需要PD的新生儿和婴儿回顾性队列研究结果显示,与延迟PD(手术第2天或之后开始)比较,调整混杂因素后,早期PD显著降低死亡率[347]。
但是,有条件时应建议急性CRS患儿实施CRRT。34例心脏手术后患儿研究显示,17例接受PD,8例接受连续动脉-静脉血液滤过(CAVH),9例接受CVVH;CAVH或CVVH较PD显著增加净负液体平衡以及血清尿素和血肌酐降低[348]。
4. 肾脏移植:肾脏移植患儿生存时间显著长于透析治疗患儿。根据美国肾脏数据系统数据,2006—2008年0~19岁接受透析治疗患儿的死亡率为35.6/1 000患者年,而接受肾移植患儿死亡率为3.5/1 000患者年[337]。
推荐CRS患者实施HLA匹配肾脏移植。18项队列研究26 018例肾移植患儿的荟萃分析结果显示,与0~1 HLA-DR错配比较,2个错配1、3、5和10年的移植物失功风险显著增加;对于HLA-A+B,与0~1不匹配比较,2~4不匹配的5年移植物失功风险显著增加,与0~2不匹配比较,3~4不匹配的5年移植物失功风险显著增加[349]。
妊娠相关CRS包括CRS女性患者妊娠,心脏病或肾脏疾病女性患者因妊娠导致心脏功能或肾脏功能恶化发生CRS,既往无心脏病或肾脏疾病女性妊娠期间发生妊娠高血压或围产期心肌病等导致的CRS。
1. 心脏病患者妊娠的临床特征:伴有心脏疾病的女性可以完成妊娠,但加重心衰的进展,并影响孕妇和胎儿/新生儿结局。34项研究2 770例先天性心脏病女性3 491例次妊娠的荟萃分析结果显示,0.67%的患者妊娠期间死亡,5.58%的患者出现心律失常,3.68%的患者出现心衰,10.82%的患者出现妊娠高血压,9.9%的患者产后出血;28.49%的患者剖宫产,17.40%的患者早产,4.89%的患者终止妊娠;17.29%为小于胎龄儿,2.15%新生儿死亡;随着妊娠女性心脏病严重程度增加,心律失常和心衰、剖宫产、早产和小于胎龄儿发生率显著增加[350]。9 585例复发性先兆子痫患者的荟萃分析结果显示,心衰显著增加复发性先兆子痫风险[351]。
2. 肾脏疾病患者妊娠的临床特征:CKD增加妊娠期不良母婴结局的风险;妊娠不引起肾脏疾病进展,但不良妊娠结局增加CKD和ESRD的风险。23项研究506 340例孕妇荟萃分析结果显示,CKD显著增加孕妇先兆子痫、早产、小于胎龄/低出生体重、剖宫产以及妊娠失败的风险;随访5年(IQR 5~14.7年)期间,与未妊娠CKD患者比较,妊娠CKD患者的血肌酐倍增、eGFR或肌酐清除率降低>50%和ESRD的复合肾脏事件发生率无明显差别[352]。23项观察性研究576 991例的荟萃分析结果显示,先兆子痫显著增加CKD、ESRD和肾脏疾病住院的风险,妊娠期高血压显著增加CKD和ESRD的风险,早产或先兆子痫以及无先兆子痫的早产显著增加ESRD风险[353]。
【推荐意见】
· 经妊娠前评估满足条件的CRS女性患者可考虑妊娠。(5,D)
· 不满足妊娠条件标准意外妊娠时,建议严密监测妊娠期间CRS病因疾病以及心、肾功能变化,符合终止妊娠适应证时,应及时终止妊娠。(5,D)
CRS患者准备妊娠前应充分评估心脏疾病、肾脏疾病的状态以及心脏和肾脏功能,建议妊娠条件:①NYHA分级<Ⅱ级,且BNP与NT-proBNP、cTnT和(或)cTnI及LVEF稳定6个月以上;②蛋白尿和肾功能稳定或维持性透析6个月以上;③具有致畸作用的免疫抑制剂停用6个月以上。而NYHA分级Ⅲ/Ⅳ级和(或)LVEF<20%患者应避免妊娠[354],尿蛋白持续增加和肾功能持续恶化以及透析导入期的患者也应避免妊娠。
达不到上述妊娠条件意外妊娠时,应严密监测妊娠期间心脏、肾脏疾病状态以及心脏功能和肾脏功能变化,符合终止妊娠适应证时,应及时终止妊娠。
【推荐意见】
· 妊娠相关CRS治疗总体上同一般CRS患者。(5,D)
· 推荐组建多学科团队治疗妊娠相关CRS。(2b,B)
· 妊娠相关CRS的营养治疗同一般CRS患者,但应适当补充优质蛋白、不饱和脂肪酸、铁剂与钙剂以及多种维生素。(5,D)
· 推荐妊娠期间控制血压<140/90 mmHg。(1b,A)
· 推荐使用袢利尿剂治疗妊娠期间轻中度高血压。(1b,A)
· 妊娠期间禁用ACEI、ARB和MRA。(2a,B)
· 推荐使用甲基多巴、β受体阻滞剂和硝苯地平治疗妊娠期间中重度高血压。(1a,A)
· CCB显著增加孕妇蛋白尿/先兆子痫风险,应慎重应用。(1a,A)
· 阿替洛尔显著增加小胎龄儿风险,应禁止使用。(1a,A)
· 妊娠期间合并严重高血压可选择或联用α受体阻断剂、硝酸甘油酯、肼屈嗪和酮舍林等血管扩张剂(5,D)。
· 洋地黄类药物、PDE抑制剂和左西孟旦等正性肌力药物对孕妇和胎儿/新生儿的结局影响缺乏临床证据,使用前应充分评估获益和风险(5,D)。
· 推荐应用溴隐亭治疗围产期心肌病(1a,A),也可选择己酮可可碱治疗(2b,B)。
· 伊伐布雷定可引起胎儿/新生儿不良结局,不建议妊娠期间应用。(2c,B)
· 推荐使用低分子肝素防治妊娠相关CRS患者的血栓栓塞事件以及心脏辅助器械的抗凝治疗。(1a,A)
· 对于合并严重心衰的妊娠相关CRS患者,建议及时进行心脏辅助器械治疗。(4,C)
· 建议对于合并严重心衰的妊娠相关CRS患者,实施静脉-静脉ECMO治疗改善孕妇和胎儿结局。(2a,B)
· 充分HD较PD有更好的胎儿/新生儿结局,建议符合适应证的CRS孕妇优先选择HD。(2a,B)
· 对于妊娠相关的急性CRS(1、3、5型)患者,建议进行CRRT。(5,D)
· 无论孕周龄,经积极治疗心衰难以控制危及孕妇生命,或胎儿情况严重恶化,建议及时终止妊娠(5,D)。
1. 治疗原则:妊娠相关CRS治疗总体上同一般CRS患者,但治疗药物选择上应禁用影响孕妇和胎儿/新生儿结局的药物;容量控制、血管扩张剂和正性肌力药物是孕妇心衰的主要治疗方法,妊娠不影响循环辅助器械的使用,需要RRT的孕妇,推荐选择HD或CRRT。
2. 一般治疗
(1)多学科团队联合治疗:与一般CRS患者不同,妊娠相关CRS还涉及到孕妇和胎儿/新生儿的管理。建议多学科团队在孕前、妊娠、分娩和产后全周期进行密切随访和治疗;制定早期妊娠和分娩计划,应对并发症,实现成功分娩和结局;进行长期产后心脏随访,以预测妊娠的潜在不良影响[354]。
(2)营养治疗:应参照《中国慢性肾脏病营养治疗临床实践指南(2021版)》[355],依据CRS患者的肾功能状态,营养师参与制定个体化治疗方案;并且依据孕妇尿蛋白和心脏功能状态以及胎儿发育情况,适当增加优质蛋白补充;应适当补充不饱和脂肪酸、铁剂与钙剂以及维生素D、辅酶Q10和维生素B等维生素。
3.妊娠相关CRS药物治疗的特殊性
(1)血压控制靶目标:推荐控制血压<140/90 mmHg。2 408例孕龄<23周、血压<160/100 mmHg孕妇的开放标签、多中心、随机试验中,与未控制血压组比较,血压控制<140/90 mmHg组严重先兆子痫、胎龄<35周、胎盘早期剥离或胎儿或新生儿死亡的主要转归事件、先兆子痫和早产发生率显著降低[356]。
(2)利尿剂:使用利尿剂控制液体超载是妊娠期间心衰的主要治疗方法,推荐使用袢利尿剂。并且对于妊娠期间轻中度高血压患者,呋塞米与氨氯地平具有相似疗效。63例孕龄≤20周、血压140~159/90~109 mmHg的孕妇随机对照试验结果显示,呋塞米与氨氯地平治疗后的孕妇严重高血压、先兆子痫、胎盘剥离、早产和小胎龄儿发生率以及胎儿平均出生体重无明显差别[357]。
(3)妊娠期间禁用RAAS抑制剂:妊娠期间ACEI/ARB使用增加胎儿/新生儿的不良结局。18项研究4 163 753例孕妇荟萃分析结果显示,妊娠期服用3个月ACEI/ARB显著增加新生儿总体先天畸形、心血管系统畸形、中枢神经系统畸形和泌尿生殖道畸形发生率,以及低体重儿、死胎、早产、流产和终止妊娠发生率;妊娠早期服用ACEI/ARB显著增加新生儿总体先天畸形、心血管系统畸形、死胎、早产和终止妊娠发生率[358]。MRA可抑制器官发育,具有致畸作用[359]。
(4)其他降压药物和血管扩张剂的应用:妊娠期间降压药物可选择甲基多巴、β受体阻滞剂和硝苯地平;血管扩张剂可选择α受体阻断剂、硝酸甘油酯、肼屈嗪和酮舍林等;但阿替洛尔增加小胎龄儿风险,不建议妊娠期间使用。
63项随机对照试验5 909例血压140~169/90~109 mmHg孕妇的荟萃分析结果显示,与无降压药物/安慰剂比较,β受体阻滞剂和甲基多巴显著降低严重高血压风险,但CCB和α受体阻断剂无明显差别;β受体阻滞剂显著降低孕妇蛋白尿/先兆子痫风险,CCB显著增加孕妇蛋白尿/先兆子痫风险,而甲基多巴、α受体阻断剂和硝酸甘油酯无明显差别;β受体阻滞剂、甲基多巴、CCB和α受体阻断剂的胎儿或新生儿死亡(包括流产)、小胎龄儿和早产无明显差别;β受体阻滞剂显著减少呼吸窘迫综合征,而CCB和西地那非无明显差别[360]。4 464例慢性高血压孕妇的荟萃分析中的随机对照试验分析表明,阿替洛尔显著增加小胎龄儿风险,被列为最差治疗;呋塞米、氨氯地平和安慰剂为先兆子痫和小胎龄儿的最高概率得分;与未服用药物相比,硝苯地平、甲基多巴、酮舍林和吲哚洛尔显著降低重度高血压的发生率;硝苯地平和甲基多巴显著降低胎盘早剥率;各种药物的剖宫产、围产期死亡、早产和分娩时胎龄无明显差别[361]。
(5)正性肌力药物:尽管洋地黄类药物、PDE抑制剂(米力农、氨力农)、儿茶酚胺(多巴胺、多巴酚丁胺、肾上腺素等)和左西孟旦已经应用于妊娠期孕妇的心衰治疗,但是临床试验证据明显不足,不能确定这些药物对孕妇和胎儿/新生儿的结局影响。24例围产期心肌病患者前瞻性随机对照研究中,与常规心衰治疗比较,联合左西孟旦治疗的患者完全康复、死亡和持续性左室功能障碍无明显差别[362]。
(6)治疗围产期心肌病的药物治疗:在常规标准抗心衰治疗基础上,推荐应用溴隐亭,也可选择己酮可可碱治疗。8项研究(2项随机对照,6项观察性研究)593例围产期心肌病患者的荟萃分析结果显示,与对照组比较,溴隐亭显著增加患者生存率和LVEF水平[363]。59例围产期心肌病患者开放性非随机前瞻性研究中,与对照组(给予利尿剂、地高辛、依那普利和卡维地洛基础治疗)比较,基础治疗添加己酮可可碱显著降低死亡率,显著减少死亡、LVEF改善<10%或NYHA Ⅲ/Ⅳ级的不良结局发生率[364]。
(7)其他抗心衰药物:伊伐布雷定可减慢胎儿心肌细胞的动作电位频率[365],可引起胎儿/新生儿不良结局。38例暴露于伊伐布雷定的孕妇,33例患者怀孕后停止服用伊伐布雷定且无心脏恶化,5例患者妊娠期间继续服用伊伐布雷定;32例活产,3例自然流产,3例选择性终止妊娠;1名新生儿出现重大出生缺陷(房间隔缺损和腭裂)[366]。
SGLT-2抑制剂、sGC刺激剂等新型抗心衰药物,目前缺少妊娠期间使用的经验。
(8)抗凝药物:应用低分子肝素可减少胎儿损耗,并且安全性良好。推荐使用低分子肝素预防血栓形成、治疗血栓栓塞以及心脏辅助器械治疗、HD或CRRT的抗凝治疗。51项试验1 538例孕妇2 113例次妊娠的荟萃分析结果显示,与普通肝素、华法林或普通肝素/低分子肝素联合华法林比较,低分子肝素的胎儿损耗率、主要血栓栓塞事件发生率以及孕产妇死亡率最低[367]。
4. 心脏辅助器械治疗:妊娠相关CRS患者应依据心脏功能状态及时进行心脏辅助器械治疗,改善孕妇和胎儿/新生儿结局。
国际指南建议:妊娠8周以上孕妇植入ICD比较安全;妊娠8周以上孕妇应用CRT总体上安全有效,通常建议12周以后实施,除非患者情况需要更早期进行[368]。4项回顾性研究、22例病例报告和1项研究亚组分析216例植入ICD女性患者的系统综述和荟萃分析结果显示,孕妇无死亡,发生心衰2例,LVEF恶化2例,静脉血栓或心房颤动18例;76例患者中电击治疗13例次,不适当电击治疗2例次;85例妊娠中,胎儿和新生儿活产77例,早产10例,低出生体重8例,宫内生长迟缓9例;2例发生导线断裂[369]。多个病例报告显示,CRT可实现围产期心肌病患者的心功能显著改善和LVEF恢复[370, 371]。
静脉-静脉ECMO对于妊娠相关急性CRS患者具有较好疗效。9项观察性研究妊娠或产后发生严重心脏或肺部疾病患者的荟萃分析结果显示,ECMO治疗后孕产妇生存率77.2%,胎儿存活率69.1%;调整妊娠状态后,静脉-静脉ECMO治疗的患者生存率高于VA-ECMO治疗[372]。
但是,目前缺乏妊娠相关CRS的心脏辅助器械治疗的临床试验证据,研究结果多来自病例报告,心脏辅助器械治疗对于孕妇和胎儿/新生儿结局的影响还需要临床试验证实。并且,围产期心肌病具有较高的恢复率,ICD、CRT和植入式长期心室辅助设备的适应证应更为严格[373]。
5. RRT:尽管HD和PD均应用于合并慢性肾衰竭孕妇的治疗,但HD较PD有更好的胎儿/新生儿结局。126篇文献(36项队列研究,90个病例报告)647例透析患者681次妊娠的荟萃分析中,队列分析显示早产(孕龄<37周)发生率83%,每周HD时间与早产或小于胎龄儿显著相关,小于胎龄儿与每周透析次数密切相关;病例报告分析表明,与PD相比,HD患者小于胎龄儿发生率显著降低[374]。
由于CRRT具有血液动力学稳定、有效溶质清除和良好的液体控制,因此推荐妊娠相关的急性CRS(1、3、5型)采用CRRT。但是,目前缺乏妊娠期间CRRT的临床试验证据,仅见于病例报告[375, 376];CRRT对孕妇和胎儿/新生儿结局的影响尚不明确。
对于妊娠相关CRS患者,无论孕周龄,经积极治疗心衰难以控制危及孕妇生命或胎儿情况严重恶化,应及时终止妊娠。
《妊娠合并心脏病的诊治专家共识(2016)》建议,出现严重心脏并发症或心功能下降应及时终止妊娠,心脏病妊娠风险分级Ⅴ级孕妇应尽快终止妊娠;如果患者及家属在充分了解风险后拒绝终止妊娠,需要转诊至综合诊治和抢救能力非常强的医院进行保健,综合母儿情况适时终止妊娠[377]。《中国心衰诊断和治疗指南2018》建议,无论孕周,经积极治疗仍失代偿心衰或血流动力学不稳定时应终止妊娠[36]。《慢性肾脏病患者妊娠管理指南》建议,CKD患者妊娠32周前孕妇或胎儿情况出现严重恶化,或妊娠32周后孕妇或胎儿情况出现不太严重的恶化均应终止妊娠[378]。
伴随人口老龄化和糖尿病患病率增加,CRS发病率与患病率持续上升。CRS复杂和多因素的病理生理学表现,成为肾内科、心内科及相关学科共同面对的一项重要临床挑战。
目前CRS的临床证据明显不足,本指南的许多建议和推荐意见均是基于心衰和(或)CKD的临床试验证据。CRS诊疗的关键科学问题亟待突破,包括:基于CRS患者的预警、早期识别生物标志物的筛选与验证,基于大数据的CRS预警、早期诊断、病情评估、治疗反应性及预后判断的诊断技术的建立,心肾交互作用对各种治疗药物体内代谢、疗效与不良事件的影响,基于CRS患者的心衰医疗器械的适应证与疗效,基于CRS患者的血液净化治疗时机、模式与剂量等。并且新型抗心衰及改善肾功能药物与医疗器械研发,将为CRS防治注入新活力。因此,开展CRS临床研究迫在眉睫。
毫无疑问,CRS的治疗需要肾内科、心内科、重症医学、影像学等多学科参与,包括对生理、心理和社会因素的关注,建立多学科协作机制,形成综合性和连续性的有效干预手段。并且,未来需要多学科合作探索CRS发生进展新机制,寻找验证CRS预警、诊断及疗效与预后评估的新的标志物以及干预新靶点,推动研究成果转化,建立诊疗新策略、新技术和新方案,研发新型医疗器械,提高CRS诊疗水平,改善患者预后。
希望本指南在指导CRS临床研究,规范诊疗行为上发挥积极建设性作用。同时,随着CRS循证证据的积累,本指南也将不断修订与完善。
指南制订组长:陈香美(解放军总医院第一医学中心肾脏病医学部)
指南制订副组长:孙雪峰(解放军总医院第一医学中心肾脏病医学部)
指南制订专家组成员(按姓氏笔画排序):丁小强(复旦大学附属中山医院肾内科);丁国华(武汉大学人民医院肾病内科);马长生(首都医科大学附属北京安贞医院心脏内科中心);王瑾(解放军总医院第一医学中心肾脏病医学部);王聪慧(解放军总医院第一医学中心肾脏病医学部);白小涓(中国医科大学盛京医院干诊科);冯哲(解放军总医院第一医学中心肾脏病医学部);宁晓红(北京协和医院老年医学科);安友仲(北京大学人民医院重症医学科);孙世仁(空军军医大学西京医院肾脏内科);牟姗(上海交通大学医学院附属仁济医院肾脏科);李为民(解放军总医院第六医学中心耳鼻咽喉头颈外科医学部);李冀军(解放军总医院第一医学中心肾脏病医学部);杨琼琼(中山大学孙逸仙纪念医院肾内科);何奔(上海市胸科医院心内科);何娅妮(陆军军医大学大坪医院心内科);何强(浙江省人民医院心内科);汪年松(上海市第六人民医院心内科);沈茜(复旦大学附属儿科医院肾脏科);张伟光(解放军总医院第一医学中心肾脏病医学部);张利(解放军总医院第一医学中心肾脏病医学部);张健(中国医学科学院阜外医院心力衰竭中心);张爱华(首都医科大学宣武医院肾科);陈良安(解放军总医院第八医学中心呼吸与危重症医学部);陈意志(解放军总医院海南医院肾病科);林洪丽(大连医科大学第一附属医院肾内科);周建辉(解放军总医院第一医学中心肾脏病医学部);郑颖(解放军总医院第一医学中心肾脏病医学部);赵慧颖(北京大学人民医院重症医学科);柏明(空军军医大学西京医院肾病内科);倪兆慧(上海交通大学医学院附属仁济医院肾脏科);徐虹(复旦大学附属儿科医院肾脏科);郭志勇(海军军医大学附属长海医院肾内科);蒋更如(上海交通大学医学院附属新华医院肾脏风湿免疫科);韩璐璐(中国医科大学盛京医院干诊科);蔡广研(解放军总医院第一医学中心肾脏病医学部)
统稿组组长:孙雪峰
统稿组成员:郑颖、王聪慧
讨论专家组成员(按姓氏笔画排序):万建新(福建医科大学附属第一医院肾内科);王荣(山东省立医院肾内科);邓跃毅(上海中医药大学附属龙华医院肾病科);占永立(中国中医研究院广安门医院肾内科);邢昌赢(江苏省人民医院肾内科);刘玉宁(北京中医药大学东直门医院肾病内分泌科);闫铁昆(天津医科大学总医院肾脏内科);吴杰(解放军总医院第一医学中心肾脏病科);李文歌(中日友好医院肾内科);杨向东(山东大学齐鲁医院肾内科);杨洪涛(天津中医药大学第一附属医院肾病科);陈洪宇(杭州市中医院肾内科);邵凤民(河南省人民医院肾脏病风湿病免疫科);黄继义(厦门大学附属第一医院肾内科);曹丰(解放军总医院第二医学中心国家老年疾病临床医学研究中心);梁萌(厦门大学附属成功医院肾内科);蒋红利(西安交通大学第一附属医院血液净化科)
外审专家组成员(按姓氏笔画排序):丁世芳(中部战区总医院心血管内科);王宇石(吉林大学第一医院心内科);刘全(吉林大学第一医院心血管疾病诊治中心);李悦(哈尔滨医科大学第一医院心内科);杨延宗(大连医科大学心内科);佟倩(吉林大学第一医院心血管疾病诊治中心);宋治远(陆军军医大学西南医院心内科);周玉杰(安贞医院心血管内科);郑杨(吉林大学第一医院心血管疾病诊治中心);葛均波(复旦大学附属中山医院心内科);韩雅玲(解放军沈阳军区总医院心血管内科);詹思延(北京大学公共卫生学院流行病与卫生统计学系);霍勇(北京大学第一医院心心脏中心)
中国医师协会肾脏内科医师分会心肾综合征指南工作组. 心肾综合征诊疗的临床实践指南(2023版)[J]. 中华医学杂志, 2023, 103(46): 3705-3759. DOI: 10.3760/cma.j.cn112137-20230822-00277.
所有作者声明不存在利益冲突