
我国是世界上糖尿病患病人数最多的国家,然而,2型糖尿病的知晓率、治疗率和控制率并不理想。糖尿病的治疗需“以患者为中心”,在降糖之外还需关注患者体重目标、改善心血管危险因素、改善心肾结局。胰高糖素样肽-1受体激动剂(GLP-1RA)可有效降低血糖,部分恢复胰岛β细胞功能,降低体重,改善血脂谱及降低血压。大量研究结果证实,GLP‐1RA在降糖作用之外具有心脏、代谢获益,随着对GLP‐1RA机制的发掘,研究者还发现其与改善胰岛素抵抗和炎症相关,对非酒精性脂肪性肝病、多囊卵巢综合征具有潜在获益,未来还有望改善阿尔茨海默病,延缓衰老等。目前一些基层医师对GLP-1RA还缺乏了解,临床应用存在误区,该文对GLP-1RA的研究概况、临床应用、种类、适应证及应用注意事项进行梳理,希望提高基层医生的应用水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
中国是世界上糖尿病患病人数最多的国家,2022年发布的《中国糖尿病地图》数据显示,我国2型糖尿病(type 2 diabetes mellitus,T2DM)2015至2019年整体患病率已达到14.92%[1]。然而,我国T2DM的知晓率、治疗率和控制率并不理想,T2DM的达标率,即糖化血红蛋白(glycated hemoglobin A1c,HbA1c)<7%者仅为50.1%[2],糖尿病患者HbA1c不达标会增加多种并发症的发生风险。近百年来,降糖药物层出不穷,同时循证证据不断增加完善,也推动了糖尿病管理理念升级,糖尿病的治疗需“以患者为中心”,在降糖之外还需关注患者体重目标、改善心血管危险因素、改善心肾结局[3]。
胰高糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA)是一类新型降糖药物,可有效降低血糖,部分恢复胰岛β细胞功能,降低体重,改善血脂谱及降低血压[4]。大量研究结果证实,GLP‐1RA在降糖作用之外还具有心脏、代谢获益,随着对GLP‐1RA机制的发掘,研究者还发现其与改善胰岛素抵抗和炎症相关,对非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)、多囊卵巢综合征(polycystic ovarian syndrome,PCOS)具有潜在获益,未来还有望改善阿尔茨海默病,延缓衰老等。目前一些基层医师对GLP-1RA还缺乏了解,临床应用存在误区,甚至和胰岛素混为一谈,基于此,笔者对GLP-1RA的临床应用进行梳理,希望提高基层医生的应用水平。
1.GLP-1RA的发现:1902年,Bayliss和Staring教授首次观察到肠道能分泌某种促进胰腺分泌功能的物质,命名为促胰液素[5]。1906年,Moore教授尝试用十二指肠的酸性提取物来治疗糖尿病[6]。1932年法国学者La Barre首次提出“肠促胰素”的概念,描述了一种可降低血糖但不会引起胰腺外分泌的肠道上段黏膜提取物。1964年,McIntyre和Elrick两个研究团队发现与静脉注射葡萄糖相比,口服葡萄糖能刺激更多的胰岛素分泌,“肠促胰素效应”得到证实,提示肠道可能释放对胰岛分泌具有调节作用的因子[7]。而后,葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide,GIP)和胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)被确定为主要肠促胰岛素激素[8],并将GLP-1开发为T2DM的潜在治疗方法,促胰岛素概念得到进一步发展。
2.生理性GLP-1的作用:人GLP-1受体广泛表达于胰岛、肾脏、肺、心脏以及周围和中枢神经系统的多个区域,因此,GLP-1作用于GLP-1受体后产生的生理作用较为广泛[9]。具体包括:(1)大脑:食物摄取减少;水摄取减少;学习和记忆能力增加;神经保护增加;炎症减少;奖赏行为减少;食欲降低;凋亡减少。(2)胰腺:胰岛素分泌增加;胰岛素合成增加;胰高糖素分泌较少;β细胞增殖增加;凋亡减少;β细胞存活增加。(3)肝脏:糖异生减少;脂肪肝好转。(4)心脏:收缩力增加;心输出量增加;心肌存活增加;具有心脏保护作用;葡萄糖利用增加;血管舒张增强;葡萄糖摄取增加;左心功能增加;心房钠尿肽生成增加;尿钠排泄增加;血压、心率可升高、降低或不变。(5)胃肠消化道:胃排空减弱;胃肠动力降低。(6)肾脏:排尿增加;尿钠排泄增加。(7)肌肉:对胰岛素敏感性增强;葡萄糖摄取增加。(8)骨:骨形成增加;骨质增加。但由于二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP-4)的降解和肾脏的快速清除作用,生理性GLP-1的半衰期很短,约为2 min[10],而GLP-1的血浆半衰期短是GLP-1作为T2DM治疗药物开发的一个重大障碍,因此,需要具有较长持续作用时间的抗降解GLP-1RA的临床研发。
3.GLP-1RA的研发:一项体外研究表明,与GLP-1相似,Exendin-4可以特异性作用于GLP-1受体,并显著增加细胞内环磷酸腺苷水平[11]。基于Exendin-4结构,2004年首个GLP-1RA艾塞那肽研发成功,2005年被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于治疗T2DM,但艾塞那肽治疗仍存在局限性,半衰期仅为2.4 h[12],仍需多次注射。2009年首个长效日制剂利拉鲁肽上市,半衰期长达13 h[13],此后,其他GLP-1RA如利司那肽、阿必鲁肽、度拉糖肽、司美格鲁肽等陆续获批上市。GLP-1RA从分子结构的角度分类,可分为动物源性GLP-1(Exendin-4)及其衍生物和人源性GLP-1及其衍生物两大类。尽管GLP-1RA共享相同的药理作用机制,但不同GLP-1RA在药物结构、药代动力学特征上却存在较大差别,因此也带来不同的临床获益[14]。
1.GLP-1RA在T2DM患者中的降糖疗效:荟萃分析结果显示,与安慰剂相比,所有GLP-1RA均可显著降低HbA1c[15]。艾塞那肽联合磺脲类和(或)二甲双胍与安慰剂相比可降低HbA1c达0.8%[16]。二甲双胍和(或)磺脲类控制不佳的T2DM患者加用利司那肽20 μg/d,24周后较安慰剂组空腹血糖下降0.48 mmol/L,餐后2 h血糖下降4.28 mmol/L,HbA1c降低0.36%[17]。血糖控制不佳的T2DM患者给予度拉糖肽1.5或0.75 mg/周单药治疗26周,较格列美脲单药分别多降低HbA1c达0.58%和0.32%。在二甲双胍和(或)磺脲类控制不佳的T2DM患者中,给予度拉糖肽1.5或0.75 mg/周治疗26周,HbA1c分别降低1.73%和1.33%[18]。真实世界研究显示,贝那鲁肽治疗3个月后,较基线空腹血糖下降3.05 mmol/L,餐后2 h血糖下降5.46 mmol/L,HbA1c降低2.87%[19]。二甲双胍联合洛塞那肽100、200 μg/周治疗24周,分别较安慰剂多降低HbA1c分别达1.51%和1.49%[20]。利拉鲁肽1.8 mg/d较西格列汀100 mg/d多降低HbA1c 0.67%[21]。GLP-1RA联合胰岛素治疗能减少胰岛素剂量,利拉鲁肽联合胰岛素可使胰岛素剂量减少66%[22]。
另外,司美格鲁肽注射制剂及口服制剂的疗效研究也陆续完成。在T2DM患者中给予司美格鲁肽注射液1.0 mg/周和艾塞那肽缓释注射液2.0 mg/周治疗56周后,HbA1c分别较基线降低1.5%和0.9%[23]。司美格鲁肽口服片剂的PIONEER系列研究显示,在饮食/运动血糖控制不佳的T2DM患者中,使用司美格鲁肽片剂3、7或14 mg/d,单药治疗26周后,HbA1c分别降低0.8%、1.3%、1.5%[24]。在二甲双胍血糖控制不佳的T2DM患者中,使用司美格鲁肽片剂14 mg/d或恩格列净25 mg/d治疗52周后,司美格鲁肽片剂降低HbA1c显著优于恩格列净,分别降低1.3%和0.8%[25]。在使用稳定剂量胰岛素的T2DM患者中,联用司美格鲁肽片剂14 mg/d治疗26周后,HbA1c显著降低达1.4%,且减少患者胰岛素使用剂量,不增加低血糖发生风险[26]。
2.GLP-1RA在T2DM患者中的心血管获益:荟萃分析结果显示,GLP‐1RA降低3P-主要心血管不良事件(major adverse cardiovascular event,MACE),即心血管死亡或非致死性心肌梗死或非致死性卒中复合事件12%,降低心血管死亡风险12%,减少致死性和非致死性卒中16%,减少致死性或非致死性心肌梗死9%,降低全因死亡风险12%,减少因心力衰竭住院9%[27]。但不同GLP-1RA制剂,心血管获益并不一致。与安慰剂相比,艾塞那肽[28, 29]、利司那肽[30, 31]未显著降低MACE发生风险。REWIND研究表明,与安慰剂相比,度拉糖肽组显著降低合并心血管事件/心血管危险因素的T2DM患者MACE发生风险22%[32]。LEADER研究表明,利拉鲁肽显著降低合并心血管疾病的T2DM患者MACE主要复合终点发生风险为13%,可显著降低扩展的MACE(导致住院的不稳定型心绞痛、冠状动脉重建或由心力衰竭引起的住院)的发生风险[33]。SUSTAIN 6研究显示,司美格鲁肽注射液显著降低合并心血管疾病的T2DM患者MACE风险达26%,结果主要由非致死性卒中(发生率显著降低39%)和非致死性心肌梗死(发生率显著降低26%)驱动[34]。PIONEER 6研究显示,司美格鲁肽片剂不增加合并心血管疾病及其心血管高风险T2DM患者的MACE风险,但可显著降低患者心血管死亡风险达51%[35, 36]。聚乙二醇洛塞那肽注射液的结果尚未发布。
3.GLP-1RA在T2DM患者中的肾脏获益:荟萃分析结果显示,GLP‐1RA减少肾脏复合终点(新发大量蛋白尿、肾小球滤过率下降30%、进展至终末期肾病或肾脏疾病导致死亡)17%[27]。GLP-1RA的心血管结局试验(cardiovascular outcomes trial,CVOT)研究次要终点探索了GLP-1RA治疗的肾脏获益。EXSCEL研究显示,艾塞那肽可使复合肾脏终点(新发持续大量白蛋白尿、血清肌酐倍增、连续性肾脏替代治疗或肾脏疾病导致的死亡)风险降低15%[37]。ELIXA研究显示,利司那肽可使T2DM患者新发大量白蛋白尿风险降低19%,伴有大量白蛋白尿患者的尿白蛋白/肌酐比值(urinary albumin/creatinine ratio,UACR)显著降低39%[38]。LEADER研究显示,利拉鲁肽降低肾脏复合终点(新发持续大量白蛋白尿、血清肌酐倍增、连续性肾脏替代治疗或肾脏疾病导致的死亡)风险22%[39]。REWIND研究显示,度拉糖肽降低肾脏复合终点(新发大量白蛋白尿、估算的肾小球滤过率下降30%、肾脏替代治疗)风险15%。SUSTAIN 6研究显示,司美格鲁肽注射液较安慰剂组降低肾脏复合终点风险36%[40]。
4.GLP-1RA在肥胖/超重患者中的体重获益:肥胖/超重是内分泌及代谢领域的热议话题,大量研究表明,无论是否合并糖尿病,GLP‐1RA均可减轻肥胖/超重患者体重。基于不同肥胖相关并发症的成年肥胖患者管理目标不同,具体包括[41]:(1)代谢综合征:减重目标为10%,以达到预防T2DM的预期结果;(2)T2DM:减重目标为5%~15%,以降低HbA1c,减少糖尿病药物治疗,糖尿病缓解(病程短者);(3)血脂异常:通过减重5%~15%,降低甘油三酯,提高高密度脂蛋白胆固醇,降低低密度脂蛋白胆固醇;(4)高血压:减重5%~15%,降低血压,减少用药;(5)NAFLD:减重目标为10%~40%,减少肝细胞内脂质和炎症;(6)PCOS:通过减重5%~15%,达到排卵、减少多毛症、降低雄激素水平、增加胰岛素敏感性的预期结果;(7)睡眠呼吸暂停:通过减重7%~11%,降低呼吸暂停/呼吸不足指数;(8)哮喘:减重7%~8%,改善1秒用力呼气容积;(9)胃食管反流病:通过减重≥10%减轻症状。
在使用甘精胰岛素的T2DM患者中,联合艾塞那肽2 mg治疗28周后患者体重较基线降低1.04 kg[42]。使用二甲双胍和(或)磺酰脲类药物的T2DM患者,使用利司那肽20 μg治疗24周后体重较基线降低1.5 kg[43]。在T2DM患者中,二甲双胍分别联合利拉鲁肽1.8 mg或格列美脲治疗26周后,体重分别较基线降低2.79、0.95 kg[44]。针对T2DM人群,使用司美格鲁肽注射液1 mg联合二甲双胍和(或)磺酰脲类药物治疗30周后,患者体重较基线降低4.2 kg[45]。针对T2DM人群,使用度拉糖肽1.5 mg联合二甲双胍或磺酰脲类药物治疗52周,患者体重较基线降低1.47 kg[46]。
在不合并T2DM的超重/肥胖患者中,GLP-1RA减重效果同样显著。肥胖患者每日1次使用利拉鲁肽1.8和3.0 mg治疗5周后,体重分别降低2.1和2.5 kg[47]。肥胖患者每周1次使用司美格鲁肽1.0 mg治疗12周后,平均体重相较于基线降低5.0 kg[48]。长效GLP-1RA Efpelenatide的Ⅱ期研究显示,肥胖且无糖尿病的患者分别使用Efpelenatide 4 mg/周、6 mg/周、6 mg/2周、8 mg/2周治疗20周后,相较于安慰剂组体重降低6.3~7.2 kg[49]。司美格鲁肽长期治疗数据显示,肥胖/超重且无糖尿病的患者使用司美格鲁肽(2.4 mg/周)或安慰剂治疗68周后,司美格鲁肽组的平均体重下降16.0%,而安慰剂组的平均体重下降5.7%[50]。
5.GLP-1RA在NAFLD患者中的获益:NAFLD的特点是肝脏中脂肪堆积,可进展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、纤维化和肝硬化[51]。因此,对NAFLD进行适当的治疗对于预防疾病进展和降低发生严重并发症的风险至关重要。NAFLD通常与肥胖、胰岛素抵抗和代谢综合征相关[52]。抗糖尿病药物可改善胰岛素抵抗、减少炎症并减少肝脏脂肪堆积,这些都是NAFLD发病机制的关键因素。因此,抗糖尿病药物在NAFLD治疗中的潜在作用已被广泛研究。
GLP-1RA治疗NAFLD的机制涉及多种途径[53]。GLP-1的主要功能是激活β细胞的胰岛素分泌并抑制α细胞的胰高糖素分泌[54]。通过提高细胞对胰岛素的敏感性,GLP-1RA可以帮助身体更有效地调节血糖水平,从而降低患NAFLD的风险[55]。此外,GLP-1RA还可减少肝脏中的脂肪积累,对NASH动物模型的多项研究表明,GLP-1RA可改善肝脏组织学[56]。
LEAN研究显示,NASH合并超重患者分别使用利拉鲁肽1.8 mg(1次/d)与安慰剂治疗48周后,利拉鲁肽组39%的患者达到主要终点(NASH缓解且纤维化未恶化),而安慰剂组这一指标仅为9%[57]。利拉鲁肽可显著降低低密度脂蛋白胆固醇、丙氨酸氨基转移酶、血清瘦素、脂联素水平[58]。一项纳入320例活检确诊为NASH合并肝纤维化(F1、F2或F3期)患者的对照研究显示,每日1次使用司美格鲁肽0.1、0.2、0.4 mg治疗72周后,分别有40%、36%、59%的患者达到了主要研究终点(NASH缓解且纤维化未恶化)[59]。与标准治疗相比,每日2次10 μg艾塞那肽可显著降低肝甘油三酯含量[60]。D-LIFT研究显示,度拉糖肽相较于对照组可显著降低甘油三酯含量[61]。但目前GLP-1RA暂未被批准用于NAFLD或NASH治疗。
1.GLP-1RA种类及适应证:截至2023年8月,我国已批准了10种GLP-1RA药物上市,其中包含两种基础胰岛素联合GLP-1RA注射液(德谷胰岛素利拉鲁肽注射液和甘精胰岛素利司那肽注射液)。目前仅利拉鲁肽注射液及司美格鲁肽注射液获批用于治疗成人T2DM合并心血管疾病患者的心血管不良事件风险两种适应证(表1)。
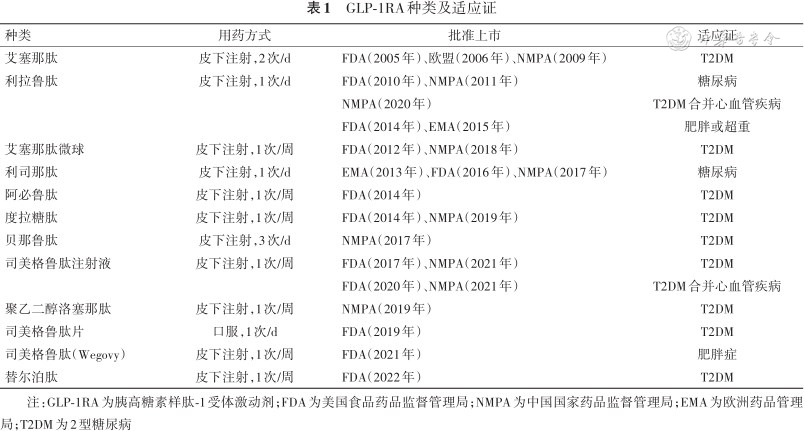
GLP-1RA种类及适应证
GLP-1RA种类及适应证
| 种类 | 用药方式 | 批准上市 | 适应证 |
|---|---|---|---|
| 艾塞那肽 | 皮下注射,2次/d | FDA(2005年)、欧盟(2006年)、NMPA(2009年) | T2DM |
| 利拉鲁肽 | 皮下注射,1次/d | FDA(2010年)、NMPA(2011年) | 糖尿病 |
| NMPA(2020年) | T2DM合并心血管疾病 | ||
| FDA(2014年)、EMA(2015年) | 肥胖或超重 | ||
| 艾塞那肽微球 | 皮下注射,1次/周 | FDA(2012年)、NMPA(2018年) | T2DM |
| 利司那肽 | 皮下注射,1次/d | EMA(2013年)、FDA(2016年)、NMPA(2017年) | 糖尿病 |
| 阿必鲁肽 | 皮下注射,1次/周 | FDA(2014年) | T2DM |
| 度拉糖肽 | 皮下注射,1次/周 | FDA(2014年)、NMPA(2019年) | T2DM |
| 贝那鲁肽 | 皮下注射,3次/d | NMPA(2017年) | T2DM |
| 司美格鲁肽注射液 | 皮下注射,1次/周 | FDA(2017年)、NMPA(2021年) | T2DM |
| FDA(2020年)、NMPA(2021年) | T2DM合并心血管疾病 | ||
| 聚乙二醇洛塞那肽 | 皮下注射,1次/周 | NMPA(2019年) | T2DM |
| 司美格鲁肽片 | 口服,1次/d | FDA(2019年) | T2DM |
| 司美格鲁肽(Wegovy) | 皮下注射,1次/周 | FDA(2021年) | 肥胖症 |
| 替尔泊肽 | 皮下注射,1次/周 | FDA(2022年) | T2DM |
注:GLP-1RA为胰高糖素样肽-1受体激动剂;FDA为美国食品药品监督管理局;NMPA为中国国家药品监督管理局;EMA为欧洲药品管理局;T2DM为2型糖尿病
2.GLP-1RA使用注意事项:(1)肝肾功能不全患者:GLP-1RA类药物不可用于终末期肾病患者。利拉鲁肽、德谷胰岛素利拉鲁肽注射液、司美格鲁肽和度拉糖肽可用于轻度和中重度肾功能不全的患者,无须调整剂量。利司那肽和度拉糖肽可用于肝功能不全的患者,无须调整剂量。(2)老年及青少年、儿童T2DM患者:GLP-1RA类药物可用于老年T2DM患者。GLP1-RA类药物在中国暂未获批用于青少年及儿童。(3)1型糖尿病患者及糖尿病酮症酸中毒患者:GLP-1RA类药物不可用于1型糖尿病患者以及糖尿病酮症酸中毒患者。GLP1-RA类药物可导致啮齿类动物发生甲状腺髓样癌,虽暂未发现人类发生此不良反应,但尚无法确定是否会发生相同情况,因此,GLP-1RA类药物禁用于有甲状腺髓样癌既往史或家族史的患者。
随着对GLP-1RA研究的逐渐深入,GLP-1RA不仅在T2DM患者中治疗地位不断提升,同时GLP-1RA作用于多种组织及靶器官的作用也在不断被发掘,可降低血压、改善血脂水平等,在代谢疾病方面的优势逐渐显现,未来可能被用于治疗更多疾病,需要更多的询证证据支持。
彭永德. 胰高糖素样肽-1受体激动剂的临床应用[J]. 中华糖尿病杂志, 2023, 15(Z2): 1-7. DOI: 10.3760/cma.j.cn115791-20230929-00206.
作者声明无利益冲突



























