
评价连续3轮次年度粪便免疫化学试验(FIT)在中国人群结直肠癌筛查中的参与率和结直肠病变检出情况。
基于2018年5月至2021年5月在全国6个中心开展的一项人群结直肠癌筛查研究,共纳入了7 793例50~74岁符合研究条件的受试者,为其提供免费的FIT检测和结肠镜检查(仅针对FIT初筛阳性者)。在基线时,所有受试者均受邀接受FIT筛查。在后续轮次筛查中,仅邀请FIT阳性但未接受结肠镜检查者或FIT阴性者进行重复FIT筛查。FIT阳性者推荐接受结肠镜和病理检查(如结肠镜下有异常发现)。研究共计开展了3轮次每年1次的FIT筛查,主要研究结局为FIT参与率、FIT阳性者的结肠镜检查参与率以及结直肠肿瘤的检出率。
7 793例受试者中男3 310人(42.5%),年龄为(60.50±6.49)岁。第1轮、第2轮和第3轮FIT筛查的参与率分别为94.0%(7 327/7 793)、86.8%(6 048/6 968)和91.3%(6 113/6 693)。在7 793例参与者中,99.3%(7 742/7 793)参加了至少1轮筛查,66.3%(5 163/7 793)参加了全部3轮筛查。第1轮筛查人群的FIT阳性率(14.6%,1 071/7 327)高于第2轮(5.6%,341/6 048)和第3轮(5.5%,339/6 113)筛查(均P<0.001)。FIT阳性受试者结肠镜检查依从率在3轮筛查中均达到70%以上,分别为76.3%(817/1 071)、75.7%(258/341)和71.7%(243/339)。logistic多因素回归分析显示,性别和吸烟状态是影响FIT筛查参与率的影响因素,男性和不吸烟者的FIT筛查参与率较高。此外,年龄与FIT阳性者的结肠镜检查依从率呈负相关。经过3轮筛查,进展期肿瘤(结直肠癌+进展期腺瘤)的检出率逐轮下降[第1轮:1.15%(90/7 793);第2轮:0.57%(40/6 968);第3轮:0.58%(39/6 693)],但进展期肿瘤的阳性预测值逐轮增加,分别为11.02%、15.50%和16.05%。在各轮次筛查中,男性病变检出率均高于女性,且检出率均随着年龄增长而增加。
每年1次的重复FIT筛查在中国人群中具有较好的接受度以及较高的病变检出率。为了优化和提升人群结直肠癌筛查效果,应在保证人群筛查参与率的条件下推行多轮次重复FIT筛检。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
根据世界卫生组织估计,2020年全球恶性肿瘤新发病例约1 929.3万例,因恶性肿瘤导致死亡病例约995.8万例;结直肠癌的发病例数位列主要恶性肿瘤的第3位,死亡例数位列第2位,引发了严重的疾病负担[1]。随着人口老龄化和经济发展,近年来中国的结直肠癌发病率和死亡率呈上升趋势[2]。国内外人群研究表明,积极开展人群筛查和早期干预可有效降低结直肠癌的发病率和死亡率[3,4]。目前应用于结直肠癌的主要筛查技术包括愈创木粪便潜血试验、粪便免疫化学试验(fecal immunochemical testing, FIT)、多靶点粪便DNA检测、计算机断层结肠镜、结肠镜及软式乙状结肠镜,每种筛查技术都具有一定的优点和局限性,目前还没有直接的研究证据证明任何一种筛查手段在降低结直肠癌发病率或死亡率方面优于另一种[5,6]。FIT是结直肠癌筛查中使用最广泛的非侵入性测试方法,对结直肠癌和晚期肿瘤的患病风险具有较高的检测灵敏度[7,8]。FIT阳性者需进行金标准结肠镜检查以明确诊断。从理论上讲,持续监测可以发现大多数早期结直肠癌,有利于提升结直肠癌筛查效果[5]。为了优化基于FIT的结直肠癌筛查效果,目前国际权威指南均建议在多年内进行每年1次或每2年1次的重复筛查[3,9,10]。
参与率和检出率是评价人群筛查项目效果的重要指标。目前已发表的文献多汇报了单次FIT筛查在中国人群中应用的参与率和检出情况,对于多轮次重复FIT筛查策略在中国人群中应用的研究证据较少。因此,本研究旨在基于一项全国多中心结直肠癌筛查试验,评价连续3轮次年度FIT检测在中国人群结直肠癌筛查中的参与率和结直肠病变检出情况以及相关的影响因素,以期为进一步优化我国结直肠癌筛查策略提供研究证据。
本研究基于2018年5月至2021年5月在全国6个研究中心(浙江省温岭市、浙江省兰溪县、湖南省长沙市、安徽省合肥市、云南省昆明市、江苏省徐州市)开展的一项人群结直肠癌筛查随机对照研究。详细的研究方案见文献[11]。由经过培训的社区工作人员在社区招募50~74岁在本地居住3年以上的常住人口,排除有恶性肿瘤病史、结直肠手术史、近5年接受过结直肠检查、近1年内接受过便隐血试验、伴有不适接受结直肠筛查的其他严重疾病者。所有受试者按1∶2∶2的比例随机分配至结肠镜组、FIT组和风险评估组,本研究纳入FIT组的受试者。本研究在基线共纳入7 793例符合研究条件的受试者。本研究已经通过国家癌症中心中国医学科学院肿瘤医院伦理委员会的审查(审批号:18-013/1615)。所有纳入研究的受试者均签署了知情同意书。
受试者按照研究方案受邀接受FIT(噗噗管,杭州诺辉健康科技有限公司)。由社区工作人员统一向受试者发放试剂盒,并向其详细解释使用方法和注意事项,由受试者自行采样后完成检测,并将检测结果拍照生成图片上传至项目数据管理平台由专业人员完成结果判读。检测结果被判读为阴性、阳性或无效,其中无效结果需再次进行FIT检测直至有效。若FIT检测结果为阳性,则建议其接受项目组提供的免费结肠镜检查,完成结肠镜者下一年度不再受邀参与FIT筛查;若FIT检测结果为阴性者,本年度不再要求完成任何检查;所有FIT阳性未完成结肠镜者、FIT阴性者进入下一年度FIT筛查,直至项目结束。
所有FIT检测阳性者均推荐接受诊断性结肠镜检查。由医院或社区工作人员联系受试者完成结肠镜预约工作,受试者在家属陪同情况下携预约信息单在指定时间内赴项目点指定的医疗机构完成结肠镜检查前的肠道准备,签署知情同意书后完成结肠镜检查。结肠镜检查中发现有肠道病变者均需取组织活检进行病理诊断。结肠镜和病理诊断均按照规范化的操作流程进行开展。
所有受试者在入组后均由专业人员完成流行病学问卷调查,问卷内容包含个人基本信息、生活方式、肠道检查史、既往疾病史及恶性肿瘤家族史等信息。结肠镜检查记录和病理诊断记录均通过标准化问卷形式由专业医师填写,并由至少1名上级医师审核诊断结果,最终出具诊断报告,由专业的数据录入人员将详细结果录入至项目数据管理平台。所有研究数据均经过多轮次的数据核查以保证结果的真实、可靠。
结直肠癌筛查所关注的结直肠肿瘤包括结直肠癌、进展期腺瘤和非进展期腺瘤。结直肠癌的诊断遵循《中国结直肠癌诊疗规范(2020年版)》[12]。进展期腺瘤被定义为符合以下条件之一:(1)腺瘤长径≥1 cm;(2)绒毛状腺瘤或管状绒毛状腺瘤;(3)高级别上皮内瘤变;(4)锯齿状腺瘤长径≥1 cm或伴有异型增生。其余类型的腺瘤被定义为非进展期腺瘤。
采用R 4.2.2软件对数据进行整理和统计分析。计数资料采用频数、百分比描述。采用亚组分析法计算不同年龄、性别、地区人群FIT筛查的参与率、阳性率、肿瘤检出率和阳性预测值(positive predictive value, PPV)。采用多因素logistic回归模型分析与FIT阳性者结肠镜检查依从率相关的影响因素,并计算OR及其95% CI。本研究中的所有统计均为双侧检验,检验水准为α=0.05。
本研究中7 793例受试者,其中男3 310人(42.5%),女4 483人(57.5%);年龄为(60.50±6.49)岁,各年龄组的年龄分布较为均衡,其中50~54岁、55~59岁、60~64岁、65~69岁、70~74岁年龄组的受试者分别为1 825人(23.4%)、1 603人(20.6%)、1 924人(24.7%)、1 729人(22.2%)、712人(9.1%);71.9%的受试者受教育程度为初中及以下(5 605例);在生活方式上,吸烟者和戒烟者分别占15.6%(1 217例)和3.6%(282例),经常饮酒和偶尔饮酒者分别占12.8%(999例)和13.4%(1 047例)。3.2%(251例)的受试者做过结肠镜检查,1.2%(94例)的受试者有肠道息肉检出史,2.2%(172例)的受试者有慢性结肠炎史,4.3%(335例)的受试者有一级亲属患结直肠癌家族史。全组患者的基本特征见表1。

7 793例参与粪便免疫化学试验筛查人群的基本特征
7 793例参与粪便免疫化学试验筛查人群的基本特征
| 基本特征 | 例数(%) |
|---|---|
| 性别 | |
| 男 | 3 310(42.5) |
| 女 | 4 483(57.5) |
| 年龄(岁) | |
| 50~54 | 1 825(23.4) |
| 55~59 | 1 603(20.6) |
| 60~64 | 1 924(24.7) |
| 65~69 | 1 729(22.2) |
| 70~74 | 712(9.1) |
| 受教育程度a | |
| 初中及以下 | 5 605(71.9) |
| 高中 | 1 542(19.8) |
| 大专及以上 | 621(8.0) |
| 吸烟情况a | |
| 不吸烟 | 6 269(80.4) |
| 既往吸烟 | 282(3.6) |
| 吸烟 | 1 217(15.6) |
| 饮酒情况a | |
| 经常 | 999(12.8) |
| 偶尔 | 1 047(13.4) |
| 不饮酒 | 5 722(73.4) |
| 既往结肠镜检查a | |
| 无 | 7 517(96.5) |
| 有 | 251(3.2) |
| 息肉检出史a | |
| 无 | 7 543(96.8) |
| 有 | 94(1.2) |
| 慢性结肠炎史a | |
| 有 | 172(2.2) |
| 无 | 7 465(95.8) |
| 一级亲属结直肠癌家族史a | |
| 有 | 335(4.3) |
| 无 | 7 277(93.4) |
| 不清楚/未知 | 156(2.0) |
注:a有缺失数据
本研究共进行了3轮次FIT筛查,在基线筛查(第1轮)的7 793例受试者中,7 327例完成FIT检测,参与率为94.0%(95% CI:93.5%~94.5%);第2轮筛查共邀请6 968例符合条件的受试者,其中6 048例完成FIT检测,参与率为86.8%(95% CI:86.0%~87.6%);第3轮筛查共邀请6 693例受试者,其中6 113例完成FIT检测,参与率为91.3%(95% CI:90.6%~92.0%)。全组人群和各亚组参与筛查情况详见表2。经过3轮次筛查,99.3%(7 742/7 793)的受试者至少参加过1次筛查,14.7%(1 148/7 793)的受试者只参加过1次筛查,18.4%(1 431/7 793)的受试者只参加过2次筛查,66.3%(5 163/7 793)的受试者参加过3次筛查,详细情况见表3。其中第1轮未参与但参与第2轮或第3轮筛查的人数为989;前2轮未参与,但是第3轮参与的人数为127,详见图1。亚组分析提示,不同地区FIT检测参与率不同(均P<0.001,表2),不同性别、年龄FIT检测参与率差异无统计学意义(均P>0.05,表2)。各轮次FIT筛查参与率的相关影响因素分析显示,在纳入性别、年龄、教育程度、吸烟、饮酒、既往结肠镜检查、息肉检出史、慢性结肠炎史和一级亲属结直肠癌家族史等因素的多元logistic回归模型中,性别和吸烟状况是影响FIT筛查参与率的主要因素,具体表现为:在第2轮、第3轮中,男性和不吸烟为FIT参与率的独立影响因素,详见表4。
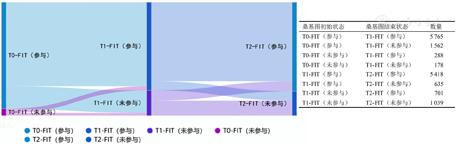

注:FIT:粪便免疫化学试验;T0:第1轮筛查;T1:第2轮筛查;T2:第3轮筛查
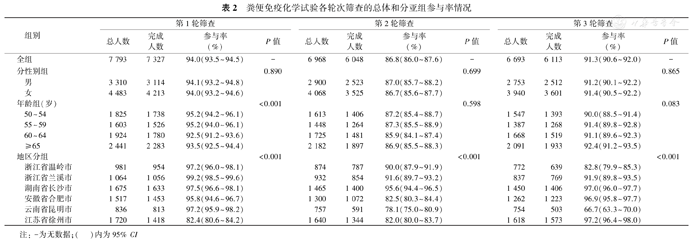
粪便免疫化学试验各轮次筛查的总体和分亚组参与率情况
粪便免疫化学试验各轮次筛查的总体和分亚组参与率情况
| 组别 | 第1轮筛查 | 第2轮筛查 | 第3轮筛查 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 总人数 | 完成人数 | 参与率(%) | P值 | 总人数 | 完成人数 | 参与率(%) | P值 | 总人数 | 完成人数 | 参与率(%) | P值 | |
| 全组 | 7 793 | 7 327 | 94.0(93.5~94.5) | - | 6 968 | 6 048 | 86.8(86.0~87.6) | - | 6 693 | 6 113 | 91.3(90.6~92.0) | - |
| 分性别组 | 0.890 | 0.699 | 0.865 | |||||||||
| 男 | 3 310 | 3 114 | 94.1(93.2~94.8) | 2 900 | 2 523 | 87.0(85.7~88.2) | 2 753 | 2 512 | 91.2(90.1~92.2) | |||
| 女 | 4 483 | 4 213 | 94.0(93.2~94.6) | 4 068 | 3 525 | 86.7(85.6~87.7) | 3 940 | 3 601 | 91.4(90.5~92.2) | |||
| 年龄组(岁) | <0.001 | 0.598 | 0.083 | |||||||||
| 50~54 | 1 825 | 1 738 | 95.2(94.2~96.1) | 1 613 | 1 406 | 87.2(85.4~88.7) | 1 547 | 1 393 | 90.0(88.5~91.4) | |||
| 55~59 | 1 603 | 1 526 | 95.2(94.0~96.1) | 1 448 | 1 264 | 87.3(85.5~88.9) | 1 387 | 1 268 | 91.4(89.8~92.8) | |||
| 60~64 | 1 924 | 1 780 | 92.5(91.2~93.6) | 1 725 | 1 481 | 85.9(84.1~87.4) | 1 668 | 1 519 | 91.1(89.6~92.3) | |||
| ≥65 | 2 441 | 2 283 | 93.5(92.5~94.4) | 2 182 | 1 897 | 86.9(85.5~88.3) | 2 091 | 1 933 | 92.4(91.2~93.5) | |||
| 地区分组 | <0.001 | <0.001 | <0.001 | |||||||||
| 浙江省温岭市 | 981 | 954 | 97.2(96.0~98.1) | 874 | 787 | 90.0(87.9~91.9) | 772 | 639 | 82.8(79.9~85.3) | |||
| 浙江省兰溪市 | 1 064 | 1 056 | 99.2(98.5~99.6) | 932 | 854 | 91.6(89.7~93.2) | 837 | 769 | 91.9(89.8~93.5) | |||
| 湖南省长沙市 | 1 675 | 1 633 | 97.5(96.6~98.1) | 1 465 | 1 400 | 95.6(94.4~96.5) | 1 450 | 1 406 | 97.0(96.0~97.7) | |||
| 安徽省合肥市 | 1 517 | 1 453 | 95.8(94.6~96.7) | 1 300 | 1 072 | 82.5(80.3~84.4) | 1 262 | 1 223 | 96.9(95.8~97.7) | |||
| 云南省昆明市 | 836 | 813 | 97.2(95.9~98.2) | 757 | 591 | 78.1(75.0~80.9) | 754 | 503 | 66.7(63.3~70.0) | |||
| 江苏省徐州市 | 1 720 | 1 418 | 82.4(80.6~84.2) | 1 640 | 1 344 | 82.0(80.0~83.7) | 1 618 | 1 573 | 97.2(96.4~98.0) | |||
注:-为无数据;( )内为95% CI
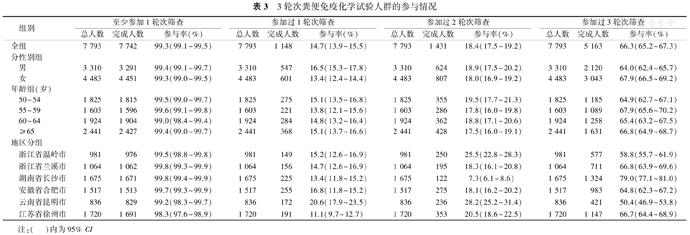
3轮次粪便免疫化学试验人群的参与情况
3轮次粪便免疫化学试验人群的参与情况
| 组别 | 至少参加1轮次筛查 | 参加过1轮次筛查 | 参加过2轮次筛查 | 参加过3轮次筛查 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 总人数 | 完成人数 | 参与率(%) | 总人数 | 完成人数 | 参与率(%) | 总人数 | 完成人数 | 参与率(%) | 总人数 | 完成人数 | 参与率(%) | |
| 全组 | 7 793 | 7 742 | 99.3(99.1~99.5) | 7 793 | 1 148 | 14.7(13.9~15.5) | 7 793 | 1 431 | 18.4(17.5~19.2) | 7 793 | 5 163 | 66.3(65.2~67.3) |
| 分性别组 | ||||||||||||
| 男 | 3 310 | 3 291 | 99.4(99.1~99.7) | 3 310 | 547 | 16.5(15.3~17.8) | 3 310 | 624 | 18.9(17.5~20.2) | 3 310 | 2 120 | 64.0(62.4~65.7) |
| 女 | 4 483 | 4 451 | 99.3(99.0~99.5) | 4 483 | 601 | 13.4(12.4~14.4) | 4 483 | 807 | 18.0(16.9~19.2) | 4 483 | 3 043 | 67.9(66.5~69.2) |
| 年龄组(岁) | ||||||||||||
| 50~54 | 1 825 | 1 815 | 99.5(99.0~99.7) | 1 825 | 275 | 15.1(13.5~16.8) | 1 825 | 355 | 19.5(17.7~21.3) | 1 825 | 1 185 | 64.9(62.7~67.1) |
| 55~59 | 1 603 | 1 596 | 99.6(99.1~99.8) | 1 603 | 221 | 13.8(12.1~15.6) | 1 603 | 286 | 17.8(16.0~19.8) | 1 603 | 1 089 | 67.9(65.6~70.2) |
| 60~64 | 1 924 | 1 904 | 99.0(98.4~99.4) | 1 924 | 284 | 14.8(13.2~16.4) | 1 924 | 362 | 18.8(17.1~20.6) | 1 924 | 1 258 | 65.4(63.2~67.5) |
| ≥65 | 2 441 | 2 427 | 99.4(99.0~99.7) | 2 441 | 368 | 15.1(13.7~16.6) | 2 441 | 428 | 17.5(16.0~19.1) | 2 441 | 1 631 | 66.8(64.9~68.7) |
| 地区分组 | ||||||||||||
| 浙江省温岭市 | 981 | 976 | 99.5(98.8~99.8) | 981 | 149 | 15.2(12.6~16.9) | 981 | 250 | 25.5(22.8~28.3) | 981 | 577 | 58.8(55.7~61.9) |
| 浙江省兰溪市 | 1 064 | 1 062 | 99.8(99.3~99.9) | 1 064 | 156 | 14.7(12.6~16.9) | 1 064 | 195 | 18.3(16.1~20.8) | 1 064 | 711 | 66.8(63.9~69.6) |
| 湖南省长沙市 | 1 675 | 1 671 | 99.8(99.4~99.9) | 1 675 | 225 | 13.4(11.8~15.2) | 1 675 | 122 | 7.3(6.1~8.6) | 1 675 | 1 324 | 79.0(77.1~81.0) |
| 安徽省合肥市 | 1 517 | 1 513 | 99.7(99.3~99.9) | 1 517 | 255 | 16.8(11.8~15.2) | 1 517 | 275 | 18.1(16.2~20.2) | 1 517 | 983 | 64.8(62.3~67.2) |
| 云南省昆明市 | 836 | 829 | 99.2(98.3~99.7) | 836 | 172 | 20.6(17.9~23.5) | 836 | 236 | 28.2(25.2~31.4) | 836 | 421 | 50.4(46.9~53.8) |
| 江苏省徐州市 | 1 720 | 1 691 | 98.3(97.6~98.9) | 1 720 | 191 | 11.1(9.7~12.7) | 1 720 | 353 | 20.5(18.6~22.5) | 1 720 | 1 147 | 66.7(64.4~68.9) |
注:( )内为95% CI
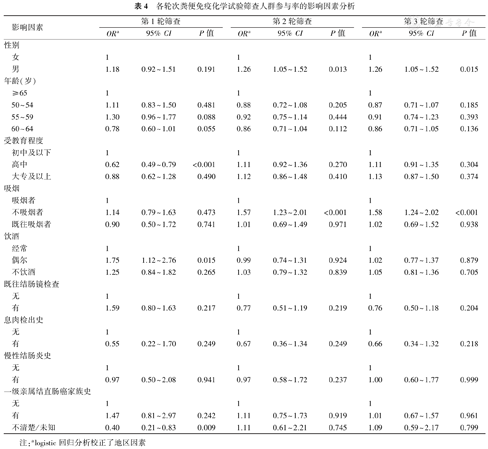
各轮次粪便免疫化学试验筛查人群参与率的影响因素分析
各轮次粪便免疫化学试验筛查人群参与率的影响因素分析
| 影响因素 | 第1轮筛查 | 第2轮筛查 | 第3轮筛查 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ORa | 95% CI | P值 | ORa | 95% CI | P值 | ORa | 95% CI | P值 | |
| 性别 | |||||||||
| 女 | 1 | 1 | 1 | ||||||
| 男 | 1.18 | 0.92~1.51 | 0.191 | 1.26 | 1.05~1.52 | 0.013 | 1.26 | 1.05~1.52 | 0.015 |
| 年龄(岁) | |||||||||
| ≥65 | 1 | 1 | 1 | ||||||
| 50~54 | 1.11 | 0.83~1.50 | 0.481 | 0.88 | 0.72~1.08 | 0.205 | 0.87 | 0.71~1.07 | 0.185 |
| 55~59 | 1.30 | 0.96~1.77 | 0.088 | 0.92 | 0.75~1.14 | 0.444 | 0.91 | 0.74~1.23 | 0.393 |
| 60~64 | 0.78 | 0.60~1.01 | 0.055 | 0.86 | 0.71~1.04 | 0.112 | 0.86 | 0.71~1.05 | 0.136 |
| 受教育程度 | |||||||||
| 初中及以下 | 1 | 1 | 1 | ||||||
| 高中 | 0.62 | 0.49~0.79 | <0.001 | 1.11 | 0.92~1.36 | 0.270 | 1.11 | 0.91~1.35 | 0.304 |
| 大专及以上 | 0.88 | 0.62~1.28 | 0.490 | 1.12 | 0.86~1.48 | 0.410 | 1.13 | 0.87~1.50 | 0.374 |
| 吸烟 | |||||||||
| 吸烟者 | 1 | 1 | 1 | ||||||
| 不吸烟者 | 1.14 | 0.79~1.63 | 0.473 | 1.57 | 1.23~2.01 | <0.001 | 1.58 | 1.24~2.02 | <0.001 |
| 既往吸烟者 | 0.90 | 0.50~1.72 | 0.741 | 1.01 | 0.69~1.49 | 0.971 | 1.02 | 0.69~1.52 | 0.938 |
| 饮酒 | |||||||||
| 经常 | 1 | 1 | 1 | ||||||
| 偶尔 | 1.75 | 1.12~2.76 | 0.015 | 0.99 | 0.74~1.31 | 0.924 | 1.02 | 0.77~1.37 | 0.879 |
| 不饮酒 | 1.25 | 0.84~1.82 | 0.265 | 1.03 | 0.79~1.32 | 0.839 | 1.05 | 0.81~1.36 | 0.705 |
| 既往结肠镜检查 | |||||||||
| 无 | 1 | 1 | 1 | ||||||
| 有 | 1.59 | 0.80~1.63 | 0.217 | 0.77 | 0.51~1.19 | 0.219 | 0.76 | 0.50~1.18 | 0.204 |
| 息肉检出史 | |||||||||
| 无 | 1 | 1 | 1 | ||||||
| 有 | 0.55 | 0.22~1.70 | 0.249 | 0.67 | 0.36~1.34 | 0.249 | 0.66 | 0.34~1.32 | 0.218 |
| 慢性结肠炎史 | |||||||||
| 无 | 1 | 1 | 1 | ||||||
| 有 | 0.97 | 0.50~2.08 | 0.941 | 0.97 | 0.58~1.72 | 0.237 | 1.00 | 0.60~1.77 | 0.999 |
| 一级亲属结直肠癌家族史 | |||||||||
| 无 | 1 | 1 | 1 | ||||||
| 有 | 1.47 | 0.81~2.97 | 0.242 | 1.11 | 0.75~1.73 | 0.919 | 1.01 | 0.67~1.57 | 0.961 |
| 不清楚/未知 | 0.40 | 0.21~0.83 | 0.009 | 1.11 | 0.61~2.21 | 0.745 | 1.09 | 0.59~2.17 | 0.799 |
注:alogistic回归分析校正了地区因素
本研究基线筛查FIT的阳性率为14.6%,但第2轮和第3轮筛查中的阳性率显著降低,分别为5.6%和5.5%,3轮次FIT阳性率差异有统计学意义(P<0.001,表5)。在3轮次筛查中,男性FIT阳性率均高于女性(基线:16.6%和13.1%;第2轮筛查:7.1%和4.6%;第3轮筛查:6.0%和5.2%);但不同年龄组的FIT阳性率差异无统计学意义(P>0.05,图2)。根据研究方案,FIT阳性者需完成诊断性结肠镜检查以明确疾病诊断。在3轮次FIT筛查中,FIT阳性者的结肠镜检查依从率均在70%以上,其中基线、第2轮和第3轮筛查的依从率分别为76.3%、75.7%和71.7%(表5)。此外,logistic多因素回归分析显示,仅年龄与FIT阳性者结肠镜检查的依从率有关,与≥65岁人群比较,65岁以下年龄人群的结肠镜检查依从率更高,其中60~64岁、55~59岁、50~54岁的人群结肠镜检查依从率OR值分别为1.39(95% CI:1.03~1.89)、1.45(95% CI:1.03~2.06)和1.45(95% CI:1.05~2.01)。
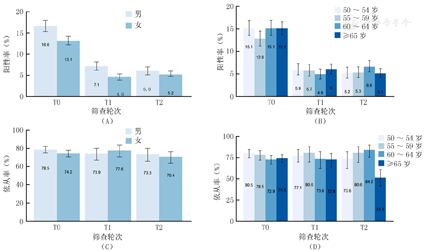

注:FIT:粪便免疫化学试验;T0:第1轮筛查;T1:第2轮筛查;T2:第3轮筛查

各轮次粪便免疫化学试验检测阳性率和结肠镜依从率情况
各轮次粪便免疫化学试验检测阳性率和结肠镜依从率情况
| 筛查轮次 | 参检人数 | 阳性人数 | 完成结肠镜人数 | 阳性率(%) | 结肠镜依从率(%) |
|---|---|---|---|---|---|
| 第1轮 | 7 327 | 1 071 | 817 | 14.6(13.8~15.4) | 76.3(73.6~78.7) |
| 第2轮 | 6 048 | 341 | 258 | 5.6(5.1~6.2) | 75.7(70.9~79.9) |
| 第3轮 | 6 113 | 339 | 243 | 5.5(5.0~6.1) | 71.7(66.7~76.2) |
注:( )内为95% CI
在基线、第2轮和第3轮FIT筛查中,进展期肿瘤(结直肠癌+进展期腺瘤)检出率分别为1.15%(90/7 793)、0.57%(40/6 968)和0.58%(39/6 693),其阳性预测值为11.02%、15.50%和16.05%。总体结直肠肿瘤(结直肠癌+进展期腺瘤+非进展期腺瘤)的检出率分别为3.28%(256/7 793)、1.25%(87/6 968)和1.36%(91/6 693),其阳性预测值分别31.33%、33.72%和37.45%。总体来看,前2轮结直肠肿瘤的检出率呈现下降趋势,第3轮与第2轮检出率相当,但3轮次整体结直肠肿瘤阳性预测值呈现上升趋势。男性结直肠肿瘤检出率高于女性(P<0.05),不同年龄结直肠肿瘤的病变检出率差异无统计学意义(均P>0.05,表6)。
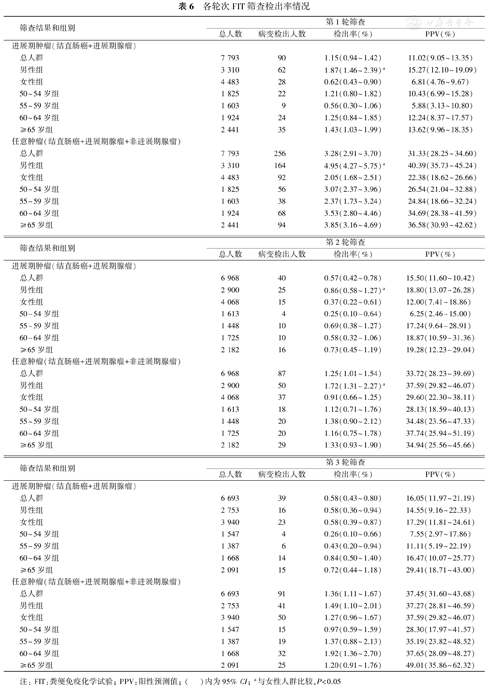
各轮次FIT筛查检出率情况
各轮次FIT筛查检出率情况
| 筛查结果和组别 | 第1轮筛查 | |||
|---|---|---|---|---|
| 总人数 | 病变检出人数 | 检出率(%) | PPV(%) | |
| 进展期肿瘤(结直肠癌+进展期腺瘤) | ||||
| 总人群 | 7 793 | 90 | 1.15(0.94~1.42) | 11.02(9.05~13.35) |
| 男性组 | 3 310 | 62 | 1.87(1.46~2.39)a | 15.27(12.10~19.09) |
| 女性组 | 4 483 | 28 | 0.62(0.43~0.90) | 6.81(4.76~9.67) |
| 50~54岁组 | 1 825 | 22 | 1.21(0.80~1.82) | 10.43(6.99~15.28) |
| 55~59岁组 | 1 603 | 9 | 0.56(0.30~1.06) | 5.88(3.13~10.80) |
| 60~64岁组 | 1 924 | 24 | 1.25(0.84~1.85) | 12.24(8.37~17.57) |
| ≥65岁组 | 2 441 | 35 | 1.43(1.03~1.99) | 13.62(9.96~18.35) |
| 任意肿瘤(结直肠癌+进展期腺瘤+非进展期腺瘤) | ||||
| 总人群 | 7 793 | 256 | 3.28(2.91~3.70) | 31.33(28.25~34.60) |
| 男性组 | 3 310 | 164 | 4.95(4.27~5.75)a | 40.39(35.73~45.24) |
| 女性组 | 4 483 | 92 | 2.05(1.68~2.51) | 22.38(18.62~26.66) |
| 50~54岁组 | 1 825 | 56 | 3.07(2.37~3.96) | 26.54(21.04~32.88) |
| 55~59岁组 | 1 603 | 38 | 2.37(1.73~3.24) | 24.84(18.66~32.24) |
| 60~64岁组 | 1 924 | 68 | 3.53(2.80~4.46) | 34.69(28.38~41.59) |
| ≥65岁组 | 2 441 | 94 | 3.85(3.16~4.69) | 36.58(30.93~42.62) |
| 筛查结果和组别 | 第2轮筛查 | |||
|---|---|---|---|---|
| 总人数 | 病变检出人数 | 检出率(%) | PPV(%) | |
| 进展期肿瘤(结直肠癌+进展期腺瘤) | ||||
| 总人群 | 6 968 | 40 | 0.57(0.42~0.78) | 15.50(11.60~10.42) |
| 男性组 | 2 900 | 25 | 0.86(0.58~1.27)a | 18.80(13.07~26.28) |
| 女性组 | 4 068 | 15 | 0.37(0.22~0.61) | 12.00(7.41~18.86) |
| 50~54岁组 | 1 613 | 4 | 0.25(0.10~0.64) | 6.25(2.46~15.00) |
| 55~59岁组 | 1 448 | 10 | 0.69(0.38~1.27) | 17.24(9.64~28.91) |
| 60~64岁组 | 1 725 | 10 | 0.58(0.32~1.06) | 18.87(10.59~31.36) |
| ≥65岁组 | 2 182 | 16 | 0.73(0.45~1.19) | 19.28(12.23~29.04) |
| 任意肿瘤(结直肠癌+进展期腺瘤+非进展期腺瘤) | ||||
| 总人群 | 6 968 | 87 | 1.25(1.01~1.54) | 33.72(28.23~39.69) |
| 男性组 | 2 900 | 50 | 1.72(1.31~2.27)a | 37.59(29.82~46.07) |
| 女性组 | 4 068 | 37 | 0.91(0.66~1.25) | 29.60(22.30~38.11) |
| 50~54岁组 | 1 613 | 18 | 1.12(0.71~1.76) | 28.13(18.59~40.13) |
| 55~59岁组 | 1 448 | 20 | 1.38(0.90~2.12) | 34.48(23.56~47.33) |
| 60~64岁组 | 1 725 | 20 | 1.16(0.75~1.78) | 37.74(25.94~51.19) |
| ≥65岁组 | 2 182 | 29 | 1.33(0.93~1.90) | 34.94(25.56~45.66) |
| 筛查结果和组别 | 第3轮筛查 | |||
|---|---|---|---|---|
| 总人数 | 病变检出人数 | 检出率(%) | PPV(%) | |
| 进展期肿瘤(结直肠癌+进展期腺瘤) | ||||
| 总人群 | 6 693 | 39 | 0.58(0.43~0.80) | 16.05(11.97~21.19) |
| 男性组 | 2 753 | 16 | 0.58(0.36~0.94) | 14.55(9.16~22.33) |
| 女性组 | 3 940 | 23 | 0.58(0.39~0.87) | 17.29(11.81~24.61) |
| 50~54岁组 | 1 547 | 4 | 0.26(0.10~0.66) | 7.55(2.97~17.86) |
| 55~59岁组 | 1 387 | 6 | 0.43(0.20~0.94) | 11.11(5.19~22.19) |
| 60~64岁组 | 1 668 | 14 | 0.84(0.50~1.40) | 16.47(10.07~25.77) |
| ≥65岁组 | 2 091 | 15 | 0.72(0.44~1.18) | 29.41(18.71~43.00) |
| 任意肿瘤(结直肠癌+进展期腺瘤+非进展期腺瘤) | ||||
| 总人群 | 6 693 | 91 | 1.36(1.11~1.67) | 37.45(31.60~43.68) |
| 男性组 | 2 753 | 41 | 1.49(1.10~2.01) | 37.27(28.81~46.59) |
| 女性组 | 3 940 | 50 | 1.27(0.96~1.67) | 37.59(29.82~46.07) |
| 50~54岁组 | 1 547 | 15 | 0.97(0.59~1.59) | 28.30(17.97~41.57) |
| 55~59岁组 | 1 387 | 19 | 1.37(0.88~2.13) | 35.19(23.82~48.52) |
| 60~64岁组 | 1 668 | 32 | 1.92(1.36~2.70) | 37.65(28.09~48.27) |
| ≥65岁组 | 2 091 | 25 | 1.20(0.91~1.76) | 49.01(35.86~62.32) |
注:FIT:粪便免疫化学试验;PPV:阳性预测值;( )内为95% CI;a与女性人群比较,P<0.05
实施结直肠癌筛查是降低结直肠癌负担的有效手段。目前,有关中国人群中重复FIT筛查的研究证据较少,本研究基于中国首个多中心的人群新型结直肠癌筛查随机对照队列,对其中FIT组的多轮次重复年度筛检的参与率、结直肠肿瘤检出率及其相关影响因素进行了评价。本研究结果显示,FIT应用于结直肠癌筛查人群参与率较高,这表明FIT检测作为无创型结直肠癌筛查新技术较易被人群所接受,为未来FIT作为开展大规模人群结直肠癌筛检方式奠定了良好的基础。此外多轮次重复邀请可进一步提高FIT检测参与率,且重复筛查可降低结直肠肿瘤的检出率,这提示开展人群多轮次FIT重复筛查的必要性。
根据既往研究,我国结直肠癌筛查中的结肠镜检查参与率大多在14%~33%之间[6,9,13]。本研究每一轮单次的FIT检测参与率在86.0%~94.0%之间,不同地区参与率存在一定差异,这一水平明显高于我国结肠镜检查参与率水平和国内其他结直肠癌筛查项目的FIT参与率水平,也高于其他国家的研究水平。如王书彩等[14]在河北某医院健康管理中心的体检人群中开展的FIT检测参与率在54%左右。苏州某医院在健康体检人群中开展的结直肠癌筛查中FIT参与率约为74%[15]。Forsberg等[16]在瑞典开展的60岁以上居民间隔2年的3轮次FIT筛查,得到3轮次FIT参与率在58%~68%之间。不同筛查项目中的FIT参与率差异可能与所用的FIT产品类型、组织动员方式、受检者的文化程度、筛查激励措施等有关[17,18]。
此外,由于晚期结直肠肿瘤可能会间歇性出血,因此单次FIT检测可能会导致漏筛,需要连续多轮次检测才能获得最大的预防效果。然而,不同国家多轮次FIT检测的结直肠癌筛查参与率也存在一定差异。例如意大利Sali等[19]对9 288名年龄在54~65岁的受试者开展3轮次FIT检测,结果显示,64.9%参加了至少1轮筛查,49.2%参加了至少2轮筛查,33.4%参加了至少3轮筛查。Schreuders等[20]开展的50~74岁人群每2年1次连续4轮的FIT检测,74.7%受试者至少参加了1次。本研究连续3年每年1次的FIT检测,99.3%受试者至少参加了1次,84.7%(18.4%+66.3%)参加了至少2次,66.3%参加了3次,高于其他各国研究水平。一方面可能是由于本研究现场工作人员的积极动员,以及随着全民健康行动的倡导和落实,居民健康素养水平逐渐提高的综合结果;另一方面可能由于本研究主要采用了自测型FIT,提高了筛查的便捷性,并且利用信息平台收集和反馈结果,提升了受试者参与筛查的体验感和满意度。此外,经过重复邀请,本项目有效增加了1 116位受试者参与FIT检测。这表明重复筛查可以提高筛查依从性差的人群的参与率,在后续的人群筛查项目中应该着重关注人群动员和重复筛查。总体而言,本研究结果提示在良好的组织动员模式下,我国结直肠癌筛查可以达到较高水平的人群参与率,值得未来其他项目参考。
早期检出结直肠癌和癌前病变可提高患者的生存率,降低死亡率。一项基于FIT检测阳性率和肠镜检出率的结直肠癌筛查对比研究显示,同时接受FIT检测和乙状结肠镜检查者比仅接受乙状结肠镜检查者的结直肠癌死亡率更低,但目前可直接评估可视化与基于粪便的结直肠癌筛查的有效性比较研究仍待补充[21]。Mohan等[22]开展的一项系统综述显示,在纳入34项研究共计约600万无症状风险人群的结直肠癌筛查中,汇总的FIT阳性率为5.4%(95% CI:4.3%~6.9%),与本研究第2轮、第3轮的FIT阳性率水平相接近。而本研究第1轮的FIT阳性率可达到14.6%,这说明重复FIT筛查可降低人群FIT阳性检出率,较单次FIT筛查取得了更好的筛查效果。这与Kapidzic等[23]开展的间隔2年的2轮单样本和双样本FIT筛查研究结果相似,该研究中单样本FIT阳性率由第1轮的8.1%下降到第2轮的6.2%,双样本FIT阳性率则由12.8%下降到8.3%。此外,本研究还显示重复FIT较单次FIT的结直肠肿瘤检出率更高,这一结论与Randel等[24]的研究一致,该研究显示经过3轮次的FIT筛查后累计结直肠癌检出率可达到0.49%,高于单次FIT筛查结直肠癌检出率(0.25%)和2轮次FIT筛查累计结直肠癌检出率(0.37%)。且随着重复检测的次数增加,阳性预测值则更高,这表明重复FIT检测能有效提高结直肠肿瘤的累计检出率,进一步提升筛查准确度,减少漏诊误诊的发生。
指南推荐FIT检测阳性者需行结肠镜检查以进一步明确诊断。不同国家开展的基于FIT的结直肠癌筛查结肠镜依从率存在一定差异。本研究3轮次FIT阳性者的平均结肠镜依从率为74.6%,略低于全球平均水平85%(95% CI:82.8%~86.9%)[22],高于美国结直肠癌筛查计划中的人群结肠镜依从率(50%)[25]。这提示在今后的研究当中,需加强对FIT阳性者的密切监测以降低结肠镜检查失访率。本研究还对FIT检测阳性者接受结肠镜检查的依从率进行分析,结果显示,高龄者较低年龄者的结肠镜依从性更差,这可能与高龄人的恶性肿瘤防治认知不足有关,也可能因结肠镜作为侵入性检查,对于高龄人而言,难以承受其相关的检查风险有关。这进一步体现了采用FIT等无创技术早期发现结直肠癌前病变在我国全人群尤其是高龄人群中的应用价值。
本研究具有一定的局限性。一是纳入本研究的受试者主要来源于一项结直肠癌筛查试验,因此受试者的恶性肿瘤筛查意愿较高,与真实世界居民相比,FIT参与率可能存在一定程度的高估。二是本研究仅开展了3轮次筛查,更多轮次的FIT筛检参与率和检出情况有待未来进行进一步评估。三是由于随访时间尚短,尚不能评估FIT筛查对于结直肠癌死亡率的影响,但本研究人群的长期随访仍在开展,未来将对这部分内容进行详细评估。
综上所述,每年1次的重复FIT筛查在中国人群中具有较好的接受度以及较高的病变检出率。为了优化和提升人群结直肠癌筛查效果,应在保证人群筛查参与率的条件下推行多轮次重复FIT筛检。本研究结果将为进一步优化中国结直肠癌人群筛查方案提供重要理论依据。
所有作者声明无利益冲突
研究团队衷心感谢浙江省肿瘤医院杜灵彬主任团队、安徽省肿瘤医院魏东华主任团队、湖南省肿瘤医院廖先珍教授团队、云南省肿瘤医院高屹主任团队、徐州市肿瘤医院董栋主任团队、兰溪市中医院郑卫方院长团队、台州市肿瘤医院陈静君主任团队在本研究实施过程中给与的支持。研究团队感谢各个研究中心参与到现场工作的所有工作人员。研究团队也感谢所有参与到本项目的研究者。



























