
探讨永存第五主动脉弓(persistent fifth aortic arch,PFAA)的解剖特征及手术方式,以期改善患儿的预后和更好的指导临床工作。
收集2018年1月至2022年12月浙江大学医学院附属儿童医院诊断和治疗的5例体-体型PFAA患儿的临床资料,其中男2例,女3例;均在新生儿期经计算机断层血管造影明确诊断,其中4例是第五主动脉弓缩窄合并第四主动脉弓中断,另1例是主动脉双腔无狭窄,均无严重的心内畸形。根据患儿的临床特征、影像数据和手术资料,总结分析其解剖特征及诊断鉴别点,讨论手术矫治方法及术后随访结果。
2例患儿采用了两种不同的手术方法矫治,其中1例术后随访至今4年余无狭窄,而另1例术后6个月出现再狭窄给予经皮球囊扩张治疗。1例进行染色体检查后发现异常,家属放弃治疗死亡。1例合并复杂的主动脉及其分支变异:右侧PFAA合并右侧第四主动脉弓中断,伴迷走左锁骨下动脉及左弓残端Kommerell憩室。
计算机断层血管造影是明确诊断PFAA最有效的无创检查方法。手术矫治应尽可能完整地切除第五主动脉弓的组织来防止术后再狭窄。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
永存第五主动脉弓(persistent fifth aortic arch,PFAA)是一种非常罕见的主动脉弓部畸形,具有多种解剖和生理形式,多数合并有主动脉缩窄或中断。自1969年首次报道[1],PFAA在全球累计文献报道仅100余例,且多为个案报道,其胚胎学的起源问题一直存有争议。Gerlis等[2]支持PFAA在人类胚胎中存在,其在死后标本检查中发现PFAA的患病率为0.3%。我国学者根据影像诊断统计出PFAA占主动脉弓部畸形的0.4%,在先天性心脏病中发生率为0.5‰[3]。早期对该病认识不足,且部分解剖类型不引起血流动力学异常,故其实际发生率应高于此数据。本文旨在总结PFAA病例的诊疗经验和随访结果,探讨其解剖特征及手术方式,以期改善患儿的预后和更好的指导临床工作。
收集2018年1月至2022年12月期间浙江大学医学院附属儿童医院诊治的5例PFAA患儿。
根据解剖和生理特征,Peirone等[4]将PFAA分作4型并由Lloyd等[5]改良如下:1型为体-体动脉连接型,多合并主动脉缩窄或中断;2型为体-肺动脉连接型,多合并右心系统梗阻性病变,如肺动脉闭锁等;3型为肺-体动脉连接型(罕见),多合并主动脉闭锁;4型为双侧或混合型(罕见)。详见图1。


注:1型,体-体型;2型,体-肺型;3型,肺-体型;4型,双侧或混合型
5例PFAA中,男2例,女3例,均在新生儿期经计算机断层血管造影(computerized tomographic angiography,CTA)明确诊断。根据Freedom分型,5例患儿均为1型PFAA,即体-体动脉连接型,其中4例是第五主动脉弓缩窄合并第四主动脉弓中断,1例是主动脉双腔无狭窄;均无严重的心内畸形。
本研究经浙江大学附属儿童医院伦理委员会批准(2023-IRB-0089-P-01),所有程序均符合机构和(或)国家研究委员会的伦理标准以及《赫尔辛基宣言》。
回顾性分析5例PFAA患儿的临床资料,包括性别、年龄、体重、临床特征、超声心动图检查、CTA检查、手术记录以及门诊或电话随访资料。总结分析PFAA解剖特征、鉴别诊断、手术方法及随访情况。
所有病例的临床资料详见表1。
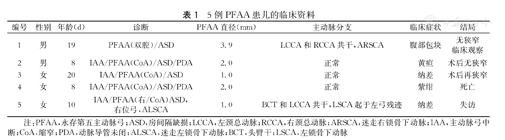
5例PFAA患儿的临床资料
5例PFAA患儿的临床资料
| 编号 | 性别 | 年龄(d) | 诊断 | PFAA直径(mm) | 主动脉分支 | 临床症状 | 结局 |
|---|---|---|---|---|---|---|---|
| 1 | 男 | 19 | PFAA(双腔)/ASD | 3.9 | LCCA和RCCA共干,ARSCA | 腹部包块 | 无狭窄临床观察 |
| 2 | 男 | 8 | IAA/PFAA(CoA)/ASD/PDA | 2.0 | 正常 | 黄疸 | 术后无狭窄 |
| 3 | 女 | 20 | IAA/PFAA(CoA)/ASD | 1.0 | 正常 | 纳差 | 术后再狭窄 |
| 4 | 女 | 8 | IAA/PFAA(CoA)/ASD/PDA | 2.0 | 正常 | 紫绀 | 死亡 |
| 5 | 女 | 10 | IAA/PFAA(右/CoA)ASD,右位弓,ALSCA | 1.0 | BCT和LCCA共干,LSCA起于左弓残迹 | 纳差 | 失访 |
注:PFAA,永存第五主动脉弓;ASD,房间隔缺损;LCCA,左颈总动脉;RCCA,右颈总动脉;ARSCA,迷走右锁骨下动脉;IAA,主动脉弓中断;CoA,缩窄;PDA,动脉导管未闭;ALSCA,迷走左锁骨下动脉;BCT,头臂干;LSCA,左锁骨下动脉
病例1为36周早产儿,合并有先天性肛门闭锁、膀胱外翻、尿道上裂、十二指肠隔膜,行腹部手术前的常规心脏超声检查发现有主动脉双腔,经CTA验证(图2A)。截至随访5个月,无血管狭窄的临床表现。


病例2~4均诊断为第五主动脉弓缩窄合并第四主动脉弓中断(图2B~2D)。其中病例4曾在当地医院被误诊为"动脉导管未闭",给予布洛芬治疗后出现严重紫绀转诊至本院。因其合并有低出生体重(1.85 kg)、小下颌、肾积水和会阴部畸形,且染色体检查提示45,X,psu dic(X;22)(q22.1;13.3),最终家属放弃治疗患儿死亡。
病例5合并复杂的主动脉及其分支变异(图3)。降主动脉位于右侧,右侧第四主动脉弓发出左颈总动脉(left common carotid artery,LCCA)、右颈总动脉(right common carotid artery,RCCA)、右锁骨下动脉(right subclavian artery,RSCA)后中断,在右侧第四主动脉弓的下方有一条血管从升主动脉近端发出连接于右侧降主动脉,连接处管腔狭窄。左侧第四主动脉弓闭锁,但近降主动脉连接处残留一段憩室样管腔,左锁骨下动脉(left subclavian artery,LSCA)从此处发出。此为本中心发现的唯一的右侧PFAA。患儿早期临床症状不典型,无下肢缺血缺氧表现,在门诊随访过程中失访。


注:RSCA,右锁骨下动脉;RCCA,右颈总动脉;LCCA,左颈总动脉;LSCA,左锁骨下动脉;R4/R5,右侧第4/5咽弓动脉;L4/L5,左侧第4/5咽弓动脉;AA,主动脉囊;DA,降主动脉
采用两种不同的手术方法治疗第五主动脉弓缩窄合并第四主动脉弓中断(图4)。手术基本要点是切除狭窄段,重建主动脉弓与降主动脉的连接。
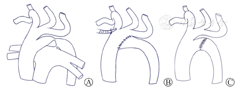

病例2手术时体重3.3 kg,术前上下肢有创平均压差30 mmHg(1 mmHg=0.133 kPa),采用胸骨正中切开和体外循环辅助标准弓前移的手术方法(图4B)。分离主动脉、头臂干、肺动脉干及其分支和动脉导管,常规体外循环插管,同时开始降温,切断缝合动脉导管。降温期间进一步游离升主动脉及其分支和降主动脉,以减少主动脉弓吻合口处的张力。当肛温降至20℃时,阻断升主动脉根部注入心脏停搏液,心脏停跳,行选择性脑灌。切除第五主动脉弓的狭窄段及所有第五弓的组织,并在3个分支汇合处的下方适当扩大吻合口。C形钳钳夹上提远端降主动脉,在主动脉弓下缘做端侧吻合,采用6-0缝线连续缝合,复温、恢复体循环行相关心内畸形纠治,开放后顺利复跳,停机关胸,术后恢复顺利。患儿随访至今已4年余未见再狭窄,生长发育情况良好。
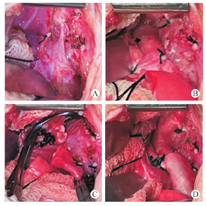
病例3手术时体重2.9 kg,术前上下肢有创平均压差29 mmHg,采用左后外侧开胸和端端吻合的手术方法(图4C)。通过标准的左后外侧切口,打开第三肋间隙,左锁骨下动脉和降主动脉之间存在闭锁连接残迹,位于动脉导管插入处的远端。将动脉导管韧带切断缝合,C型钳夹住近端主动脉弓,降主动脉阻断钳夹闭后,仅切除PFAA的狭窄段,然后行降主动脉-第五主动脉近端的端端吻合术(图5),术后上下肢有创血压无差别,恢复顺利。患儿术后6个月时发现吻合口再狭窄,降主动脉流速3.8 m/s,压差57 mmHg,1周岁时给予经皮球囊扩张治疗,狭窄处压差减小,目前仍密切随访中。

PFAA是一种非常罕见的、多种解剖形式的心血管畸形,其真正的胚胎学起源目前仍有争议。1969年Van Praagh等[1]首次在1例尸检标本中发现双腔主动脉弓并命名为PFAA。2016年Gupta等[6]基于鼠模型提出PFAA的解剖定义:一条心包外血管,起源于头臂动脉起点附近的升主动脉,走行蜿蜒,终止于背主动脉或通过动脉导管进入肺动脉汇合处。近年Anderson等[7]提出用连接第四和第六咽弓的背侧支通道来解释1型PFAA可能更合理。
随着医学影像技术的发展,CTA是目前诊断PFAA最有效的无创检查方法,能够清晰、直观、多角度立体展示血管的解剖形态、走行特征、毗邻关系及连接情况,对各型PFAA均可作出正确诊断,明显优于超声心动图,一定程度上可替代血管造影[3]。早期对该病认识不足,本中心有2例(病例2和病例4)被误诊为"真性牛主动脉弓",升主动脉直接发出三个分支,类似于头臂干(brachiocephalic trunk,BCT)、LCCA和LSCA共干,同时升主动脉发出另一个血管与降主动脉相连。2022年Murray和Meguid[8]对人类主动脉分支变异的文献进行统计分析,共找到28种变异,其中最常见的变异称作牛主动脉弓,指的是BCT和LCCA共开口或LCCA作为BCT的分支,这在人群中的发生率为10%~25%,占主动脉弓分支变异的三分之二。而BCT、LCCA和LSCA共干的这种主动脉弓分支变异模式未报道过,与文献中命名的"牛主动脉弓"明显不同,故该类型的解剖特征应考虑为PFAA合并第四主动脉弓中断,而主动脉分支是正常的。
本研究病例5是非常罕见的右侧PFAA并伴有复杂的主动脉弓及其分支变异。根据Edward的双弓胚胎学模型[9],本团队制作了该患儿的右侧第五弓畸形的推导示意图(图3C)。右位主动脉弓最常见的变异是与迷走左锁骨下动脉(aberrant left subclavian artery,ALSCA)有关,是胚胎发育期间LCCA与LSCA之间的左侧第四咽弓异常退化导致的[10,11]。这使得LCCA看上去像升主动脉的第一个分支,但结合该病例的超声和CTA图像可以发现PFAA是在比LCCA更低的位置上从升主动脉发出,符合第五弓的胚胎学位置。有趣的是,该患儿同时合并了右位第四主动脉弓中断,右侧PFAA与降主动脉相连处狭窄,这也是左侧PFAA最常见的类型。文献指出ALSCA的起点有时有一个球状扩张,称为Kommerell憩室,它是从胚胎左第四主动脉弓的残余发展而来[10]。因此病例5的ALSCA的起始处血管盲端应考虑Kommerell憩室,并提示左侧动脉韧带存在,形成血管环,需要手术治疗。探讨主动脉弓发育的胚胎起源、诊断和描述异常血管以及任何其他或非典型特征,对制定患儿的手术方案和治疗策略是非常重要的。
第五主动脉缩窄合并第四主动脉弓中断,一经诊断均需手术治疗。多种手术方式已有文献报道:Gore-Tex管道的植入,狭窄段切除主动脉弓部重建,左颈总动脉与左锁骨下动脉处弓部行侧-侧吻合再补片扩大狭窄处,球囊扩张成形术或支架置入术的介入治疗等[12,13,14]。本中心2例患儿均在新生儿期进行手术矫治,均顺利出院门诊随访。其中病例2采用的是胸骨正中切开和体外循环辅助标准弓前移的手术方法,病例3是左后外侧开胸和端端吻合进行的修复手术,均未使用补片。两者ICU住院时间均为5 d,而后者呼吸机撤离时间较前者缩短了2 d,主要考虑是体外循环因素的影响。随访数据显示,后者在术后6月龄时出现了吻合口再狭窄。2例手术的主要区别点在于保留或不保留第五主动脉弓组织。部分学者也报道了切除狭窄段后采用保留的第五主动脉弓组织与降主动脉行端-端吻合或侧-端吻合的手术案例[15]。Carroll等[16]提出第五弓与第六弓组织均具有前列腺素E1依赖性,远期再缩窄发生率高。Kusano等[17]发现PFAA的组织学特征与动脉导管相似,没有内部弹力膜,少且紊乱的平滑肌细胞,大量断裂的弹性纤维。结合病例随访结果,本团队认为完整切除第五弓组织可能是防止再狭窄的重要因素。
综上所述,CTA是目前诊断PFAA最有效的无创检查方法,当出现BCT、LCCA和LSCA共干的主动脉分支变异时,需考虑第四主动脉弓中断合并第五主动脉弓缩窄。准确诊断主动脉弓的解剖变异或非典型特征,对于临床制定合适的治疗方法和管理策略是非常重要的。本研究有1例极其罕见的右侧PFAA合并右侧第四主动脉弓中断、ALSCA及左弓残端的Kommerell憩室,文献中未发现有相同的病例报告。建议手术应尽量完整切除第五弓组织防止再狭窄。本研究需要更多的病例报告和长期随访数据来加强证据,以期改善PFAA患儿的预后。
所有作者均声明不存在利益冲突



























