
肝静脉压力梯度(HVPG)是诊断临床显著性门静脉高压的金标准。为了进一步规范我国HVPG技术应用开展,中国门静脉高压联盟(CHESS)、中华医学会消化病学分会微创介入协作组更新《中国肝静脉压力梯度临床应用专家共识(2023版)》。本共识形成十条推荐意见,旨在推动我国肝硬化门静脉高压领域的HVPG标准化检测和规范化应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
门静脉高压是肝硬化的主要并发症之一,其严重程度决定了肝硬化失代偿事件(如食管胃静脉曲张出血、腹腔积液、肝性脑病)的发生和发展[1, 2]。临床上门静脉压力的直接测量创伤大、风险高,且腹内压力改变等因素会对测量结果造成干扰,从而导致技术推广困难。肝静脉压力梯度(hepatic venous pressure gradient,HVPG)是肝静脉楔压(wedged hepatic venous pressure,WHVP)和肝静脉自由压(free hepatic venous pressure,FHVP)之间的差值,间接反映了门静脉和腔静脉之间的压力差。与单独测量WHVP相比,HVPG的测量消除了腹腔内压力的影响,更准确地反映门静脉压力的变化[3]。最新发布的《Baveno Ⅶ门静脉高压共识更新版——门静脉高压的个体化治疗》再次强调了HVPG≥10 mmHg(1 mmHg=0.133 kPa)是诊断临床显著性门静脉高压(clinically significant portal hypertension,CSPH)的金标准[1]。
为了标准化HVPG检测流程、规范化HVPG在肝硬化门静脉高压的临床应用,我国专家在2018年牵头制订了第一部《中国肝静脉压力梯度临床应用专家共识(2018版)》[4]。自2018版共识发表后,我国HVPG检测例数逐年升高。据已开展HVPG检测的70家医疗机构调研结果显示,2021年全国共计开展 HVPG检测4 398例,开展医院分布于28个省(自治区、直辖市),所有调研机构均认为未来需要推广以及规范化HVPG检测[5]。自2018版共识发布后,HVPG检测例数及临床应用范围在近5年来得到快速发展,与此同时,在国内外发表的许多HVPG临床应用的高级别证据中不乏基于我国肝硬化人群的高质量数据。然而,我国HVPG检测仍然存在覆盖医院范围相对不足、检测水平参差不齐、费用差距较大等问题。
为进一步规范我国HVPG应用开展,中国门静脉高压联盟(Chinese Portal Hypertension Alliance,CHESS)、中华医学会消化病学分会微创介入协作组依据《中国临床实践指南的评价标准》[6]和《中国制订/修订临床诊疗指南的指导原则(2022版)》[7],现更新并发布《中国肝静脉压力梯度临床应用专家共识(2023版)》(以下简称“共识”)。本共识在国际实践指南注册平台注册(IPGRP-2021CN342),计划发表后每5年更新1次。本共识参照的循证医学证据等级参考证据质量分级和推荐强度系统(grading of recommendations,assessment,development,evaluation,GRADE),将证据质量分为高(A:非常确信真实的效应值接近效应估计)、中(B:对效应估计值有中等程度的信心,即真实值有可能接近估计值,但仍存在二者大不相同的可能性)、低或极低[C:对效应估计值的确信程度有限(真实值可能与估计值大不相同);对效应估计值几乎没有信心(真实值很可能与估计值大不相同)]3个等级。以及两个推荐强度:1(强)明显利大于弊;2(弱)可能利大于弊。
1. HVPG用于肝硬化门静脉高压危险分层:HVPG可反映肝硬化门静脉高压的进展程度,Baveno Ⅶ共识和美国肝病学会(American Association for the Study of Liver Diseases,AASLD)2016版门静脉高压出血管理共识均明确强调了HVPG在肝硬化门静脉高压危险分层和预后评价中的价值[1,3]。对于肝脏活检病理检查提示无肝硬化的慢性肝病患者,HVPG对肝硬化相关并发症的发生较活检病理检查具有更高的预测价值[8]。
一项队列研究显示:对于单发≤5 cm肝细胞癌,HVPG≥7 mmHg患者行肝移植术较肝切除术具有更好的长期生存获益[9]。对于丙型肝炎肝硬化、酒精性肝硬化及非酒精性脂肪性肝硬化患者,HVPG>10 mmHg预示更多失代偿事件的发生[10, 11]。HVPG较基线值每升高1 mmHg,失代偿风险升高11%[12]。一项前瞻性、多中心、双盲研究结果显示:HVPG≥10 mmHg患者发生肝癌的风险是HVPG<10 mmHg的6倍[13]。多项前瞻性队列研究结果均提示:HVPG≥10 mmHg患者行肝癌切除术后发生失代偿事件的风险更高[14, 15, 16, 17]。
推荐意见1:HVPG≥10 mmHg提示代偿期肝硬化患者发生静脉曲张、失代偿事件和肝癌的风险升高(A,1),且提示肝癌切除术后发生失代偿事件的风险升高(C,1)。
对于不合并静脉曲张的失代偿期肝硬化患者,一项前瞻性、多中心、随机、安慰剂对照研究结果显示:HVPG较基线下降>10%患者发生静脉曲张的概率更低,HVPG下降至12 mmHg以下是预防静脉曲张出血和腹腔积液的保护因素[18]。另一项前瞻性、观察性研究结果显示:HVPG≥12 mmHg是静脉曲张出血的必要条件[19]。此外,荟萃分析结果证实:HVPG<12 mmHg可以显著降低肝硬化门静脉高压患者发生静脉曲张出血的风险[20]。
推荐意见2:HVPG≥12 mmHg是肝硬化患者发生静脉曲张出血的高危因素(A,1)。
一项巢式病例对照研究显示,对于合并腹水和(或)肝性脑病的肝硬化静脉曲张出血患者,基线HVPG≥16 mmHg能够有效识别高危患者并显著减少HVPG重复测量次数[21]。另一项多中心研究评估了HVPG在肝硬化患者择期肝外手术中的预后作用,证实了HVPG>16 mmHg与术后死亡的高风险相关[22]。多项临床研究表明,HVPG≥16 mmHg提示肝硬化患者死亡风险升高[23, 24, 25, 26]。
推荐意见3:HVPG≥16 mmHg提示肝硬化患者的死亡风险升高(C,2)。
一项回顾性研究显示,在所有纳入的165例肝硬化食管胃静脉曲张出血患者中,内镜治疗1年后的总体再出血率为23.6%。其中相较于未出血组,再出血组患者具有更高的HVPG(18 mmHg比14 mmHg,P=0.024),且logistic回归分析显示更高的HVPG是内镜治疗后再出血的唯一风险因素[27]。
推荐意见4:HVPG≥18 mmHg提示内镜治疗食管胃静脉曲张出血的失败率增高(C,2)。
一项回顾性研究结果显示,HVPG≥20 mmHg是代偿期肝硬化患者早期发生失代偿事件及预后不良的独立风险因素[28]。另一项前瞻性研究结果证实,急性静脉曲张出血患者HVPG≥20 mmHg接受常规药物联合内镜治疗的失败率及1年死亡率较HVPG<20 mmHg患者明显升高[29]。另有研究表明,HVPG≥20 mmHg的急性静脉曲张出血患者再出血率和6周内死亡风险显著增高[30]。
推荐意见5:HVPG≥20 mmHg提示肝硬化急性静脉曲张出血患者的治疗失败率和死亡风险增高(C,1)。
2. HVPG用于肝硬化门静脉高压的治疗管理:2016版AASLD门静脉高压出血管理共识依据HVPG将肝硬化门静脉高压分为轻度门静脉高压(5 mmHg<HVPG<10 mmHg)、CSPH(HVPG≥10 mmHg)、肝硬化门静脉高压失代偿期(HVPG≥12 mmHg),且针对不同分期制定了相应的治疗目标[3],详见表1。

不同分期肝硬化门静脉高压患者的临床表现及治疗目标
不同分期肝硬化门静脉高压患者的临床表现及治疗目标
| 肝硬化分期 | 静脉曲张 | 门静脉高压并发症 | 治疗目标 |
|---|---|---|---|
| 代偿期 | |||
| 5 mmHg<HVPG<10 mmHg | 无 | 无 | 预防进展至临床显著性门静脉高压 |
| 10 mmHg≤HVPG<12 mmHg | 无 | 无 | 预防失代偿事件 |
| 有 | 无 | 预防失代偿事件(如首次静脉曲张出血) | |
| 失代偿期 | |||
| HVPG≥12 mmHg | 有 | 急性静脉曲张出血 | 止血、预防早期再出血和死亡 |
| 有 | 有出血史,不合并腹腔积液、肝性脑病 | 预防失代偿进展(再出血、其他并发症) | |
| 有 | 有出血史,合并腹腔积液、肝性脑病 | 预防失代偿进展、死亡或原位肝移植 |
注:HVPG为肝静脉压力梯度;1 mmHg=0.133 kPa
一项随机、双盲、安慰剂对照、多中心临床研究显示,长期服用β受体阻滞剂可延长代偿期肝硬化伴CSPH患者的无失代偿生存期,这主要得益于腹水发生率的降低[31]。一项荟萃分析评估了非选择性β受体阻滞剂(non-selective beta-blocker,NSBB)用于食管胃静脉曲张出血一级预防的临床价值,从1 172篇文章中纳入6篇随机对照试验和高质量病例队列研究,结果显示:与药物无应答组相比,血流动力学应答组即HVPG<12 mmHg和(或)较基线水平降低≥10%可显著减少静脉曲张出血风险[20]。
推荐意见6:在食管胃静脉曲张出血的一级预防药物治疗中,HVPG较基线下降≥10%或HVPG<12 mmHg,可有效降低首次出血发生风险(A,1)。
HVPG≥20 mmHg是静脉曲张出血治疗失败的独立预测因素,多项临床研究表明这类患者早期(24 h内)接受经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)的止血效果优于内镜下治疗[32, 33]。拟行早期TIPS时,可考虑先行HVPG测定,有助于优选适合早期TIPS的目标人群[34]。基于高危患者早期行TIPS治疗优于药物联合内镜的可靠数据[35],Baveno Ⅶ共识新增推荐食管静脉曲张和1/2型胃食管静脉曲张急诊出血,符合以下任一标准,应在72 h(理想情况下<24 h)内行优先TIPS:Child-Pugh C<14 分,或 Child-Pugh B>7 分初次内镜下有活动性出血,或 HVPG>20 mmHg[1]。
推荐意见7:对于HVPG≥20 mmHg的急性静脉曲张出血患者,推荐优先行早期TIPS治疗(A,1)。
对于既往静脉曲张出血史患者,行二级预防治疗后,HVPG<12 mmHg或较基线下降20%的患者再出血率更低[36]。一项随机对照研究结果显示:基于HVPG指导的肝硬化失代偿患者的个体化二级预防,能够降低再出血率和进一步失代偿事件的发生[37]。多项临床研究表明HVPG可用于指导静脉曲张出血的二级预防[38, 39]。
推荐意见8:对于食管胃静脉曲张出血的二级预防,HVPG较基线下降≥20%或HVPG<12 mmHg,可有效降低再出血率和进一步失代偿事件的发生风险(B,1)。
3. HVPG用于新药的疗效评估:HVPG对于新药研发意义重大。一项随机、双盲临床研究结果显示:相较于安慰剂,口服二甲双胍能够显著地降低肝硬化患者的门静脉压力,且不影响系统或肝脏血流动力学及炎症指标[40]。另一项随机、双盲、安慰剂对照、单中心临床试验表明:试验组(普萘洛尔+叶酸)较对照组(普萘洛尔+安慰剂)的肝硬化门静脉高压患者HVPG降幅更显著[41]。近年来多项药物研究评价通过抗纤维化、抗氧化应激、抗凋亡等途径改善门静脉高压,均采用HVPG作为血流动力学的药效评判标准[42, 43, 44, 45, 46]。针对慢性非酒精性脂肪性肝炎的新药研发一直是肝病领域的研究热点[47, 48, 49]。鉴于HVPG与非酒精性脂肪性肝炎的纤维化程度高度相关[50],为了缩短研发进程,美国食品药品监督管理局和AASLD均推荐使用HVPG作为临床研究终点事件的替代指标[51],用于非酒精性脂肪性肝炎进展期肝纤维化或肝硬化的临床试验[52, 53]。
推荐意见9:HVPG可用于评估相关新药疗效(B,1)。
4. HVPG用于新型无创诊断与监测技术研发:CSPH是肝硬化门静脉高压患者病程进展的关键阶段[54],对其精准诊断与评估具有重要的临床意义[37]。HVPG>10 mmHg是诊断CSPH的金标准[9],但其侵袭性及对设备、器械及操作者技术等要求限制了其常规推广应用,因此研发具有高度准确性的无创诊断与监测技术是本领域的热点和难点之一[2,55, 56, 57, 58, 59, 60, 61]。目前,HVPG作为诊断金标准已经广泛应用于无创预测CSPH的相关研究,包括血清标志物[62, 63, 64, 65, 66, 67]、弹性成像[68, 69, 70, 71, 72]、人工智能技术[73, 74, 75, 76, 77, 78]、CT[79, 80]及MRI[81, 82, 83, 84, 85, 86]、超声技术[87, 88, 89, 90]等。同时,胃十二指肠镜检查是评估食管胃静脉曲张的金标准,但同样存在检查不适、患者依从性差等问题。在探索无创预测静脉曲张出血的诊断性研究中,HVPG≥12 mmHg可作为参考标准[3,20]。此外,HVPG≥16 mmHg的肝硬化门静脉高压患者死亡风险增加,可将其作为评估标准用于预测死亡风险的无创技术研发[2,91]。
推荐意见10:HVPG是无创诊断与监测新技术研发的参考标准(A,1)。
1. 绝对禁忌证:无法平卧不能耐受手术者。
2. 相对禁忌证:①严重凝血功能障碍(国际标准化比值>5)。②严重心、肺、肾功能衰竭。
1. 人员准备:对于初学的操作者,需要经过至少30例标准化操作培训。
2. 患者准备:(1)建议患者在测量前空腹至少2 h,静息10~20 min;(2)询问麻醉药品和碘剂过敏史。
3. 物品准备:(1)标准的检测需要全程记录压力数值的变化,确保测压的连续性和稳定性,因此需要准备能持续记录测压过程的记录仪。压力连续记录需要纸质版或电子版全程记录整个测压过程(图1);(2)建议使用记录静脉压力的量程,一般选择0~50 mmHg,且两条相邻刻度的网格相差1~2 mmHg。如使用动脉压力的量程,则无法清晰地在图纸上记录较小的压力改变;(3)记录的走纸速度建议1~5 mm/s;(4)记录图纸的网格清晰打印;(5)建议根据记录图纸判读压力。
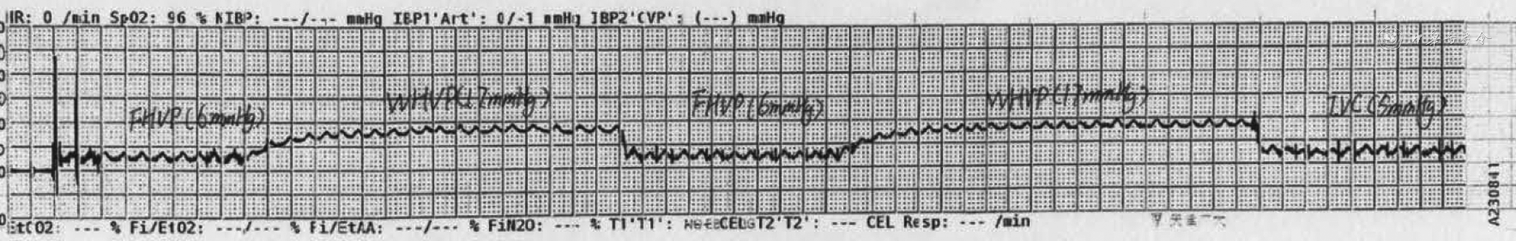

1. 麻醉:深度镇静可能导致HVPG测量不准确,建议测量HVPG时患者保持清醒状态,如需要轻度镇静,可选择低剂量咪达唑仑(0.02 mg/kg)[92],不建议使用丙泊酚等麻醉药物[93, 94]。
Steinlauf等[92]研究证实咪达唑仑以0.02 mg/kg的剂量使用,可有效增加患者在HVPG测量期间的舒适度并有利于放松,而不会显著影响压力(HVPG、WHVP或FHVP)值变化。而Reverter 等[93]一项研究证实使用丙泊酚和瑞芬太尼进行深度镇静会增加HVPG测量的变异性和不确定性。最近一项研究同样证实了在HVPG测量期间丙泊酚镇静通常是安全的,但这可能导致HVPG数值的改变[94]。
2. 校零:将压力传感器与监护仪连接,用无菌生理盐水充分排净连接管中空气,将换能器及其连接三通固定于患者右心房水平(腋中线水平),旋转三通接通大气进行校零。对于换能器旁无三通者,可同时将导管末端固定于右心房水平进行校零,注意保持换能器在整个测压过程中处于固定位置,避免移动位置;如有移动,需重新校零后再次测压。检查测压使用的端孔顺应性球囊导管(以下简称“球囊导管”)的完整性。
3. 入路:(1)穿刺入路选择:HVPG的测量通常选取经右侧颈内静脉路径。常规消毒、铺无菌洞巾,局部麻醉,穿刺成功后置入导管鞘,利用导丝将导管经上腔静脉、右心房引入下腔静脉。将造影导管(例如多功能导管、单弯导管或Cobra导管)引入肝静脉分支,先进行肝静脉造影检查,确认拟测压静脉通畅、无狭窄,周边未见明显的静脉-静脉侧支分流,则可选择该肝静脉为测压血管(否则必须更换其他肝静脉)。再引入导丝,退出导管并经导丝引入球囊导管至肝静脉入口处。退出导丝,回抽见血后注入生理盐水排净球囊导管内血液及对比剂,连接球囊导管和压力转换器连接管,注意避免产生气泡。经前臂静脉入路(肘正中静脉、贵要静脉、腋静脉等)行HVPG检测已经被证实可安全可靠地完成,无严重不良并发症,并且具有增加患者舒适性、减少放射暴露等优势,建议具备一定检测经验的团队开展(图2)。Akira汇报了41例经前臂静脉系统测量HVPG,具有98%检测成功率,以及较短的操作时间(中位操作时间19.1 min)。经前臂静脉系统测量的HVPG数值与白蛋白胆红素评分、Child-Pugh评分、终末期肝病模型评分、Lok指数呈显著正相关,与血小板计数呈显著负相关,表明经前臂静脉系统测量HVPG与门静脉高压程度、肝功能和血清学模型具有很好的相关性[95]。(2)肝静脉分支选择:考虑到肝静脉插管难度及测压准确性,建议首选肝右静脉;当肝右静脉存在狭窄或静脉-静脉侧支分流时,可更换为肝中静脉。
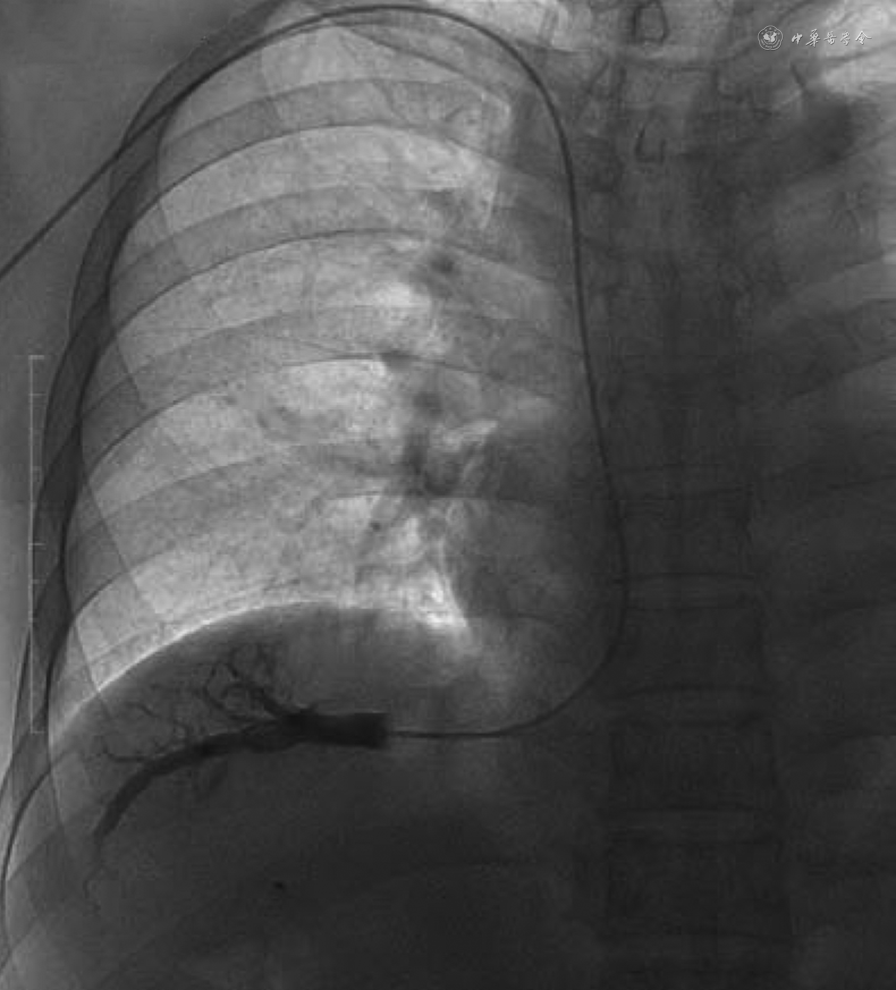

CHESS团队前期小样本研究分别测量了多支肝静脉HVPG,以观察不同肝静脉测量HVPG之间的差异。研究结果显示利用肝右静脉、肝中静脉、肝左静脉测量的HVPG分别为(16.4±2.6)、(15.1±4.6)、(13.4±4.3)mmHg,证实了肝左静脉与其他肝静脉HVPG的差值存在较大的变异性[96]。因此,建议首选肝右静脉或肝中静脉进行检测。
4. 测压过程:(1)测量FHVP:透视下将球囊导管选择至肝静脉,在距离下腔静脉2~4 cm处,等待至少20 s(部分患者达到读数稳定的时间会更长),待压力数值稳定后,读取FHVP。(2)测量WHVP:注入对比剂或空气使球囊扩张以充分阻断肝静脉血流,等待至少40 s,待压力数值稳定后,读取WHVP。保持球囊扩张状态,嘱患者屏住呼吸,经球囊导管缓慢注入5 ml对比剂行肝静脉造影检查,确认无对比剂反流或静脉-静脉侧支分流。(3)重复测量FHVP:将球囊中的对比剂或空气抽出,重复测量第2次FHVP。两次FHVP测量结果间的差值不超过1 mmHg,否则需进行第3次测定,并取3次结果中差值在1 mmHg内的两次测量结果。(4)重复测量WHVP:测量WHVP,两次WHVP测量结果间的差值不超过2 mmHg,否则需进行第3次测定,并取3次结果中差值在2 mmHg内的两次测量结果。(5)计算HVPG:根据公式HVPG=WHVP-FHVP计算,HVPG应取2次测量的平均值。(6)测量下腔静脉压及右心房压:完成上述步骤后,将球囊中的对比剂或空气抽出,退出球囊导管至下腔静脉及右心房,分别测量肝后段下腔静脉压及右心房压。
5. 术后管理:(1)测量结束后,拔除导管及导管鞘,及时用无菌纱布加压包扎,按压穿刺点至少10 min;(2)若患者凝血功能差或穿刺过程中误入动脉,则应适当延长按压时间;(3)术后应减少穿刺部位活动,严密观察患者生命体征及观察有无穿刺点出血或周围搏动性血肿,必要时对症处理;(4)观察如无不适反应,嘱患者当日进流质饮食并鼓励多饮水。
6. 注意事项:(1)HVPG检测的围手术期护理非常重要(具体内容请扫描本文首页二维码)。(2)在穿刺、校零、置入器械过程中严防空气进入,防止发生空气栓塞及影响测量结果;(3)球囊导管型号应根据肝静脉直径而定,一般选择5.5 F;(4)每次测量前应将球囊导管内充满无菌生理盐水,将空气、血液及对比剂排空,以免影响测压结果;(5)在安静状态、平静呼吸时,进行压力测定。避免在咳嗽、抽搐时读取数值,影响测压的准确性;(6)若导管发生阻塞,应回抽至回血,再用肝素盐水或枸橼酸钠冲洗导管或变动其位置,避免过分加压冲洗;若仍不通畅,则应更换导管;(7)在向球囊内注入对比剂或空气时,避免注入量过多造成球囊破裂;(8)球囊阻断肝静脉并完成WHVP测定后需进行造影检查,如出现对比剂反流,表明封堵不良,需调整球囊充盈状态后重新造影检查;如出现静脉-静脉侧支分流,需调整球囊位置或更换其他肝静脉进行阻断;(9)若患者术前影像学检查提示肝内有动脉-静脉瘘或动脉-门静脉瘘,应记录说明;(10)若压力记录走纸速度过快,则较难在稳定期读取数值,且容易造成记录纸太长,不便保存;(11)保持血流动力学稳定在测压过程中至关重要,操作者需耐心等待压力值达到稳定后才能进行下一步的压力测定;(12)导管前端伸入肝静脉部分不宜过长,FHVP不应超过下腔静脉压2 mmHg。如超过下腔静脉压2 mmHg,则应适当退出导管,在更靠近肝静脉汇入下腔静脉出口处重新测定;(13)对于因评估临床干预疗效而多次测定的患者,测压条件(如患者准备、仪器、操作过程等)应保持一致。
CHESS发起的一项国际前瞻性、多中心研究通过问卷调查评估了肝硬化患者HVPG检测术后并发症发生情况。271例患者成功接受了HVPG检测并参与调查。结果显示,HVPG检测的总体并发症发生率为0.4%。术后疼痛明显低于术前预期(P<0.001)和术中疼痛(P<0.001),术中疼痛也显著低于术前预期。在HVPG测量期间,36.9%的患者报告无不适,仅有0.4%的患者出现无法忍受的不适,该比例在HVPG检测后为54.6%和0。整体而言,HVPG术后并发症是轻微的,且绝大多数是自限性的[97]。
HVPG测量对于肝硬化患者是安全且耐受性良好的,为了最大程度减少患者的不适感和术后并发症发生,建议术前进行充分的患者教育和沟通,必要时可给予镇静镇痛药物。
1. 体位:平卧位时回心血量增加,测量压力较半卧位偏高,改变体位可使零点发生偏移;
2. 管路:管路不通畅、混入空气、打折、渗漏等情况会影响测压准确性;
3. 呼吸:肥胖者、慢性支气管炎、慢性阻塞性肺疾病、长期吸烟、机械通气等患者在测量过程中易出现呼吸性波动,影响测量稳定性;
4. 肝内分流:肝内静脉-静脉分流、动脉-静脉分流及动脉-门静脉分流均会影响测压准确性;
5. 活动:躁动、咳嗽、抽搐、过度紧张等情况会增加腹内压力,造成测量误差;
6. 药物:术前使用门静脉降压药物或麻醉药物会影响测压准确性,深度镇静会导致测量值显著变异;
7. 导管位置:导管插入肝静脉过深或过浅均会影响测压准确性;
8. 导管堵塞:导管前端发生堵塞会导致测压不准确。
HVPG在肝硬化门静脉高压的危险分层、精准管理、疗效评估及新药和新技术研发中具有重要意义,然而其在我国的临床应用中主要存在以下问题:(1)HVPG检测流程及围手术期护理缺乏统一的质量控制,导致不同中心测量结果的准确性难以评估,测压过程未被规范记录;(2)HVPG检测极少应用于肝硬化患者的失代偿事件二级预防(如药物治疗、内镜治疗、介入治疗、外科手术及肝移植)指导和疗效评估中;(3)HVPG检测较少作为参考标准应用于相关新药和无创新技术研发中。
未来应强调对肝硬化门静脉高压患者的全程管理,继续推动HVPG标准化检测及围手术期管理[98]。进一步推广普及更微创的经前臂静脉通路HVPG检测方法;利用经HVPG验证的无创技术进行高危人群的筛选及长期随访;对于代偿期人群,可利用HVPG进行危险分层,并指导高危人群出血的一级预防及疗效评估;对于失代偿期患者,可利用HVPG指导出血二级预防的方案及疗效评估,并对疾病预后做出判断。尽管已有研究将HVPG应用于肝癌肝切除术和肝移植的预后评估中[13, 14, 15, 16,99, 100, 101, 102],但目前尚缺乏高级别证据证明HVPG对肝癌患者的分层治疗价值。期待通过本共识有效推动HVPG的标准化检测和规范化应用,优化我国肝硬化门静脉高压的精准诊疗实践。
《中国肝静脉压力梯度临床应用专家共识(2023版)》编审专家组名单
名誉组长:滕皋军(东南大学附属中大医院介入治疗中心);唐承薇(四川大学华西医院消化内科)
组长:祁小龙(东南大学附属中大医院门静脉高压中心);张春清(山东第一医科大学附属省立医院消化内科)
成员(按照姓氏汉语拼音排序):暴金伦(山南市人民医院消化内科);曹国洪(树兰杭州医院放射科);陈金军(南方医科大学南方医院感染内科);戴真煜(盐城市第三人民医院介入影像科)丁惠国(首都医科大学附属北京佑安医院肝病消化中心);冯对平(山西医科大学第一医院肿瘤与血管介入科);高海女(树兰杭州医院感染病科);更藏尖措(青海省第四人民医院介入科);苟卫(青岛市第六人民医院肝病科);郭文波(中山大学附属第一医院放射介入科);郭武华(福建医科大学孟超肝胆医院介入科);何福亮(首都医科大学附属北京友谊医院肝病中心);何绍飞(云南蒙自市人民医院放射科);侯昌龙(中国科学技术大学附属第一医院介入科);胡红杰(浙江大学医学院附属邵逸夫医院放射科);胡小雄(宜春市人民医院肝病科);胡晓钢(金华市中心医院介入科);胡舟朝(浙江省舟山医院介入诊疗中心);黄必润(荆州市第一人民医院介入血管外科);黄广军(山东第一医科大学附属省立医院消化内科);黄明声(中山大学附属第三医院介入科);黄勇(自贡市第四人民医院介入室);姜泓(空军军医大学第二附属医院感染科);孔德润(安徽医科大学第一附属医院消化科);雷彦明(西藏自治区人民医院介入放射科);李东良(联勤保障部队第九〇〇医院肝胆内科);李汾香(临汾市第三人民医院肝病三科);李佳楠(佳木斯市传染病医院肝四科);李雷(兰州大学第一医院介入医学科);李双生(亳州市人民医院介入科);李志伟(深圳市第三人民医院肝胆外科);梁煊(沈阳市第六人民医院感染科);林福煌(海南省人民医院综合介入科);刘登湘(邢台市人民医院放疗科);刘福全(首都医科大学附属北京世纪坛医院介入治疗科);刘江涛(解放军总医院海南医院消化内科);刘士荣(曲阜市人民医院感染科);刘天宇(遂宁市中心医院消化内科);刘伟(丽水市人民医院介入科);路婷(阳泉市第三人民医院消化内科);罗薛峰(四川大学华西医院消化内科);马超(阜阳市第二人民医院消化内科);马德强(十堰市太和医院感染科);马军(宁夏回族自治区人民医院介入血管外科);穆可涛(华中科技大学同济医学院附属同济医院放射科);牛猛(中国医科大学附属第一医院介入治疗科);庞鹏飞(中山大学附属第五医院介入医学中心);彭利军(临沂市人民医院消化内科);曲卫(日照市人民医院消化内科);任涛(西藏自治区人民政府驻成都办事处医院消化内科);任伟新(新疆医科大学第一附属医院介入放射科);邵初晓(浙江省丽水市人民医院普外科);沈文拥(重庆大学附属涪陵医院消化内科);孙军辉(浙江大学医学院附属第一医院肝胆胰介入中心);孙勤学(宁波市医疗中心李惠利医院介入治疗科);唐以军(十堰市太和医院呼吸与危重症医学科);王方(深圳市第三人民医院肝炎肝硬化科);王峰(大连医科大学附属第一医院介入治疗科);王广川(山东第一医科大学附属省立医院消化内科);王涛(烟台毓璜顶医院介入治疗科);王卫东(南方医科大学顺德医院肝胆胰脾外科);王勇(海南医学院第二附属医院介入血管外科);王宇(首都医科大学附属北京友谊医院肝病中心);王泽鑫(内蒙古医科大学附属医院介入放射科);王志伟(郑州大学第一附属医院腔内血管外科);吴斌(中山大学附属第三医院消化内科);吴凡(华中科技大学同济医学院附属武汉中心医院消化内科);吴浩(四川大学华西医院消化内科);吴军(兰州市第二人民医院放射科);吴伟(温州医科大学附属第一医院消化科);吴晓明(金华市人民医院介入血管外科);向华(湖南省人民医院介入血管外科);向慧玲(天津市第三中心医院消化肝病科);谢青(上海瑞金医院感染科);熊恺(南昌大学第二附属医院消化内科);薛挥(西安交通大学第一附属医院消化内科);阎朝光(新疆自治区第二人民医院消化内科);杨少奇(宁夏医科大学总医院消化内科);姚升娟(天津市第二人民医院放射科);姚文暾(宁夏医科大学总医院消化内科);易宏锋(武汉市第一医院消化内科);余雷(广西壮族自治区人民医院介入科);余磊(福建医科大学附属三明第一医院介入科);余强(解放军总医院第五医学中心介入放射科);于涛(葫芦岛市中心医院介入科);袁敏(上海市公共卫生临床中心介入科);张成大(绵阳市第三人民医院消化内科);张峰(南京鼓楼医院消化内科);张建(江苏大学附属医院介入放射科);张敬强(晋城市人民医院介入放射科);张昆鹏(邢台市人民医院肝胆外科);张黎桂(桂林市人民医院介入治疗科);张林鹏(太原市第三人民医院影像科);张齐(东南大学附属中大医院介入与血管外科);张文峰(南昌大学第一附属医院江西省重大公共卫生事件医学中心);张雯(复旦大学附属中山医院介入治疗科);赵剑波(南方医科大学南方医院血管与介入科);赵新功(渭南市中心医院消化内科);赵中伟(丽水市中心医院介入科);周卫忠(南京医科大学第一附属医院介入放射科);朱贺(沈阳市第六人民医院介入科);朱康顺(广州医科大学附属第二医院微创介入科);朱清亮(西南医科大学附属医院消化内科);朱晓黎(苏州大学附属第一医院介入科);朱晓亮(兰州大学第一医院普外科);庄少鹉(福建医科大学附属漳州市医院介入治疗科)
执笔者:王继涛(邢台市人民医院肝胆外科);高龙(山西医科大学第一医院肿瘤与血管介入科)
中国门静脉高压联盟(CHESS), 中华医学会消化病学分会微创介入协作组. 中国肝静脉压力梯度临床应用专家共识(2023版)[J]. 中华医学杂志, 2023, 103(48): 3885-3895. DOI: 10.3760/cma.j.cn112137-20230831-00342.
所有作者声明不存在利益冲突


























