
本文回顾1例月经稀发伴痤疮数年病例。患者显示高雄激素血症和胰岛素抵抗。初始诊断考虑多囊卵巢综合征,并予以2个月的口服药物治疗,症状无明显改善。进一步超声检查提示右侧卵巢一非均质性包块(3.2 cm×3.0 cm)。遂行腹腔镜下右侧卵巢病损切除,术后病理:卵巢性索-间质细胞肿瘤、成年型颗粒细胞瘤(弥漫型)。术后3 d睾酮水平下降至正常值,且月经在术后2个月恢复来潮。本研究针对该病例总结并文献复习,患有严重高雄激素血症和男性化的女性,建议详细评估可能分泌雄激素的肿瘤。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
卵巢颗粒细胞瘤是最常见的具有恶性潜能的卵巢性索间质细胞瘤,该肿瘤诊断时大多处于临床早期,但具有晚期复发趋势。卵巢颗粒细胞瘤常有内分泌功能,可分泌多种激素:雌激素、促黄体生成素、抑制素、雄激素、抗苗勒激素等,其中最常见为雌激素,而分泌雄激素导致男性化体征者相对罕见[1,2]。本研究报道1例分泌雄激素的卵巢颗粒细胞瘤患者临床资料,并进行文献复习。
患者女性,27岁,因月经稀发伴痤疮3年就诊。患者14岁月经初潮,22岁结婚,未孕,既往无特殊病史。体格检查可见前额及面颊部痤疮,明显多毛,阴蒂肥大。实验室检查:血清睾酮161.16 ng/dL(参考范围14~76 ng/dL,下同)、脱氢表雄酮4 260 ng/dL(50~200 ng/dL),甲状腺功能、催乳素水平正常。口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)提示血糖正常,胰岛素释放试验(insulin release test, IRT)提示患者存在胰岛素抵抗(表1)。临床诊断:高雄激素血症原因待查;多囊卵巢综合征(polycystic ovarian syndrome, PCOS)。予以炔雌醇环丙孕酮片行人工周期,吡格列酮(15 mg/d)、安体舒通(40 mg/d)治疗。患者遵医嘱用药2个月,月经周期恢复规律,但面部痤疮无明显改善,睾酮水平161.2 ng/dL,较前无下降,复查IRT提示胰岛素抵抗无明显改善(表1)。进一步行妇科三维彩超检查,提示右侧卵巢非均质性包块(3.2 cm×3.0 cm无回声区,边界清晰,壁厚,内可见密集的细小强光点,囊壁可见条状血流信号存在);道格拉斯腔积液。患者择日行腹腔镜下右侧卵巢病损切除术,术中见右侧卵巢增大约4.0 cm×5.0 cm×4.0 cm,表面光滑,呈灰白色,用超声刀在卵巢游离缘切一小口,用血管钳钝性分离包块,分离过程中见卵巢深处一实质性包块,边界清楚,分叶状,约3.0 cm×3.0 cm×2.0 cm,术中包块剥除完整。术中见左侧卵巢大小、外观正常,子宫及双侧输卵管外观正常,腹腔内未见盆腔粘连、腹水或卵巢肿瘤向大网膜或其他器官播散。病理免疫组化:CD99(+)、CD56(+)、WT-1(部分+)、calretinin(散在+)、a-inhibin(少许+)、Melan-A(散在+)、CK20(散在+)、ER(散在+)CD117(散在+)、CD30(少许+)、CD10(-)、PCK(-)、EMA(-)、CK8/18(-)、CK7(-)、SALL4(-)。符合卵巢性索-间质细胞肿瘤,成年型卵巢颗粒细胞瘤(弥漫型;图1),国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)分级为1a级。术后3 d复查睾酮下降至正常值(44.73 ng/dL),术后1周睾酮27.11 ng/dL、脱氢表雄酮167 ng/dL,均恢复至正常值。术后行3次放疗,面部痤疮基本消退,月经也恢复正常周期。随访3年无复发。
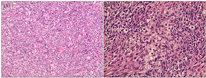

注:(A)×40; (B)×100;成年型卵巢颗粒细胞瘤(弥漫型)组织病理显示,瘤细胞为梭形或多角形,弥漫分布,排列紧密,细胞核卵圆形或圆形,可见纵行核沟,染色质呈细网状,瘤细胞周围纤维结缔组织少
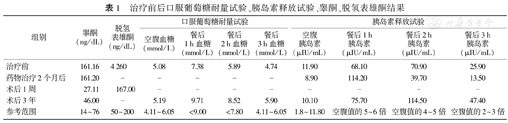
治疗前后口服葡萄糖耐量试验、胰岛素释放试验、睾酮、脱氢表雄酮结果
治疗前后口服葡萄糖耐量试验、胰岛素释放试验、睾酮、脱氢表雄酮结果
| 组别 | 睾酮(ng/dL) | 脱氢表雄酮(ng/dL) | 口服葡萄糖耐量试验 | 胰岛素释放试验 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 空腹血糖(mmol/L) | 餐后1 h血糖(mmol/L) | 餐后2 h血糖(mmol/L) | 餐后3 h血糖(mmol/L) | 空腹胰岛素(μIU/mL) | 餐后1 h胰岛素(μIU/mL) | 餐后2 h胰岛素(μIU/mL) | 餐后3 h胰岛素(μIU/mL) | |||
| 治疗前 | 161.16 | 4 260 | 5.08 | 7.38 | 5.89 | 4.74 | 11.90 | 68.10 | 70.90 | 25.90 |
| 药物治疗2个月后 | 161.20 | - | - | - | - | - | 8.90 | 114.20 | 39.70 | 13.50 |
| 术后1周 | 27.11 | 167.00 | - | - | - | - | - | - | - | - |
| 术后3年 | 46.00 | - | 5.19 | 9.71 | 8.52 | 5.90 | 10.10 | 75.70 | 114.50 | 47.40 |
| 参考范围 | 14~76 | 50~200 | 4.11~6.05 | <9.00 | <7.80 | 4.11~6.05 | 1.8~11.80 | 空腹值的5~6倍 | 空腹值的4~5倍 | 空腹值的2~3倍 |
卵巢颗粒细胞瘤通常伴有高雌激素血症,而分泌雄激素引起男性化表现的则相对罕见。本研究报道了1例分泌雄激素的卵巢颗粒细胞瘤(成年型),临床表现类似PCOS,掩盖了卵巢肿瘤的发现。本例患者有以下特点:(1)青年女性。(2)病史较长。(3)典型的PCOS就诊表现:月经稀发并痤疮,高雄激素水平。(4)初诊PCOS,给予相应治疗2个月后症状无缓解后于妇科彩超中发现右侧卵巢包块。(5)手术后临床症状改善明显。
颗粒细胞瘤是最常见的具有恶性潜能的卵巢性索间质细胞瘤,占比约90%,但在卵巢恶性肿瘤中占比不到5%,临床上相对少见[1,2]。不同于PCOS在育龄期发病,卵巢颗粒细胞瘤通常在50岁以上的人群发病[3]。而本例患者为27岁的育龄期女性,非常少见。卵巢颗粒细胞瘤通常为实体瘤,可分泌大量雌激素,导致激素相关的临床症状,青春期前可发生异常子宫出血或性早熟,绝经后患者常表现为绝经延迟或绝经后阴道出血,这些肿瘤很少分泌雄激素而引起男性化[4,5,6]。本例患者雄激素水平异常升高,并有男性化和胰岛素抵抗。2018年Gainder等[7]报道1例29岁月经稀发的不孕患者,与本例类似,初始诊断为PCOS,未能发现肿瘤,该患者予以克罗米芬诱导排卵失败,之后发现卵巢颗粒细胞肿瘤,予以手术切除后成功怀孕。
女性高雄激素血症的病因中最常见的是PCOS,约占72.1%[8]。典型的临床症状包括多毛、月经周期不规则、肥胖、胰岛素抵抗和高雄激素血症,以及经阴道超声显示的卵巢多囊样表现。大多数临床专家组首选使用鹿特丹标准来诊断PCOS[9]。诊断需要符合以下3个标准中的2条:(1)少排卵或无排卵。(2)高雄激素血症的临床和(或)生化证据。(3)超声示多囊卵巢。确诊PCOS也是排他性诊断,例如其他同样会引起少排卵/无排卵和(或)高雄激素血症的疾病(例如卵泡膜细胞增殖、甲状腺功能减退、非典型肾上腺皮质增生、高催乳素血症和雄激素分泌性肿瘤等)。但PCOS亦可与卵巢颗粒细胞瘤并存,相关报道目前仅有2例,分别是2013年Vera等[10]报道的18岁肥胖、多毛并月经稀发的患者和2020年Harris等[11]报道的25岁闭经、多毛、痤疮并2型糖尿病的患者[10,11]。2例患者均在手术切除肿瘤后症状得以减轻,但PCOS持续,需要药物维持治疗。本例患者有高雄激素血症和高雄激素相关的临床症状,并伴有月经稀发。不同于以上2例患者,本例术后雄激素水平下降,虽然术后3年随访IRT仍有胰岛素抵抗,OGTT提示处于糖尿病前期,但雄激素水平仍处于正常值(表1),月经周期无异常,考虑无PCOS并存。
女性高雄激素血症与胰岛素抵抗之间的关系目前尚未完全阐明。研究表明,过量的雄激素可以直接抑制骨骼肌和脂肪组织中胰岛素介导的葡萄糖摄取[12,13];还可以抑制瘦素活性,使棕色脂肪产热减少并增加内脏脂肪,从而导致胰岛素抵抗[14]。本例患者因卵巢颗粒细胞瘤分泌过多的雄激素,考虑是导致患者术前胰岛素抵抗的可能原因。
卵巢颗粒细胞瘤的首选治疗方法为手术切除。绝经前妇女如有保留生育能力或避免外源性激素替代的需求,可进行单侧输卵管及卵巢切除术,并行分段诊刮。如果所有活检标本和冲洗液均为阴性,则不建议进一步治疗,同时,应仔细检查对侧卵巢,必要时行活检[15,16]。对于无生育需求的绝经后妇女,应进行全子宫切除术和双侧输卵管及卵巢切除术[17]。卵巢颗粒细胞瘤的预后取决于肿瘤的分期。在一项针对37例1期卵巢颗粒细胞肿瘤患者的研究报告中,5年、10年和20年的生存率分别为94%、82%和62%[18]。该肿瘤具有转移潜能和晚期复发趋势。因此,术后2年内必须每隔2~3个月进行1次随访。随后3年,每6个月1次,然后每年1次。已有研究报道,晚期复发发生在初次治疗后的20~40年[19,20]。因此,对此类患者应进行长期随访。本例患者仅给予保守的卵巢病损切除,保留了双侧卵巢和输卵管,术后行3次放疗,随访3年无复发,仍需长期随访观察。
综上所述,对于患有严重高雄激素血症和男性化的女性,临床上必须要评估雄激素分泌性肿瘤。产生雄激素的卵巢颗粒细胞瘤虽少见,但有恶性潜能,需早期诊断并手术治疗,值得临床医生予以重视。
所有作者均声明不存在利益冲突



























