
患者女,64岁,2023年2月21日因“右侧胸痛4年余,左侧胸痛9个月余”就诊于北京朝阳医院。既往有陈旧性肺结核、类风湿关节炎病史。2018年10月胸部CT示双肺多发结节。CT引导下穿刺病理未见肿瘤。胸腔积液腺苷脱氨酶升高,考虑结核可能性大,于2019年3月起给予抗结核治疗。2019年12月因右侧局限性液气胸,行右肺下叶切除,术后病理示肉芽肿性炎伴坏死。2020年5月胸部CT示肺部结节及空洞较前明显增多。2023年1月考虑不除外隐球菌肺炎,给予氟康唑口服。最终,术后病理会诊确诊为肺类风湿结节,给予口服泼尼松及吗替麦考酚酯治疗1个月后复查胸部CT较前好转,建议继续目前治疗,定期复查胸部CT。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,64岁,主因“右侧胸痛4年余,左侧胸痛9个月余”于2023年2月21日入院。2018年10月患者因“免疫性血小板减少性紫癜”行CD20单抗治疗后出现右侧胸痛,以针刺样疼痛为主,季肋部为著,深呼吸时加重。伴有间断发热,最高体温39 ℃,伴有寒战,以夜间为著。伴有咳嗽、咳黄痰,痰量多,黏稠不易咳出。无咯血、盗汗、呼吸困难等不适。于外院给予头孢类抗生素(具体不详)治疗1周后,咳痰、发热明显好转,右侧胸痛未见改善。胸部CT(图1~4)示双肺多发结节。2019年1月因右侧胸痛加重就诊于解放军总医院海南分院,气管镜下未见异常,PET-CT考虑非肿瘤性病变,行CT引导下经皮肺穿刺活检,病理未见肿瘤征象,未予特殊治疗。2019年3月就诊于佳木斯当地医院,考虑肺结核可能性大,给予规范四联(异烟肼、利福平、乙胺丁醇、吡嗪酰胺)抗结核药物治疗。2019年5月患者右侧胸痛症状加重,胸部CT(图5~8)示双肺多发不规则结节影,右侧胸腔积液。行右侧胸腔穿刺,引出血性胸腔积液,性质为渗出液,胸腔积液常规检查可见多个核细胞占比81.9%,腺苷脱氨酶(ADA)44.54 U/L,葡萄糖1.25 mmol/L,仍考虑结核可能性大,继续抗结核药物治疗。2019年12月患者突感右侧胸痛加剧,呼吸困难,胸部CT示右侧局限性液气胸,于北京市胸科医院行右肺下叶切除+部分胸膜剥脱+黏连松解术,术后右肺下叶标本病理示肉芽肿性炎伴坏死,分枝杆菌分子基因检测阴性。手术后右侧胸痛症状较前缓解,继续抗结核药物治疗2个月后自行停用,2020年5月复查胸部CT(图9~12)示右肺下叶切除术后,双肺多发结节,部分结节增大,结节内形成空洞。
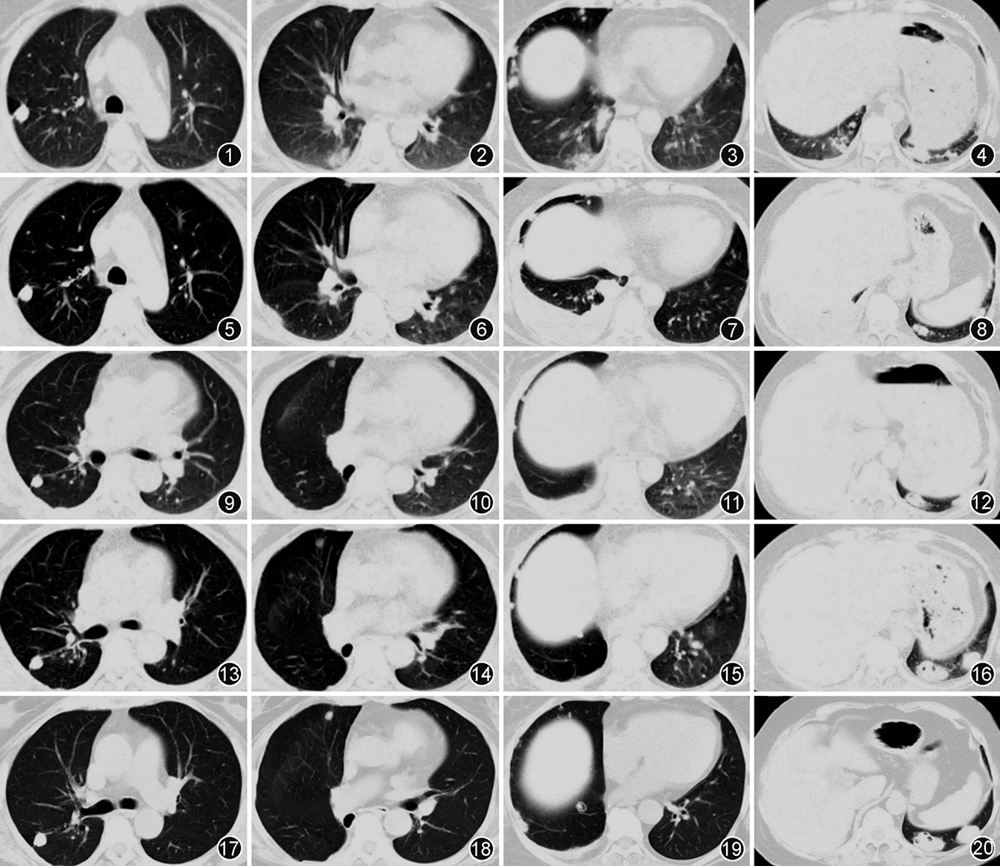

2022年5月患者无明显诱因出现左侧胸痛,以针刺样疼痛为主,季肋部为著,深呼吸时加重,无发热、咳嗽、咯血、盗汗、体重下降等,给予莫西沙星口服3周未见缓解,胸部CT(图13~16)示双肺多发结节,左下肺结节较前增大伴有空洞形成。2023年1月就诊于解放军总医院海南分院,考虑不除外隐球菌肺炎,给予氟康唑口服(450 mg/次,1次/d),治疗3周,患者自觉左侧胸痛症状较前好转。2023年3月,为行进一步诊治,就诊于首都医科大学附属北京朝阳医院,行胸部CT示双肺多发结节,较前增大、增多(图17~20),病程中患者偶有手关节不适,近3个月踝关节肿痛,右足麻木。
既往有陈旧性肺结核病史40余年,已治愈;类风湿关节炎病史20余年,规律口服来氟米特(10 mg/次,2次/d)、醋酸泼尼松(5 mg/次,2次/d),偶有手关节不适,无关节畸形和皮下结节;免疫性血小板减少性紫癜病史4年余,给予血小板输注、激素、环孢素、CD20单抗治疗后好转,未再复发;2型糖尿病病史4年余,血糖控制满意。因胆囊结石行胆囊切除术后15年;因胆管结石反复发作行胆肠吻合术后6年。对利多卡因过敏,表现为过敏性休克,无鸟类接触史,无吸烟、饮酒史。患者生于黑龙江,久居当地,5年前起秋冬季居住在海南,海南居住环境潮湿。否认家族遗传病史。
入院体检:体温36.5 ℃,脉率78次/min,呼吸频率18次/min,血压126/67 mmHg(1 mmHg=0.133 kPa)。神志清楚,口唇无发绀,全身皮肤未见皮疹、黄染、皮下结节,上腹部可见长约10 cm手术瘢痕,全身浅表淋巴结未及肿大。双侧胸廓对称,双肺呼吸音粗,右肺呼吸音减弱,双肺未及明显干湿性啰音,未闻及胸膜摩擦音。心率78次/min,律齐,瓣膜区未及杂音、额外心音。腹软,无压痛、反跳痛,肝、脾未及肿大,肝区脾区无叩击痛,双下肢无水肿。
实验室检查:血常规、血气分析、尿常规、便常规、生化全项、ESR、抗核抗体、ENA抗体谱、抗双链DNA抗体、抗中性粒细胞胞质抗体(ANCA)、细胞免疫、体液免疫未见异常。降钙素原、痰细菌及真菌涂片及培养均阴性,肺炎支原体 IgM、IgG阴性,肺炎衣原体 IgM 阴性,新型隐球菌荚膜抗原、G实验、GM实验、曲霉IgG未见异常。C反应蛋白(CRP)26.25 mg/L,类风湿因子125 U/ml,抗CCP抗体2 006.61 U/ml。
石欣雨(呼吸与危重症医学科):本例特点:(1)老年女性,慢性病程。(2)既往类风湿关节炎、2型糖尿病及免疫性血小板减少性紫癜病史。(3)主要症状为胸痛,不伴其他系统症状。右侧胸痛4年余,手术切除右下叶后右侧胸痛缓解,左侧胸痛9个月余,病程中先后给予头孢类抗生素及莫西沙星抗炎、四联抗结核等药物治疗,双肺多发结节病变仍持续进展。应用氟康唑治疗后患者自觉症状较前略减轻。(4)5年前起秋冬季居住在海南,居住环境潮湿。(5)体检:双侧胸廓对称,双肺呼吸音粗,右肺呼吸音减弱,双肺未及明显干湿性啰音,未闻及胸膜摩擦音。(6)实验室检查:类风湿因子 125 U/ml,抗CCP抗体2 006.61 U/ml,结核、隐球菌、血管炎、肿瘤等实验室检查指标均阴性。(7)胸部CT示双肺多发结节影,多位于胸膜下,边缘清晰,结节周围肺组织、气管形态、血管纹理均无异常。部分结节伴空洞形成,抗结核治疗无效,右肺上叶胸膜下的结节变化不大,余双肺多发结节增大且数量增多,部分形成空洞,逐步进展。(8)右肺下叶切除病理示肉芽肿性炎伴坏死。
综上所述,首先不除外感染性疾病。患者经过抗结核治疗无效,其影像学方面的表现要考虑到真菌感染可能。患者每于秋冬季节居住在海南,居住环境潮湿。患者既往有2型糖尿病病史,且因类风湿关节炎长期口服激素,具有罹患肺部真菌感染的危险因素。患者在经过氟康唑抗真菌治疗3周后,胸痛症状略有好转。但不符合的方面是患者无发热,不伴有咳嗽、咳痰、咯血等表现。胸部影像学上双肺结节持续增大,空洞较前增多。此次住院相关的病原学及血清学检查未见真菌感染证据,故需警惕特殊病原体感染。
安立(呼吸与危重症医学科):本例患者3年余前因右肺下叶结节破裂于北京市胸科医院行右肺下叶切除术,右肺下叶切除病理结果示肉芽肿性炎伴坏死。病因可从两个方面考虑。(1)感染性肉芽肿疾病:患者有类风湿性疾病和2型糖尿病,目前口服糖皮质激素,有罹患结核、真菌等特殊病原体感染的高危因素。部分肺结核可以起病隐袭,无明显的低热、盗汗等典型结核中毒症状,影像可以表现为团块、结节、空洞、纤维化及钙化表现,表现为多形性的特点,主病灶周围可见卫星灶。本例患者双肺结节表现为逐渐增大,并出现空洞,各结节之间无气道分布及播散特征,周围也未见卫星灶。影像表现不是典型肺结核的特点。另外,从治疗反应来看抗结核治疗无效,逐渐加重。目前继发性肺结核可以排除。患者除了宿主自身的高危因素,还有海南潮湿环境的长期居住史,应考虑到肺部真菌感染的可能。肺部真菌感染从影像上要考虑到两种疾病,一种是肺曲霉病,另一种是隐球菌肺炎。前者从病程来看应注意除外慢性曲霉病,慢性肺曲霉病可表现为曲霉结节、单发曲霉球、慢性空洞性肺曲霉病和慢性纤维化性肺曲霉病,这几种类型互相之间有交叉,并可向慢性坏死性肺曲霉病演变。本例患者不除外表现为曲霉结节的慢性曲霉感染,但此患者结节出现空洞后并无咯血等血管侵袭的表现,不符合曲霉病的临床特点。患者的影像表现为胸膜下结节为主,并有空洞形成,符合隐球菌肺炎的CT分布特点,部分隐球菌肺炎患者症状轻微,有时因体检发现,有的因侵及胸膜而出现胸痛症状。此例患者目前不除外此诊断。因此诊断上需完善气管镜检查,行气管镜下诊断性灌洗,送检肺泡灌洗液培养、涂片、GM试验、隐球菌荚膜抗原,墨汁染色以及二代测序等病原学微生物相关检测。(2)非感染性肉芽肿性疾病较常见的是结节病和血管炎,少见的可见类风湿结节。结节病多表现为淋巴管周围分布的微结节病变,最常见于胸膜下支气管血管束周围间质。微结节病变可以融合形成较大结节。部分结节病患者肺部纤维化改变逐渐明显,形成牵拉性支气管扩张及纤维化,多伴有纵隔及肺门淋巴结对称性肿大,此患者影像学表现不符。血管炎为系统性疾病,常常伴随多器官受累的表现,目前此患者临床表现无系统性血管炎的支持证据。现患者有类风湿关节炎病史,目前仍在活动期。类风湿结节是类风湿关节炎(RA)肺部的罕见表现。RA肺内结节易发生于RA病程较长的患者,大多无症状,多位于下胸膜处,直径数毫米至数厘米不等,肺内结节性质与发生于其他部位结节性质相同[1]。此患者不除外此诊断。为明确诊断,可行支气管镜检查,完善肺泡灌洗液病原微生物学检查,并获取左肺新近进展病灶的病理。
经病例讨论后,入院后行支气管镜检查,镜下未见异常,于左下叶外基底段-亚段分支处,超声探及可疑病灶后取活检,活检标本病理示(左肺下叶外基底段)支气管黏膜及肺组织,支气管管腔结构正常,细胞未见异型性,刚果红染色阴性,网状纤维染色显示肺泡腔结构未见肉芽肿。痰及肺泡灌洗液病原学方面真菌、细菌培养及涂片结果均阴性,结核分枝杆菌测定阴性,肺泡灌洗液病原微生物二代测序阴性。
方秋红(呼吸与危重症医学科):患者病原微生物检测方面无阳性发现,经过抗细菌、抗结核、抗真菌等治疗后胸部影像呈进行性进展,空洞形成增多。气管镜下小病理也未能明确病变性质。既往右肺下叶切除标本病理示肉芽肿性炎伴坏死,因而鉴别诊断上应考虑到相对罕见的肉芽肿性疾病。如血管炎,坏死性结节病样肉芽肿病,支气管中心性肉芽肿病,肺类风湿结节的可能。(1)血管炎方面要考虑到嗜酸性肉芽肿性多血管炎(EGPA)和肉芽肿性多血管炎(GPA)的可能,两者主要病理表现为小血管壁的炎症与坏死,在血管壁浸润的炎性细胞可形成巨细胞及由不同炎性细胞组成的肉芽肿。EGPA为嗜酸性粒细胞性肉芽肿而GPA为淋巴细胞性肉芽肿。血管炎肺部影像学上可表现为肺浸润影、结节和空洞,空洞多为厚壁空洞,其中EGPA最常见一过性且部位多变的肺部浸润影。血管炎多伴有多系统的累及及相应血清学方面的异常。其中EGPA表现为血嗜酸性粒细胞明显升高,伴发哮喘、鼻窦炎,部分患者有多发性单神经炎的表现。本例患者无EGPA相应临床表现及实验室检查结果,故不考虑此病。GPA临床表现复杂多样,可累及多个系统发病,典型表现为上呼吸道、肺、肾脏病变三联征,起病急,进展快,病死率高,预后较差。本例患者病情相对稳定,进展缓慢,无其他系统受累表现,临床上不考虑GPA。(2)坏死性结节病样肉芽肿病是一种罕见的原发性肺肉芽肿性疾病,其病理特征为非干酪样坏死性肉芽肿形成和坏死性血管炎。临床可表现为咳嗽、胸痛或全身不适,症状轻微且不特异。胸部影像以双肺多发的结节影最为多见,也可表现为大片的实变、空洞,胸膜增厚,胸腔积液等,其确诊依赖于病理诊断[2]。本例患者有胸痛的症状,肺切除样本病理示肉芽肿性炎,胸部影像学双肺多发结节,临床上需要进一步病理会诊以鉴别此病。(3)支气管中心性肉芽肿病,是支气管及细支气管周围的坏死性肉芽肿性炎症,破坏气道壁和邻近肺实质,导致黏膜和黏膜下层被肉芽肿组织取代[3]。临床表现咳嗽、咳痰、乏力等非特异性表现。胸部影像学表现为单发或多发的肺结节及肺实变区域,肺上叶受累更为常见[4]。本例患者有多发肺部结节,抗生素治疗无效,临床上不能除外,但患者影像上结节无支气管中心分布特征,不符合此病的影像特点。(4)患者有较长的RA病史,目前仅偶有关节不适。肺类风湿结节是RA特异性的肺部表现,一般无症状,但也可导致包括胸腔积液、气胸、支气管胸膜瘘或咯血等并发症。通常位于胸膜下区域或小叶间隔,直径数毫米至数厘米不等。类风湿结节的组织学表现为结节中央区的坏死,其外围包绕栅栏样巨噬细胞和淋巴细胞[5, 6],部分结节存在局灶性血管炎,可伴有免疫球蛋白、纤维蛋白的沉积及补体的激活。此患者不能除外此诊断。由于以上疾病的治疗方案及预后均不相同,均需要足够的肺组织进行病理学检查明确诊断。考虑到支气管镜下肺穿刺活检组织较少,且除右肺上叶结节外,患者余双肺结节分布、特征基本一致,建议患者将右肺下叶切除组织送至北京协和医院病理科进行病理会诊。
为进一步明确诊断,将北京胸科医院右肺下叶切除术后病理送至北京协和医院病理科会诊(图21, 22, 23)。
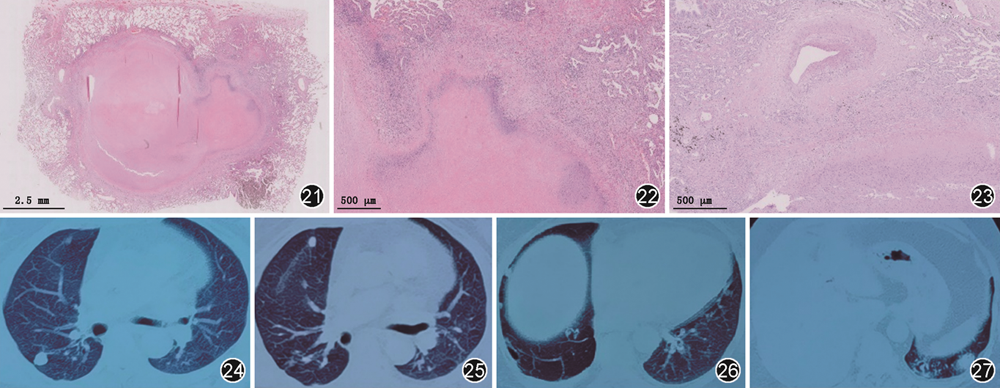

冯瑞娥(北京协和医院病理科):该病例镜下可见肺组织内大片退变坏死,坏死形状不规则、层状分布,中心嗜酸性、周边嗜碱性,坏死周边见上皮样细胞及多核巨细胞围绕,部分区域内见中性粒细胞核碎,病变周围见血管壁炎症细胞浸润,血管壁增厚,部分管腔闭塞,符合肺类风湿结节。特殊染色(PAS、抗酸、六胺银染色)均阴性。
很多肺部疾病可表现为肉芽肿病变,其病理诊断需要结合病变的分布,肉芽肿形态及伴随病变。组织病理学方面需鉴别以下疾病:(1)感染性肉芽肿性肺疾病,如结核分枝杆菌感染可见干酪样坏死,周围伴有上皮样组织细胞、朗格汉斯巨细胞、淋巴细胞等的浸润,抗酸染色可查找抗酸杆菌。如真菌感染,病理可见真菌菌丝和孢子,PAS、六胺银染色可呈阳性。(2)非感染性肉芽肿性肺疾病,以过敏性肺炎和结节病最为常见。过敏性肺炎多表现为以细支气管为中心的富细胞性间质性肺炎、非坏死性松散的肉芽肿结节以及小灶状肺泡腔内机化[7]。结节病的病理特征以非坏死性肉芽肿为其特点,为局灶性、慢性炎症反应,病变多沿淋巴管分布,肉芽肿结节排列紧密,其周边伴有显著纤维组织增生及玻璃样变。结节病可观察到中心区域纤维素样坏死,但大量坏死往往提示坏死性结节病样肉芽肿病或其他疾病[8]。坏死性结节病样肉芽肿病典型病理表现为单个的非干酪样肉芽肿性炎及由其聚集而成的病灶取代肺实质,形成灶性的肺实质坏死和以血管壁和肺实质为主的肉芽肿性血管炎[9]。对于既往支气管镜及CT引导下肺穿刺活检病理结果未能明确诊断的原因考虑为穿刺活检组织块过小所致。
高燕莉(放射科):本例患者胸部影像学表现为胸膜下分布的双肺多发结节伴空洞形成。其中右肺上叶结节多次复查胸部CT未见明显变化,考虑为陈旧性结核。其余结节的形态、分布及演变过程与肺类风湿结节的文献报道相符。肺类风湿结节主要表现为:单发或多发,边界多光滑,大小从几毫米到几厘米不等,实性、部分实性或伴有空洞形成的多位于胸膜下或小叶间隔的结节[10, 11, 12, 13]。影像学上需与包括结核、真菌感染在内的感染性疾病及血管炎等疾病相鉴别。首先是肺结核,其结节好发在双肺上叶尖后段及下叶背段。影像学表现多样,可表现为实变影、空洞和结节影。病变的分布多沿气道分布,周围可见卫星灶、树芽征。本例患者双肺多发结节逐渐增大并伴有空洞形成,病变无气道分布特征,周围也未见卫星灶及树芽征,影像不符合典型肺结核的表现。其次是肺隐球菌病,多分布在肺野外带或胸膜下区域,下叶多见。可表现为单个或多个胸膜下孤立结节或多发结节伴肿块,结节或肿块部分可成融合趋势,边界多较清楚。也可表现为大片的斑片实变影或弥漫粟粒影。本例患者的影像表现以胸膜下结节为主的多发的伴有空洞形成的结节,影像上不能除外隐球菌肺炎。最后是GPA,其影像学常见特征为:多发性、多形性、多变性,典型征象为弥漫性分布的多发结节或肿块合并空洞,结节大小不一,几毫米至数十厘米不等,50%的结节呈空泡状,多见于>2 cm的结节,部分的结节可能有“晕征”,提示邻近的实质性出血[14]。空洞常有增厚的壁,其特征是内边缘不规则和无钙化[15]。本例患者胸膜下分布,病变无血管分布特征,且周围没有晕征,影像上不符合典型的血管炎表现。综上所述,肺类风湿结节的影像学表现无明显特异性,与隐球菌、肉芽肿性多血管炎等疾病的影像表现类似,临床上需要结合临床表现、实验室检查、影像学及病理结果综合判断。
徐莉莉(呼吸与危重症医学科):患者在病程中出现了胸腔积液,穿刺化验示胸腔积液性质为渗出液,细胞以多个核细胞为主,ADA为44.54 U/L,葡萄糖1.25 mmol/L。从胸腔积液性质进行鉴别诊断,首先考虑为结核性胸腔积液。结核性胸腔积液的细胞多以淋巴细胞为主。ADA作为一种参与嘌呤代谢的酶,广泛存在于多种细胞中,特别是活化的T淋巴细胞。当ADA>40 U/L时,诊断结核性胸腔积液的敏感度和特异度分别为92%和90%[16]。但ADA水平升高也见于类风湿性关节炎、系统性红斑狼疮、淋巴瘤及脓胸等疾病[17]。胸腔积液中的葡萄糖水平通常与血液中的水平一致。胸腔积液中葡萄糖水平明显降低(<1.6 mmol/L)最常见于类风湿性关节炎和脓胸[18]。从胸腔积液鉴别诊断的角度分析,患者应考虑到类风湿关节炎导致胸腔积液的可能。肺类风湿结节好发于胸膜下,易产生坏死和空洞,导致与胸膜腔连通,可形成支气管胸膜瘘,易导致气胸或血气胸。本例患者即因右肺类风湿结节破裂导致右肺液气胸。类风湿关节炎患者有3%~5%会出现胸腔积液,大多数患者无症状,通常为少量积液,积液性质为渗出液,葡萄糖含量降低(<3.3 mmol/L),80%患者胸腔积液葡萄糖/血清葡萄糖比值<0.5,胸腔积液中类风湿因子的滴度常升高(>1∶320),积液中补体C4降低(<0.04 g/L)[19]。胸腔积液需完善常规、生化、细胞学化验检查排查肺炎、结核、肿瘤等病因,积液类风湿因子和补体C4检测有一定的鉴别诊断价值。
史旭华(风湿免疫科):类风湿性关节炎是一种进行性的系统性自身免疫性疾病。肺和胸膜是类风湿性关节炎常见的关节外受累部位[20, 21]。肺类风湿结节是类风湿性关节炎特异性的肺部表现,在不同研究中其发生率不一[22, 23]。肺类风湿结节一般没有症状,但结节内空洞的形成和破裂可导致并发症,包括胸腔积液、气胸、支气管胸膜瘘或咯血。
一般而言,病程较长且伴有皮下类风湿结节的患者更常发生肺类风湿结节。有关各种类风湿关节炎药物治疗(如甲氨蝶呤、来氟米特、硫唑嘌呤等)后结节的大小和数量的变化情况报道不一,目前尚无定论[24, 25, 26]。本例患者平素规律口服来氟米特(10 mg/次,2次/d)、醋酸泼尼松(5 mg/次,2次/d),偶有手关节不适,无关节畸形,全身体检未见皮下类风湿结节。在因免疫性血小板减少性紫癜接受CD20单抗治疗后出现了胸痛的症状,影像上可见双肺多发结节,经抗结核、抗真菌等治疗后影像学持续进展。右肺下叶切除标本病理会诊后明确为肺类风湿结节。
安立(呼吸与危重症医学科):再次回顾本病例特点,老年女性,既往类风湿关节炎病史,日常口服小剂量激素及免疫调节剂控制,偶有手关节不适,无关节畸形,全身体检未见皮下类风湿结节。慢性病程,主要以胸痛为症状。胸部CT示双肺多发结节,5年间除右肺上叶结节外,余结节逐步增大,部分结节形成空洞。病程中曾患胸腔积液及液气胸,并因右侧局限性液气胸行右肺下叶切除术,术后病理经会诊后明确为肺类风湿结节。本例患者没有发现恶性肿瘤、感染及其他自身免疫性疾病证据。
目前缺乏关于肺类风湿结节的相关流行病学资料。肺类风湿结节通常无症状,当胸膜下分布的结节形成空洞或结节破裂时可出现胸腔积液、气胸等并发症。还有一部分患者通过进行胸部CT检查发现。治疗上,首先是并发症的治疗。针对肺类风湿结节所导致的胸腔积液,可应用非甾体抗炎药或给予中等剂量糖皮质激素改善病情,可行胸腔穿刺缓解胸腔积液所致呼吸困难。对于肺类风湿结节所导致的气胸,按照自发性气胸指南进行初始治疗,气胸初步稳定后,多数患者需要接受包括胸膜下结节切除、胸膜固定等操作以防止复发。对于没有症状的患者,无须针对肺类风湿结节进行治疗。这类患者预后通常较好,可自行消退。有报道称,部分类风湿关节炎患者因关节病变在接受利妥昔单抗治疗后,肺类风湿结节变小、变少[27]。而本例患者则是在因免疫性血小板减少性紫癜接受利妥昔单抗治疗后,出现了胸痛的症状,并随诊观察到肺类风湿结节的变大、变多。目前人们对于类风湿结节的发生机制及诱发因素知之甚少,未来需要更多的观察及研究。
随诊:明确诊断后,患者出院。院外患者口服醋酸泼尼松(50 mg,1次/d)和吗替麦考酚酯(0.75 g,2次/d),2周后醋酸泼尼松减至45 mg,1个月后患者胸痛症状缓解,复查胸部CT(图24~27)可见左下肺最大结节长径由4.2 cm缩小至3.4 cm。醋酸泼尼松继续减量,2周减1片。
此病例提示我们,肺类风湿结节可表现为胸膜下分布的双肺多发的结节伴空洞形成,缺乏特异性的临床表现。穿刺获得的小活检标本,较为局限,单独靠病理组织形态,无法精准鉴别各类肉芽肿性疾病。肺类风湿结节的精确诊断需要临床、影像、病理多学科的紧密配合。
石欣雨, 徐莉莉, 高燕莉, 等. 双肺多发结节伴空洞形成[J]. 中华结核和呼吸杂志, 2024, 47(3): 214-221. DOI: 10.3760/cma.j.cn112147-20230802-00038.
所有作者声明无利益冲突



























