
乳腺癌骨健康管理贯穿患者治疗的全周期。早期乳腺癌在辅助治疗过程中需要注意预防治疗引起的骨丢失,辅助应用骨改良药物则有助于改善部分患者的预后,而晚期骨转移患者应给予多学科综合治疗,并应用骨改良药物帮助预防骨相关不良事件。因此,无论早期还是晚期患者的治疗,都需要对骨健康给予重视,制定恰当的治疗策略,并处理好药物不良反应。良好的骨健康管理,将有助于改善患者的生活质量和生存。国家肿瘤质控中心乳腺癌专家委员会组织相关专家,基于循证医学证据,深入探讨乳腺癌骨健康的全周期管理,详细阐述了早期乳腺癌肿瘤治疗所致骨丢失的风险分级和治疗策略、辅助应用骨改良药物的适用人群和获益、晚期乳腺癌骨转移的诊疗以及骨改良药物不良反应的处理方法,为临床提供合理建议,以指导临床医师更好地应对临床中的骨健康问题。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺癌是全球发病率最高的恶性肿瘤[1]。随着早期筛查的普及和综合治疗水平的提高,乳腺癌的5年生存率逐年上升,国家癌症中心数据显示,中国乳腺癌患者的5年生存率超过83%[2]。随着乳腺癌患者生存期的不断延长,乳腺癌患者的骨健康管理愈发重要,乳腺癌骨健康全周期规范化管理势在必行。
乳腺癌骨健康全周期规范化管理包括早期乳腺癌患者骨健康管理、晚期乳腺癌患者骨健康管理以及骨改良药物安全性管理。早期乳腺癌患者骨健康管理主要包括防治骨丢失和预防骨转移、辅助应用骨改良药物带来生存获益。发生骨转移的晚期乳腺癌患者,骨健康管理的主要目标是防治骨相关事件(skeletal related events,SREs),提高生活质量[3]。而合理应用骨改良药物,正确认识和处理药物不良反应则贯穿骨健康管理始终。
目前,国内外尚无乳腺癌骨健康系统的管理方案及规范的诊疗建议。为进一步改善乳腺癌患者的预后,提高患者生存及生活质量,中国乳腺癌诊疗领域专家携手放疗科、骨科及其他相关科室的众多专家,结合国内外最新指南及循证医学证据,制订《乳腺癌骨健康规范化管理规范》,以期为乳腺癌患者骨健康管理提供参考依据及诊疗规范。
早期乳腺癌患者骨健康管理包括防治肿瘤治疗引起的骨丢失(cancer treatment-induced bone loss,CTIBL)和预防骨转移、改善生存获益两部分。
乳腺癌患者中80%为早期乳腺癌,化疗和内分泌治疗是重要的治疗组成部分。乳腺癌患者在接受化疗、芳香化酶抑制剂(aromatase inhibitor,AI)治疗、卵巢去势等治疗后常引起骨丢失,被称为CTIBL。防治骨丢失在早期乳腺癌患者骨健康管理中显得尤为重要。
骨从出生前开始生长,30岁时女性的骨会达到最大强度和密度的95%以上,此后骨仅会有极轻微的变化,直到绝经期因雌激素水平的迅速下降造成大量骨丢失。雌激素对骨量具有重要的保护作用。雌激素能够增加成骨细胞的功能,诱导破骨细胞凋亡,抑制骨吸收。绝经后妇女雌激素水平迅速下降,引起破骨细胞分化加快、促进破骨细胞形成并增强其活性,加快骨丢失。尤其是绝经10年内,雌激素缺乏引起的快速骨丢失每年为2%~3%[4, 5],这导致患者骨密度(bone mineral density,BMD)逐年下降,容易出现骨质疏松和骨折[6]。而当患者接受内分泌治疗或化疗等抗肿瘤治疗时,骨丢失会进一步加速。研究显示,接受AI治疗的乳腺癌患者脊柱骨量丢失率为每年2.2%~2.6%,髋部为1.7%~2.2%[7, 8]。骨丢失会导致骨折风险增加,进而影响患者的生活质量和生存。如髋关节发生骨折,1年的死亡率高达33%,约50%的生存者致残[4];脊柱骨折后12个月的生存率女性为86.5%,5年生存率为56.5%[9]。同时,相关治疗不仅会给患者带来沉重的经济负担和心理压力,也会给社会带来显著的经济负担。因此,临床医师应常规对相应患者的骨健康进行评估,做好CTIBL的防治工作。
绝经前患者的卵巢功能抑制(ovarian function suppression,OFS)治疗、绝经后患者的AI治疗、化疗、卵巢放疗及卵巢切除等去势治疗均会导致患者体内雌激素水平显著下降,造成骨丢失。其中,OFS和AI治疗是导致骨丢失最主要的因素。对于绝经前患者,OFS治疗能够有效降低血清雌激素水平,使患者的雌激素水平达到绝经后状态;对于绝经后患者,AI治疗会进一步降低患者的内源性雌激素水平,二者均会导致患者骨丢失加速[10, 11],骨折风险增加。绝经前乳腺癌患者接受OFS治疗2年,腰椎BMD较基线下降10.5%,股骨颈BMD下降6.4%[12]。如果是45岁前发生早绝经的女性,BMD下降更快,平均每年BMD减少3%~4%[13]。绝经后乳腺癌患者接受AI治疗,骨折风险较未治疗患者增加17%[14];接受延长内分泌治疗的患者,发生临床骨折的概率是没有接受治疗或仅接受安慰剂治疗患者的1.34倍[15]。
除肿瘤治疗相关因素外,还有其他一些因素会影响到患者骨健康,如不良生活习惯、性腺功能减退症在内的多种内分泌系统疾病、风湿免疫性疾病、影响钙和维生素D吸收和代谢的消化系统和肾脏疾病等基础疾病,而糖皮质激素、过量的甲状腺激素等药物,也会引起骨丢失[16, 17],临床治疗应对此予以关注。
1.BMD检测:BMD是评价绝经后乳腺癌患者骨丢失和骨质疏松的主要指标。检测BMD的通用方法是双能X射线吸收法(dual energy X-ray absorptiometry,DXA),其主要测量部位是中轴骨,包括正位腰椎和股骨(髋骨)近端,若腰椎和股骨近端测量受限,可选择非优势侧桡骨远端1/3处作为测量部位[18]。
2.骨折风险评估工具:除BMD外,欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)骨健康指南和美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)指南还推荐FRAX(the WHO fruactre risk assessment tool,www.shef.ac.uk/FRAX/,亦可下载APP使用)作为评估工具,量化早期乳腺癌发生骨质疏松性骨折的风险[19, 20]。FRAX工具能够根据年龄、性别、临床风险因素、股骨颈BMD(T值)和其他因素预测健康绝经后女性10年内发生骨质疏松引起的骨折事件风险,数据也适用于中国绝经后女性[21]。但是,FRAX工具并未将抗肿瘤治疗纳入到特定风险因素,对绝经后乳腺癌患者骨丢失的影响可能存在低估,使用时需要结合乳腺癌患者的疾病和治疗来综合考虑骨折风险。
3.骨生化标志物的监测:骨转换生化标志物是骨本身的代谢产物,可以动态地反映全身骨骼状况。骨转换生化标志物的测定有助于判断骨转换类型和骨丢失速率、评估骨折风险、了解病情进展、选择干预措施和判断抗骨质疏松治疗的疗效等。目前,常用的骨形成标志物有骨碱性磷酸酶(bone alkaline phosphatase,BALP)、Ⅰ型原胶原氨基端前肽(precollagen type Ⅰ N-terminal propeptide,PINP)和骨钙素等,可反映成骨细胞活性及骨形成能力;骨吸收标志物有Ⅰ型胶原氨基末端肽(N-telopeptide of type Ⅰ collagen,NTX)、Ⅰ型胶原羧基末端肽(C-terminal telopeptide of type Ⅰ collagen,CTX)和吡啶啉交联肽等,可反映破骨细胞的活性及骨吸收水平。在双膦酸盐或者地舒单抗等治疗骨丢失时,可以应用骨转换指标监测治疗反应[22]。有条件的医院,可以对生化标志物进行监测[21]。
4.骨丢失和骨质疏松的风险分级:根据BMD、FRAX工具和临床因素,CTIBL导致骨折的风险分级见表1。

肿瘤治疗引起的骨丢失(CTIBL)导致骨折的风险分级
肿瘤治疗引起的骨丢失(CTIBL)导致骨折的风险分级
| 风险分级 | 风险分级影响因素 |
|---|---|
| 低危 | T值≥-1.0且无计划或未使用芳香化酶抑制剂(AI)治疗 |
| 中危 | (1)T值≥-1.0且计划或正在使用AI治疗。(2)-2.5<T值<-1.0且无计划或未使用AI治疗。满足以上2条中任一条即可判定 |
| 高危 | (1)髋部或椎体脆性骨折。(2)DXA测定中轴骨骨密度或桡骨远端1/3骨密度T值≤-2.5。(3)骨密度测量符合骨量减少(骨密度-2.5<T值<-1.0),且具备以下高危因素之一:①计划或正在使用AI治疗;②肱骨近端、骨盆或前臂远端脆性骨折FRAX®计算未来10年髋部骨折风险≥3%,或任何主要骨质疏松性骨折发生风险≥20%。满足以上3条中任一条即可判定 |
注:DXA为双能X线吸收法;FRAX为WHO骨折风险评估工具
1.预防和治疗策略:(1)低危患者:建议改善生活方式、补充钙剂和维生素D。(2)中危患者:建议改善生活方式、补充钙剂和维生素D,考虑使用骨改良药物。(3)高危患者:建议改善生活方式、补充钙剂和维生素D,同时使用骨改良药物。早期乳腺癌CTIBL的预防和治疗临床推荐路径见图1。
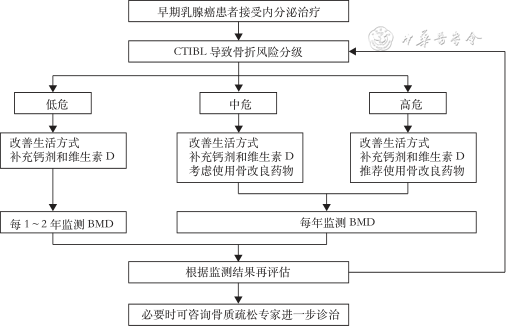

注:CTIBL为肿瘤治疗引起的骨丢失;BMD为骨密度
2.预防和治疗的具体内容:(1)改善生活方式:所有患者均应改善生活方式,生活方式的干预是早期乳腺癌患者防治CTIBL的基础[21,23]。①调整饮食结构:建议摄入含钙丰富的食物,增加多种蔬菜、水果摄入,选择全谷物或高纤维食物,每周至少食用两次鱼,限制反式不饱和脂肪酸、饱和脂肪酸、酒精、胆固醇和糖的摄入,避免过量饮用咖啡和碳酸饮料;②运动:每周至少坚持150 min中等强度的有氧运动,如慢跑、走路、游泳、骑车、跳舞等,绝经后女性应每周至少进行两次肌肉张力锻炼,但要注意防止跌倒和身体撞击[21]。可增加光照以促进体内维生素D的合成;③减重或保持体重:通过运动、控制饮食和行为训练维持或减轻体重,保持体质指数(body mass index,BMI)≥20 kg/m2且≤24 kg/m2,且腰围<80 cm;④戒烟戒酒:因为抽烟会增加骨质疏松的风险,酒精的摄入也会影响患者的BMD。鼓励患者不吸烟、避免吸二手烟、戒酒。
(2)补充钙与维生素D:①钙剂:充足的钙有助于减少骨丢失、促进骨矿化、维护骨骼健康。国际骨质疏松基金会建议绝经后女性每天摄入元素钙1 300 mg[24]。中国居民膳食营养素参考摄入量建议:50岁以上中老年推荐每日元素钙摄入量为1 000~1 200 mg,可耐受的最高摄入量为2 000 mg。营养调查显示我国居民每日膳食约摄入元素钙400 mg,故尚需补充元素钙500~600 mg/d。常选择的钙剂为碳酸钙和枸橼酸钙。碳酸钙含钙量高,吸收率好,溶于胃酸,常见不良反应为上腹不适、便秘、高钙血症、高钙尿症等。枸橼酸钙含钙量相对较低,水溶性好,溶解不依赖于胃酸,胃肠道刺激小,不易形成肾结石,适用于胃酸缺乏和有肾结石风险的患者。补钙需适量,避免超大剂量补钙增加肾结石和心血管疾病的风险。高钙血症和高钙尿症时应避免使用钙剂。在CTIBL防治中,钙剂应与其他药物联合使用[25];②维生素D:维生素D可以促进钙的吸收,有助于维持骨骼健康、保持肌力、改善平衡能力、降低骨折风险。维生素D缺乏或不足者可尝试每日口服维生素D31 000~2 000 U,以维持血清25羟维生素D水平在30 μg/L以上[26]。使用活性维生素D或其类似物并不能纠正维生素D缺乏或不足;不建议单次口服超大剂量普通维生素D作为补充[18]。
(3)骨改良药物:①作用机制:骨改良药物包括双膦酸盐和地舒单抗。双膦酸盐通过结合骨骼中的羟基磷灰石,抑制破骨细胞介导的骨吸收,减少骨丢失,加强BMD[25]。不同的双膦酸盐对BMD和骨吸收的改善以及对骨折的预防力度均有不同[23]。地舒单抗是一种完全人源化单克隆抗体(免疫球蛋白G2单抗),能特异性地与靶向核因子-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)相结合,通过干扰RANKL蛋白活化,阻断RANK与RANKL之间的相互作用,通过抑制破骨细胞前体向破骨细胞转化,从而抑制破骨细胞形成、功能和存活,降低骨吸收,增加BMD和骨强度[27];②药物及用法:双膦酸盐有口服制剂和静脉制剂。口服制剂包括阿仑膦酸钠、利塞膦酸钠等,服用时对饮食和体位都具有严格要求,依从性较低,70%的患者在第1年就中断了治疗[28, 29],而中断治疗会影响药物疗效,骨折发生率显著高于坚持用药的患者[30]。故口服双膦酸盐治疗需关注患者依从性,不能坚持服药者应及时调整药物,改为静脉或皮下用药。静脉制剂为唑来膦酸和伊班膦酸,其中唑来膦酸最为常用[31]。地舒单抗只有皮下注射一种剂型。常用的骨改良药物及用法见表2;③用药时长:应根据患者的辅助内分泌治疗时长和绝对骨折风险综合判断。如辅助内分泌治疗计划为5年,在可能的情况下可持续治疗至AI结束[32, 33]。对于辅助内分泌治疗超过5年的患者,需要对骨折风险与长期治疗的潜在不良反应进行个体化风险-效益评估。如骨折风险仍高,则治疗可适当延长[18,34]。

预防和治疗早期乳腺癌CTIBL的常用骨改良药物
预防和治疗早期乳腺癌CTIBL的常用骨改良药物
| 药品名称 | 用法用量 |
|---|---|
| 阿仑膦酸钠 | 70 mg/片,每周1片,口服,清晨空腹服用,服药后30 min内保持直立体位,避免平卧,30 min后再摄入其他食物和药物 |
| 利塞膦酸钠 | 35 mg/片,每周1片;5 mg/片,每次1片,每日1次,口服,服用方法同阿仑膦酸钠 |
| 伊班膦酸钠 | (1)片剂:150 mg/片,每月1 片,口服,服用方法同阿仑膦酸钠;(2)注射剂:2 mg静脉滴注,每3个月1次 |
| 唑来膦酸 | 4 mg静脉滴注,每6个月1次;亦可考虑5 mg静脉滴注,每年1次 |
| 地舒单抗 | 60 mg皮下注射,每6个月1次 |
注:CTIBL为肿瘤治疗引起的骨丢失
1.BMD和骨生化标志物的监测:在开始OFS或AI治疗前,应常规检测BMD。对于仅需补充钙剂和维生素D的患者,可以每1~2年评估危险因素及BMD;对于应用骨改良药物的患者,应该每年评估BMD,甚至可以酌情提高BMD监测频率,每6~12个月进行检测[35]。此外,骨生化标志物的变化明显早于BMD,如条件允许,可以在治疗前检测骨生化标志物的基线水平,并在治疗过程中每隔3~6个月复查,动态了解其变化,辅助判断药物疗效及患者治疗的依从性[18]。
2.OFS患者的处理:绝经前女性如果因接受化疗或卵巢去势治疗,导致OFS,骨丢失会在OFS的6个月后出现并且在12个月之后加快[11]。TEXT-SOFT研究显示,绝经前卵巢抑制联合他莫昔芬或AI均观察到骨质疏松和骨折,二者发生率在联合AI组和联合他莫昔芬组之间差异无统计学意义[36]。因此,对于接受卵巢抑制的患者,应评估BMD和风险因素,符合要求者应给予骨改良药物治疗。
3. 地舒单抗停药后的反弹性骨吸收增加:有数据显示,地舒单抗停药后,BMD迅速下降,椎体骨折发生率较未用药组增加,原因可能是因为停药后骨吸收反弹性增加[37]。因此,在停用地舒单抗后,应序贯双膦酸盐或其他药物,以防止BMD下降或骨折风险增加[20]。
4.内分泌药物选择:内分泌治疗的药物选择上,建议选择对骨安全影响较小的内分泌药物,以降低骨安全问题的发生。选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)对骨丢失的影响小于AI,故而这一类药物如三苯氧胺、托瑞米芬是可选用的药物。而在AI类药物中,甾体类AI(依西美坦)具有独特的雄激素样结构,较非甾体类AI(阿那曲唑和来曲唑)对骨安全的影响较小,且在接受双膦酸盐治疗后,BMD上升较快[38, 39],亦可选择。因此,高危患者如需更换内分泌治疗的药物,SERM类药物或甾体类AI均可考虑。
早期乳腺癌的预后总体较好,5年生存率可达83.2%,但晚期乳腺癌的预后相对较差,5年生存率仅20%[40]。骨是乳腺癌患者最常见的转移部位[41]。一项纳入7 000多例早期乳腺癌患者的观察研究发现,经过8.4年的随访后有22%的患者出现了骨转移[42]。早期乳腺癌患者发生骨转移后生存期及5年生存率会明显下降[43]。而骨改良药物用于早期乳腺癌患者术后辅助治疗,能够帮助预防骨转移、降低复发风险,甚至在一定程度上带来生存获益,因而受到了关注。
早期乳腺癌辅助治疗中应用双膦酸盐预防骨转移、改善生存获益临床推荐路径见图2。
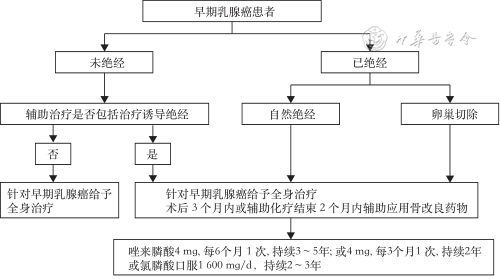

1.作用机制:肿瘤细胞产生细胞因子和生长因子,刺激破骨细胞生成,诱导骨吸收增加和骨基质释放生长因子。骨基质释放生长因子刺激肿瘤细胞的增殖、迁移和血管生成,而骨改良药物可以通过抑制破骨细胞生成和骨吸收来打破这种恶性循环[44]。除了对破骨细胞和骨微环境的作用之外,基础研究还提示骨改良药物具有一定的抗肿瘤活性。如唑来膦酸能够使甲羟戊酸代谢产物(IPP/ApppI)在细胞内蓄积,激活Vγ9Vδ2T细胞,通过分泌γ-干扰素和穿孔素杀伤肿瘤细胞[45];此外,唑来膦酸还可通过降低肿瘤微血管密度,发挥抗肿瘤作用[46]。
2.骨改良药物预防早期乳腺癌骨转移、改善生存获益:双膦酸盐为早期乳腺癌带来的预防骨转移及生存获益,主要集中于绝经后和绝经前接受OFS治疗的患者。早期乳腺癌试验协作组(Early Breast Cancer Trialists′Collaborative Group,EBCTCG)开展了一项关于双膦酸盐辅助治疗早期乳腺癌的荟萃分析[47],共入组18 766例患者,使用唑来膦酸的患者9 290例、伊班膦酸3 072例,双膦酸盐中位治疗时长3.4年。结果发现几乎所有的获益都集中在绝经后或药物诱导绝经的患者,辅助应用双膦酸盐可以显著降低这部分患者的骨转移发生率(P<0.001)和乳腺癌死亡率(P=0.002)。
地舒单抗在早期乳腺癌预防骨转移和改善生存方面的疗效存在一定争议。ABCSG-18研究显示,对于早期激素受体(hormone receptor,HR)+乳腺癌,与安慰剂相比,地舒单抗可改善无病生存期(DFS)(P=0.02),对无骨转移生存(bone metastasis-free survival,BMFS)有改善趋势(P=0.05),但两组总生存率差异无统计学意义(P=0.06)[48]。在另外一项大型Ⅲ期随机对照研究D-CARE研究中,使用了更高剂量的地舒单抗和更高的用药频率,地舒单抗组和安慰剂对照组之间BMFS(P=0.70)和DFS(P=0.57)差异均无统计学意义[49]。
双膦酸盐及地舒单抗辅助治疗早期乳腺癌的临床研究见附录1(扫描本文首页二维码可查阅)[15,49,52, 53, 54, 55, 56, 57]。
3.用药推荐:(1)使用人群:所有绝经后(自然绝经或治疗诱导绝经)的原发乳腺癌患者,无论HR和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的状态如何,都应考虑辅助应用双膦酸盐的获益[50]。最终的应用应综合分析患者的疾病特征、复发风险、预期寿命、药物不良反应、患者偏好等因素,权衡潜在的获益和风险后确定。英国国家医疗服务体系(National Health Service)的PREDICT工具(https://breast.predict.nhs.uk/)能够评估辅助应用双膦酸盐的获益,如辅助应用双膦酸盐后死亡率的降低情况,帮助共同制定治疗决策[50, 51];(2)使用时机:建议尽早开始双膦酸盐治疗,即在术后3个月内或辅助化疗结束2个月内开始使用双膦酸盐;(3)药物选择及推荐用法用量:①唑来膦酸:4 mg,每6个月1次,持续3~5年;或4 mg,每3个月1次,持续2年;②氯膦酸口服:1 600 mg/d,持续2~3年。在药物选择方面,唑来膦酸的临床证据最为充分,因不良反应而中止治疗的人数少于口服制剂[52],故而是首选用药。氯膦酸作为口服制剂亦可作为选择[47,52]。主要注意的是,部分患者可能同时接受辅助双膦酸盐和防治CTIBL的治疗,如二者用药有冲突,以用药频率高、持续时间长的治疗为准;(4)骨改良药物辅助治疗早期乳腺癌的临床应用情况:2023年圣加仑(St.Gallen)国际乳腺癌会议上,80%专家支持在绝经后全体或有选择的部分人群中使用双膦酸盐,但仅有42.6%在临床实践中常规使用双膦酸盐[58]。而在2023年中华乳腺肿瘤论坛上,76%的专家支持在早期乳腺癌患者辅助治疗中使用骨改良药物,76%的专家首选的骨改良药物是唑来膦酸或其他双膦酸盐。虽然众多指南和专家共识声明都认为在绝经后的早期乳腺癌患者中应使用辅助双膦酸盐治疗[3,20,50,58, 59, 60],但临床实践中双膦酸盐的使用率仍比较低。临床医师可权衡患者使用双膦酸盐辅助治疗的利弊,并与患者进行充分沟通,制定临床治疗决策。
骨骼、尤其是中轴骨,是乳腺癌最常见和最早发生的转移部位[61, 62, 63]。新诊断为晚期乳腺癌的患者中50%有骨转移[52],而在全部晚期乳腺癌患者中,骨转移的发生率高达75%[64],且Luminal 型乳腺癌较其他亚型更易发生骨转移[65]。骨转移一旦发生,将会影响到患者的生存。即便是对于仅有骨转移的患者,报道的中位生存期依然不容乐观,为26个月~4年[66, 67]。乳腺癌骨转移一旦发生,最常见的并发症为SREs,不仅会降低患者的生活质量,而且影响患者的长期生存[20]。有研究对35 912例乳腺癌患者随访了8年,发现乳腺癌骨转移患者发生SREs后,生存期较没有发生SREs的患者显著缩短[68]。因此,早期诊断和治疗骨转移,降低或延缓SREs的发生,对患者的生存和生活质量都具有重要价值。
乳腺癌骨转移在临床上主要以单发或多发的溶骨性病变为主,15%~20%的患者以成骨性病变为主,还有少部分患者为成骨溶骨混合性病变[48]。随着骨转移的发生,往往会出现SREs。SREs是指骨痛、病理性骨折、椎体塌陷、脊髓压迫以及高钙血症等,也包括为了预防和治疗SREs而进行的骨放疗和骨手术。丹麦一项研究显示,SREs的发生率在首次诊断骨转移的第1年最高,可高达38.5%[69];韩国一项为期12年的队列研究显示,乳腺癌患者SREs的累积发生率为47%[70]。
骨痛是最常见的SREs,可见于80%的骨转移患者[65,71]。高钙血症是最致命的SREs,并与预后不良相关,溶骨性病变有10%~30%患者会发生高钙血症[72]。严重的高钙血症会导致患者出现身体不适、恶心、嗜睡、肌肉无力、心血管和肾功能障碍、意识混乱和昏迷[73, 74]。病理性骨折发生率为17%~50%,出现相对较晚,可导致疼痛、畸形、行动不便、瘫痪和死亡[74]。10%的患者会因脊柱结构不稳导致脊髓压迫[75],严重时可导致运动和感觉功能障碍、失禁、神经根疼痛和瘫痪[76]。
早期诊断对于乳腺癌分期、SREs的预防和治疗都很重要,有助减少和缓解SREs对患者的不良影响。当患者出现以下情况时,需怀疑是否出现骨转移:(1)骨痛或骨折;(2)脊髓或神经受压症状;(3)血碱性磷酸酶升高;(4)高钙血症[76]。乳腺癌骨转移的诊断需要结合病史、症状、体征、实验室检查等共同判断,影像学检查是主要的诊断手段,必要时可以进行骨活检。
骨扫描是筛查骨转移最常用的检测方法,优点是可以对全身骨骼进行扫描,明确骨转移灶的部位和转移灶数量,灵敏度比较高,缺点是特异性较低[77]。推荐进行锝-99m(99mTc)-亚甲基二磷酸盐(methylenediphos-phonate,MDP)放射性核素显像检查。99mTc-MDP亲骨性极强,因而对成骨性病变更为敏感,而对溶骨性病变特异性较低,易发生误诊和漏诊,造成假阴性[78]。另外,骨扫描对良性病变如退变、骨折等也会显影,可能造成假阳性。因此,骨扫描一般用于诊断广泛、多灶病变,对于可疑或单灶热点,需要结合X线平片、CT或MRI进一步确诊[78]。此外,对于一些治疗有效的患者,在头3个月内因为在修复过程中形成新骨,对于示踪剂的吸收增加(闪烁反应),骨扫描会显示活性增加或出现新的病变,治疗6个月后,由于未成熟的新骨的增加停止,闪烁反应下降,骨扫描的表现才会显示改善,因此不建议使用骨扫描评估溶骨性病变的治疗反应[20,78]。
X线是出现疼痛、疑似病理性骨折的首选检查方案,还可以帮助判断肿瘤属于溶骨性、成骨性还是混合性病变。其优势在于速度快,成本低,但对于早期骨转移X线灵敏度很低。对于溶骨性病变,需要直径>1 cm且病变部位骨矿物质含量损失达到50%以上才有可能识别;对于单纯成骨性病变则更难评估[20]。
CT是确定骨病变大小和评估骨皮质受累范围较好的检测方法,敏感性优于X线。CT一般不作为骨转移的系统筛查。使用CT检测时,骨转移瘤的大小必须至少为1 cm,BMD损失5%~50%[71]。另外,CT对肋骨的评估较为准确,还可在骨破坏变得明显之前检测到骨髓转移。增强CT扫描还可清晰显示骨转移瘤的血供情况及其与临近血管、神经的关系,判断脊柱的转移瘤是否突入椎管。CT非常适合用于活检定位,但不适合全身扫描以进行骨转移筛查[20]。目前CT是临床常用的疗效评估方法,但其不能区分病变部位的代谢情况,亦存在一定局限性。
MRI对于骨转移的检测具有较高的敏感性和特异性,能够准确地显示病灶侵犯部位、范围及周围软组织侵犯情况,对于脊柱转移的检测较骨扫描更敏感,可用于评估脊髓完整性和最终压迫状态[20,71]。此外,MRI还可以在成骨性病变发展之前检测到骨髓受累,且分辨率高于CT,是评价乳腺癌骨转移骨髓内浸润的首选工具[78]。MRI亦可用于骨转移疗效评估。因MRI费用较高,不适合用于骨转移的筛查[78]。
PET-CT是一种很好的检测骨转移的方法,检测精度高于CT和骨扫描,具有很高的敏感性和特异性[71,78]。不同的放射性示踪剂对于骨转移的检测优势有所不同,18F-脱氧葡萄糖(18F-fluorodeoxy glucose,18F-FDG)PET-CT应用最为广泛,对于溶骨性骨转移的显影具有更高的敏感度和特异度;18F-NaF PET-CT最为准确,对于成骨性转移更为敏感,但价格昂贵,不能广泛使用[79]。FDG-PET-CT可以准确区分进行性骨质硬化,通过对治疗前、治疗中和治疗后的FDG摄取量的定量评估,反映肿瘤的进展或对治疗的反应,是评估高代谢骨转移瘤治疗反应的最准确方法[28]。
病理学是诊断乳腺癌骨转移的金标准,但不是所有的骨转移瘤患者均需要骨穿刺活检。对于单纯骨受累,特别是当病变较少或影像学检查不明确时,可对转移性疾病进行组织学确认[28]。穿刺活检的优势在于明确转移、提供转移灶的分子分型,以指导后续治疗。
骨生化标志物可反映骨吸收和骨形成的速度,提示骨转移过程中骨破坏和修复程度。常见的骨生化标志物中,反映溶骨代谢水平的标志物包括CTX、交联C端肽(ICTP)、血清端肽(NTx)等;反应成骨性代谢水平的标志物包括BALP等。骨生化标志物水平升高可能提示骨转移,但敏感性和特异性都很低,不建议用于骨转移的诊断[80]。
乳腺癌骨转移需要采用多学科共同协作(multiple disciplinary treatment,MDT)的模式,在肿瘤内科、放疗科、骨科、整形外科医师等多学科专家的指导下,为患者制定合理、个体化的治疗方案。治疗目标为预防或延迟SREs的发生、缓解疼痛、恢复功能、控制肿瘤进展、提高生存质量和尽可能延长患者的生存时间。乳腺癌骨转移诊疗流程见图3。
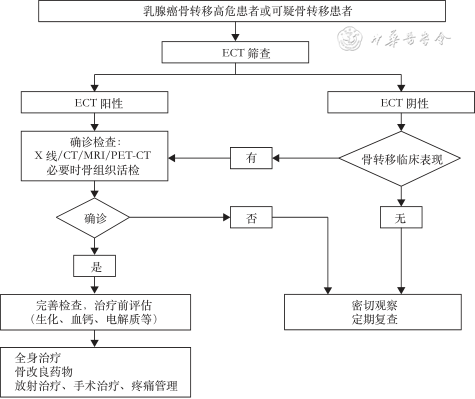

注:ECT为放射性核素骨扫描
治疗过程中应根据治疗周期进行疗效评估。单纯骨转移的疗效评估是基于骨骼的修复和破坏而不是肿瘤体积的变化,需要结合患者的临床表现、影像学检查综合评估。骨转移的愈合过程缓慢,治疗3~6个月后才开始出现,一年多才能成熟[28]。如果患者骨痛症状减轻,影像学检查提示骨内病变边界清晰化、密度增高,软组织包块体积缩小,肿瘤中心出现液化坏死,ECT或PET-CT提示肿瘤摄取减少等,均提示肿瘤治疗可能有效[81]。
乳腺癌骨转移属于晚期全身性疾病,治疗首先以全身治疗为主。具体治疗策略需要根据患者的原发灶分子分型、复发转移特征以及转移灶穿刺后的分子分型情况,选择有效的抗肿瘤治疗。内分泌药物联合CDK4/6抑制剂成为大多数HR阳性晚期乳腺癌患者一、二线治疗的标准选择;而化疗是无进展间期短、疾病进展迅速、合并内脏危象或多线内分泌治疗失败乳腺癌患者的主要选择。对于晚期HER2阳性乳腺癌患者,抗HER2靶向治疗是重要的治疗手段之一。对于HER2低表达的患者,除常规治疗外,抗体-药物偶联药也是很好的治疗选择。对于三阴性乳腺癌,除化疗外,靶向药物、抗体-药物偶联药、免疫检查点抑制剂亦可作为选择。
骨改良药物能够减少骨转移患者SREs的发生,是乳腺癌骨转移的基础用药。骨改良药物包括双膦酸盐和地舒单抗。
1.双膦酸盐:双膦酸盐能够有效推迟SREs的发生时间(3~6个月)、降低SREs发生率(30%~40%)、改善骨痛(50%),同时是恶性高钙血症有效治疗方法[82],但不能改善骨转移患者的生存[83]。目前双膦酸盐的药物已有3代。(1)第1代双膦酸盐:以氯膦酸二钠为代表,氯膦酸二钠目前有静脉、口服两种制剂可供选择。用量和用法:口服制剂1 600 mg/d;也可以先给予氯膦酸二钠静脉制剂400 mg/d,静脉滴注>2 h,连用3 d,而后口服氯膦酸二钠1 600 mg/d,每3~4周给药1次;(2)第2代双膦酸盐:以帕米膦酸二钠为代表,药物抑制骨吸收的体外活性作用强于第一代药物。用量和用法:帕米膦酸二钠60~90 mg,静脉滴注>2 h,每3~4周给药1次;(3)第3代双膦酸盐:主要包括唑来膦酸、伊班膦酸和因卡膦酸,作用强度和疗效比第二代进一步提高。用量和用法:唑来膦酸盐4 mg,静脉滴注>15 min,;伊班膦酸盐6 mg,静脉滴注>2 h;因卡膦酸一般剂量为10 mg,65周岁以上患者推荐剂量为5 mg,静脉滴注>2 h。上述药物每3~4周给药1次。
2.地舒单抗:地舒单抗能够有效延缓乳腺癌骨转移患者SREs的发生时间,降低SREs的发生风险23%[84],并推迟中重度疼痛的发生[85]。Ⅲ期随机对照研究及荟萃分析显示其疗效优于唑来膦酸,患者生活质量亦优于唑来膦酸[71,83, 84]。此外,地舒单抗不经过肾脏代谢及排泄,对于存在肾功能不全或联合应用铂类等肾毒性药物的患者来说,地舒单抗是更好的选择。用量和用法:120 mg皮下注射,每4周1次。
3.用药开始时机:对于预期生存≥3个月的患者,建议在出现骨转移影像学表现时即开始用药,无论是否有症状[86, 87]。可以在乳腺癌骨转移全身系统性治疗基础上加用骨改良药物每月1次。
4.给药间隔的调整:骨改良药物用于晚期患者骨转移治疗的剂量和用法与早期防治骨质疏松的剂量和用法有所不同。建议唑来膦酸等双膦酸盐常规每3~4周给药1次。荟萃分析显示,唑来膦酸每12周给药1次疗效并不劣于每4周给药1次,但12周给药组中有更多患者接受骨手术[88]。因此对于病情稳定者,唑来膦酸连用12次后可以酌情考虑每12周注射1次。地舒单抗每4周给药1次,不宜间断治疗,因其并不储存于骨中,间断治疗可能存在风险[20]。
5.用药时长:推荐2年以上,长期用药酌情延长间隔时间。双膦酸盐治疗骨转移的中位时间为 9~18 个月,目前临床研究缺乏超过用药2年的数据,但这不应该成为临床治疗中延长用药的禁忌[89]。即使在应用骨改良药物治疗过程中发生SREs,仍建议继续用药,并根据患者获益情况考虑是否长期用药[90]。骨痛缓解并不是停药指征。如在用药过程中出现明确药物严重不良反应或临床医师认为继续用药患者不能获益时,应停止使用或换用另一个骨改良药物。
6.注意事项:(1)骨改良药物可以与放疗、化疗、内分泌治疗、止痛药联合使用;(2)双膦酸盐停药后换用地舒单抗建议间隔时间为4周;(3)如果地舒单抗停用超过6个月,建议进行双膦酸盐治疗(如唑来膦酸)续贯治疗,以抑制反弹性骨吸收增加[20];(4)从安全角度考虑,不推荐双膦酸盐和地舒单抗联合使用;(5)对骨吸收的抑制可能引起低钙血症,这在使用地舒单抗时最为明显[20]。
1.体外放射治疗:姑息性放射治疗是乳腺癌骨转移姑息性治疗的有效治疗方法,治疗目标是减轻疼痛、骨骼再钙化和稳定、减少脊髓压迫和缓解神经症状、预防功能障碍和SREs等[91]。此外,对于承重骨无症状者亦可预防性照射,以减少SREs的发生。同时,局部放疗还可以进一步巩固长期生存的寡转移患者的全身治疗效果。缓解疼痛是放疗最常见的适应证。放疗对疼痛的缓解率较高,疼痛缓解不佳、疼痛不缓解或者疼痛复发可考虑再次放疗[20,92, 93]。如为骨骼再钙化和骨稳定,放疗联合骨改良药物效果更优,80%的患者都可以达到治疗目的[92]。对于出现脊髓压迫的患者,应作为急症立即给予治疗,并由外科和放疗科医师联合评估,制定手术和放疗方案。不适合手术患者可单独接受放疗[20,92]。常用的放疗技术包括三维适形放疗、调强放疗、立体定向放疗(stereotactic body radiotherapy,SBRT)[94]。
2.放射性核素治疗:放射性核素治疗主要用于全身性骨转移的疼痛控制,尤其是难治性骨痛的治疗,常用于成骨性病变。如果患者在解剖区域内有多个疼痛的成骨细胞转移部位,且该部位大于外照射可安全治疗的部位,可考虑给予放射性核素治疗[95]。89Sr是乳腺癌骨转移内照射放射治疗中最常用的核素药物[96]。由于部分患者放射性核素治疗后会出现明显的骨髓抑制且恢复较慢,影响化疗等后续全身治疗,故放射性核素治疗应严格掌握适应证,不做优先选择。
外科手术是骨转移有症状患者很重要的缓解措施。手术的作用包括:(1)预防性固定以防止即将发生的病理性骨折;(2)病理性骨折的稳定;(3)肿瘤的节段切除;(4)置换被肿瘤破坏的关节[97]。通过手术,能够帮助保存或恢复骨骼的完整性和肢体功能,预防或消除神经系统损害,从而改善患者生活质量[98, 99]。手术前需要骨科、肿瘤内科、放疗科进行多学科评估,确定患者是否适合手术,并根据患者的肿瘤特征、存在的转移瘤数量及其解剖位置、预期寿命、患者期望值和活动水平等因素,选择最佳的外科治疗方法[100]。
在骨折发生前进行预防性内固定具有最佳的功能恢复效果[100],因而是首选。这需要对手术时机和手术方式进行有效判断,争取在骨折前、截瘫前进行处理,从而使患者免受不必要的痛苦[101]。可以预测骨折的风险因素有:存在严重疼痛、病变长度超过2.5 cm、超过50%的皮质骨破坏、Harington标准和Mirel标准[100,102, 103, 104]。
骨转移骨折可发生在长骨、椎体和骨盆,治疗方式因位置而异,髓心钉、头髓钉、半关节成形术或使用假体的全关节置换术、骨成形术是主要的选择[105]。四肢病理性骨折对患者的功能活动能力有显著影响,建议对四肢长骨即将发生和已经发生的病理性骨折进行手术治疗[99,106]。脊柱和骨盆是受转移影响最常见的部位之一[100]。脊柱病理性骨折的治疗需要考虑神经损伤的程度和特征、患者的整体状况和预期的肿瘤结局。有严重但不完全神经功能缺损的患者、最近出现症状的患者和预后良好的患者最有可能从手术中受益[106]。骨盆转移瘤的手术因其复杂的骨骼解剖结构和邻近的重要结构,具有一定的挑战性,需外科医师根据骨盆的区域和骨折类型选择恰当的手术方式[97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107]。
对于疼痛的治疗也是改善乳腺癌骨转移患者生活质量的重要全身治疗。针对骨转移疼痛的治疗,要遵循癌症三阶梯止痛治疗指导原则和《国家癌症疼痛诊疗规范(2018年版)》指导原则,遵循口服给药、按阶梯给药、按时给药、个体化给药和注意具体细节五大基本原则。
疼痛治疗首先要对疼痛程度进行评估,通常应用数字分级法(numerical rating scale,NRS)、面部表情评估量表法及主诉疼痛程度分级法(verbal rating scales,VRS)3种方法。按照三阶梯原则选择用药,并根据疼痛缓解情况调整药物及剂量,并关注药物不良反应。
1.非甾体类抗炎药物和对乙酰氨基酚:是止痛治疗的首选基础用药,常见的有阿司匹林、布洛芬。常用于缓解轻度疼痛,或与阿片类药物联合缓解中、重度疼痛。FDA建议患者每日对乙酰氨基酚用量最多4 g。
2.阿片类药物:是中、重度癌痛治疗的首选药物,推荐选择阿片受体激动剂类药物。长期用药时,首选口服给药途径,有明确指征时可选用透皮吸收途径给药,也可临时皮下注射用药,必要时可以自控镇痛给药。解救剂量为前24 h用药总量的10%~20%。每日短效阿片解救用药次数≥3次时,应考虑将前24 h解救用药换算成长效阿片类按时给药。
使用双膦酸盐类药物、地舒单抗或抗血管生成药物(如舒尼替尼)引起的颌骨坏死被统称为MRONJ[108]。目前MRONJ的发病机制还未完全阐明,可能与颌骨部位骨代谢旺盛及口腔特殊环境有关。使用骨改良药物是MRONJ的发生危险因素之一,其机制可能与破骨细胞活性抑制、口腔局部感染或创伤有关,发生风险和使用药物的时长相关[109, 110]。研究显示,按照每月1次的治疗方案,双膦酸盐和地舒单抗MRONJ的发生率类似,约每年1%[111]。
骨改良药物研究中报道的MRONJ病例,多数为无症状或轻中度患者,且超过50%的病例均可通过口腔冲洗或抗生素治疗缓解[111]。美国口腔颌面外科医师协会(American Association of Oral and Maxillofacial Surgeons,AAOMS)曾对MRONJ的分期标准和治疗策略进行推荐[112, 113],关于颌骨坏死的诊疗建议详见表3。若使用骨改良药物后发生MRONJ,建议停用并请颌面外科医师进行诊疗,早期可采用保守或小范围的手术进行治疗,但在临床诊疗过程中,分期偏晚MRONJ的可考虑下颌骨节段性截骨或者上颌骨部分切除等手术治疗。

MRONJ的分期和诊疗策略推荐-AAOMS 2014-2022
MRONJ的分期和诊疗策略推荐-AAOMS 2014-2022
| 临床分期 | 分期标准 | 治疗策略 | 治疗后观察 |
|---|---|---|---|
| 风险期 | 无明显症状的接受抗骨吸收治疗的患者 | 患者教育 | |
| 0期 | 临床无骨坏死征象,影像学检查提示颌骨病变,可伴非特异性临床症状 | 对症治疗,包括止痛药和抗生素的使用 | |
| 1期 | 骨坏死或暴露,或深达骨面的瘘管,无感染表现(此期可持续数月至数年不等) | (1)对骨暴露进行局部护理;含抗菌含漱液;(2)去除游离死骨;(3)对于位于神经血管上方的下颌病变可行边缘性切除;对于窦底下方的上颌病变可行牙槽突切除术 | (1)疾病缓解后可停止治疗;(2)疾病稳定可继续当前的非手术治疗;(3)疾病进展后重新评估,根据进展后的疾病分期选择相应的治疗方式 |
| 2期 | 骨坏死或暴露、深达骨面的瘘管,有感染表现,如疼痛、病损部位红肿、伴或不伴溢脓 | (1)对骨暴露进行局部护理;含抗菌含漱液;(2)去除游离死骨;(3)全身抗生素治疗;(4)疼痛控制;(5)对于萎缩或无牙颌的下颌骨,如果病变累及神经管或其下方,可行下颌骨节段性截骨术;(6)位于上颌窦底或其上的病变,可行上颌骨部分切除术 | (1)疾病缓解后可停止治疗;(2)疾病稳定或降至1期,可继续当前的非手术治疗;(3)疾病进展后重新评估,根据进展后的疾病分期选择相应的治疗方式 |
| 3期 | 骨坏死或暴露,或深达骨面的瘘管,有感染。疼痛并至少伴有以下1种表现:病损范围超过牙槽骨区域(如下颌骨下缘和升支、上颌窦和颧骨)导致病理性骨质/口外瘘管/口腔上颌窦或口鼻贯通/下颌骨下缘或鼻旁窦底部骨质溶解破坏 | (1)对骨暴露进行局部护理;含抗菌含漱液;(2)去除游离死骨;(3)全身抗生素治疗;(4)疼痛控制;(5)下颌骨节段性截骨术;(6)上颌骨部分切除或全切术 | (1)疾病缓解后可停止治疗;(2)疾病稳定可继续当前的非手术治疗;(3)如果进展可考虑手术治疗 |
注:MRONJ为药物相关性颌骨坏死;AAOMS为美国口腔颌面外科医师协会
通过预防手段可有效降低MRONJ的发生率,预防措施包括患者教育、用药前牙科检查、预防性牙科治疗、避免用药过程中的创伤性牙科手术[114]。建议患者在骨改良药物治疗前完成牙周基础治疗、牙体治疗以及拔除不能保留的牙齿等口腔操作,拔牙后应等待至少4~6周,待骨质基本愈合后再行给药[115, 116]。在应用骨改良药物过程中,建议患者做好自身的口腔护理,定期牙科随访,每6个月1次。MDT成员应尽早处理导致MRONJ的风险因素,包括口腔健康状况差、创伤性牙科手术、不合适义齿、控制不佳的糖尿病和吸烟[117]。在肿瘤相关治疗中如需进行患牙治疗,宜采取以去除感染灶为目的非创伤性牙科治疗(如牙体充填、根管治疗)。另外强烈建议定期进行非创伤性的牙周治疗。如果患者需要接受拔牙或其他创伤性牙科手术,应考虑暂停骨改良药物的使用,拔牙时采用微创拔牙技术并使软组织充分封闭拔牙窝等。术后牙科专家应每6~8周对患者进行评估,直到手术部位完全覆盖黏膜,并使用抗菌漱口水和全身性抗生素以将MRONJ的风险下降至最低[109,116, 117]。骨改良药物停药后仍可能发生颌骨坏死,治疗结束后仍应对口腔进行定期随访[116,118]。
由于骨改良药物对破骨细胞的抑制作用,治疗时有可能发生低钙血症。低钙血症为在血浆蛋白浓度正常情况下血浆总钙浓度<8.8 mg/dl(<2.20 mmol/L),或血浆钙离子浓度<4.7 mg/dl(<1.17 mmol/L)。低钙血症常见的临床表现包括感觉异常、手足搐搦,严重时可有癫痫、脑病和心力衰竭。根据文献资料的数据显示,骨改良药物导致的低钙血症发生率差异较大,发生率在1%~39%[119]。此外,临床上治疗实体瘤骨转移引起的高钙血症时,可能会导致低钙血症的发生,这种低钙血症在中国人群的发生率比较低,因此容易被临床医师忽视。
中国人群骨改良药物引起的低钙血症发生率虽然低于国外人群,但仍需重视,治疗过程中应尽早补钙并定期监测血清钙或钙离子含量,避免严重低钙血症的发生。骨改良药物治疗期间尤其是初始治疗阶段,应定期监测电解质水平,定期复查心电图[120]。有研究显示,地舒单抗引起的低钙血症发生率高于唑来膦酸,因此,在地舒单抗治疗期间应密切监测血钙水平,尤其是初始治疗数周内[121]。应用地舒单抗的同时补充钙和维生素D,可显著降低低钙血症的发生率[122]。低钙血症的主要治疗目标为纠正低钙,控制症状,避免严重并发症的发生。因此建议接受骨改良药物治疗的患者(除了出现高钙血症的患者),每天至少补充钙500 mg和维生素D 400 U,并定期监测血清钙或钙离子含量[120,123]。
骨改良药物可直接或间接引起不同程度的肾脏损伤,主要见于双膦酸盐。研究显示,早期患者辅助应用唑来膦酸的药物相关肾不良反应发生率为8.8%,伊班膦酸为10.5%[52]。中国人群中,晚期患者短期(≤24个月)使用唑来膦酸的药物相关肾不良反应发生率为0.7%,长期(>24个月)使用的发生率为1.1%[124]。地舒单抗主要通过细胞溶酶体系统代谢,肾功能对地舒单抗的药代动力学和药效学没有显著影响[125]。
为预防双膦酸盐引起的肾不良反应,使用前应评估患者肾功能和有无肾脏相关基础性疾病,用药过程中定期监测肾功能,及早发现肾脏损伤并尽早予以必要的干预措施。如果连续几次评估无异常可适当延长评估间期。监测指标包括肾小球的滤过率和蛋白尿情况,并用肌酐清除率(80~120 ml/min)来判断肾功能。其他预防措施包括采取适当延长输注时间、避免与有肾不良反应的药物同时使用、必要时调整药物剂量等[126, 127]。
双膦酸盐所致的急性肾损伤通过有效治疗多数可以逆转,少部分患者可能转为慢性肾病[128]。当发生抗肿瘤药物或骨改良药物相关的急性肾损伤时,需调整药物剂量(表4)。对于轻中度肾功能不全患者(肌酐清除率为30~80 ml/min),帕米膦酸无需调整剂量,建议输注时间>4 h;对于严重肾功能不全患者(肌酐清除率<30 ml/min),不推荐给予唑来膦酸或帕米膦酸,伊班膦酸则需要减量至2 mg,输注时间应>1 h[129]。因卡膦酸在肌酐清除率<30 ml/min的患者中需慎用或减量使用并监测肾功能。地舒单抗不经肾脏代谢,当患者出现肾功能下降时,应充分排查其他原因,无需立即调整地舒单抗的使用剂量。若调整用药方案2周后患者仍然存在肌酐清除率下降,且存在持续性蛋白尿或24 h尿蛋白定量>1 g等肾功能相关指标仍未恢复的情况,提示患者已存在一定程度的肾脏损伤,应尽早去肾内科就诊,并进行早期干预。

肾功能不全患者双膦酸盐的剂量调整方案
肾功能不全患者双膦酸盐的剂量调整方案
| 药物名称 | 肌酐清除率(ml/min) | 药物推荐剂量(mg) |
|---|---|---|
| 唑来膦酸 | >60 | 4.0 |
| 50~60 | 3.5 | |
| 40~49 | 3.3 | |
| 30~39 | 3.0 | |
| <30 | - | |
| 帕米膦酸 | >30 | 90.0 |
| <30 | - | |
| 伊班膦酸 | 50~80 | 6.0 |
| 30~50 | 4.0 | |
| <30 | 2.0 | |
| 因卡膦酸 | >30 | 10.0 |
| <30 | 5.0 |
注:-为不推荐使用
乳腺癌骨健康管理涵盖了患者早期和晚期的治疗全程,做好骨健康全周期管理,可为患者带来生存和生活质量的获益,应给予必要的重视。无论是对于CTIBL还是骨转移,早预防、早诊断、早治疗都是最佳治疗决策。而对于乳腺癌辅助应用骨改良药物预防转移、改善预后,还需进一步探索生物标志物预测患者的获益。此外,在骨健康管理的过程中,除了需要根据患者的具体病情制定恰当的治疗策略外,还需注意处理好药物的不良反应,以使治疗顺利进行。当然,在临床治疗过程中,尚存在一些问题,因缺乏循证医学证据,本规范无法一一涵盖,还需临床医师根据患者病情,权衡利弊,制定个体化治疗方案。本规范不具备强制性,不作为医疗事故鉴定和医学责任认定依据。
执笔人:马飞(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院肿瘤内科);施秀青(中国医学科学院肿瘤医院廊坊院区内科)
顾问(按姓氏汉语拼音排序):邱贵兴(中国医学科学院北京协和医院骨科);宋尔卫(中山大学孙逸仙纪念医院乳腺外科);徐兵河(中国医学科学院肿瘤医院内科);Robert E. Coleman(英国谢菲尔德大学肿瘤与代谢学系肿瘤内科)
专家委员会(按姓氏汉语拼音排序):蔡莉(哈尔滨医科大学附属肿瘤医院肿瘤科);曾晓华(重庆市肿瘤医院乳腺肿瘤中心);陈佳艺(上海交通大学附属瑞金医院放疗科);陈前军(广东省中医院乳腺科);陈蓉(中国医学科学院北京协和医院妇科内分泌科);崔久嵬(吉林大学第一医院肿瘤科);丁悦(中山大学孙逸仙纪念医院骨外科);杜彩文(中国医学科学院肿瘤医院深圳医院肿瘤内科);范照青(北京大学肿瘤医院);冯继锋(江苏省肿瘤医院肿瘤科);傅佩芬(浙江大学医学院附属第一医院乳腺外科);葛红(河南省肿瘤医院放疗科);何畏(江苏省人民医院内分泌科);胡夕春(复旦大学附属肿瘤医院肿瘤内科);姜艳(中国医学科学院北京协和医院内分泌科);金锋(中国医科大学附属第一医院乳腺外科);李国辉(中国医学科学院肿瘤医院药剂科);李建一(辽宁省肿瘤医院乳腺外科);李静(中国医学科学院肿瘤医院影像诊断科);李俊杰(复旦大学医学院附属肿瘤医院乳腺外科);李先明(深圳市人民医院放疗科);李兴睿(华中科技大学同济医学院附属同济医院乳腺甲状腺外科);李毅(北京市顺义区妇幼保健院乳腺中心);厉红元(重庆医科大学附属第一医院乳腺外科);廖宁(广东省人民医院乳腺外科);林颖(中山大学附属第一医院乳腺外科);刘彩刚(中国医科大学附属盛京医院乳腺外科);刘红(天津医科大学肿瘤医院);刘健(福建省肿瘤医院乳腺内科);刘运江(河北医科大学第四医院乳腺外科);刘真真(河南省肿瘤医院乳腺科);卢雯平(中国中医科学院广安门医院肿瘤科);陆劲松(上海交通大学医学院附属仁济医院乳腺外科);罗婷(四川大学华西医院肿瘤科);马斌林(新疆医科大学第三临床医学院附属肿瘤医院乳腺甲状腺外科);明越(中国医学科学院肿瘤医院PET-CT中心);莫钦国(广西医科大学附属肿瘤医院乳腺外科);倪青(贵州省人民医院乳腺外科);欧阳取长(湖南省肿瘤医院乳腺内科);潘剑(四川大学华西口腔医院口腔科);潘跃银(安徽省立医院肿瘤化疗科);齐立强(中国医学科学院肿瘤医院山西医院乳腺外科);乔广东(烟台毓璜顶医院乳腺外科);阮祥燕(首都医科大学附属北京妇产医院内分泌科);史业辉(天津市肿瘤医院乳腺肿瘤内科);宋张骏(陕西省人民医院乳腺外科);孙涛(辽宁省肿瘤医院肿瘤科);孙晓南(浙江大学医学院附属邵逸夫医院放疗科);汤立晨(复旦大学附属肿瘤医院乳腺外科);滕月娥(中国医科大学附属第一医院肿瘤内科);佟仲生(天津医科大学肿瘤医院乳腺肿瘤内科);万冬桂(中日友好医院中西医结合肿瘤内科);王川(福建医科大学附属协和医院乳腺外科);王海波(青岛大学附属医院乳腺外科);王佳玉(中国医学科学院肿瘤医院内科);王浩(四川省肿瘤医院乳腺外科);王靖(中国医学科学院肿瘤医院乳腺外科);王瓯晨(温州医科大学附属第一医院乳腺外科);王殊(北京大学人民医院乳腺外科);王淑莲(中国医学科学院肿瘤医院放疗科);王树森(中山大学肿瘤防治中心肿瘤内科);王廷(空军军医大学西京医院甲乳血管外科);王晓稼(浙江省肿瘤医院乳腺肿瘤内科);王永胜(山东省肿瘤医院乳腺外科);王玉(中国医学科学院肿瘤医院山西医院放疗科);王正珍(北京体育大学运动医学与运动康复学院);吴炅(复旦大学附属肿瘤医院乳腺外科);吴南(中国医学科学院北京协和医院骨科);伍文杰(北京大学口腔医院颌面外科);吴新红(湖北省肿瘤医院乳腺外科);夏维波(中国医学科学院北京协和医院内分泌科);熊慧华(华中科技大学同济医学院附属同济医院肿瘤科);徐贵颖(吉林省肿瘤医院乳腺外科);杨谨(西安交通大学附属第一医院肿瘤内科);杨其峰(山东大学齐鲁医院乳腺外科);姚和瑞(中山大学孙逸仙纪念医院乳腺内科,肿瘤内科);叶京明(北京大学第一医院);叶松青(福建省立医院肿瘤外科);殷咏梅(江苏省人民医院肿瘤内科);应红艳(中国医学科学院北京协和医院肿瘤内科);岳华(上海市第六人民医院骨质疏松和骨病专科);张殿龙(大连大学附属中山医院乳腺甲状腺科);张钢龄(内蒙古包头肿瘤医院乳腺外科);张杰(北京大学口腔医院颌面外科);张频(中国医学科学院肿瘤医院内科);张清媛(哈尔滨医科大学附属肿瘤医院肿瘤科);赵艳霞(华中科技大学同济医学院附属协和医院肿瘤科)
国家肿瘤质控中心乳腺癌专家委员会. 乳腺癌骨健康全周期管理规范[J]. 中华医学杂志, 2024, 104(2): 107-124. DOI: 10.3760/cma.j.cn112137-20231109-01132.
所有作者声明不存在利益冲突




























