
肝脏良性肿瘤种类繁多,组织来源多样,成分组成复杂,鉴别诊断困难。MRI在肝脏病变的诊断中具有重要价值。本文将从肝脏MRI检查技术出发,重点阐述海绵状血管瘤、血管平滑肌脂肪瘤、局灶性结节增生、肝细胞腺瘤4种常见肝脏良性肿瘤的MRI表现,以提高影像医师对肝脏良性肿瘤的认识和诊断水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
肝脏良性肿瘤种类繁多,组织来源多样,成分组成复杂,常于体检偶然发现,患者多无明显症状及体征。影像学表现与恶性肿瘤以及良性肿瘤间均有较多重叠,临床上也缺少特异性的肿瘤标志物,鉴别诊断困难。借助于高分辨、多参数、多模态成像优势以及肝胆细胞特异性对比剂的应用,MRI在肝脏良性肿瘤的诊断中具有非常大的优势。肝脏最常见的4种良性肿瘤包括海绵状血管瘤、血管平滑肌脂肪瘤(angiomyolipoma,AML)、局灶性结节增生(focal nodular hyperplasia,FNH)和肝细胞腺瘤(hepatocellular adenoma,HCA),本文中对其MRI表现进行阐述。
肝脏MRI平扫常用的序列包括冠状面T2WI、横断面T2WI及脂肪抑制T2WI、T1WI化学位移成像和DWI。Gd-DTPA增强多采用3D T1WI脂肪抑制序列,采集期相包括动脉期、门静脉期和延迟期。采用肝胆细胞特异性对比剂钆塞酸二钠和钆贝葡胺时,还需要进行肝胆细胞期成像,推荐延迟时间分别为20 min和60 min。
海绵状血管瘤是最常见的肝脏良性肿瘤,发病率为1%~20%,女性多见。患者多无症状,多数病灶长期保持稳定。
海绵状血管瘤呈圆形或卵圆形,边界清楚,无包膜,切面呈海绵状。镜下可见大小不等的囊状血窦,内衬覆单层内皮细胞,血窦间为纤维组织所分隔。较大者(>6 cm)可继发血栓、钙化、纤维化、透明样变及黏液变等[1, 2, 3]。
MRI上,T1WI为低信号,T2WI呈高信号,且随TE时间延长(>160 ms)信号逐渐增高,称之为“亮灯征”。DWI上呈高信号,但因存在T2透射效应,ADC值常无明显减低。巨大的海绵状血管瘤信号多不均匀,位于周边者可因纤维化而出现肝包膜皱缩。增强动脉期表现为周边强化,呈结节状、斑片状或环状,强化程度接近腹主动脉,随时间延迟向心性充填,表现为“快进慢出”(图1~3)。较小病灶也可表现为均匀强化,而较大病灶常不能完全充填对比剂。极少数病灶在增强各期强化均不明显,可能与窦腔狭小、富含纤维组织有关[4, 5, 6, 7]。
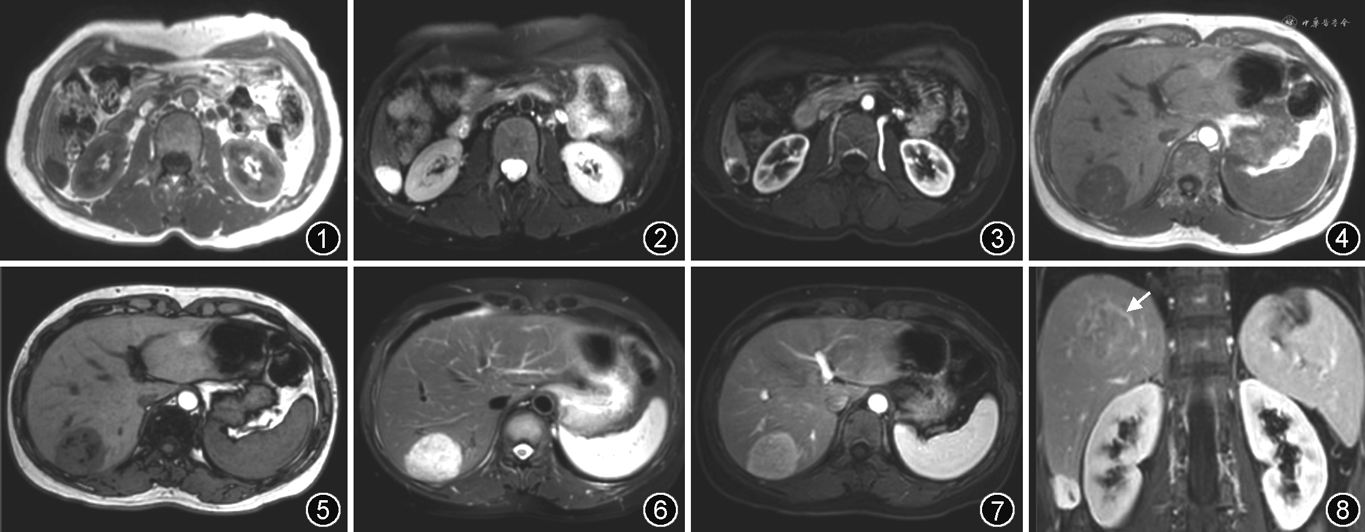

AML起源于肝脏间叶组织,好发于中年女性,患者多无明显症状和体征,无恶变倾向。
AML多为单发,类圆形或椭圆形,无包膜,境界清楚,有时瘤组织可向邻近肝组织扩展呈犬牙交错改变,但不侵犯血管。镜下,AML由厚壁畸形血管、平滑肌细胞、脂肪细胞混合组成,根据各成分比例可分为4型:(1)混合型,最为常见,占70%左右,各种成分均存在;(2)脂肪瘤型,以脂肪细胞为主,脂肪含量>70%;(3)肌瘤型,以平滑肌细胞为主,脂肪含量<10%;(4)血管瘤型,以厚壁畸形血管或扩张血窦为主[8, 9]。
AML平扫信号多不均匀,T1WI呈高低混杂信号,T2WI呈不同程度的高信号。病灶内的血管在T1WI可呈流空信号,在T2WI多因慢血流而呈高信号。脂肪成分在T1WI、T2WI均呈高信号,在脂肪抑制序列上呈低信号。脂肪成分是准确诊断AML的关键,T1WI化学位移成像有助于检出少量脂肪。AML内含有大块脂肪组织成分,当含量较多时在T1WI反相位表现为周边环形信号衰减。除脂肪瘤型外,大多数AML是富血供的,增强动脉期实质部分呈明显不均匀强化。“中心血管影”是AML的特异征象,表现为明显强化的实质成分中有增多扭曲的小血管,特别是在脂肪成分中见到血管影更具诊断意义[10, 11, 12, 13, 14]。增强门静脉期及延迟期可持续强化,也可呈稍低信号,周边常见到迂曲扩张的引流静脉。肿瘤较大压迫周围肝实质时,可形成不完整的假包膜(图4~8)。
上皮样AML是肌瘤中的特殊类型,具有恶性潜能,一般大于4 cm者需手术切除。上皮样AML通常不含脂肪成分,出血坏死少见,T1WI呈均匀低信号,T2WI呈不均匀高信号,动脉期明显强化,“中心血管影”出现的机会较高,门静脉期及延迟期可呈低信号、等信号或高信号,可见到环形强化的假包膜。
FNH占肝脏肿瘤及肿瘤样病变的8%,女性多见,男女之比约1∶8,无恶变倾向。
FNH多为单发,多呈圆形,边界清楚,大小不一,一般小于5 cm,无包膜,病灶中央可见“星芒状”瘢痕样纤维组织,形成向四周放射状分布的间隔。纤维组织基底部可见异常增粗的动脉,纤维间隔内含有增生的胆管及血管。镜下见肝细胞形态正常,围绕富于胆管和血管的纤维结缔组织间隔生长,仍含有正常胆管结构,但不与周围胆道交通。
典型的FNH在T1WI上为等或稍低信号,在T2WI上为均匀等或稍高信号,DWI上呈稍高信号。约70%的病灶可观察到中心瘢痕,是FNH的特异性表现,中心瘢痕T1WI呈低信号,T2WI呈高信号。增强动脉期除中心瘢痕以外的实质部分明显均匀强化,有时可显示粗大而扭曲的滋养动脉,门静脉期及延迟期呈等或稍高信号,少数FNH因为引流静脉较丰富而呈低信号。中心瘢痕在动脉期多无强化,与瘢痕内血管畸形、管壁增厚、管腔狭窄所致对比剂进入缓慢有关,在延迟期通常表现为持续强化,这是由于对比剂在瘢痕内的纤维组织中滞留时间长所致。10%~37%的FNH在延迟期可见到假包膜,是由受压的肝实质、血管、扩张血窦及炎性反应等因素所致[15, 16, 17]。
约20%的FNH影像表现不典型,肝胆细胞特异性对比剂增强扫描具有重要价值。FNH可以摄取肝胆细胞特异性对比剂,但因其内部胆管结构不与胆道交通,致对比剂排泄受阻,在肝胆细胞期呈等或高信号,尤其是环形高信号更具特异性,中心瘢痕在各期均无强化,呈低信号(图9~12)。

HCA是少见的起源于肝细胞的良性单克隆肿瘤,可能与长期服用合成类固醇、巴比妥类、克罗米酚和雄激素类等药物有关,可并发出血(10%~20%)、恶变(<5%)。基于分子遗传学基因型和表型特征,按照Bordeaux分型标准,HCA分为以下4种亚型[18, 19, 20, 21, 22]。
1.炎症型:最多见,占HCA的40%~55%,既往曾归类为血窦扩张型FNH,通常无恶变风险,但易出血。病理上表现为肝细胞增生或萎缩、肝窦扩张或紫癜样改变等。
炎症型HCA在T1WI上多表现为不均匀低信号,约20%的病灶内可见局灶性脂肪成分,在T1WI反相位表现为局灶性信号减低,30%有瘤内出血,40%伴有脂肪肝。T2WI呈不同程度的高信号,约40%的病灶可见“环礁征”,表现为中央呈稍低信号、周围呈环形高信号,系肿瘤周边血窦扩张所致,是较为特异的征象。增强动脉期病变明显强化,门静脉期和延迟期持续强化。在肝胆细胞期,约2/3的HCA呈略低信号,1/3呈等或高信号。
2.肝细胞核因子1α(hepatocyte nuclear factor 1α,HNF1α)失活型:由TCF1基因突变引起HNF1α失活,占HCA的30%~35%。约90%有口服避孕药病史,约50%为多发。该型无恶变风险,预后最好。镜下以肿瘤细胞弥漫性脂肪变性为特征。
MRI上,80%可见肿瘤内弥漫性脂肪成分,表现为T1WI反相位弥漫性信号减低,为较特异征象,此征象预测该亚型的灵敏度为86.7%、特异度为100%。T2WI上可表现为等、低或高信号,增强动脉期表现为轻中度强化,门静脉期及延迟期为低信号,肝胆细胞期约80%的病灶呈稍低信号。
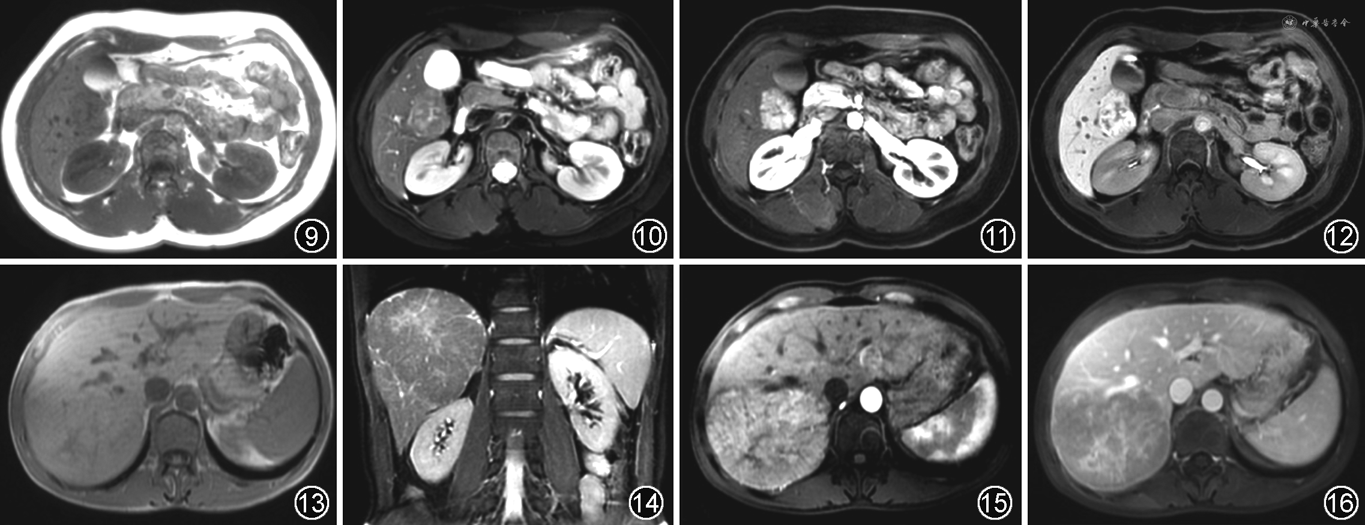
3.β-连环蛋白(β-catenin)激活型:占HCA的15%~20%,男性多见,具有很高的恶变风险,在恶变的HCA中占2/3。镜下可见细胞增大,核形态不规则,肝板增厚或形成假腺样结构,邻近肝组织多无脂肪变性和炎性细胞浸润。
MRI上,T1WI为等或低信号,T1WI反相位上无信号减低,T2WI呈不均匀高信号。70%的病灶内可见中央瘢痕,在T2WI呈高信号,且伴有延迟强化,酷似FNH或高分化肝细胞癌。增强动脉期明显强化,门静脉期和延迟期持续强化。在肝胆细胞期大部分呈低信号(图13~16)。
4.未分类型:无上述基因型特征,也缺少特异影像学征象,近期有学者提出细分为sonic hedgehog活化型、精氨基琥珀酸合成酶阳性HCA,二者都有较高的出血风险[23]。
肝脏良性肿瘤着重需要与高分化肝细胞癌、纤维板层肝癌等恶性肿瘤鉴别。肝细胞癌多有慢性肝病或肝硬化病史,增强后呈“快进快出”强化模式,常见假包膜,易侵犯门静脉及肝静脉,肝胆细胞期呈低信号。高分化肝细胞癌与β-连环蛋白激活型HCA在信号、血供及肝胆细胞期表现均有较多重叠,仅依靠影像学难以鉴别,但β-连环蛋白激活型HCA癌变风险高,也主张手术切除,二者鉴别对临床决策并无实质性影响。另外,FNH及纤维板层型肝癌均可见到中心瘢痕,但纤维板层型肝癌的纤维瘢痕通常更为粗大,在T1WI及T2WI上均为低信号,多无延迟强化,68%的病灶内可见钙化,70%的患者可见转移性淋巴结肿大,有助于与FNH鉴别。
在肝脏良性肿瘤间的鉴别中,准确诊断HCA更为重要。FNH与β-连环蛋白激活型HCA均可见中心瘢痕,但FNH的实性成分强化程度较HCA更明显,且更为均匀,在肝胆细胞期呈等或高信号,尤其是环形高信号更具特异性;而β-连环蛋白激活型HCA在肝胆细胞期多呈低信号。AML与HNF1α失活型HCA均含有脂肪,但后者病灶内脂肪分布较为均匀,T1WI反相位表现为弥漫性信号减低,动脉期轻度强化;而AML脂肪分布不均匀,还含有平滑肌及血管结构,当脂肪含量较多时在T1WI反相位表现为周边信号衰减,增强动脉期明显强化,可见中心血管影,病灶周边可有粗大扩张的引流静脉早期显影。
肝脏分子病理学、遗传学等进展推进了对肝肿瘤亚型的认识,也对影像学提出了新的挑战与要求。基于影像组学和机器学习等技术,可以深入挖掘肿瘤内部信息,有望构建精准的病灶检测、分类、预后评估模型,为肝脏良性肿瘤的诊断与鉴别诊断提供新的方法。
李若坤, 邓林, 严福华. 肝脏常见良性肿瘤的MRI表现[J]. 中华放射学杂志, 2024, 58(1): 114-118. DOI: 10.3760/cma.j.cn112149-20231121-00411.
中华医学会放射学分会MR学组对本栏目给予大力支持
所有作者声明无利益冲突
1.以下征象对肝脏海绵状血管瘤有定性诊断作用的是()
A.肿块信号均匀
B.T2WI呈亮灯征
C.动脉期明显均匀强化
D.瘤内出血
E.中央瘢痕
2.关于肝脏海绵状血管瘤的强化方式,错误的是()
A.动脉期病灶周边结节状强化,逐渐向中央充填
B.对比剂完全填充的时间取决于病灶的大小
C.大的病灶中心可有囊变区域,延迟期出现强化表现
D.延迟10~15 min,病灶仍保持类似于血池的信号强度
E.血管瘤可由于出血、透明样变而呈现不典型的MRI表现
3.关于FNH肝胆细胞期的表现,错误的是()
A.FNH可呈均匀等信号
B.FNH可呈均匀高信号
C.中心瘢痕呈高信号
D.FNH可呈环形高信号
E.肝胆细胞特异性对比剂对FNH和HCA的鉴别具有较大价值
4.关于HCA的MRI表现,表述不恰当的是()
A.β-连环蛋白激活型往往伴有脂肪变性
B.多期增强扫描可表现为“快进快出”
C.β-连环蛋白激活型可出现中央瘢痕
D.炎症型出血机会较多
E.T1WI不均匀低信号、T2WI不均匀高信号
5.典型的肝脏AML不会出现()
A.由平滑肌细胞、厚壁血管及脂肪细胞混合组成
B.增强动脉期病灶内可见“中心血管影”
C.病灶周边可出现假包膜
D.病灶内可见纤维瘢痕
E.增强门静脉期及延迟期持续性强化



























