
比较活体亲属ABO血型不相容肾移植(ABO-incompatible kidney transplantation,ABOi-KT)受者应用不同种类免疫诱导方案的早期(术后6个月内)临床结局。
回顾性分析2018年6月至2022年9月在华中科技大学同济医学院附属同济医院器官移植研究所行活体亲属ABOi-KT 41例受者的临床资料。其中,采用抗人T细胞猪免疫球蛋白(anti-human T lymphocyte porcine immunoglobin,pATG)行诱导治疗者13例(pATG组),采用白细胞介素-2受体拮抗剂者19例(巴利昔单抗组),采用兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte immunoglobulin,rATG)诱导者9例(rATG组)。统计并分析3组受者的年龄、性别、体重指数(body mass index,BMI)、透析方式、透析时间、左右供肾、血型抗体处理次数、利妥昔单抗使用剂量、基础血型抗体效价(IgG和IgM)以及受者供体的性别和BMI等方面的差异。单因素方差分析比较3组受者预处理前和移植术后6个月内的淋巴细胞计数评估受者免疫状态;单因素方差分析比较3组受者移植术后6个月内的血清肌酐、估算肾小球滤过率(estimated glomerular filtration rate,eGFR)、血清尿素氮水平评估移植肾功能。比较3组受者术后移植肾功能延迟恢复(delayed graft function,DGF)、术后6个月内急性排斥反应(acute rejection,AR)和感染的发生情况。
基线资料方面,除pATG组供者年龄[(60.23±6.10)岁]较巴利昔单抗组[(51.95±6.97)岁]大,差异有统计学意义(P=0.002)外,3组其余参数比较,差异均无统计学意义(P值均>0.05)。pATG组受者术后第1、3、7、10、14天淋巴细胞计数分别为(0.17±0.07)×109/L、(0.27±0.14)×109/L、(0.85±0.40)×109/L、(1.05±0.56)×109/L、(1.10±0.56)×109/L,rATG组分别为(0.69±0.04)×109/L、(0.18±0.21)×109/L、(0.57±0.44)×109/L、(0.67±0.45)×109/L、(0.81±0.46)×109/L,均较巴利昔单抗组[(0.46±0.18)×109/L、(0.67±0.26)×109/L、(1.29±0.48)×109/L、(1.56±0.49)×109/L、(1.75±0.53)×109/L]低,差异均有统计学意义(P值均<0.05);在预处理前和术后21 d后3组淋巴细胞绝对计数比较差异无统计学意义(P值均>0.05)。在移植术后第1周、第2周、1个月、3个月及6个月的血清肌酐和血清尿素氮水平的差异无统计学意义(P>0.05);rATG组术后1个月、3个月时的eGFR分别为(47.24±14.51)ml·min-1·(1.73 m2)-1和(49.94±14.31)ml·min-1·(1.73 m2)-1,较巴利昔单抗组(67.36±21.60)ml·min-1·(1.73 m2)-1和(65.00±14.67)ml·min-1·(1.73 m2)-1低,差异有统计学意义(P<0.05);但3组术后1周、2周及6个月时的eGFR水平差异无统计学意义(P>0.05)。3组术后1周内DGF均发生1例;术后6个月内,pATG组、巴利昔单抗组、rATG组分别发生AR 2例、2例和1例,分别发生感染4例、7例和3例。
单中心有限的样本观察发现,对于使用pATG、巴利昔单抗和rATG进行免疫诱导治疗的ABOi-KT受者,移植术后早期的DGF差异无统计学意义。3组均有DGF、AR和感染发生,但组间差异不大。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植是治疗终末期肾功能衰竭最有效的方法之一。由于肾源短缺,亲属活体供肾如跨越血型障碍的ABO血型不相容供肾已成为肾移植手术供肾的重要来源之一。因ABO血型不相容肾移植(ABO-incompatible kidney transplantation,ABOi-KT)手术术前需应用利妥昔单抗对受者进行免疫预处理和用血浆置换(plasma exchange,PE)等方法以清除血型抗体,术后受者的血型抗体水平可能存在"反跳"而出现排斥反应,故ABOi-KT受者术后感染及免疫排斥风险均较ABO血型相容肾移植(ABO-compatible kidney transplantation,ABOc-KT)高[1,2],合理使用免疫诱导制剂十分重要。
《ABO血型不相容亲属活体肾移植临床诊疗指南(2017版)》[3]和《ABO血型不相容亲属活体肾移植技术操作规范(2019版)》[4]均推荐将白细胞介素-2受体拮抗剂(interleukin-2 receptor antagonist,IL-2RA)或抗人胸腺细胞免疫球蛋白(anti-human thymocyte immunoglobulin,ATG)用于高免疫风险的ABOi-KT受者,但有关不同诱导方案对移植物早期功能的比较研究在国内还不多见。另外,我国自主研发的抗人T细胞猪免疫球蛋白(anti-human T lymphocyte porcine immunoglobin,pATG)已在十多年前广泛应用于尸体肾移植中,具有明确的抗排斥作用和良好的安全性,不良反应较少[5,6]。本研究回顾性对比分析使用pATG、巴利昔单抗和兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte immunoglobulin,rATG)进行免疫诱导治疗的活体亲属ABOi-KT受者的临床资料,探讨不同免疫诱导治疗方案的临床有效性和安全性,以期为ABOi-KT受者个体化诱导治疗提供依据。
回顾性分析2018年6月至2022年9月华中科技大学同济医学院附属同济医院器官移植研究所行亲属ABOi-KT手术41例受者的临床资料。其中,使用pATG行诱导治疗13例(pATG组),使用巴利昔单抗19例(巴利昔单抗组),使用rATG诱导9例(rATG组)。
病例纳入标准:(1)受者为初次肾移植,群体反应性抗体阴性;(2)供受者及家属对治疗方案均知情同意。排除标准:(1)多器官移植受者;(2)既往有器官移植史;(3)移植前使用过其他免疫抑制药物;(4)过去5年有恶性肿瘤病史。(5)随访不规范、失访。
本研究遵循《世界医学协会赫尔辛基宣言》,并已通过华中科技大学同济医学院附属同济医院医学伦理委员会审核(伦理号:TJ-IRB20221300),本研究免除了知情同意。
受者在术前1~2周开始口服免疫抑制剂,具体方案为:他克莫司0.05~0.10 mg·kg-1·d-1+吗替麦考酚酯500~750 mg/次,每12 h 1次。术前14 d左右根据受者体重水平使用利妥昔单抗1剂(100 mg)或2剂(200 mg),并通过PE、双重滤过血浆置换(double filtration plasmapheresis,DFPP)或免疫吸附(immunoadsorption,IA)清除受者体内预存的血型抗体。移植术前至少2次复查受者血型抗体,IgG和IgM效价水平均≤1∶16可接受手术。
术中静脉注射甲泼尼龙琥珀酸钠500 mg,术后第1天和第2天分别静脉注射甲泼尼龙琥珀酸钠300~500 mg。
pATG组:在术中静脉滴注pATG 500~750 mg,术后第1~4天静脉滴注pATG 500 mg/d,共5次。巴利昔单抗组:在术中及术后第4天分别静脉滴注巴利昔单抗20 mg,共2次。rATG组:在术中静脉滴注rATG 25~50 mg,术后第1~4天静脉滴注rATG 25 mg/d,共5次。
术后继续口服他克莫司及吗替麦考酚酯,根据血药浓度调整用药剂量,他克莫司血药浓度维持在7~9 μg/L。术后第3天开始口服醋酸泼尼松50 mg,之后每日减量10 mg,最终维持5~10 mg/d。
3组受者预处理前(术前14 d左右)及术后的淋巴细胞绝对计数变化情况;术后1周、2周、1个月、3个月、6个月的移植肾功能指标,包括:血清肌酐、估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)、血清尿素氮;术后6个月内急性排斥反应(acute rejection,AR)、感染以及术后1周内移植肾功能延迟恢复(delayed graft function,DGF)发生情况;术后6个月移植肾存活情况等。
AR的诊断包括病理证实的AR及临床诊断的AR。经病理证实的AR按2017年Banff标准[7]评估。临床诊断AR标准:移植术后尿量突然减少伴血清肌酐进行性升高,伴或不伴彩色多普勒超声检查结果提示移植肾血流阻力指数增加,且经糖皮质激素冲击治疗有效。若伴有血型抗体效价水平升高,经PE/DFPP/IA治疗有效,则考虑血型抗体介导的AR。
DGF定义为移植后1周内血清肌酐未恢复正常,至少需要进行一次透析治疗。
使用SPSS 27.0统计软件进行数据处理。符合正态分布的计量资料用 ±s表示,多组间比较采用单因素方差分析(组间两两比较采用Bonferroni t检验);不符合正态分布的计量资料用M(IQR)表示,组间比较采用Kruskal-Wallis H检验;计数资料用例(%)表示,组间比较采用Fisher精确检验。P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析(组间两两比较采用Bonferroni t检验);不符合正态分布的计量资料用M(IQR)表示,组间比较采用Kruskal-Wallis H检验;计数资料用例(%)表示,组间比较采用Fisher精确检验。P<0.05为差异有统计学意义。
3组受者在年龄、性别、体重指数(body mass index,BMI)、透析方式、透析时间、左右供肾、血型抗体处理次数、利妥昔单抗使用剂量、基础血型抗体效价(IgG和IgM)以及受者、供者的性别和BMI等方面比较,差异均无统计学意义(P值均>0.05,表1)。pATG组供者年龄(60.23±6.10)岁较巴利昔单抗组(51.95±6.97)岁大,差异有统计学意义(P=0.002,表1);而rATG组分别与pATG组和巴利昔单抗组比较,差异均无统计学意义(P值均>0.05,表1)。
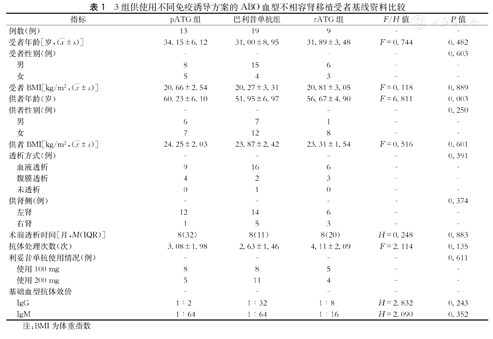
3组供使用不同免疫诱导方案的ABO血型不相容肾移植受者基线资料比较
3组供使用不同免疫诱导方案的ABO血型不相容肾移植受者基线资料比较
| 指标 | pATG组 | 巴利昔单抗组 | rATG组 | F/H值 | P值 |
|---|---|---|---|---|---|
| 例数(例) | 13 | 19 | 9 | - | - |
受者年龄[岁,( ±s)] ±s)] | 34.15±6.12 | 31.00±8.95 | 31.89±3.48 | F=0.744 | 0.482 |
| 受者性别(例) | - | - | - | - | 0.603 |
| 男 | 8 | 15 | 6 | - | - |
| 女 | 5 | 4 | 3 | - | - |
受者BMI[kg/m2,( ±s)] ±s)] | 20.66±2.54 | 20.27±3.31 | 20.81±3.05 | F=0.118 | 0.889 |
| 供者年龄(岁) | 60.23±6.10 | 51.95±6.97 | 56.67±4.90 | F=6.811 | 0.003 |
| 供者性别(例) | - | - | - | - | 0.250 |
| 男 | 6 | 7 | 1 | - | - |
| 女 | 7 | 12 | 8 | - | - |
供者BMI[kg/m2,( ±s)] ±s)] | 24.25±2.03 | 23.87±2.42 | 23.31±1.54 | F=0.516 | 0.601 |
| 透析方式(例) | - | - | - | - | 0.391 |
| 血液透析 | 9 | 16 | 6 | - | - |
| 腹膜透析 | 4 | 2 | 3 | - | - |
| 未透析 | 0 | 1 | 0 | - | - |
| 供肾侧(例) | - | - | - | - | 0.374 |
| 左肾 | 12 | 14 | 6 | - | - |
| 右肾 | 1 | 5 | 3 | - | - |
| 术前透析时间[月,M(IQR)] | 8(32) | 8(11) | 8(20) | H=0.248 | 0.883 |
| 抗体处理次数(次) | 3.08±1.98 | 2.63±1.46 | 4.11±2.09 | F=2.114 | 0.135 |
| 利妥昔单抗使用情况(例) | - | - | - | - | 0.611 |
| 使用100 mg | 8 | 8 | 5 | - | - |
| 使用200 mg | 5 | 11 | 4 | - | - |
| 基础血型抗体效价 | - | - | - | - | - |
| IgG | 1∶2 | 1∶32 | 1∶8 | H=2.832 | 0.243 |
| IgM | 1∶64 | 1∶64 | 1∶16 | H=2.090 | 0.352 |
注:BMI为体重指数
pATG组受者术后第1、3、7、10、14天时淋巴细胞绝对计数分别为(0.17±0.07)×109/L、(0.27±0.14)×109/L、(0.85±0.40)×109/L、(1.05±0.56)×109/L、(1.10±0.56)×109/L,rATG组分别为(0.69±0.04)×109/L、(0.18±0.21)×109/L、(0.57±0.44)×109/L、(0.67±0.45)×109/L、(0.81±0.46)×109/L,两组各时间点淋巴细胞绝对计数均较巴利昔单抗组[(0.46±0.18)×
109/L、(0.67±0.26)×109/L、(1.29±0.48)×109/L、(1.56±0.49)×109/L、(1.75±0.53)×109/L]低,差异均有统计学意义(pATG组与巴利昔单抗组比较,P值分别为<0.001、<0.001、0.025、0.026、0.005;rATG组与巴利昔单抗组比较,P值均<0.001);但pATG组和rATG组各时间点淋巴细胞绝对计数比较,差异均无统计学意义(P值均>0.05)。3组在预处理前、术后第21天、1个月、2个月、3个月及6个月淋巴细胞绝对计数比较,差异均无统计学意义(P值均>0.05,图1)。
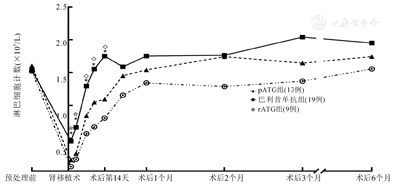

注:*为巴利昔单抗组与rATG组比较,P<0.001;☆为巴利昔单抗组与pATG组比较,P<0.001;◇为巴利昔单抗组与pATG组比较,P<0.05;"预处理前"指术前14 d左右使用利妥昔单抗及通过PE/DFPP/IA进行血型抗体处理前
3组受者的血清肌酐和尿素氮等指标在术后1周、2周、1个月、3个月及6个月差异无统计学意义(P>0.05)。3组受者术后1周、2周及6个月eGFR水平比较,差异无统计学意义(P>0.05);但rATG组eGFR在术后1个月、3个月时分别为(47.24±14.51)ml·min-1·(1.73 m2)-1和(49.94±14.31)ml·min-1·(1.73 m2)-1,与巴利昔单抗组(67.36±21.60)ml·min-1·(1.73 m2)-1和(65.00±14.67)ml·min-1·(1.73 m2)-1比较,差异有统计学意义(P=0.043和0.047)。3组移植物存活情况:pATG组12例、rATG组19例、巴利昔单抗组9例。(表2)
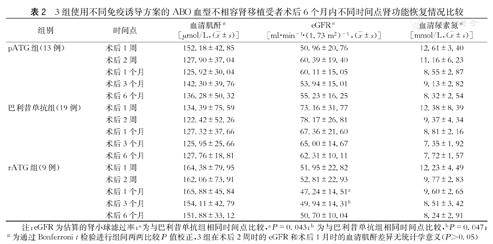
3组使用不同免疫诱导方案的ABO血型不相容肾移植受者术后6个月内不同时间点肾功能恢复情况比较
3组使用不同免疫诱导方案的ABO血型不相容肾移植受者术后6个月内不同时间点肾功能恢复情况比较
| 组别 | 时间点 | 血清肌酐#[μmol/L,( ±s)] ±s)] | eGFR#[ml·min-1·(1.73 m2)-1,( ±s)] ±s)] | 血清尿素氮#[mmol/L,( ±s)] ±s)] |
|---|---|---|---|---|
| pATG组(13例) | 术后1周 | 152.18±42.85 | 50.96±20.76 | 12.61±3.40 |
| 术后2周 | 127.90±37.04 | 60.39±19.40 | 11.16±6.23 | |
| 术后1个月 | 125.92±30.04 | 60.11±15.05 | 8.55±2.87 | |
| 术后3个月 | 142.30±39.76 | 53.94±15.01 | 9.13±2.82 | |
| 术后6个月 | 136.28±50.32 | 55.23±16.25 | 8.32±2.54 | |
| 巴利昔单抗组(19例) | 术后1周 | 134.39±75.59 | 73.16±31.77 | 12.38±8.39 |
| 术后2周 | 122.42±52.26 | 78.17±26.81 | 9.37±4.34 | |
| 术后1个月 | 127.32±37.66 | 67.36±21.60 | 8.81±2.16 | |
| 术后3个月 | 125.95±25.66 | 65.00±14.67 | 7.35±1.92 | |
| 术后6个月 | 127.76±18.81 | 62.31±10.11 | 7.72±1.57 | |
| rATG组(9例) | 术后1周 | 164.38±79.95 | 51.95±22.82 | 12.23±4.49 |
| 术后2周 | 162.06±73.91 | 52.81±22.93 | 9.77±2.83 | |
| 术后1个月 | 165.88±45.84 | 47.24±14.51a | 9.60±2.65 | |
| 术后3个月 | 154.11±42.79 | 49.94±14.31b | 8.51±3.42 | |
| 术后6个月 | 151.88±33.12 | 50.70±10.04 | 8.24±2.91 |
注:eGFR为估算的肾小球滤过率;a为与巴利昔单抗组相同时间点比较,aP=0.043;b为与巴利昔单抗组相同时间点比较,bP=0.047;#为通过Bonferroni t检验进行组间两两比较P值校正,3组在术后2周时的eGFR和术后1月时的血清肌酐差异无统计学意义(P>0.05)
术后1周以内3组各有1例发生DGF;术后6个月内,pATG组、巴利昔单抗组、rATG组分别发生AR 2例、2例和1例,具体AR发生时间、类别、治疗方案、结局详见表3。

3组使用不同免疫诱导方案的ABO血型不相容肾移植受者急性排斥反应发生和治疗情况
3组使用不同免疫诱导方案的ABO血型不相容肾移植受者急性排斥反应发生和治疗情况
| 受者 | 急性排斥反应发生时间 | 排斥反应类别 | 治疗方案 | 治疗结局 |
|---|---|---|---|---|
| pATG组 | ||||
| 受者1 | 术后第6天 | 临床诊断TCMR+ABMR* | 利妥昔单抗+DFPP+rATG+MP | 逆转 |
| 受者2 | 术后第17天 | 病理诊断TCMR,临床诊断ABMR* | rATG+MP +PE+DFPP | 逆转 |
| 术后第49天 | 临床诊断ABMR* | DFPP+PE | 未逆转 | |
| 巴利昔单抗组 | ||||
| 受者1 | 术后第45天 | 病理诊断TCMR | MP | 逆转 |
| 受者2 | 术后第14天 | 病理诊断极轻微TCMR | 调整免疫抑制强度 | 逆转 |
| rATG组 | ||||
| 受者1 | 术后第19天 | 临床诊断TCMR+ABMR* | MP +PE | 逆转 |
注:TCMR为T细胞介导的排斥反应;ABMR为抗体介导的排斥反应;DFPP为双重滤过血浆置换;rATG为兔抗人胸腺细胞免疫球蛋白;MP为甲泼尼龙;PE为血浆置换;*表示ABMR为血型抗体所介导
pATG组13例中有4例发生感染、巴利昔单抗组19例中有7例发生感染、rATG组9例中有3例发生感染。其中,pATG组发生微小病毒B19(human parvovirus B19,HPV-B19)感染1例、BK病毒感染2例、肺部感染1例;巴利昔单抗组发生HPV-B19感染1例、BK病毒感染3例、泌尿系统感染1例、肺部感染2例;rATG组发生泌尿系统感染1例、肺部感染2例。术后6个月内,巴利昔单抗组和rATG组受者的移植肾均存活,pATG组出现1例移植肾失功,为"受者2"。该例受者术后第17天出现血红蛋白快速下降、肌酐上升,HPV-B19的DNA含量检测及病理穿刺结果显示受者HPV-B19感染并发T细胞介导的排斥反应(T cell mediated rejection,TCMR),经积极治疗后TCMR逆转,肾功能恢复。但此例受者在后续治疗HPV-B19感染过程中血型抗体水平"反弹",血型抗体IgM效价最高达1∶1024,发生抗体介导的排斥反应(antibody mediated rejection,ABMR),最终未能逆转导致移植肾失功。
1955年Hume等[8]首次对ABOi-KT进行了探索。经过数十年的发展,跨血型肾移植术在手术技术、手术例数及临床效果方面均有了巨大飞跃。尤其在日本,ABOi-KT约占活体肾移植总数的30%,已成为临床常规的肾移植手术[9]。多年来积累的数据表明,ABOi-KT受者术后近期和远期临床效果与ABOc-KT基本一致[10,11]。绝大多数ABOi-KT受者需在术前进行预处理治疗,包括使用PE、DFPP、IA等方法清除体内预存的血型抗体,并使用利妥昔单抗清除B淋巴细胞以预防肾移植术后新生抗体的产生[3]。但同时,这些预处理策略可能升高受者术后的感染风险[12]。临床上也观察到,ABOi-KT术后受者病毒(巨细胞病毒、单纯疱疹病毒、水痘-带状疱疹病毒、BK病毒等)感染发生率高于ABOc-KT受者,ABOi-KT受者较ABOc-KT受者具有更高的术后肺部感染发生率[13,14]。多变量分析显示ABOi-KT受者术后包括病毒及导致住院的细菌感染的发生率为50%,明显高于ABOc-KT的21%[13]。所以,一般认为ABOi-KT既有免疫排斥高风险,术后也存在着感染高风险[1,2]。
对于高免疫排斥风险的ABOi-KT受者,免疫诱导治疗可以降低AR的发生率,提高移植肾的存活率。免疫诱导剂主要分为两大类,一类是T淋巴细胞清除剂,包括rATG、抗人T淋巴细胞兔免疫球蛋白(anti-human T lymphocyte rabbit immunoglobulin,ATG-F)和pATG等;另一类是能抑制T淋巴细胞活化的IL-2RA[15]。改善全球肾病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)建议对排斥反应风险较高的移植受者使用淋巴细胞清除性抗体(如rATG、ATG-F等)进行诱导治疗[16],而我国则将ATG或IL-2RA均推荐用于高免疫排斥风险的ABOi-KT受者[3,4]。但在ATG和IL-2RA两者之间具体该如何选择,则鲜见阐述。一项尸体供肾肾移植的前瞻性随机研究对rATG和IL-2RA进行比较,结果表明rATG诱导组的AR发生率(15.6%)较IL-2RA组(25.5%)低,严重程度也较轻;但rATG组总感染率(85.8%)较IL-2RA组(75.2%)高[17]。也有研究表明,使用IL-2RA诱导后的ABOi-KT受者术后1年内AR发生率为36%,高于T淋巴细胞清除剂诱导治疗组(15%)[18]。如果用足量的rATG(累积剂量4 mg/kg)进行诱导治疗,在进行PE和应用利妥昔单抗后,受者可能处于过度免疫抑制状态,导致术后感染的增加[2,19]。而如果使用小剂量rATG(累积剂量75 mg)诱导,则与使用IL-2RA诱导的抗排斥临床效果相似(AR发生率:IL-2RA组为29.4%,rATG组为21.7%,P=0.580),但并不增加术后感染的风险[20]。
pATG是我国自主研发具有自主知识产权的抗人T细胞猪免疫球蛋白,由原武汉生物制品研究所研制,1983年批准上市(国药准字S10830001)。中华医学会器官移植分会制定的《器官移植免疫抑制剂临床应用技术规范(2019版)》[15]推荐pATG用于临床器官移植排斥反应预防和治疗。研究显示,pATG与rATG抗排斥效果一致,而白细胞水平降低和肺部感染的发生率明显降低[21]。杨楠等[22]研究显示,与使用rATG相比,重型再生障碍性贫血患者在使用了pATG后淋巴细胞绝对计数最低值相对较高,而且停用后恢复较快[22];淋巴细胞绝对计数在第8~14天就大致恢复到了使用前的水平[23],这与本研究中观察到的淋巴细胞绝对计数变化类似。冯小芳等[5]在肾移植受者术后同样观察到了类似情况,相较于使用pATG诱导,使用rATG的受者外周血中T淋巴细胞计数最低值更低,清除更彻底,尤其是CD4+ T淋巴细胞。Zhang等[6]近期发表的研究也显示,在尸体肾移植中,pATG诱导仅中度消耗淋巴细胞,效果弱于rATG,在停止用药后,pATG相对较快地恢复到正常水平。众所周知,ABOi-KT中由血型抗体诱发的排斥反应主要发生在术后2周内,移植2周后即使血型抗体有一定程度的反弹也不一定发生排斥,这种现象称为"适应(Accommodation)"[24]。而本研究观察到,使用pATG治疗可有效清除受者体内的T淋巴细胞,术后14 d内淋巴细胞计数明显低于巴利昔单抗组,可以较好地保护移植肾过渡到"适应"期;之后淋巴细胞绝对计数快速恢复,到术后21 d与巴利昔单抗组已无明显差异,减少术后感染的发生。因此,pATG可能兼具降低排斥反应和术后感染发生风险的作用,是一种可供选择的ABOi-KT免疫诱导治疗药物。
从术后6个月的随访观察情况来看,3组受者移植肾功能恢复情况均良好。rATG组和巴利昔单抗组受者在术后第1、3个月时的eGFR差异可能与术后早期他克莫司药物浓度和体重变化相关,调整药物剂量后,术后6个月时3组受者eGFR已无差异。
本研究中pATG组出现1例移植肾功能丧失,该受者术后发生HPV-B19感染同时先后并发TCMR和ABMR,最终因严重的ABMR导致移植肾功能丧失。查阅文献可知,国内公开报道的ABOi-KT后移植肾功能丧失病例并不多。雷文华等[20]报道40例ABOi-KT中出现2例移植肾功能丧失,原因分别为HPV-B19感染继发血栓性微血管病以及血型抗体介导的ABMR。武政华等[25]报道1例ABOi-KT后HPV-B19感染继发严重的排斥反应,术后74 d移植肾功能丧失。这4例移植物失功病例中有3例与HPV-B19感染相关,使用的诱导治疗分别为pATG、巴利昔单抗、rATG和未使用除利妥昔单抗外的其他免疫诱导制剂;因均为个案,尚难以判断移植物失功是否与免疫诱导制剂的种类有关。HPV-B19感染是肾移植术后最常见的感染性并发症之一,常常导致纯红细胞再生障碍性贫血,无特异性治疗方法,目前主要通过调整免疫抑制剂的种类和剂量的方式进行治疗,如停用霉酚酸类药物、更换他克莫司为环孢素A以及输注静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)等,在免疫抑制方案调整过程中容易诱发排斥反应[26]。而此时一旦出现血型抗体的反弹,很容易出现ABMR并导致移植物失功。不同移植中心的移植物失功病例提示,在ABOi-KT受者出现HPV-B19感染时一定要注意预防排斥反应的发生。
我国于2006年首次开展ABOi-KT手术,相较于国外开展的时间较晚、例次较少,诱导治疗和免疫抑制方案也无统一意见,亟需各中心积累经验、交流不同治疗方案对移植物存活的影响。本文比较了pATG、巴利昔单抗和rATG在ABOi-KT中免疫诱导治疗的临床效果,从单中心有限的病例观察发现,ABOi-KT受者使用3种不同诱导治疗术后早期移植肾功能恢复差异无统计学意义,3组均有DGF、AR和感染发生,但组间差异不大,且未观察到其他并发症的增加。但本研究为单中心回顾性观察性研究,样本量有限,后续仍需增加移植例数和随访时间,以观察长期临床效果。
所有作者声明无利益冲突
































本文中文摘要“结论”部分的第1个“DGF"应为“移植肾功能恢复”。更正的同时表示歉意!