
血糖曲线、胰岛β细胞功能(BCF)和胰岛素敏感性(IS)都是动态变化的,血糖曲线上任意一点的血糖值取决于该时点的BCF和IS。血糖数值是判断BCF是否正常的“金标准”。理想的BCF指数应能反映BCF是否正常、代偿程度或损伤程度;IS是受试者在某种状态下定量的胰岛素作用于靶细胞,在单位时间内产生的糖代谢生物学效应;而葡萄糖处置指数(DI)则是受试者在某种试验状态下血浆胰岛素产生的实际糖代谢生物学效应。该文对血糖波动、BCF及IS的动态变化,现有BCF指数、IS或胰岛素抵抗指数、DI的特点其应用,临床研究中应用BCF与IS指数的几个常见问题进行阐述,并提出临床期待开发出新的BCF及IS指数应具有的特点。正确使用BCF及IS指数,必须秉持糖代谢的动态观,牢记血糖、BCF、IS三者之间的调节原理,弄清各种BCF及IS指数的特点与病理生理学意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血糖水平取决于血浆有效胰岛素浓度和胰岛素敏感性(insulin sensitivity,IS)两个决定因素。在胰岛素清除速率相对恒定的情况下,血浆胰岛素浓度是胰岛分泌胰岛素β细胞功能(β-cell function,BCF)的标志。IS与胰岛素抵抗(insulin resistance,IR)互为倒数关系。以1型糖尿病(type 1 diabetes mellitus,T1DM)为代表的原发性BCF减损相关的糖代谢异常可以不伴有IR,以2型糖尿病(type 2 diabetes mellitus,T2DM)为代表的其他糖代谢紊乱则两者兼而有之。然而,BCF减损与IS下降,孰先孰后,孰轻孰重,则因人而异,这就形成了糖代谢紊乱的高度异质性。因此,BCF和IS是研究糖代谢常用的测量指标,正确评估BCF和IS对糖尿病的诊断分型、预后判断和制订个体化治疗方案有重要的临床意义[1, 2]。但是,回顾现有BCF和IS检测指标的实际应用效果,尚有不尽如人意之处。研究者发现,即使与最优越的IS指数正糖钳夹技术测定的葡萄糖代谢率相结合,常用的BCF指数,如静脉糖耐量试验急性胰岛素分泌反应(intravenous glucose tolerance test acute insulin response,IVGTT-AIR)指数、稳态模型评估β细胞功能(homeostasis model assessment β cell function,HOMA-β)指数以及口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)30 min胰岛素增值(ΔI30/ΔI0)也只能了解餐后2 h血糖的20%和OGTT平均血糖30%的变化[3]。出现这一现象的原因是复杂的,厘清这些原因将有助于提高BCF和IS指数的应用效果。笔者阐述对于胰岛BCF及IS指数在临床研究应用中几个问题的思考,以飨读者。
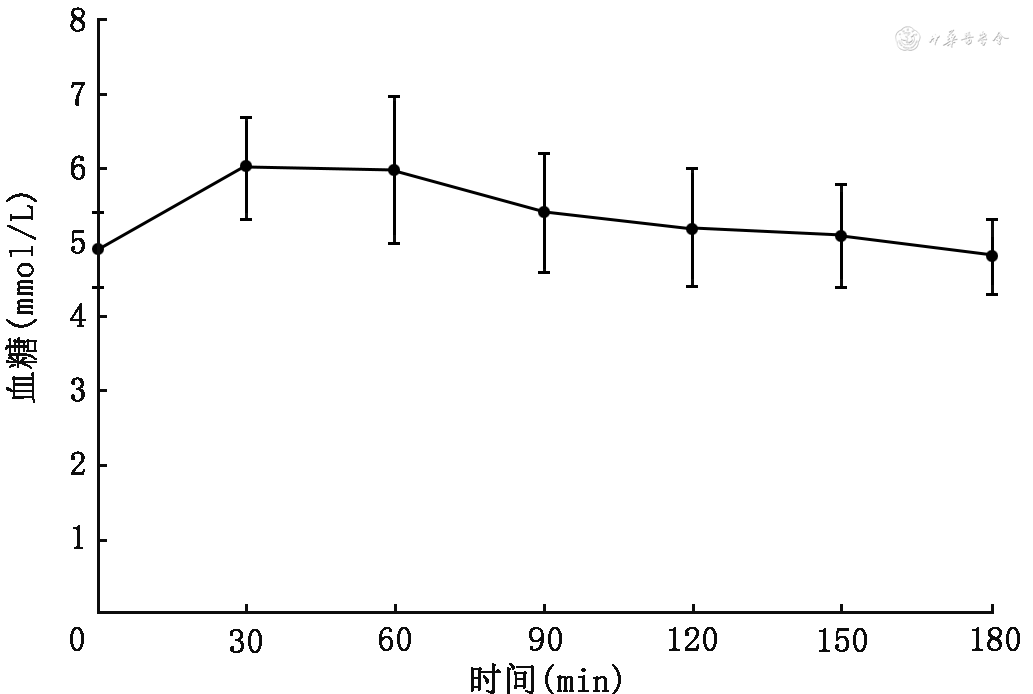
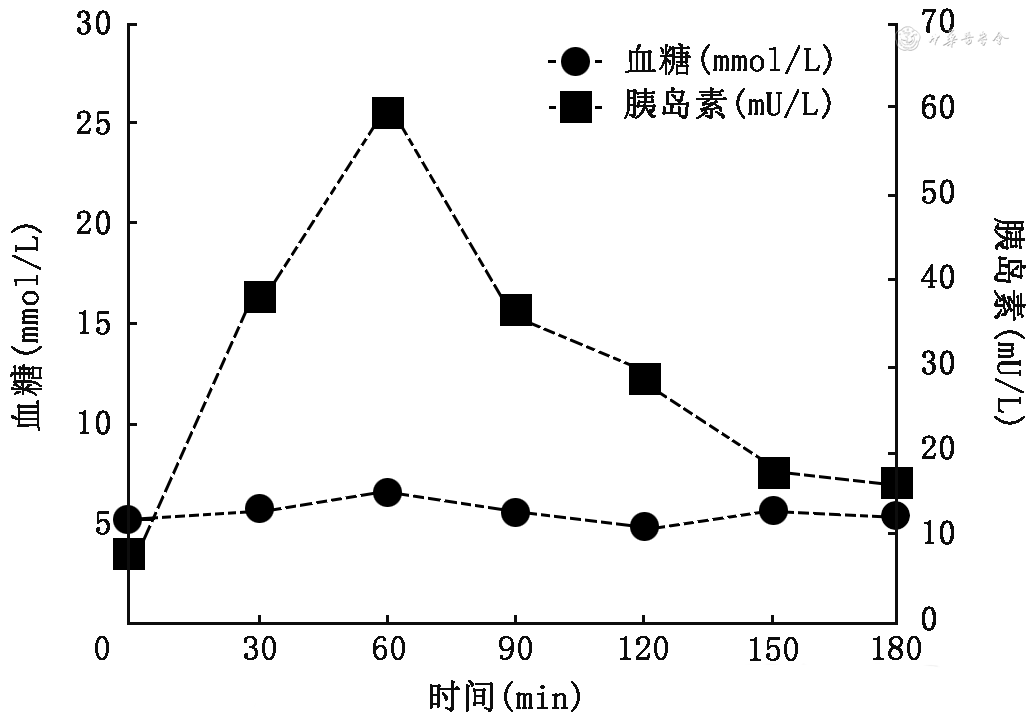
为了研究糖代谢的调节机制,我们招募了31名糖代谢正常的健康志愿者进行OGTT试验。纳入标准为:年龄≤35岁,体重指数(body mass index,BMI)18.5~24.0 kg/m2,男性腰围≤85 cm,女性腰围≤80 cm,血压<130/80 mmHg(1 mmHg=0.133 kPa),总胆固醇<4.50 mmol/L,低密度脂蛋白胆固醇<2.6 mmol/L,高密度脂蛋白胆固醇>1.10 mmol/L,甘油三酯<1.6 mmol/L,空腹血糖<5.6 mmol/L,餐后2 h血糖<7.8 mmol/L,无烟酒嗜好,无糖尿病、妊娠期糖尿病、高血压及高脂血症个人史及家族史。他们的OGTT平均血糖曲线显示,正常人糖负荷后血糖水平随着时间的变化而动态变化,0~90 min血糖曲线出现一些漂移(图1)。任意选取其中1名受试者的OGTT血糖与胰岛素曲线显示,相对平稳的血糖曲线对应的是剧烈变化的胰岛素曲线(图2)。以上结果提示,多种代谢指标及遗传背景相对完美的受试者,其糖负荷后血糖、BCF和IS是动态变化着的;即使在血糖曲线相对平稳的阶段,其背后也可能掩藏着BCF及IS此消彼长、甚至波澜壮阔的变化。另外,Fujimoto等[4]报道,随着生物钟的变化,正常人早晚对OGTT的反应(包括血糖曲线形态、BCF和IS)均会发生变化。在昼夜不同时段工作的人,其IR指数亦有着显著的区别[5]。我们团队既往的研究发现,T2DM患者随着病程的延长,餐后血糖高峰的位置从餐后0.5 h开始逐渐后移,与之对应的是胰岛素和C肽分泌高峰也逐渐后移,峰的高度逐渐下降[6]。因此,研究糖代谢的病理生理机制,必须秉持血糖、BCF及IS时刻动态变化的理念,某一时点或时段血糖升高,要在同一时点或时段的BCF损伤及IR上找答案;在血糖调节反馈回路健存的前提下,某一时点或时段的IS发生变化,一定伴同一时点或时段BCF的改变。


通常胰岛BCF是指其合成、储存以及分泌胰岛素的能力[7]。正常的胰岛β细胞合成、储存以及分泌胰岛素是以正确感知血糖浓度变化为前提的,BCF是否正常是以能否维持血糖于正常水平为标志的。在胰岛素清除率相对恒定的情况下,BCF的变化表现为血浆有效胰岛素浓度的改变和血糖水平的波动[8]。BCF的变化可以分为正常、完全代偿、代偿不全、功能衰竭4个等级;可用损伤程度和残余功能这两个维度描述BCF减退。准确衡量BCF的前提是要了解实际血浆胰岛素浓度与胰岛素的实际需要量。
现在临床研究常用的BCF指数包括血浆胰岛素(或C肽)浓度、胰岛素峰值/胰岛素基础值、胰岛素原与胰岛素的比值、HOMA-β、修正的BCF指数、胰岛素敏感指数(insulin sensitivity index,ISI)、OGTT胰岛素曲线下面积、IVGTT-AIR指数、高葡萄糖钳夹试验(第一时相胰岛素分泌、第二时相胰岛素分泌、最大胰岛素分泌量)、精氨酸刺激试验和(或)胰高糖素试验等。IVGTT-AIR、高葡萄糖钳夹试验、精氨酸刺激试验和胰高糖素试验的结果,都是机体在特定条件下的BCF,可用于血糖正常及各种糖代谢异常的受试者;而其他指数是BCF的替代指标。HOMA-β=20×空腹胰岛素(fasting insulin,FINS)浓度(μU/ml)/[空腹血糖(mmol/L)-3.5];修正的BCF指数=FINS(μU/ml)×空腹血糖(mmol/L)/[负荷后血糖120 min(mmol/L)+负荷后血糖60 min(mmol/L)-2×空腹血糖(mmol/L)];ISI=胰岛素变化值ΔI(I30 min-I0)/血糖变化值ΔG(G30 min-G0);OGTT胰岛素曲线下面积=(I0+2×I30 min+3×I60 min+4×I120 min+2×I180 min)/4。
1.直接用血浆胰岛素或C肽浓度来反映BCF:T1DM有效胰岛素浓度就是实实在在的BCF,如果不伴有IR,胰岛素浓度与正常值的差就是BCF受损的程度;胰岛素浓度占正常值的百分比,就是β细胞的残余功能。但是在T2DM患者,胰岛素或C肽浓度不仅取决于残余的β细胞功能,还受IR的影响。正常人在维持血糖恒定的前提下,随着IR逐渐增加,血浆胰岛素浓度相应上升,两者间有着良好的直线相关关系[9]。对于伴有IR的受试者来说,直接用血浆胰岛素或C肽浓度的变化来反映BCF,将两个影响因素的作用结果归结于β细胞残余功能这一个因素,显然是有失公允的。
2.用胰岛素浓度/血糖浓度比值表示BCF:如前所述,胰岛素浓度升高的程度取决于BCF的残余功能和IR,而血糖升高的程度则取决于BCF受损的程度与IR。所以,胰岛素(或C肽)/葡萄糖的比值可以理解为“胰岛素残余功能×IR”与“BCF受损程度×IR”的比值,简化为“胰岛素残余功能/BCF受损程度”。因此,这一类的BCF指数可以在一定程度上反映BCF的变化,但它反映的既不是残余的BCF,也不是BCF受损的程度。HOMA-β是一种修饰的胰岛素浓度与血糖浓度的比值,其理论上的正常值是100%,但是在空腹血糖正常的受试者中使用HOMA-β,容易出现>100%的结果。Khalili等[10]发现,许多糖代谢正常的人基线HOMA-β高于100%,而且这些人很容易在5年内发展为糖调节异常或糖尿病,这在逻辑上是难以接受的。ISI通常被认为是OGTT的早相BCF,该指数在少数受试者中可出现负数或零值[11]。真理是放之四海而皆准的,即使对于少数人不适用,也说明该指数缺乏存在的合理性。有研究者发现,在高血糖患者中C肽与葡萄糖的比值似乎比C肽可以更准确地评估BCF,C90-0/G90-0比值与葡萄糖钳夹试验的葡萄糖处置指数(dispostion index,DI)相关,该指数被认为是相当于经IS调整后的BCF[12, 13]。基于OGTT多点胰岛素的平均浓度或累积值与多点血糖的平均值或累积数值的比,反映的是该时段内的总体或平均BCF。用胰岛素浓度/血糖浓度比值来反映BCF,最大的问题是在糖代谢正常人中有时BCF与血糖水平之间没有相关性[14],其原因是IR引起了代偿性胰岛素分泌增加而血糖则恒定于正常水平。
3.理想状态下高浓度血糖刺激内源性胰岛素分泌:IVGTT-AIR和高糖钳夹下的胰岛素分泌试验,通常被认为是BCF的“金标准”。这类试验具有如下特征:(1)人为理想状态的试验结果,有别于自然状态下的实际BCF;(2)反映的是糖负荷状态下的BCF,与空腹状态下的BCF有别;(3)这类试验结果的计算单位,标明了其真实的病理生理学意义;(4)静脉注射葡萄糖刺激试验绕过了消化道内分泌调节因素的参与。所以,将这类试验与生理状态下(尤其是与空腹状态下)的某些BCF指数进行对比或一致性分析,其可比性有时是值得商榷的。
4.非葡萄糖胰岛素促泌剂刺激试验:胰岛β细胞膜上存在功能相对独立的非葡萄糖受体。一般认为,糖代谢紊乱的早期,β细胞首先失去对葡萄糖刺激的敏感性,第一时相或早期胰岛素分泌相首先消失,而非葡萄糖(如精氨酸、胰高糖素)刺激的胰岛素分泌反应可以依然保留,但随着病程的延长,这种功能亦逐渐下降。任何刺激引起的胰岛素分泌总量,都是平均单个β细胞分泌量与β细胞总数的乘积。胰岛素分泌总量减少可见于以下情况:(1)单个β细胞分泌量减少,β细胞总数正常;(2)β细胞总数变小(如胰腺占位性病变或者部分切除),单个β细胞分泌量正常;(3)单个β细胞分泌量与β细胞总数都减少[15]。所以,受试者对精氨酸刺激的反应优于葡萄糖刺激试验,可能是由于β细胞保留了对精氨酸刺激的反应性,精氨酸刺激后单个β细胞分泌量增加,这种情况不足以作为评估残余β细胞总数多少的依据。T2DM患者经过胰岛素强化治疗后,葡萄糖刺激的胰岛素分泌反应显著改善,胰高糖素刺激反应无显著变化,提示胰岛素强化治疗可改善β细胞对葡萄糖的反应性[16]。在精氨酸或胰高糖素刺激的基础上再增加葡萄糖刺激,胰岛素分泌反应高于单独的精氨酸或胰高糖素刺激试验,得到最大的胰岛素分泌反应性[17]。因此,葡萄糖刺激与非葡萄糖刺激β细胞反应通路具有相对的独立性。
5.对血浆胰岛素品质的评估:血浆总胰岛素包括真胰岛素及少量胰岛素原,胰岛素原没有糖代谢生物学作用,但是在BCF代偿的情况下,其分泌比例可能会显著增高。所以,胰岛素原与胰岛素的比值可作为评估BCF代偿程度和胰岛素实际生物学作用的参考,但是在胰岛素浓度显著低下时是没有实际意义的。使用以上指数检测BCF,除了功能衰竭可以一目了然外,大多情况下并不能直接得出BCF是否正常、代偿或代偿不全的结论,这些指数也不能提供BCF损伤程度和残余功能的信息。但是,这并不影响它们可以用于组间对照或自身对照研究。
所谓IS是指定量的胰岛素作用于靶细胞在单位时间内产生的糖代谢生物学效应。经典的检测方法是静脉糖耐量试验-微小模型-胰岛素敏感性(intravenous glucose tolerance test-minimal model-insulin sensitivity,IVGTT-MM-IS)、高胰岛素-正糖钳夹试验。IS或者IR指数不仅可提供糖代谢主要生理或病理生理学信息,还是评估BCF不可或缺的校正系数[18]。目前临床研究常用的IS和IR指数有血浆胰岛素或C肽浓度、稳态模型评估胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR)、空腹IR指数[19]、肝脏IR指数[20]、QUICK指数、Bennett IS、李光伟指数、Matsuda指数、胰岛素抑制试验、甘油三酯葡萄糖指数、Stumvoll指数、Gutt指数等。基于IR与血糖和血浆胰岛素浓度正相关的原理,大多数IR指数都是用“血糖浓度×胰岛素浓度”或“血浆C肽浓度×胰岛素浓度”计算出来的,少数指数在血糖、胰岛素两个参数之外还整合了体格指数与脂质代谢等参数。
高胰岛素-正糖钳夹试验是目前公认的IS“金标准”,它是在稳态下给受试者以120 mU·m-2·min-1的速度静脉输注胰岛素,同时又静脉输注葡萄糖将血糖稳定在(5.0±0.3)mmol/L的情况下得出的葡萄糖代谢率(mg·kg-1·min-1·μU-1)。这个试验有如下特点:(1)注射外源性胰岛素不可能模拟内源性胰岛素的脉冲式分泌,单位剂量外源性胰岛素的生物效应可能与内源性胰岛素有别。(2)大剂量外源性胰岛素几乎完全抑制了肝糖输出,试验结果反映的是肌肉对葡萄糖的摄取速率;肌肉糖代谢率的变化主要影响餐后血糖,所以该试验得到的IS相当于餐后IS。(3)这可能是血浆胰岛素浓度达到或者接近靶细胞胰岛素受体饱和状态下的葡萄糖代谢速率。(4)与本试验类似的试验还有IVGTT-MM-IS,这两种试验是真IS试验;它们真正反映了“在某种试验状态下定量的胰岛素作用于靶细胞在单位时间内产生的糖代谢生物学效应”。
高胰岛素-正糖钳夹试验和IVGTT-MM-IS之外的其他IS指数,大多是基于“IR=血糖浓度×胰岛素浓度”的原理形成的,这些指数充其量只能算作IS或IR的替代指数。胰岛素需要量=血糖/IS,在维持血糖恒定于正常水平的状态下,IS每下降一半胰岛素需要量都要增加1倍;IS与胰岛素需要量之间的数量关系是半数下降导致倍数增长的关系。所以一些IS或IR公式对胰岛素和血糖原始数据进行了对数或开平方处理。
以HOMA-IR为代表的由FINS和空腹血糖计算出的IR指数,它反映的是空腹(主要是肝脏)IR[21, 22]。这一特性与高胰岛素-正糖钳夹试验形成鲜明的对应关系,后者反映的是糖负荷状态下的IS。另外,HOMA-IR使用了正常人理想状态下FINS和空腹血糖的乘积(22.5)作为校正系数[2]。所以,HOMA-IR指数可以理解为受试者IR与正常人IR程度的比值。这样看来,尽管开发HOMA-IR的初衷是使用简便的办法以适应大样本群体研究的需要,但是它的特性却决定着它应该可以用于个体空腹IR状态的诊断。但是,当空腹血糖低于3.5 mmol/L时不宜使用HOMA-IR[21]。与HOMA-IR形式相似但是校正指数为25的空腹IR指数,可以用于包括空腹血糖<3.5 mmol/L的受试者[15]。QUICK指数、Bennett IS、李光伟指数等没有像HOMA-IR那样使用正常人的数据进行校正,也没有正常值范围,但这并不影响它们用于组间对照或自身前后对照研究。
Matsuda指数是一个典型的糖负荷状态下的时段IS指数,亦称为全身IS指数[23],指数中的胰岛素是葡萄糖经消化道摄入与吸收后,生理信号刺激的内源性胰岛素,其浓度未必达到或接近饱和状态。甘油三酯葡萄糖指数、Stumvoll指数和Gutt指数[24]等一些指数中还引入了人体测量学数据、血脂或细胞因子等参数,这些参数在群体研究中显示出与真IS变化之间具有显著相关性,这些IS指数反映的是平均IS或者全身IS[25]。Hanley等[26]曾经将收集到的18个时点和时段IS替代指数用于T2DM的预测研究,结果发现时段或整体IS指数,尤其是Gutt IS I0,120的预测力度是时点IS指数不可比拟的。
DI是受试者在某种试验状态下血浆胰岛素产生的实际糖代谢生物学效应,理论上的计算方法是某一时点或时段的胰岛素浓度与IS的乘积[27]。Bergman等[27]基于BCF与IS之间闭环调节血糖的原理,提出BCF(实际上是胰岛素浓度)与IS之间呈现双曲线关系,在血糖正常的情况下它们的乘积保持一个常数。受试者的BCF与IS之间符合模型log(BCF)=常数+β×log(IS),β近似等于-1,95%可信区间排除0,则相应的BCF和IS指数之间存在双曲线关系。Kahn等[28]基于对93例包括体重正常、超重及不同程度肥胖、年龄<45岁和血糖<6.4 mmol/L的受试者进行了分析,用IVGTT-MM-IS与IVGTT-BCF、精氨酸试验BCF,发现ln FINS、ln AIRglucos、ln AIRarg、ln AIRmax等BCF指数与IVGTT-MM-IS之间呈显著的曲线与倒数关系,符合双曲线方程式BCF×IS=常数的要求,散点图上可以直观地表明每个受试者初始及随访后DI所处的位置及糖代谢的变化轨迹。糖代谢正常者IS任何程度的变化都伴随BCF相应程度的代偿性反应。最近有研究表明,OGTT的时段BCF与时段IS计算DI才是合情合理的[29]。
早期证实的可用于计算DI的BCF都源于IVGTT、高糖钳夹试验及精氨酸刺激试验,IS则来源于IVGTT-MM-IS和正糖钳夹试验,这些DI基本上源于“实际胰岛素浓度与IS的乘积”,是“真实的DI”。Bergman等[27]发现,IVGTT期间的1相和2相BCF中,只有2相BCF与IS之间具有双曲线关系。研究发现,空腹血糖≥6.4 mmol/L者AIR消失,IS与AIR之间在血糖正常人可见的相关性随之消失,他们认为IS与AIR之间存在双曲线关系,受试者的空腹血糖必须<6.4 mmol/L[29]。有学者对受试者进行静脉糖耐量试验,直接用10 min内外周血胰岛素浓度的均值代表AIR(1相)胰岛素分泌,与IS之间具有良好的双曲线关系[30]。此外,他们还证明了精氨酸试验的AIR与IS之间的双曲线关系。
目前文献中用各种BCF与IS的替代指数计算DI(非真实的DI)的情况比较普遍。基于血糖曲线上任一点的血糖值取决于这一时点的BCF及IS的原理,用同一时点或时段的BCF与IS替代指数计算DI理论上是最合适的。但是研究发现,有时不在同一时点或时段的BCF与IS或IR替代指数,它们之间的变化也有存在双曲线关系的“巧合”。基于ISI与1/FINS之间的双曲线关系存在于包括正常人及所有糖代谢异常的受试者中,随着糖耐量的恶化,曲线向左下偏移,该DI简称为DI0。而ISI与HOMA-IR之间的双曲线关系只存在于正常人及糖调节异常的患者,在T2DM患者中则消失殆尽[11,31]。胰岛素生成指数与FINS的倒数之间,在糖代谢正常及各种糖代谢异常的患者中都存在显著的双曲线关系,其DI还可以预测糖代谢正常人10年内发展为糖尿病的危险。Retnakaran等[32]还证明,在糖代谢正常的人群中,OGTT的AUCins/AUCgluc与Matsuda指数相关,ISI与1/FINS和1/HOMA-IR相关;IVGTT-AIR和IVGTT-MM-IS之间,AUCins/AUCgluc与Matsuda指数之间的关系,完全符合双曲线相关的条件,而ISI与1/FINS以及ISI与1/HOMA-IR之间的相关性不完全符合条件。Retnakaran等[33]报道,BCF指数ISI、Stumvoll 1相BCF、Stumvoll 2相BCF、AUCins/AUCgluc以及增量AUCΔins/AUCΔgluc与Matsuda指数及HOMA-IR的倒数之间,只有AUCins/AUCgluc与Matsuda指数之间在糖代谢正常、糖耐量受损及糖尿病患者中存在显著的双曲线关系,其DI随着糖异常的加重而进行性下降;他们将AUCins/AUCgluc与Matsuda指数求得的DI称为BCF-敏感指数2。最近他们又报道,T2DM患者在基础状态下用BCF-敏感指数2、ISI/HOMA-IR、ΔCPT0-120/ΔGS0-120×Matsuda和ΔI0-120/ΔGS0-120×Matsuda四种DI评估胰岛素功能,发现BCF-敏感指数2是短期胰岛素强化治疗获得长期缓解的最强预测指数,其他指数的作用微弱[34]。看来,还是符合规则与原理的DI才是最有用的。
DI整合了同一时点或时段BCF和IS两个糖代谢调节参数的信息,直观地量化糖调节能力及其动态变化,还可作为T2DM患者短期胰岛素治疗后糖尿病获得缓解的预测指数[34]。目前的问题是,有些BCF指数并非实际胰岛素浓度,部分IS或IR指标也没有确切地反映受试者在某些状态下胰岛素作用于靶细胞在单位时间内糖代谢生物学效应的变化。所以,即使是同一时点或时段的BCF指标与IS指标之间,也未必存在典型双曲线关系。
1.指数选择与研究对象或研究目的不相匹配:之所以用正糖钳夹试验测定的IS与常用的BCF指数如AIR、HOMA-β以及ΔI30/ΔI0组合,只能解释餐后2 h血糖的20%和OGTT平均血糖30%的变化,其主要原因是研究选择的BCF及IS指数与餐后2 h血糖和OGTT平均血糖不匹配。餐后2 h血糖的变化取决于餐后2 h的BCF和IS指数,OGTT平均血糖的变化取决于平均BCF和平均IS指数。其次,HOMA-β以及ΔI30/ΔI0并非真正意义上的BCF,它们反映的是BCF变化的趋势。单纯空腹升高的机制主要是空腹BCF和IS下降,而餐后血糖升高则主要是餐后BCF和IS异常;正糖钳夹试验的IS反映糖负荷稳态下的IS,与OGTT的餐后时点或平均IS的确切关系尚不明确。正糖钳夹试验对于单纯空腹血糖受损者,不是一个敏感的IS指标;对于单纯糖耐量减低,使用HOMA-IR也未必得出理想的结果[35]。不同干预因素对糖代谢调节器官组织的影响也是不一样的,作用于肝脏的干预治疗主要影响空腹血糖、空腹BCF及IS;而作用于骨骼肌的干预措施则主要影响餐后血糖、糖负荷状态下的BCF及IS。有学者在观察运动对IS的影响时发现,非糖尿病成人在基础状态下,单独使用FINS与QUICK指数的效果相仿,而且与IVGTT-MM-IS结果之间具有显著的相关性;但是运动训练后,QUICK和FINS都不能反映运动前后IS的变化,IVGTT-MM-IS与QUICK指数之间还得出了完全相反的结果[26]。其实这不一定是QUICK指数本身的问题,而是指数选择不当所致。再例如,研究T2DM预测指标时,考虑到绝大多数早期T2DM患者首先表现为餐后血糖升高,所以应该选择主要反映糖负荷后BCF与IS的指数[22],如果仅仅使用空腹BCF及IS指数,其效果大多是不理想的[36]。研究胃肠动力对糖代谢的影响时,单纯选用HOMA-IR显然是不够的,因为胃肠动力改变主要影响餐后血糖,糖负荷后IS及BCF的变化可能与胃肠动力之间关系更为密切[37]。
2.将空腹BCF与糖负荷后BCF或空腹IS指数与糖负荷后IS指数进行对标处理:最常见的例子是以钳夹试验结果为“金标准”,来验证或比较空腹BCF与IS替代指数[38]。其实,空腹IS检测结果与正糖钳夹试验结果的相关性与一致性或差别,可能不是两种检测方法的一致性或差别,而是空腹IS与糖负荷后IS的一致性或差别。
3.空腹BCF与糖负荷后(或餐后)IS指数搭配,或者空腹IS与糖负荷后(餐后)BCF搭配计算DI:如前所述,这种混搭虽然有时也可出现双曲线关系,但这并不是两者之间的必然联系,在一定的条件下它有可能存在,而在另一种情况下它可能会消失。
4.以偏盖全,不兼顾空腹与餐后两种状态:用单一的空腹IS或者BCF指数评估糖代谢紊乱或者预测受试者发生糖代谢异常的发生风险[39, 40]。有些研究虽然使用了多种IS的检测指数,但是没有兼顾空腹与餐后,而是使用同一时点的多个IS指数[41, 42]。糖代谢紊乱在发病及干预过程中,空腹与餐后胰岛素IS的变化不仅存在程度上的差别,有时甚至会出现变化方向上的对立。最近有研究发现,正常人在长时间饥饿后,肝脏IS显著改善,而IVGTT-MM-IS则显著下降[41, 42]。妊娠期糖尿病的血糖改变主要是餐后血糖升高,所以,餐后IS或BCF指数对于妊娠期糖尿病的预测与诊断效果显然要高于空腹指数[43]。但是,单纯使用空腹BCF及IS指数预测妊娠期糖尿病的研究并不罕见[44, 45]。
临床期待开发出新的BCF及IS指数,包括:(1)开发新的餐后时点BCF及IS指数:普通糖代谢异常有空腹血糖与餐后2 h血糖两个诊断切点,妊娠期糖尿病另外还有餐后1 h血糖的诊断切点。这3个切点中只有空腹血糖现在具有相应的BCF及IS指数,另外两个切点的指数尚且空缺。所以,开发与这3个诊断切点对应的时点BCF及IS指数具有必要性。(2)新的BCF指数要分门别类,分为代偿功能指数、功能损伤指数和残余功能指数。(3)新的BCF和IS指数既要符合糖调节的生理学与病理生理学原理,又要符合数学运算的规则,指数的计算单位要清晰明了。
综上,血糖曲线、BCF和IS都是动态变化的,血糖曲线上任意一点的血糖值取决于该时点的BCF和IS。正确使用BCF及IS指数,研究者必须秉持糖代谢的动态观,牢记血糖、BCF、IS三者之间的调节原理,弄清各种BCF及IS指数的特点与病理生理学意义。
崔世维. 胰岛β细胞功能及胰岛素敏感性指数在临床研究应用中的若干问题[J]. 中华糖尿病杂志, 2024, 16(1): 1-8. DOI: 10.3760/cma.j.cn115791-20231003-00213.
作者声明无利益冲突



























