
对比18F-前列腺特异性膜抗原(18F-PSMA)-1007 正电子发射体层摄影(PET)/CT与18F-脱氧葡萄糖(18F-FDG)PET/CT在脑胶质瘤分级诊断中的应用价值。
回顾性队列研究。纳入2022年8月—2023年3月西安交通大学第一附属医院脑胶质瘤患者32例,其中男16例、女16例,年龄19~79(50.3±13.2)岁。患者术前均行头颅18F-PSMA-1007 PET/CT和18F-FDG PET/CT检查,2次扫描间隔时间均<1周;均接受颅内占位切除术治疗,术后病理WHO分级Ⅱ级14例、Ⅲ6例、Ⅳ级12例。根据WHO分级将患者分为2组:Ⅲ~Ⅳ级18例为高级别胶质瘤(HGG)组,Ⅱ级14例为低级别胶质瘤(LGG)组。观察指标:(1)比较HGG组和LGG组在18F-PSMA-1007 PET/CT和18F-FDG PET/CT图像中病灶最大标准摄取值(SUVmax)、肿瘤/背景比值(TBR)的差异,统计2种不同示踪剂PET/CT显像在诊断HGG和LGG时的灵敏度、特异度和准确度。绘制受试者操作特征曲线并计算曲线下面积(AUC),评估2种示踪剂在胶质瘤分级中的诊断效能。(2)统计HGG组和LGG组中18F-PSMA-1007 PET/CT和18F-FDG PET/CT能够清晰显示病灶边界的病例数,比较2种显像方法在显示病灶边界清晰度上的差异。
LGG组18F-PSMA-1007 PET/CT和18F-FDG PET/CT的SUVmax分别为0.69±0.32、8.87±3.20,TBR分别为1.05±0.45、0.89±0.30;HGG组18F-PSMA-1007 PET/CT和18F-FDG PET/CT的SUVmax分别为5.39±3.88、11.85±3.54,TBR分别为12.99±10.60、1.25±0.54。LGG组18F-PSMA-1007 PET/CT和18F-FDG PET/CT的SUVmax、TBR均小于HGG组,差异均有统计学意义(P值均<0.05)。18F-PSMA-1007 PET/CT的SUVmax和TBR对HGG和LGG分级诊断的灵敏度、特异度、准确度和AUC均高于18F-FDG PET/CT。18F-PSMA-1007 PET/CT中TBR的AUC最高,为0.988(95%可信区间 0.960~1.000),相应的阈值为2.15;18F-FDG PET/CT TBR的AUC最低,为0.694(95%可信区间 0.512~0.877),相应的阈值为0.97。18F-PSMA-1007 PET/CT图像上HGG组和LGG组清晰显示病灶边界的病例均高于18F-FDG PET/CT图像,差异均有统计学意义(P=0.039、0.016)。
18F-PSMA-1007 PET/CT在胶质瘤分级诊断中具有潜在的诊断价值。与18F-FDG PET/CT相比,18F-PSMA-1007 PET/CT在区分高级别和低级别脑胶质瘤时,具有更高的灵敏度、特异度、准确度和诊断效能,可更清晰地描绘病变边界。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑胶质瘤为常见的颅内原发肿瘤,是原发性脑肿瘤的主要死亡原因[1]。根据WHO分类标准,脑胶质瘤病理检查可分为Ⅰ~Ⅳ级,其中Ⅰ~Ⅱ级为低级别胶质瘤(low-grade glioma,LGG),Ⅲ~Ⅳ级为高级别胶质瘤(high-grade glioma,HGG)[2]。脑胶质瘤分级不同会影响治疗的决策。目前,对于胶质瘤的影像学检查方法主要是MRI,但由于部分恶性胶质瘤在MRI中缺乏典型强化特征且肿瘤边界显示不清,在术前无法进行准确分级,不能满足临床诊疗的需求。PET/CT融合了功能代谢图像与解剖图像的优势,通过采用不同类型的示踪剂反映组织分子水平变化,较之传统MRI可提供更多的生物学信息,目前已越来越广泛地应用于临床[3]。18F‐脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)是目前最常用的PET示踪剂,然而,由于脑组织对FDG的高生理性摄取,FDG-PET并不是脑胶质瘤的理想成像方式[4]。前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)是一种Ⅱ型跨膜糖蛋白,在胶质瘤、结肠癌、乳腺癌等实体瘤的血管内皮中高表达[5]。然而,目前有关胶质瘤中PSMA表达情况的研究主要是个案报道和小样本量的研究,而且在评估高级别与低级别胶质瘤方面的研究报道相对较少。因此,在本研究中,我们比较18F-PSMA-1007 PET/CT和18F-FDG PET/CT在高、低级别胶质瘤患者中的显像情况,旨在为脑胶质瘤影像学分级诊断方法的选择提供参考。
纳入标准:(1)经手术切除病理证实为脑胶质瘤;(2)年龄≥18岁,既往未接受治疗;(3)术前均行头颅18F-PSMA-1007 PET/CT和18F-FDG PET/CT检查,检查间隔1周内。排除标准:(1)影像资料质量不佳或不完整;(2)孕妇,合并心血管、肝脏、肾脏等严重疾病,合并其他部位恶性肿瘤。
回顾性队列研究。纳入2022年8月—2023年8月西安交通大学第一附属医院32例脑胶质瘤的患者,其中男16例、女16例,年龄19~79(50.3±13.2)岁。术前均于3 d内,先后行头颅18F-PSMA-1007 PET/CT和18F-FDG PET/CT检查。脑胶质瘤均为单发,病灶位于额叶12例、颞叶9例、顶叶6例、丘脑3例、枕叶1例、岛叶1例。患者均行颅内占位切除术治疗,术后病理检查:星形细胞瘤14例,间变性星形细胞瘤4例,间变性少突神经胶质瘤2例,髓母细胞瘤12例;WHO分级Ⅱ级14例、Ⅲ6例、Ⅳ级12例。32例患者根据WHO分级分为2组:Ⅲ~Ⅳ级18例为高级别胶质瘤(HGG)组,男10例、女8例,年龄(53.6±12.9)岁;Ⅱ级14例为低级别胶质瘤(LGG)组男6例、女8例,年龄(45.9±12.7)岁。
本研究经西安交通大学第一附属医院伦理委员会批准(2022-X-173),所有患者签署知情同意书。
采用荷兰PHILIPS公司Gemini TF-64 PET/CT扫描仪,在美国GE公司MINItrace小型回旋加速器及多功能合成模块上合成18F-PSMA和18F-FDG,放射性化学纯度均>95%,产品通过无菌和无热原测试,符合放射性药品使用要求。18F-FDG PET/CT检查前患者禁食>6 h,控制血糖水平≤11.1 mmol/L;18F-PSMA PET/CT检查前患者无需特殊准备。18F-PSMA-1007和18F-FDG的肘静脉注射,剂量为3.7~4.5 MBq/kg,患者安静休息40 min后行头颅PET/CT显像。患者仰卧位,扫描范围颅顶至枕骨大孔。首先进行低剂量CT扫描,扫描参数:电压100 kV,电流120 mA,螺距0.531∶1,球管单圈旋转时间0.8 s,层厚3.75 mm;保持患者体位不变,进行PET扫描,采用3D模式采集10 min。PET数据经CT衰减校正、迭代法重建后传送至后处理工作站,经图像重建获得横断面、冠状面及矢状面多幅图像及融合图像。
由2名具有10年以上工作经验的高级职称核医学医师采用双盲法对18F-FDG和18F-PSMA-1007 PET/CT成像结果进行独立测量、分析判断,测量结果取平均值;若2位医师分析判断意见有分歧时经共同讨论达成一致诊断意见。
在PET图像上选取病灶摄取最高的区域,避开坏死囊变区域沿病灶周边勾画圆形ROI,ROI直径10~15 mm,计算脑胶质瘤病灶的最大标准摄取值(maximum standard uptake value,SUVmax)。同时,在对侧镜像位置勾画相同直径的ROI,计算大脑灰质ROI的SUVmax。脑胶质瘤病灶的肿瘤/背景比值(tumor background ratio,TBR)=病灶SUVmax/大脑灰质SUVmax。
(1)观察18F-PSMA-1007 PET/CT和18F-FDG PET/CT图像中病灶SUVmax与TBR在HGG组和LGG组间的差异,统计2种不同示踪剂PET/CT显像在诊断HGG和LGG时的灵敏度、特异度和准确度。绘制ROC曲线并计算AUC,以评估2种示踪剂在胶质瘤分级中的诊断效能。(2)统计HGG组和LGG组中18F-PSMA-1007 PET/CT和18F-FDG PET/CT能够清晰显示病灶边界的病例数,比较2种显像方法清晰显示病灶边界例数的差异。
应用SPSS 26.0及GraphPad Prism 5.0软件分析数据。服从正态分布的计量数据以±s表示,组间比较采用独立样本t检验。分类资料以频数表示,采用Fisher确切概率法或配对χ2检验。绘制ROC曲线,获得18F-PSMA-1007 PET/CT和18F-FDG PET/CT各观察指标鉴别HGG与LGG的最佳截断值,根据约登指数最大值计算各观察指标相对应的灵敏度及特异度。采用ICC评估不同观察者间测量结果的一致性:ICC>0.8,一致性好;ICC 0.6~0.8,一致性中等;ICC<0.6,一致性差。以P<0.05为差异有统计学意义。
HGG组与LGG组胶质瘤患者年龄(t=1.68)、性别构成上(P=0.722)差异均无统计学意义(P值均>0.05)。
2名观察者间测量结果的一致性检验ICC均>0.8,一致性好。
LGG组18F-FDG PET/CT和18F-PSMA-1007 PET/CT的SUVmax、TBR均小于HGG组,差异均有统计学意义(P值均<0.05)。见表1。
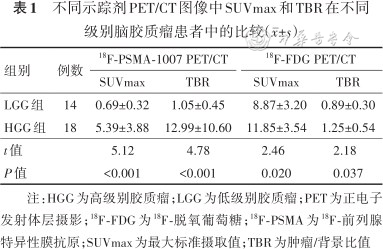
不同示踪剂PET/CT图像中SUVmax和TBR在不同级别脑胶质瘤患者中的比较(±s)
不同示踪剂PET/CT图像中SUVmax和TBR在不同级别脑胶质瘤患者中的比较(±s)
| 组别 | 例数 | 18F-PSMA-1007 PET/CT | 18F-FDG PET/CT | ||
|---|---|---|---|---|---|
| SUVmax | TBR | SUVmax | TBR | ||
| LGG组 | 14 | 0.69±0.32 | 1.05±0.45 | 8.87±3.20 | 0.89±0.30 |
| HGG组 | 18 | 5.39±3.88 | 12.99±10.60 | 11.85±3.54 | 1.25±0.54 |
| t值 | 5.12 | 4.78 | 2.46 | 2.18 | |
| P值 | <0.001 | <0.001 | 0.020 | 0.037 | |
注:HGG为高级别胶质瘤;LGG为低级别胶质瘤;PET为正电子发射体层摄影;18F-FDG为18F-脱氧葡萄糖;18F-PSMA为18F-前列腺特异性膜抗原;SUVmax为最大标准摄取值;TBR为肿瘤/背景比值
18F-PSMA-1007 PET/CT的SUVmax和TBR在鉴别LGG、HGG时的灵敏度、特异度、准确度和AUC均高于18F-FDG PET/CT;其中18F-PSMA-1007 PET/CT的TBR的AUC最高,相应的阈值为2.15;18F-FDG PET/CT的TBR的AUC最低,相应的阈值为0.97。见表2、图1。
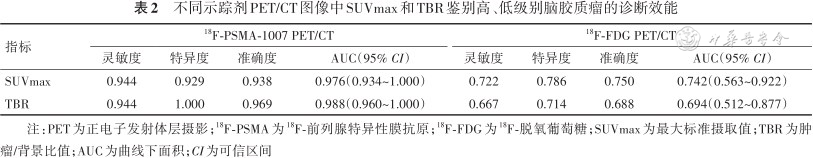
不同示踪剂PET/CT图像中SUVmax和TBR鉴别高、低级别脑胶质瘤的诊断效能
不同示踪剂PET/CT图像中SUVmax和TBR鉴别高、低级别脑胶质瘤的诊断效能
| 指标 | 18F-PSMA-1007 PET/CT | 18F-FDG PET/CT | ||||||
|---|---|---|---|---|---|---|---|---|
| 灵敏度 | 特异度 | 准确度 | AUC(95% CI) | 灵敏度 | 特异度 | 准确度 | AUC(95% CI) | |
| SUVmax | 0.944 | 0.929 | 0.938 | 0.976(0.934~1.000) | 0.722 | 0.786 | 0.750 | 0.742(0.563~0.922) |
| TBR | 0.944 | 1.000 | 0.969 | 0.988(0.960~1.000) | 0.667 | 0.714 | 0.688 | 0.694(0.512~0.877) |
注:PET为正电子发射体层摄影;18F-PSMA为18F-前列腺特异性膜抗原;18F-FDG为18F-脱氧葡萄糖;SUVmax为最大标准摄取值;TBR为肿瘤/背景比值;AUC为曲线下面积;CI为可信区间
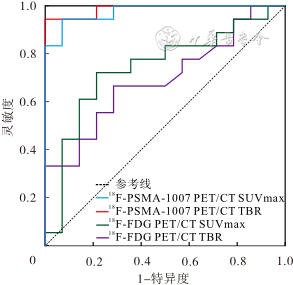

注:PET为正电子发射体层摄影;18F-FDG为18F-脱氧葡萄糖;18F-PSMA为18F-前列腺特异性膜抗原;SUVmax为最大标准摄取值;TBR为肿瘤/背景比值
以正常脑灰质为对照,18F-PSMA-1007 PET/CT图像上HGG组和LGG组清晰显示病灶边界的病例数均高于18F-FDG PET/CT,差异均有统计学意义(P值均<0.05)。见表3。典型病例见图2。
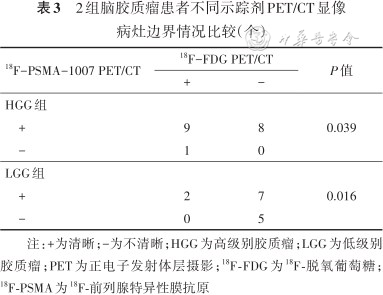
2组脑胶质瘤患者不同示踪剂PET/CT显像病灶边界情况比较(个)
2组脑胶质瘤患者不同示踪剂PET/CT显像病灶边界情况比较(个)
| 18F-PSMA-1007 PET/CT | 18F-FDG PET/CT | P值 | |
|---|---|---|---|
| + | - | ||
| HGG组 | 0.039 | ||
| + | 9 | 8 | |
| - | 1 | 0 | |
| LGG组 | 0.016 | ||
| + | 2 | 7 | |
| - | 0 | 5 | |
注:+为清晰;-为不清晰;HGG为高级别胶质瘤;LGG为低级别胶质瘤;PET为正电子发射体层摄影;18F-FDG为18F-脱氧葡萄糖;18F-PSMA为18F-前列腺特异性膜抗原
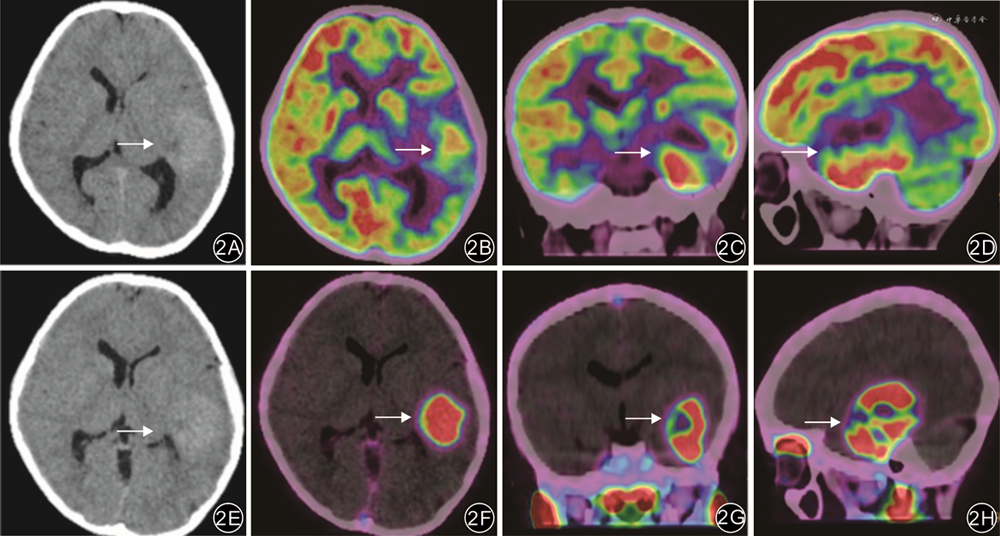

不同级别的神经胶质瘤患者具有不同的临床结局:HGG的预后不良,几乎所有患者在手术后会出现复发;而LGG患者在数年内通常没有或只有少数患者病情发生进展[6]。在手术前对脑胶质瘤患者进行无创分级评估有助于制定正确的治疗方案。目前,不同PET示踪剂在脑胶质瘤分级诊断中的应用已有较多报道[7, 8, 9]。研究显示,正常脑组织与非肿瘤性病变(如炎症)对FDG的高摄取可能会干扰18F-FDG PET/CT对脑胶质瘤的准确诊断[10]。氨基酸类显像剂如11C-蛋氨酸(11C-methionine,11C-MET)在脑胶质瘤诊断中的应用仅次于18F-FDG,但大部分氨基酸代谢类显像剂半衰期过短,且特异度不高,导致其临床应用受限。PSMA作为靶向肿瘤新生血管的特异性标志物,可能为胶质瘤的诊疗一体化提供新的有效靶点,其中PET显像可实现肿瘤中PSMA表达程度的可视化,而基于α或β放射性核素(177Lu、225Ac)标记的PSMA可用于后续的放射性配体治疗[11],这是糖代谢及氨基酸代谢显像剂无法实现的。
SUVmax是描述肿瘤代谢特性的重要半定量参数,代表了ROI中最高的标准摄取值。由于坏死组织会影响肿瘤代谢的平均SUV,而且从ROI中排除所有的坏死区几乎是不可能的,因此我们选择SUVmax作为基础的研究指标。在探究不同级别脑胶质瘤对PSMA的摄取情况时,不同研究的结果有所不同。Akgun等[12]评估不同级别的脑胶质瘤与PSMA摄取值之间的关系,结果显示,Ⅳ级脑胶质瘤的SUVmax明显高于Ⅱ级和Ⅲ级,但在Ⅱ级和Ⅲ级脑胶质瘤间未观察到明显差异。然而,Sasikumar等[13]对13例脑胶质瘤患者68Ga-PSMA-11 PET/CT阳性病灶进行的研究得出了不同见解,13例患者中Ⅱ级1例、Ⅲ级2例、Ⅳ级10例,该研究结果显示,示踪剂的摄取强度与神经胶质瘤的级别并无显著关联。本研究结果显示,HGG组18F-PSMA-1007 PET/CT和18F-FDG PET/CT的SUVmax均高于LGG组,与Akgun等[12]的研究结论相似。除了SUVmax之外,TBR是另一个常用的PET成像参数,通过比较肿瘤区域与对侧相应正常组织区域摄取率,可减少个体因素对观察结果的影响,从而提供一种更为可靠、相对定量的测量方法。Verma等[14]使用PET/CT观察胶质瘤,结果发现,高级别脑胶质瘤表现出比低级别更高的TBR,这表明TBR在区分脑胶质瘤高、低级别方面具有潜在的临床价值。在本研究中,HGG组18F-PSMA-1007 PET/CT和18F-FDG PET/CT的TBR均高于LGG组,与Verma等[14]的研究结果一致。综上,本研究结果也提示SUVmax和TBR在脑胶质瘤分级诊断中具有潜在价值。
为了进一步确定使用不同示踪剂在PET显像中鉴别高、低级别胶质瘤最有效的代谢指标,Takahashi等[15]对44例HGG和19例LGG患者进行了18F-FDG PET和11C-MET PET扫描,并比较了SUVmax和TBR在脑胶质瘤分级诊断中的诊断效能,结果表明,TBR是一个更有效的指标,能更好地区分HGG和LGG,且11C-MET PET的TBR在诊断HGG和LGG时的AUC为0.800、阈值为3.0,诊断效能优于18F-FDG PET(AUC为0.773、阈值为0.9)。本研究也显示,18F-PSMA-1007 PET/CT在诊断高、低级别脑胶质瘤时的灵敏度、特异度、准确度及诊断效能均优于18F-FDG PET/CT,其中18F-PSMA-1007 PET/CT的TBR诊断HGG和LGG的AUC最高,为0.988,高于18F-FDG PET/CT TBR的0.694,与既往研究结论相似。因此,笔者认为,利用TBR进行脑胶质瘤分级诊断的方法适用于接受18F-PSMA-1007 PET/CT检查的患者,但可能不适用于接受18F-FDG PET/CT检查的患者。笔者分析原因,可能是LGG中的18F-FDG摄取量通常与正常白质相似,而HGG中的摄取量可能少于或相似于正常灰质,从而降低了病变检测的灵敏度。
由于脑胶质瘤的异质性和浸润性生长的特点,肿瘤边界的确定对于手术及术后放疗具有重要意义。由于正常脑实质缺乏对PSMA的生理性摄取,使图像对比度高,有利于大脑中代谢活跃病灶的显示。Şahin等[16]的研究结果显示,68Ga-PSMA PET/CT可清晰显示肿瘤界限,有助于区分肿瘤病灶和坏死组织,对精准指导勾画脑胶质瘤边界具有重要作用。Schwenck等[17]研究发现,与FDG PET/CT相比,PSMA进行PET/CT显像时肿瘤边界更为清晰。本研究结果也显示,HGG和LGG中18F-PSMA-1007 PET/CT清晰显示病灶边界的病例数高于18F-FDG PET/CT,与既往研究结论一致。本研究结果提示,18F-PSMA-1007 PET/CT在描绘肿瘤边界方面具有潜在优越性,可为患者手术及术后放疗提供精准影像学信息。
总之,18F-PSMA-1007 PET/CT在胶质瘤分级诊断中具有潜在价值,在区分高、低级别脑胶质瘤时的灵敏度、特异度、准确度、诊断效能及显示病灶边界清晰度上均优于18F-FDG PET/CT,为临床脑胶质瘤分级诊断选择更为敏感的示踪剂和评估指标提供参考。本研究的不足:(1)样本量少,缺少Ⅰ级神经胶质瘤的病例资料;(2)未对胶质瘤示踪剂摄取与分子基因型的相关性进行分析;(3)由于研究是基于回顾性分析设计,无法对PSMA在脑肿瘤组织中表达进行免疫组织化学验证。在今后的研究中,需扩大样本量,细化PET参数与脑胶质瘤基因型的相关性及其诊断效能的研究,并通过免疫组织化学技术对PSMA的应用价值进行验证。
尚宇, 刘军, 李瑞春, 等. 18F-PSMA-1007 PET/CT与18F-FDG PET/CT在脑胶质瘤分级评估中的对比研究[J]. 中华解剖与临床杂志, 2024, 29(1): 9-14. DOI: 10.3760/cma.j.cn101202-20231014-00111.
所有作者声明不存在利益冲突



























