结直肠癌腹主动脉旁淋巴结转移相对罕见。文献显示,根治性腹主动脉旁淋巴结清扫可使部分患者获得类似Ⅲ期结直肠癌的预后。关于结直肠癌腹主动脉旁淋巴结转移的手术指征、清扫区域和处理原则,仍有很多问题尚存争议,制约了该技术的推广和疗效评价。随着腹腔镜结直肠手术技术的提升,使得腹主动脉旁淋巴结清扫这项曾因操作复杂、高风险而令很多外科医生望而却步的术式变得安全可行。但该领域尚存在诸多问题,为了证实这项操作的生存获益,亟待开展多中心临床研究,以获得更多的高级别循证医学证据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌腹主动脉旁淋巴结(para-aortic lymph node,PALN)转移相对罕见。文献显示,根治性PALN清扫可使得部分患者生存获益[1, 2]。虽然随着腹腔镜结直肠手术技术的提升,使得PALN清扫这项曾因操作复杂、风险高而令很多外科医生望而却步的术式变得安全可行。但是,关于结直肠癌PALN转移的手术指征、清扫区域和处理原则,特别是如何将手术获益转化为更大的生存获益,仍存在很多争议和有待解决的问题,一定程度上制约了该技术的推广和疗效评价。本文从PALN转移的流行病学、分类及其诊断和治疗等方面进行阐述,以为临床提供参考。
PALN转移是结直肠癌一种相对罕见的淋巴结转移类型。文献报道,其发病率为1.2%~2.1%[3, 4, 5]。结直肠癌PLAN转移途径主要有两种:(1)沿肠系膜下动脉向上转移;(2)沿乙状结肠系膜和降结肠系膜与PALN和淋巴管相通的淋巴管网[6]。根据PALN转移的出现时间,可分为同时性转移和异时性转移。同时出现或在原发病灶术后6个月内出现的PALN转移,称为同时性转移;在原发病灶术后6个月之后出现的PALN转移,称为异时性转移。根据是否合并其他转移,又分为孤立性和混合性PALN转移。孤立性转移指的是仅有PALN转移,发生率仅为1.2%[5];混合性转移指的是PALN转移合并其他脏器转移,如合并肝、肺、骨、脑及腹腔转移等[7]。
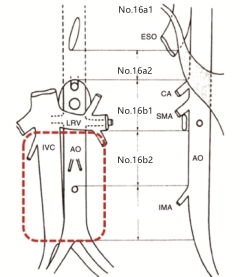
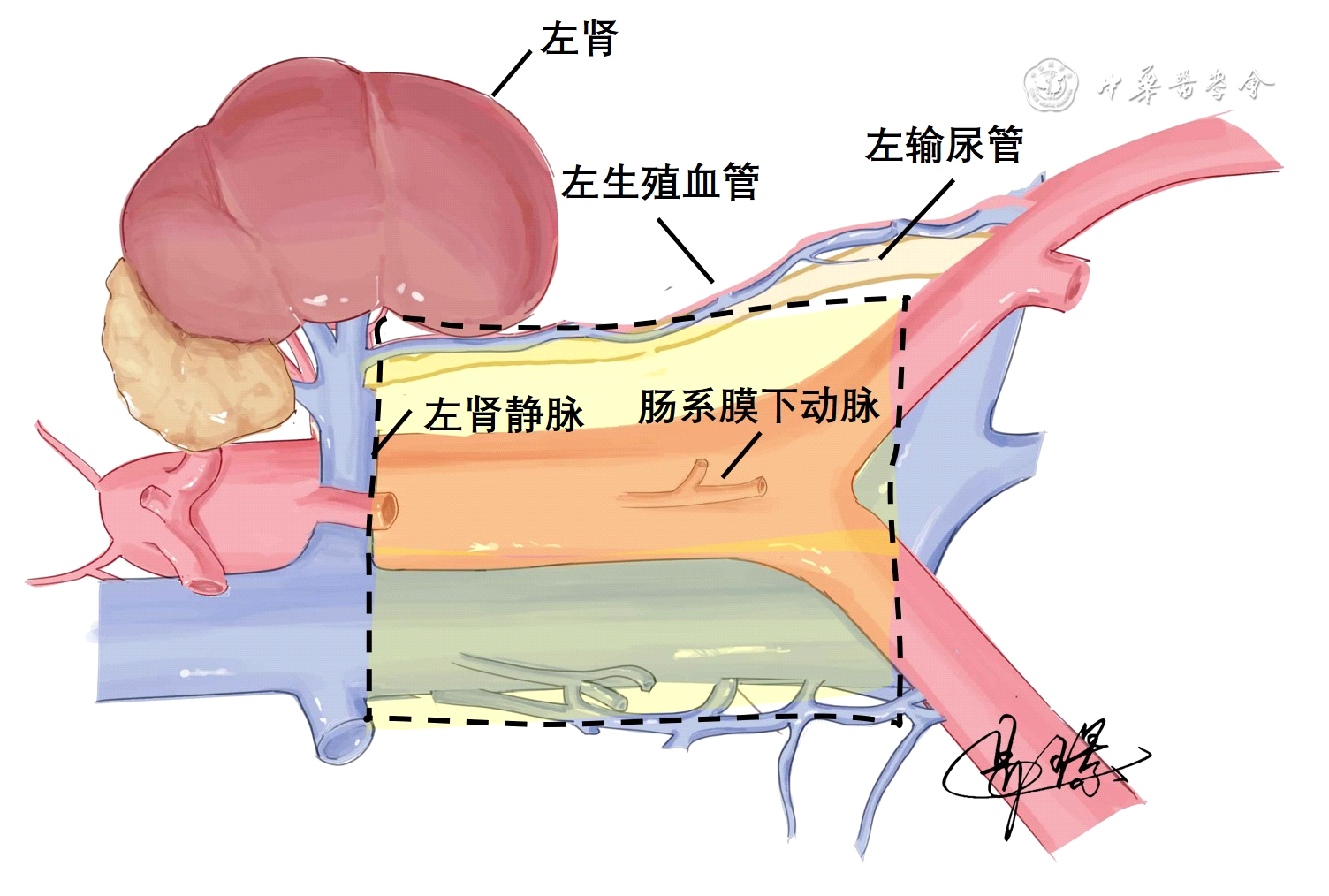
按照第12版日本《胃癌处理规约》描述的PALN与左肾静脉的关系,将PALN进一步划分为肾静脉上方的No.16a组和肾静脉下方的No.16b组,并自上而下划分为4个区域,分别为No.16a1(腹主动脉裂孔,即膈肌脚包绕的4~5 cm范围)、No.16a2(腹腔动脉根部上缘至左肾静脉下缘高度)、No.16b1(左肾静脉下缘至肠系膜下动脉根部上缘)和No.16b2(肠系膜下动脉根部上缘至髂总动脉分叉高度)[8, 9]。见图1。结直肠癌合并PALN转移的常规清扫范围为No.16b1和No.16b2。
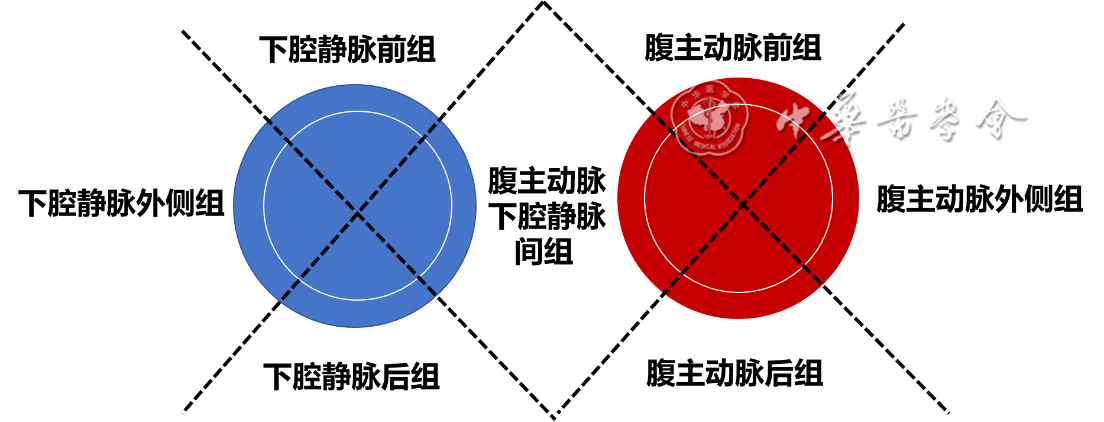
另外,以45°线将腹主动脉与下腔静脉的横截面纵切划分为7个区域,包括腹主动脉前组、下腔静脉前组、腹主动脉后组、下腔静脉后组、腹主动脉外侧组、下腔静脉外侧组及腹主动脉下腔静脉间组。见图2。

1.影像学诊断:因难以获得病理学诊断依据,影像学检查(包括CT、MRI和PET-CT等)仍是主要诊断手段,但尚无其诊断PALN转移的统一标准。通过CT或MRI测量淋巴结的短径,是诊断PALN转移最常用且最重要的参数。目前,关于疑诊PALN转移的最佳短径阈值尚未达成共识。不同文献报道,影像学上疑诊PALN转移的淋巴结短径界于5~10 mm之间[8, 9, 10, 11]。除淋巴结短径外,淋巴结形态不规则、内部信号不均匀、边缘不规则以及合并坏死和团块浸润等,对诊断PALN转移也有一定帮助。研究表明,综合淋巴结短径、形态及内部信号等CT指标来诊断PALN,其敏感性、特异性及准确性分别为50%、90%和80.3%[12]。
PET-CT检查目前尚未常规用于诊断结直肠癌PALN转移。PET-CT检查可从分子代谢角度反映淋巴结大小和形态,并排除其他部位转移,对下一步的诊疗计划具有重要指导意义,并使PALN清扫的手术指征更确切。但是,由于假阴性率为50.0%,PET-CT检查是否能提高PALN转移的诊断能力尚有争议[12]。
2.影像学诊断存在的问题:文献报道,影像学检查疑似PALN转移的结直肠癌患者行PALN清扫,其病理阳性符合率波动在30%~40%[10, 11,13]。术中根据肉眼观察PALN有无肿大来判断其有无转移,亦存在一定的误差。有研究表明,可借助术中快速冰冻病理诊断PALN转移,特别对合并PALN转移风险因素者(如肠系膜下动脉根部淋巴结转移)[13]。近年来,我们团队尝试通过腹腔镜下荧光标记引导的方式进行PALN清扫,以期提高术中的诊断率及R0切除率[14]。但仍需要深入研究以及更多临床研究的支持。
1.治疗现状:根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版的结直肠癌TNM分期系统,结直肠癌PALN转移被认为属于远处转移(M1)[11,15]。故建议行姑息性治疗。而根据日本《大肠癌处理规约》第9版描述,结直肠癌孤立性PALN转移患者的预后总体要优于出现肝、肺等转移者,与Ⅲ期肿瘤接近,应归为局部转移,建议对某些患者进行手术治疗[16]。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南并未就结直肠癌合并孤立性PALN转移进行明确规定[17]。既往,由于PALN转移发生率低、术前诊断准确率低、手术切除技术难度高及预后价值尚不明确,大多数外科医生并不积极主张进行手术干预,一般采用全身化疗[5]。然而,这很难彻底控制PALN转移。
2.PALN转移的清扫价值:近年来,对于结直肠癌PALN转移外科治疗的观点也在逐步发生转变。越来越多的研究表明,同时性清扫肾静脉水平以下的孤立性转移PALN,可能为患者带来生存获益,R0切除后的中位生存期为34~64个月,5年总生存率(overall survival,OS)为29.1%~53.4%[3,8,11,13]。Bae等[2]研究显示,结肠癌合并PALN转移清扫术后患者存活率与同期肝转移癌R0切除术后相当(33.9%比38.7%,P=0.080)。本中心一项纳入2010—2019年左半结直肠癌疑诊PALN转移并实施PALN清扫术的154例患者研究结果显示,PALN转移发生率为0.9%(47/5 052),PALN清扫的病理阳性符合率为30.5%(47/154),术后中位随访时间为43(5~119)个月,5年OS和中位生存期分别为62.7%和43个月,有无PALN转移的患者5年OS分别为37.7%和73.1%(P<0.001)[18]。
文献报道,PALN转移者的预后不良因素包括PALN转移数目>3枚、影像学PALN直径>10 mm、术前癌胚抗原检测水平>50 μg/L、R1或R2切除、术后未行辅助化疗以及直肠癌合并侧方淋巴结转移等[3,9,11,13]。如何处理PALN转移、以及哪些患者将从PALN清扫中受益的问题,再次被提出。
3.多学科团队治疗:结直肠癌合并PALN转移治疗方案尚无指南及共识的推荐,也缺乏高质量循证医学证据支持。我们认为,治疗上应遵循手术为主的多学科团队(multiple disciplinary team,MDT)治疗原则。对于同时性PALN转移者,术前需要进行评估,最大程度地使患者生存获益。参照文献[5]并结合我们团队的经验,建议:(1)若原发灶和PALN转移灶均可一期R0切除,则同期手术切除,术后再行辅助治疗,或考虑先术前新辅助治疗,评估治疗效果后,再及时手术切除;(2)若原发灶经MDT评估无法一期R0切除,则先行术前新辅助治疗,评估治疗效果,再决定手术时机。而对于异时性PALN转移者:(1)若已行规范的术后治疗,评估转移PALN可切除,即可手术切除;(2)若无法手术切除,可待MDT后,再评估疗效以决定是否手术。
1.转移PALN的清扫指征:术前准确评估PALN是否转移及其转移位置,是选择合适的患者进行PALN清扫的前提,可避免不必要的PALN清扫。此外,PALN清扫能否使结直肠癌PALN转移患者真正受益,需要掌握好PALN清扫的手术指征。文献报道的结直肠癌行PALN清扫的手术指征见表1。

文献报道的结直肠癌行腹主动脉旁淋巴结(PALN)清扫手术指征
文献报道的结直肠癌行腹主动脉旁淋巴结(PALN)清扫手术指征
第一作者 (按发表年份排序) | 年份 | 国家 | 肿瘤位置 | 病例数 | PALN清扫指征 |
|---|---|---|---|---|---|
| Bae SU [2] | 1988—2009 | 韩国 | 结肠癌 | 49 | 1. CT提示PALN>0.5 cm(短径);边缘不规则,PET呈高摄取 |
| 2. 无其他远处转移及盆侧方淋巴结转移 | |||||
| 3. 无肾血管水平以上PALN转移 | |||||
| Yamamoto S [11] | 1984—2011 | 日本 | 结直肠癌 | 54 | 1. CT、PET-CT怀疑PALN转移 |
| 2. PALN转移局限于左肾血管下方 | |||||
| 3. PALN转移可R0切除 | |||||
| Sahara K [10] | 1992—2012 | 日本 | 左半结直肠癌 | 322 | PALN>1 cm(长径) |
| Song SH [1] | 2004—2013 | 韩国 | 结直肠癌 | 40 | 1. CT提示PALN>0.8 cm(短径);边缘不规则,PET-CT呈高摄取 |
| 2. 肾血管水平以下PALN转移 | |||||
| Nakai H [13] | 2002—2013 | 日本 | 左半结直肠癌 | 93 | 1. CT提示PALN>1.0 cm(短轴);边缘不规则,信号不均匀,PET呈高摄取 |
| 2. 肾血管水平以下PALN转移 | |||||
| 3. PALN转移未累及大血管 | |||||
| Sun [18] | 2010—2019 | 中国 | 左半结直肠癌 | 154 | 1. 临床怀疑PALN转移 |
| 2. PALN转移局限于左肾血管下方 | |||||
| 3. PALN转移可R0切除 |
结合文献报道、肝转移治疗模式和我们团队的经验,以下患者可能从PALN清扫中获益:(1)影像学上疑诊:MR或CT提示淋巴结短径>0.8 cm,其内边缘不规则,合并坏死和团块浸润,或PET-CT显示高代谢摄取;(2)肿瘤学可根治:孤立的PALN转移,无不可切除的远处转移灶;(3)技术上可行:PALN转移局限于肾血管水平以下,未侵犯腹主动脉与下腔静脉;(4)全身情况好。
2.转移PALN清扫范围:目前文献上较为公认的根治性PALN清扫的上界为左肾静脉,下界为双侧髂总动脉,左侧界为左生殖血管内侧缘,右侧界为下腔静脉右侧缘[3]。见图3。Ichikawa等[19]的研究纳入2001—2008年期间的28例进行PALN清扫的结直肠癌患者,其中根治性PALN清扫组17例,靶向性PALN清扫组(仅清扫肿大淋巴结)11例;结果显示,根治性清扫组患者的3年无复发生存率(recurrence-free survival,RFS)优于靶向性清扫组,这提示,根治性PALN清扫是安全的,有助于延长RFS。

3.转移PALN的清扫方式:腹腔镜和机器人手术技术的出现和逐步成熟,让外科进入了微创时代,这些技术在直肠癌PALN清扫中也获得了尝试和推广。腹腔镜PALN清扫治疗妇科恶性肿瘤转移的手术效果良好[20, 21]。结直肠癌行腹腔镜下PALN清扫报道较少,多为回顾性、小样本(<50例)研究[8,11]。本中心至今已行微创(腹腔镜或机器人)PALN清扫150余例,初步结果显示,腹腔镜PALN清扫治疗临床怀疑PALN转移在技术上是可行的,并可能对某些患者有益[22]。
关于机器人PALN清扫,目前研究主要集中在妇科肿瘤手术[23, 24]。结直肠癌手术中应用较少。结合本团队经验笔者认为,应用机器人行PALN清扫,其优势在于灵活的腕关节,特别有利于化疗后位于腹主动脉左侧缘转移淋巴结的清扫,而腹腔镜直杆器械越过腹主动脉则难以操作。见图4。

4.PALN清扫的手术步骤:同时性PALN转移的清扫步骤(见视频1):(1)肠系膜下动脉根部分离与PALN探查:No.253淋巴结清扫与相关的结直肠癌根治术相同,即行肠系膜下动脉神经平面以下清扫,左腹膜后间隙显露,肠系膜下静脉根部切断。(2)下腔静脉前方清扫:沿右髂总动脉起始部右侧,清扫下腔静脉表面与腹主动脉右侧之间的淋巴脂肪组织,直至左肾静脉与空肠曲下缘(应先向上游离空肠曲),再显露横跨腹主动脉前上方的右肾静脉,注意保护十二指肠空肠曲和右腰动静脉。沿腹主动脉右侧上行的右肠系膜下神经丛是否保留,应根据其是否受转移的淋巴结浸润而定,有时在左肾静脉下方可见发自腹主动脉的右肾动脉,应注意保护。(3)腹主动脉左侧方清扫:沿左髂总动脉起始部左侧,清扫腹主动脉左侧与左生殖血管内侧之间的左腰大肌表面的淋巴脂肪组织,清扫至左肾静脉下方(左肾动脉常位于其后方或下方);在分离左髂总动脉左侧起始部时,应避免损伤走行于腰大肌表面的交感神经链以及左腰动静脉,沿腹主动脉左侧走行的肠系膜下神经丛是否切除,根据其转移淋巴结浸润而定。PALN清扫完成后见图5。
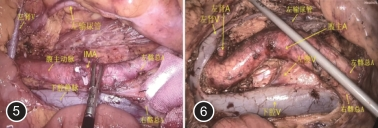

注:左肾V:左肾静脉;IMA:肠系膜下动脉;下腔V:下腔静脉;左肾A:左肾动脉;左腰V:左腰静脉;髂总A:髂总动脉
异时性PALN转移的清扫步骤(见视频2):(1)下腔静脉前方的淋巴结清扫:沿右髂总动脉起始部右侧,清扫下腔静脉与腹主动脉右侧淋巴组织,直至左肾静脉与空肠曲下缘。清扫过程中,注意保护右侧肠系膜下神经丛和右腰静脉。(2)腹主动脉前方的淋巴结清扫:沿左右髂总动脉分叉上方,向上清扫腹主动脉前方的淋巴脂肪组织,通常在髂总分叉点上方4 cm左右显露肠系膜下动脉(inferior mesenteric arter,IMA)残端,直至横跨腹主动脉前方的左肾静脉下缘。(3)腹主动脉左侧方的淋巴结清扫:应先分离粘连于裸露原左腹膜后上方的小肠,辨认显露保护“新”左半结肠内侧缘血管弓,避免损伤(特别是原行直肠癌根治术后),显露左输尿管,余下步骤同上。PALN清扫完成后见图6。
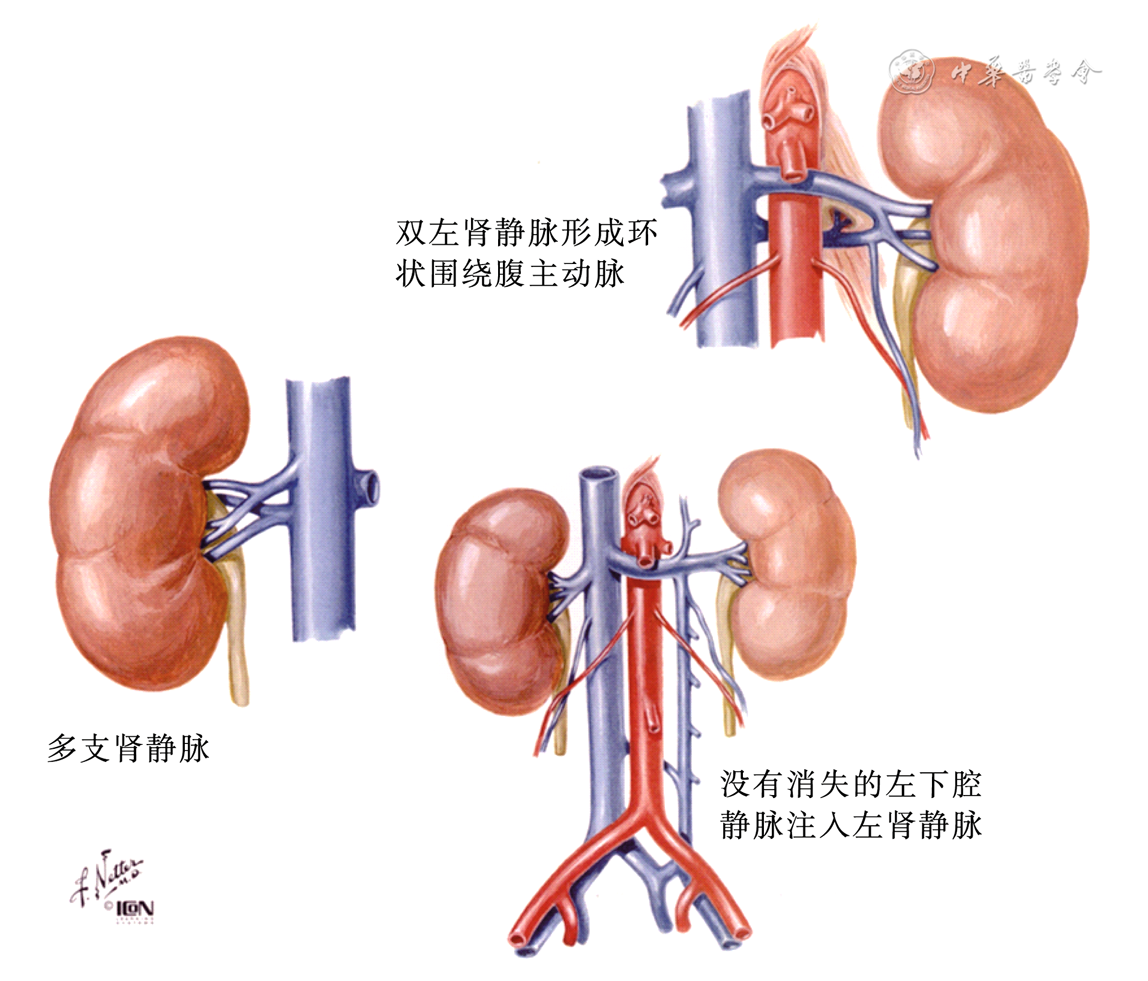
5.PALN清扫的注意要点:PALN清扫的操作难点主要在于左肾静脉的暴露,故熟悉左肾静脉的解剖及变异至关重要。文献报道,正常左肾静脉(left renal vein,LRV)主干由2~4个分支在出肾门之前汇合成1支,走行于肾动脉前方,穿越肠系膜上动脉和腹主动脉之间的夹角,向右汇入下腔静脉的左侧壁[25]。LRV解剖变异通常是指主干变异,主要包括主动脉后型LRV、LRV汇合过晚、环主动脉型LRV、左侧下腔静脉或双侧下腔静脉畸形及LRV异常回流[26]。见图7[27]。在分离裸化左肾静脉时,需注意小心操作,了解血管走形及周围组织结构,避免汇入血管及重要脏器损伤。
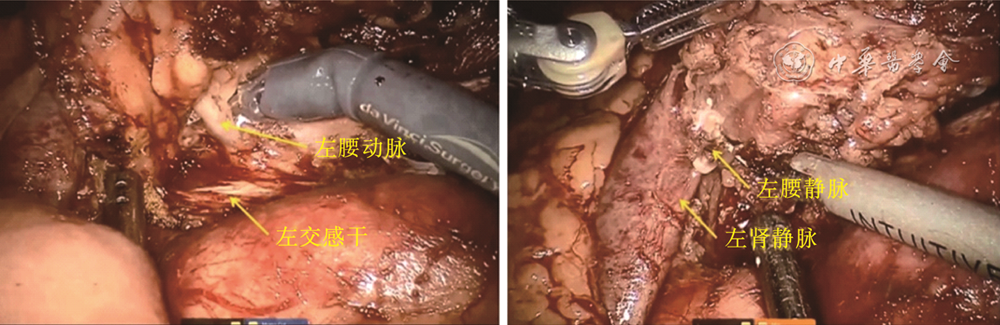
同时,在腹主动脉左侧方的淋巴结清扫时,要注意保护左腰交感干。故熟悉其解剖及走形对避免术中损伤有所帮助。左腰交感干与腹主动脉左缘相邻,两者相距0.5~2.0 cm,其中以相距1 cm者为多见。左腰交感干的下端位于左髂总静脉的后方。腰动脉均走行于腰交感干的深面。腰静脉位于腰交感干浅面者,以腰4、5静脉多见,有的腰5静脉自腰交感干浅面汇入左或右髂总静脉,且较粗大。位于浅面的腰静脉大多与相应的腰交感神经节毗邻,关系紧密[28]。见图8。
1.并发症:传统观点认为,PALN清扫涉及腹主动脉和下腔静脉等重要大血管,技术复杂,特别是术中大出血和输尿管等邻近脏器损伤的风险大,故术后并发症较多。近年来,文献报道的PALN清扫手术并发症的发生率为7.8%~26.9%,且以低等级为主,见表2。本中心既往一项纳入154例左半结直肠癌联合PALN清扫术的研究结果显示,术后总并发症发生率为27.3%(Clavien DindoⅡ~Ⅳ级),主要包括肺炎(11.0%)、乳糜漏(7.8%)和尿路感染(4.5%),其次还有吻合口漏、术后肠梗阻和手术部位感染(均各占1.9%)以及腹腔感染、腹腔内出血、胃排空延迟和败血症(均各占0.7%);无术后30 d内死亡[18]。我们的研究结果显示,结直肠癌PALN清扫安全可行,并未显著增加手术并发症。

文献报道的结直肠癌行腹主动脉旁淋巴结(PALN)清扫的术后并发症
文献报道的结直肠癌行腹主动脉旁淋巴结(PALN)清扫的术后并发症
第一作者 (按发表年份排序) | 年份 | 清扫 例数 | 并发症 [例(%)] | 并发症类型(例) |
|---|---|---|---|---|
| Choi PW[5] | 1993—2006 | 24 | 6(25.0) | 切口感染(3),肠梗阻(2),出血(1) |
| Ogura A[29] | 2004—2013 | 16 | 3(18.8) | 肠梗阻(1),出血(1),盆腔感染(1) |
| Bae SU[2] | 1988—2009 | 129 | 10(7.8) | 切口感染(4),肠梗阻(3),排尿困难(3) |
| Song SH[1] | 2004—2013 | 40 | 6(15.0) | 吻合口漏(2),肠梗阻(2),伪膜性肠炎(1),心绞痛(1) |
| Nakai N[13] | 2002—2013 | 93 | 25(26.9) | 腹腔内脓肿(6),吻合口漏(6),肠梗阻(4),泌尿系感染(4),切口感染(3),尿潴留(1), 乳糜漏(1) |
| Yamamoto S[11] | 2013—2018 | 11 | 3(27.3) | 肠梗阻(1),乳糜漏(1),神经源性膀胱(1) |
2. 乳糜漏预防和诊治:PALN区域含有重要的淋巴通道,包括腰淋巴干和肠淋巴干等,必须小心处理,防止可能发生乳糜漏。
本中心总结的结直肠癌根治术后腹腔乳糜漏的预防和治疗经验如下:(1)术中操作时应注意:开腹手术中,对较粗的淋巴管道或清扫位于淋巴干附近的淋巴结时,尽量少用电刀而采用丝线缝合或结扎,遵循淋巴清扫的完整性原则,避免淋巴结部分切除;腹腔镜手术中,采用超声刀慢档及双重烧灼,避免因术后淋巴管道封闭不完全或重新开放造成乳糜漏;手术完成时,对淋巴管聚集之创面喷洒医用或生物蛋白胶,可进一步预防术后乳糜漏的发生[30]。(2)术后应注意:术后第1天主动进食后,检查腹腔引流液甘油三酯水平,有助于乳糜漏的早期诊断[18]。(3)对于发生乳糜漏的患者,应采取积极保守治疗。我们初始即采用“禁食+全肠外营养+生长抑素”,使80%的患者在1周内治愈,总体保守治愈率为99.3%[18]。对于积极保守治疗6~8周以上仍未好转者,需要果断手术干预。难治性术后乳糜漏可采用ICG术前注射协助定位,综合采用电烧、生物蛋白胶、大网膜填塞等措施。
近年来,有研究表明,铜绿假单胞菌注射液可减少乳腺癌及甲状腺癌淋巴结清扫术后淋巴漏发生率,也有将铜绿假单胞菌注射液用于膀胱癌行盆腔淋巴结清扫术后的淋巴漏,均取得较为满意的疗效[31, 32, 33]。目前,尚无将铜绿假单胞菌注射液用于结直肠癌术后淋巴漏防治的相关报道。本中心的相关经验是大量蒸馏水冲洗腹腔腹主动脉与下腔静脉后吸净、擦干,特别注意左右髂总动脉起始部两侧、腹主动脉旁或左肾静脉下方有无大量清水涌出(淋巴管破裂),予缝扎,涂抹蛋白胶;采用铜绿假单胞菌注射液一支(1 ml)+生理盐水50 ml,喷洒于腹主动脉和下腔静脉周围;于盆底放置引流管并于3~5 h后开放。如此,取得了满意的疗效。
近年来,吲哚菁绿(indocyanine green,ICG)近红外光成像技术作为一种新的外科导航技术在乳腺癌、宫颈癌、非小细胞肺癌等肿瘤前哨淋巴结清扫定位上取得了较肯定的效果[34, 35, 36]。2006年,Nagata等[37]首次发表了ICG在结直肠外科手术的应用研究。Kawada等[38]报道了ICG引导下直肠癌侧方淋巴结清扫的个案,并在荧光成像的淋巴结中检测转移的淋巴结。Noji等[39]应用ICG检测肝门部恶性肿瘤的PALN转移。这为ICG荧光成像引导腹腔镜下结直肠癌手术,尤其是区域外淋巴结清扫提供了一个新的探索方向。然而,ICG存在一定的假阴性率,即术中ICG-FI图像上并未显影的淋巴结,但术后病理学检查提示存在转移淋巴结。这可能与进展期肿瘤阻塞淋巴管相关,以至于ICG不能回流,无法正常显影。探索ICG近红外光成像技术在识别左半结肠癌PALN转移的特异性和敏感性,对选择合适的人群进行PALN清扫有一定的临床意义。
池畔, 孙艳武. 结直肠癌腹主动脉旁淋巴结清扫研究进展[J]. 中华胃肠外科杂志, 2024,27(1):77-83. DOI: 10.3760/cma.j.cn441530-20230926- 00110.
福建医科大学易璟医生绘制本文部分图片
所有作者均声明不存在利益冲突