
中肾样腺癌是一种新近报道的罕见女性生殖系统肿瘤,因其组织学特点、免疫表型及分子改变均类似于起源于中肾管残件的宫颈中肾腺癌而得名,但是中肾样腺癌多发生于缺乏中肾管残件的子宫体和卵巢。因卵巢中肾样腺癌往往与子宫内膜异位症或苗勒管肿瘤相关而被认为其可能起源于苗勒管。中肾样腺癌多样性的组织结构与多种肿瘤形态存在交叉,极易误诊。现报道1例曾被误诊为尿路上皮癌的膀胱中肾样腺癌。本文将阐述其临床病理特征及鉴别诊断,并对中肾样腺癌起源加以探讨,以提高在临床诊疗过程中对该疾病的认识,避免漏诊误诊。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,50岁。因发现“膀胱占位11年伴间歇性肉眼血尿2个月”于2021年11月18日入院。患者11年前因“子宫腺肌症和卵巢子宫内膜异位囊肿”行子宫及双附件切除。当时彩超发现膀胱后壁大小约3.6 cm×1.9 cm的肿块,考虑子宫内膜异位症,未行治疗。随后每年复查超声,均未见膀胱肿块明显增大。2个月前患者无明显诱因出现肉眼血尿,无尿频、尿急、尿痛。外院腹部CT显示膀胱后壁大小约4.6 cm×3.1 cm软组织肿块,考虑子宫内膜异位症(图1)。肿瘤标志物CA19-9 446 kU/L,甲胎蛋白、癌胚抗原、CA125、CA153等无异常。正电子发射计算机断层扫描显示其他部位未见占位。外院膀胱肿物活检,病理诊断为具有腺样和肉瘤样分化的膀胱浸润性尿路上皮癌。患者随后在我院膀胱镜检查,见膀胱后壁一广基底肿物,大小约为3.0 cm×3.0 cm,活动度差,遂行“经尿道膀胱肿瘤切除术”。
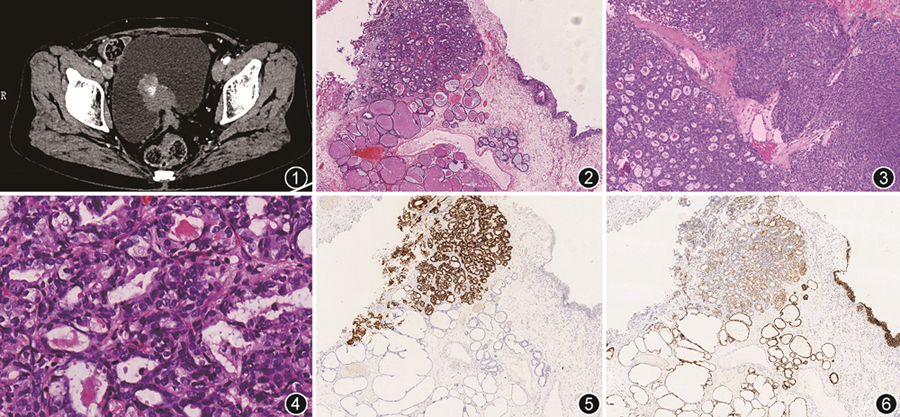

病理检查:外院活检及我院手术标本,大体检查:送检灰褐色碎组织,大小共约3.2 cm×3.2 cm×0.6 cm。镜下观察,肿瘤呈多种生长模式:假复层柱状或立方状细胞密集排列成乳头状、管状结构,部分管腔内见嗜酸性分泌物,局部梭形细胞实性生长,并与腺管状区域相移行(图2, 3, 4)。瘤细胞中等大,胞质少,细胞核轻至中度异型,空泡状,排列拥挤,部分可见核沟,形似甲状腺乳头状癌,核分裂象易见(约30个/10 HPF)。此外,瘤周及肌层见异位子宫内膜腺体及间质,内膜样腺体部分呈乳头状增生和黏液性化生,部分囊状扩张,腔内含嗜酸性分泌物,与肿瘤过渡。免疫组织化学:肿瘤细胞甲状腺转录因子1(TTF1)、PAX8、PAX2、p63、细胞角蛋白(CK)7、MLH1、PMS2、MSH2、MSH6弥漫阳性,GATA3和雌激素受体(ER)局灶阳性,TTF1与GATA3表达互补(图5,6);CD10呈腔缘阳性,p16斑驳状阳性,p53野生型表达,β-catenin呈膜质阳性,Calretinin、WT1、Napsin A、CK20、嗜铬粒素A(CgA)、突触素、CK5/6、甲状腺球蛋白(TG)、孕激素受体(PR)和CDX2阴性。瘤周组织中内膜样腺体PAX8、PAX2、ER阳性,TTF1、GATA3、CDX2阴性,间质细胞CD10阳性。形态与肿瘤有过渡的扩张腺体免疫表型类似于肿瘤,但缺乏腺体融合和细胞异型性,Ki-67低表达,符合中肾样分化(图2,5,6)。分子检测结果:使用二代测序,进行泛癌种425基因检测,检测到KRAS基因第2号外显子错义突变[NM_033360.4c.35G>T(p.Gly12Val)],ATRX基因第15号外显子错义突变[NM_000489.5c.4348G>A(p.Glu1450Lys)],HDAC2基因第6号外显子错义突变[NM_001527.4c.617T>G(p.Phe206Cys)]。本例中肾样腺癌组织样本未检测到POLE和TP53基因突变,且未检测出微卫星不稳定,按照癌症基因组图谱(TCGA)子宫内膜癌分子分型,属于低拷贝数组。
病理诊断:膀胱子宫内膜异位症,伴癌变,癌变成分为中肾样腺癌。
治疗与随访:患者未进行根治手术治疗,予多西他赛+卡铂方案化疗2个疗程,后联合抗PD1(帕博利珠单抗)免疫治疗和抗血管(安罗替尼)靶向治疗4个疗程。目前随访10个月,未见肿瘤复发和/或转移。
讨论:中肾样腺癌起源尚不明确,目前文献报道中肾样腺癌多发生于子宫内膜或卵巢,罕见于卵巢外子宫内膜异位症[1]。有报道卵巢中肾样腺癌与混合存在的子宫内膜异位症或苗勒管肿瘤具有同样的基因变异模式,因而表明二者存在克隆相关性。提示中肾样腺癌很可能是苗勒管向中肾管转化生的基础上发生的[2]。本例膀胱中肾样腺癌周围也存在子宫内膜异位症,而且部分内膜样腺体伴有中肾样分化。本例发现中肾样分化的异位内膜腺体与肿瘤混合存在,提示肿瘤可能是内膜样腺体中肾分化并恶变而来。
分子遗传学特征:研究数据显示76%~89%中肾样腺癌具有KRAS基因突变[2, 3],但不是诊断必需,因为KRAS突变并不特异,也存在于中肾腺癌[2]、子宫内膜样腺癌、浆液性癌等妇科肿瘤[4]。此外在部分中肾样腺癌还检测到在苗勒管肿瘤中常见的PIK3CA、PTEN和CTNNB1基因突变[2],这也进一步支持了中肾样腺癌起源于苗勒管并向中肾管分化的假说。本病例除了KRAS基因突变,还发现ATRX基因和HDAC2基因突变。在中肾腺癌、中肾样腺癌或子宫内膜癌中尚未见ATRX(α地中海贫血伴智力低下综合征X连锁)基因突变的报道。HDAC(组蛋白去乙酰化酶)家族是一类蛋白酶,通过对组蛋白修饰进行表观遗传学调控,其异常表达会促进癌症发展。有研究发现HDAC2在子宫内膜异位症中表达上调,其异常表达可能促进子宫内膜异位症的恶性转化[5],HDAC2可能也参与了本例膀胱子宫内膜异位症向中肾样腺癌的恶性转化。
肿瘤病理形态及免疫组织化学特征:中肾样腺癌表现为管状、性索样、乳头状和实性等多种生长模式混合存在,管腔内含有特征性的嗜酸性分泌物[6]。肿瘤细胞主要呈柱状或立方状,胞质稀少、淡染,细胞核轻至中度异型、空泡状,排列拥挤、重叠,可见核沟及小核仁,类似于甲状腺乳头状癌的核。中肾样腺癌典型的免疫组织化学表型是PAX8、PAX2、GATA3、TTF1阳性,而且TTF1与GATA3呈互补染色模式[7];CD10腔缘阳性,p53呈野生型表达模式[8]。ER、PR通常阴性,但部分病例可以局灶表达ER,因而ER表达并不能排除中肾样腺癌的诊断[3]。本例也可以观察到从异位子宫内膜样腺体、中肾样化生,到中肾样腺癌中,ER、PR表达呈现逐渐减弱的趋势。
鉴别诊断:中肾样腺癌结构多样,与很多肿瘤存在形态交叉,很容易误诊。发生于膀胱的中肾样腺癌需要与以下病变鉴别:(1)浸润性尿路上皮癌:中肾样腺癌容易误诊为伴有腺样、神经内分泌分化及肉瘤样亚型的尿路上皮癌,尿路上皮癌异型性和多形性更明显,肉瘤样型还会出现异源性分化,尿路上皮癌表达GATA3,但不表达TTF1和PAX8。(2)滑膜肉瘤:中肾样腺癌密集的腺管与梭形细胞相移行的形态类似滑膜肉瘤,但PAX8、TTF1、GATA3等阳性表达,而且缺乏滑膜肉瘤特征性SS18易位。(3)中肾腺癌:中肾样腺癌与中肾腺癌具有相似的组织学、免疫组织化学特征及分子改变,但二者发生部位不同,中肾腺癌发生于宫颈、阴道等部位,与中肾管残余及中肾管增生相关,ER、PR完全阴性,中肾腺癌可表达GATA3和TTF1,但TTF1阳性率低于中肾样腺癌,且未见TTF1与GATA3互补表达模式[7]。分子方面,除了与中肾腺癌共同的KRAS基因突变,中肾样腺癌还检测出苗勒管肿瘤中常见的PIK3CA、PTEN和CTNNB1基因突变。(4)透明细胞癌:膀胱透明细胞癌属于苗勒管肿瘤,通常发生在子宫内膜异位症基础上,也具有乳头状、管状及实性等多样性结构,其特征性靴钉样癌细胞及透明胞质罕见于中肾样腺癌[9]。二者均表达PAX8,少数中肾样腺癌也表达HNF1-beta和Napsin A[8],但透明细胞癌不表达TTF1和GATA3。(5)低级别子宫内膜样腺癌:也属于苗勒管肿瘤,有助于内膜样癌诊断的形态特征包括出现鳞状分化和细胞内黏液,缺乏腺腔内嗜酸性分泌物及甲状腺乳头状癌样细胞核,通常弥漫表达ER、PR[3],不表达GATA3、TTF1。但需要注意的是ER阴性/TTF1阳性,甚至同时存在KRAS突变的情况也可见于子宫内膜样癌,需要结合形态、MMR、p53及PTEN突变状态综合考虑[10]。(6)肾源性腺瘤:同样具有乳头状、管状结构,腔内可见嗜酸性分泌物,但肾源性腺瘤体积小,细胞异型小、胞质透亮、核分裂少,常与慢性膀胱炎相关[11]。(7)转移性甲状腺乳头状癌:二者具有相似的细胞核特征和结构模式,均表达PAX8和TTF1,但甲状腺乳头状癌表达TG,不表达PAX2、p63、GATA3,此外,具有甲状腺癌临床病史或影像改变。(8)转移性肺腺癌,因中肾样腺癌表达TTF1可能被诊断为转移性肺腺癌,而且转移至肺的中肾样腺癌也易误诊为原发性肺腺癌,但同时表达PAX8及临床病史支持中肾样腺癌的诊断。
治疗及预后:虽然呈现低级别形态[9],但是研究数据显示,子宫中肾样腺癌比一般的子宫内膜癌侵袭性强,容易复发,并发生肺、肝等远处转移[3]。目前治疗手段以手术为主,尚缺乏有效的辅助治疗方案。新近报道2例伴有KRAS基因突变的复发性子宫中肾样腺癌联合应用仑伐替尼和帕博利珠单抗具有较好疗效[12]。
中肾样腺癌是新近报道女性生殖系统肿瘤,我们报告1例罕见的源于子宫内膜异位症的膀胱中肾样腺癌,认识其多样的形态结构,避免误诊。
黄文清, 张龙, 付莎, 等. 子宫内膜异位症相关的女性膀胱中肾样腺癌1例[J]. 中华病理学杂志, 2024, 53(2): 201-203. DOI: 10.3760/cma.j.cn112151-20231007-00232.
所有作者声明无利益冲突



























