
儿童支气管管腔相对狭窄、肺部间质发育优于弹性组织、纤毛清除能力弱的生理结构使儿童更易发生肺部感染形成肺炎。人工智能(AI)的发展及其在医学领域的应用正在改变传统的疾病诊断、评估及治疗模式。以深度学习为核心的AI越来越多应用于儿童肺炎的诊断以及病情预后评估,有利于对患儿进行早期诊断、准确评估病情。除新型冠状病毒肺炎与急性呼吸窘迫综合征外,研究者很少关注其他病毒性肺炎、细菌性肺炎、支原体肺炎、真菌性肺炎,同时目前仍存在数据集少、样本量少、算法不完备等问题,且对于区分肺炎类型、亚型给予的关注度不够,有待改进。未来应建立儿童肺部感染的大样本数据集,开展医学生、医务人员对AI的学习,探索AI在儿童肺部感染中的更多价值,以推动其在诊疗相关临床决策时的辅助作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
由于儿童支气管管腔相对狭窄、肺部间质发育优于弹性组织、纤毛清除能力弱的生理结构,使儿童易发生肺部感染形成肺炎。肺炎是全球最常见的影响儿童健康的一种疾病[1,2,3]。其发病率高,诊断不明确、治疗不彻底、反复发作均可引起多种并发症,影响儿童发育及健康,是5岁以下儿童死亡的主要原因之一[4]。儿童肺炎的主要致病原为细菌、病毒、非典型病原体,不同年龄段主要致病原显著不同[5]。根据患儿的严重程度,可表现为不同程度的肺段实变、含气支气管征、多发肺结节、胸腔积液及肺不张等病理学变化[6,7]。除血常规等感染指标及病原学检测外,影像学检查是检查肺部、支气管病变的重要辅助诊断方法。
人工智能(artificial intelligence,AI)是以机器学习为核心,模拟、延伸和扩展人类智能的理论、技术及应用的科学。利用AI技术,使用计算机语言对图像、听觉数据等以往无法计算分析的数据类型进行分析处理,克服了传统分析方法的不足之处,在一定程度上提高了疾病诊断、治疗的准确性[8]。近年来已有较多研究将AI应用于儿童感染性肺炎的诊断和病情评估,并证实AI定量计算分析值与临床表现之间具有相关性[9]。现就AI的影像学分析技术在儿童感染性肺炎中的研究进展进行综述。
儿童胸部疾病常采用胸部X线平片、计算机断层扫描(computed tomography,CT)和磁共振成像3种较为常见的方式进行检查。胸部因肺组织含有大量气体,对于X射线类的影像检查具有良好的对比性,其检查简单方便、成本低,疾病阳性检出率较其他部位高,辐射剂量低[10],故常作为儿童肺部疾病诊断和治疗后随访的主要影像检查方法。临床常用的CT技术包括多排螺旋CT、高分辨率CT等。磁共振成像虽然无电离辐射,可多方位成像,但由于存在伪影的干扰,合并肺信号弱、扫描时间长、对比度较差、费用较高、对于不能配合的儿童需要镇静等缺点,故应用较少,尚处于探索阶段,需进一步研究[10,11]。需注意的是,尽管X线平片检查射线相对减少,但儿童正处于生长发育阶段,对X射线敏感且抵御能力远低于成人,过多的X射线照射可能影响儿童身体发育[12]。
AI是计算机对人类智能的模拟:通过计算机语言,将数据集整理分为训练集和验证集,在训练集中识别各数据的特点和相关性后构建模型输出结果,最后在验证集中加以验证。其内容包括智能医学成像系统、医学影像大数据与智能图像分析、医学影像与自然语言文本处理的结合分析[13,14]。
AI的核心是机器学习,主要包括监督式机器学习和无监督式机器学习[15]。其中,监督式机器学习模型主要用于诊断和预测模型的构建,目前主要包括神经网络模型、支持向量机、决策树和随机森林等,应根据不同数据的不同特征选取最佳算法。其中深度学习是机器学习中较为重要的一个子集,是指使用深度神经网络模型模拟人脑,其建立的模型往往具有多个参数和层数,在图像识别中具有重大优势[16]。深度学习强调模型结构的深度,具有多层隐藏层,意味较强的非线性表达能力,可进行更加复杂的非线性变换学习,因此在儿童肺炎的模型建立中较为常见,在疾病诊疗评估方面具有巨大潜力。但在当下,将AI运用在医疗中仍存有伦理问题,如患者隐私权的保护缺失、医学AI的技术依赖、医疗责任认定的难题等[17,18]。
当下胸部影像学检查人数增多所致的工作强度增高、低年资影像医师临床经验不足、阅片者主观决策偏差均可导致病灶检出敏感性差、识别率低[19]。故仅以传统的阅片方法进行图像分析诊断儿童肺炎是耗时且主观的,易致肺部病变的漏诊与误诊[20,21]。马敏涛等[22]对比了胸部X线、肺部超声、CT检查对儿童肺炎的诊断效能,其中胸部X线误诊率达8.2%。李娲[23]分析了儿童肺炎支原体肺炎采用低剂量CT扫描与X线胸片的临床效果,结果显示,CT组误诊率12.5%,漏诊率达7.5%,X线胸片误诊率45%,漏诊率达30%。人工阅片诊断的局限性为使用AI提高诊断的速度和准确性提供了强大的动力[24]。
AI可提供相关病变信息,其出具的诊断结果和"第二意见"可潜在提高影像诊断的一致性和规范性,减少漏诊、误诊出现,缩短诊断时间,但仅做参考作用,尚不能直接作为最终诊断[25]。既往研究显示,AI辅助肺炎诊断是有效的,是一种潜在的医疗诊断辅助工具,可使临床专家获得更快、更准确的诊断结果,从而提供相应的治疗[26,27,28,29,30],具体见表1。多数研究均使用了神经网络,并在预测中观察到较高的准确率[31]。可以推断,AI算法在一定程度上改善了肺炎的诊断速度和准确性。然而AI数据集获取途径特殊,一般情况下只能在医院获得,公开肺部影像数据集较少,故现阶段尚不成熟。
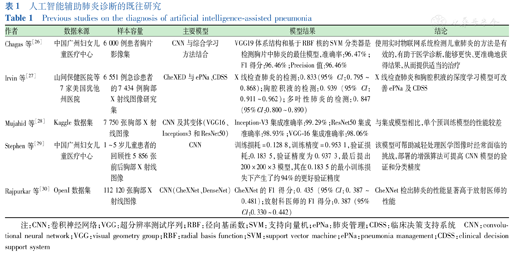
人工智能辅助肺炎诊断的既往研究
人工智能辅助肺炎诊断的既往研究
| 作者 | 数据来源 | 样本容量 | 主要模型 | 模型结果 | 结论 |
|---|---|---|---|---|---|
| Chagas等[26] | 中国广州妇女儿童医疗中心 | 6 000例患者胸片 影像集 | CNN与综合学习方法结合 | VGG19体系结构和基于RBF核的SVM分类器是检测胸片中肺炎的最佳模型,准确率:96.47%;F1得分:96.46%;Precision值:96.46% | 使用实时物联网系统检测儿童肺炎的方法是有效的,有助于医学诊断,能够更快、更准确地获得结果,从而提供适当的治疗 |
| Irvin等[27] | 山间保健医院等7家美国犹他州医院 | 6 551例急诊患者的7 434例胸部X射线图像研究集 | CheXED与ePNa、CDSS | X线检查肺炎的检测:0.833(95% CI:0.795~0.868);胸腔积液的检测:0.939 (95% CI:0.911~0.962);多叶性肺炎的检测:0.847(95%CI:0.800~0.890) | X线检查肺炎和胸腔积液的深度学习模型可改善ePNa及CDSS |
| Mujahid等[28] | Kaggle数据集 | 7 750张胸部X射线图像 | CNN及其变体(VGG16、Inceptionv3和ResNet50) | Inception-V3集成准确率:99.29%;ResNet50集成准确率:98.93%;VGG-16集成准确率:98.06% | 与集成模型相比,单个预训练模型的性能较差 |
| Stephen等[29] | 中国广州妇女儿童医疗中心 | 1~5岁儿童患者的回顾性5 856张前后胸部X射线图像 | CNN | 训练损耗=0.128 8,训练精度=0.953 1,验证损耗:0.183 5,验证精度为0.937 3,最后提出200×200×3模型,其在0.183 5的最小训练损失下产生了约94%的更好验证精度 | 该模型可帮助减轻处理医学图像时经常面临的挑战,部署的增强算法可提高CNN模型的验证和分类精度 |
| Rajpurkar等[30] | OpenI数据集 | 112 120张胸部X射线图像 | CNN(CheXNet、DenseNet) | CheXNet的F1得分:0.435 (95%CI:0.387~0.481);放射科医师的F1得分:0.387 (95%CI:0.330~0.442) | CheXNet检出肺炎的性能显著高于放射医师的性能 |
注:CNN:卷积神经网络;VGG:超分辨率测试序列;RBF:径向基函数;SVM:支持向量机;ePNa:肺炎管理;CDSS:临床决策支持系统
CNN:convolutional neural network;VGG:visual geometry group;RBF:radial basis function;SVM:support vector machine;ePNa:pneumonia management;CDSS:clinical decision support system
儿童肺炎感染的病原体主要有病毒、细菌、支原体等,小儿肺炎病原体的早期检测可更好地预测、判断病情进展,提高治愈率,改善预后[32,33],减少重症肺炎的发生,同时对临床合理用药有重要的指导作用。但现阶段的病原学界别技术并不完备,如McCracken[34]研究显示,在疑似细菌性肺炎的住院婴儿和儿童中,仅10%~15%发现病原体的证据,Nathan等[35]在300例病例研究中,仅62%的患者检测出明显的病原体,其中23.7%检测到病毒,25%检出细菌。基于临床影像图像的特征、类型复杂性,赵琼姝等[36]利用半监督、弱监督学习等方法进行儿童肺炎影像特征的量化、提取,以对疾病状态进行评估、分析其风险等级,同时辅助肺炎分型诊断。
儿童病毒性肺炎在儿童社区获得性肺炎中占重要地位[37,38],细菌性肺炎是儿童及婴幼儿常见的呼吸道感染性疾病[39]。细菌性肺炎需紧急转诊,立即进行抗生素治疗,而病毒性肺炎则可通过支持性护理进行治疗。因此,准确、及时的诊断势在必行。表2列出了AI辅助儿童病毒性、细菌性肺炎鉴别、诊断等既往研究[19,40,41,42,43,44]的相关内容。对于病毒性肺炎,绝大多数研究的关注点都在于新型冠状病毒肺炎,却忽视了其他常见病毒感染的病毒性肺炎,可从此点出发进行深入研究。同时,AI能够将细菌性肺炎与病毒性肺炎进行区分,但在区分细菌菌属菌种方面研究尚浅,肺炎严重度分级等方面的相关研究较少,未来具有一定的研究价值。表3列出了表1与表2中所提及的主要模型的算法构建及其应用与不足。
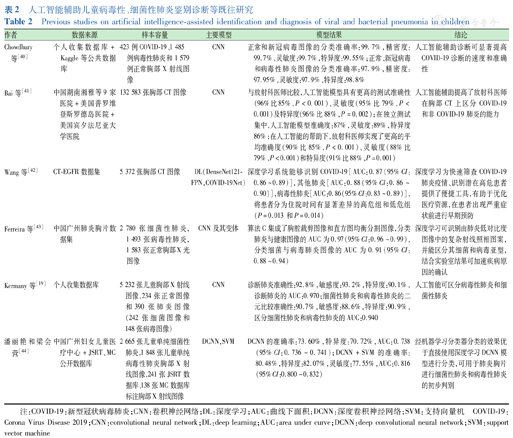
人工智能辅助儿童病毒性、细菌性肺炎鉴别诊断等既往研究
人工智能辅助儿童病毒性、细菌性肺炎鉴别诊断等既往研究
| 作者 | 数据来源 | 样本容量 | 主要模型 | 模型结果 | 结论 |
|---|---|---|---|---|---|
| Chowdhury等[40] | 个人收集数据库+Kaggle等公共数据库 | 423例COVID-19、1 485例病毒性肺炎和1 579例正常胸部X射线图像 | CNN | 正常和新冠病毒图像的分类准确率:99.7%,精密度:99.7%,灵敏度:99.7%,特异度:99.55%;正常、新冠病毒和病毒性肺炎图像的分类准确率:97.9%,精密度:97.95%,灵敏度:97.9%,特异度:98.8% | 人工智能辅助诊断可显著提高COVID-19诊断的速度和准确性 |
| Bai等[41] | 中国湖南湘雅等9家医院+美国普罗维登斯罗德岛医院+美国宾夕法尼亚大学医院 | 132 583张胸部CT图像 | CNN | 与放射科医师比较,人工智能模型具有更高的测试准确性(96%比85%,P<0.001)、灵敏度(95%比79%,P<0.001)及特异度(96%比88%,P=0.002);在独立测试集中,人工智能模型准确度:87%,灵敏度:89%,特异度86%;在人工智能的帮助下,放射科医师实现了更高的平均准确度(90%比85%,P<0.001)、灵敏度(88%比79%,P<0.001)和特异度(91%比88%,P=0.001) | 人工智能辅助提高了放射科医师在胸部CT上区分COVID-19和非COVID-19肺炎的能力 |
| Wang等[42] | CT-EGFR数据集 | 5 372张胸部CT图像 | DL(DenseNet121- FPN,COVID-19Net) | 深度学习系统能够识别COVID-19[AUC:0.87(95%CI:0.86~0.89)],其他肺炎[AUC:0.88(95%CI:0.86~0.90)],病毒性肺炎[AUC:0.86(95%CI:0.83~0.89)],将患者分为住院时间有显著差异的高危组和低危组(P=0.013和P=0.014) | 深度学习为快速筛查COVID-19肺炎疫情、识别潜在高危患者提供了便捷工具,有助于优化医疗资源,在患者出现严重症状前进行早期预防 |
| Ferreira等[43] | 中国广州肺炎胸片数据集 | 2 780张细菌性肺炎,1 493张病毒性肺炎,1 583张正常胸部X光图像 | CNN及其变体 | 算法C集成了胸腔裁剪图像和直方图均衡分割图像,分类肺炎与健康图像的AUC为0.97(95%CI:0.96~0.99),分类细菌与病毒肺炎图像的AUC为0.91(95%CI:0.88~0.94) | 深度学习可识别由肺炎低对比度图像中的复杂射线照相图案,并能区分其细菌和病毒亚型,结合实验室结果可加速疾病原因的确认 |
| Kermany等[19] | 个人收集数据库 | 5 232张儿童胸部X射线图像,234张正常图像和390张肺炎图像(242张细菌图像和148张病毒图像) | CNN | 诊断肺炎准确性:92.8%,敏感度:93.2%,特异度:90.1%,诊断肺炎的AUC:0.970;细菌性肺炎和病毒性肺炎的二元比较准确性:90.7%,敏感度:88.6%,特异度:90.9%,区分细菌性肺炎和病毒性肺炎的AUC:0.940 | 人工智能可区分病毒性肺炎和细菌性肺炎 |
| 潘丽艳和梁会营[44] | 中国广州妇女儿童医疗中心+JSRT、MC公开数据库 | 2 665张儿童单纯细菌性肺炎,1 848张儿童单纯病毒性肺炎胸部X射线图像,241张JSRT数据库、138张MC数据库标注胸部X射线图像 | DCNN,SVM | DCNN的准确率:73.60%,特异度:70.72%,AUC:0.738(95%CI:0.736~0.741);DCNN+SVM的准确率:80.48%,特异度:82.07%,灵敏度:77.55%,AUC:0.816(95%CI:0.800~0.832) | 经机器学习分类器分类的效果优于直接使用深度学习DCNN模型进行分类,可用于肺炎胸片进行细菌性肺炎和病毒性肺炎的初步判别 |
注:COVID-19:新型冠状病毒肺炎;CNN:卷积神经网络;DL:深度学习;AUC:曲线下面积;DCNN:深度卷积神经网络;SVM:支持向量机
COVID-19:Corona Virus Disease 2019;CNN:convolutional neural network;DL:deep learning;AUC:area under curve;DCNN:deep convolutional neural network;SVM:support vector machine

人工智能主要模型的算法构建及其应用与不足
人工智能主要模型的算法构建及其应用与不足
| 主要模型 | 模型算法构建 | 应用与不足 |
|---|---|---|
| CNN | 使用卷积代替一般的矩阵乘法,根据图像数据对对象进行分类,总体架构由2个主要部分组成:特征提取器和分类器 | CNN的深度学习算法经过训练、验证和测试可用于使用胸部X射线图像对健康人和肺炎患者进行分类,但应同时使用其他图像增强训练提高CNN模型的验证和分类精度 |
| CheXED | 经过训练后的模型将胸片研究分类为:放射学肺炎为阴性、不确定和阳性;可能的肺炎研究为单叶或多叶;胸腔积液阴性或阳性,使用121层密集连接卷积网络结构 | CheXED可提供关于肺炎的初步发现,在放射学报告出现之前进行早期治疗,可能可以缩短诊断和治疗的时间,改善临床结果 |
| DL(DenseNet121-FPN、COVID-19Net) | DL系统中DenseNet121-FPN用于胸部CT图像肺部面积确定,结合立方体边界框裁剪肺段面积增其稳定性;COVID-19Net由4个密集块组成,使用密集连接来虑多级图像信息 | 有助于COVID-19的流行病控制,对于疑似患者快速完成CT扫描,预测患者患COVID-19的概率,并在确诊后预测预后情况,其不需要人工辅助图像注释增加了临床价值和稳定性,但未考虑其他预后终末事件以及重症和轻症COVID-19的不同管理 |
| DCNN,SVM | DCNN模型拥有大量的隐含层,给予足够多的训练样本学习隐含层中的参数后,可对肺炎胸片肺区域进行分割,再将提取出的特征输入到SVM中 | 能自动识别并区分肺炎细菌感染、病毒感染,但仅限于这两种病原体 |
注:CNN:卷积神经网络;DL:深度学习;COVID-19:新型冠状病毒肺炎;DCNN:深度卷积神经网络;SVM:支持向量机
CNN:convolutional neural network;DL:deep learning;COVID-19:Corona Virus Disease 2019;DCNN:deep convolutional neural network;SVM:support vector machine
支原体肺炎感染儿童多发,可累及多系统产生严重的肺部损伤及并发症发展为难治性肺炎支原体肺炎,但临床诊断及实验室检查敏感性较差,易出现假性结果[45,46],如在Montagnani等[47]的研究中,34.8%的免疫球蛋白M结果为假阳性。AI计算机肺部感染辅助诊断的不断优化,给客观评估病灶提供了可能。有研究者利用计算机肺部感染辅助诊断分析软件,对儿童支原体肺炎的CT结果定量分析,并探讨了血清C反应蛋白与影像学定量指标相关性,能对病变的早期检出及严重程度进行评估,将C反应蛋白正常与异常进行准确分类,具有极大的临床应用价值[48],但目前AI的影像学分析技术在儿童支原体肺炎中的研究仍较少,值得继续关注。
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种常见的、毁灭性的危重疾病,被认为是重症监护病房入院的主要原因之一[49],在23%接受有创机械通气的患者中发生,死亡率为30%~55%,然而,ARDS在全球范围内仍然存在严重误诊、漏诊或诊断较晚的情况[50]。
Zeiberg等[51]考虑了学习模型的线性和非线性方法,开发了基于电子健康记录数据的ARDS预测模型,具有良好的判别性能,尽管样本量较小,但表现最好的模型在保持的测试集特征曲线下面积为0.81上取得了良好的判别性能,识别出队列中ARDS风险高出4倍的患者和住院成年人基线风险的17倍;对于患有ARDS的患者,该模型在ARDS发病前10 h将其确定为高危患者,该分析证明了使用自动提取的电子健康记录数据进行ARDS风险分层的机器学习方法的可行性,并代表了进一步努力的基准。Parreco等[52]研究表明,通过机械学习分类器使用AI来早期识别对长期机械通气和气管切开术有风险的患者,可进行早期干预来改善结果,对ARDS的治疗有一定指导作用。
近些年,AI的浪潮涌起,特别是深度学习。尽管许多文献在研究深度学习方法进行儿童肺部感染的检测诊断方面取得了一定进展,但其效果仍不足以满足实际的诊断需求。AI辅助诊断技术的质量保证需要大量有效临床试验的验证、较高的数据闭环能力及健全完备的数据库,数据集少、样本量少、算法落后不全面也成为当下亟需解决的技术问题。在目前技术不成熟的情况下,仍需专业医师再次检查,最终结果需要医师根据临床诊断经验和专业知识做最终判断。针对尚存的伦理问题必须及时得到有效的规治,对策包括成立相应的组织进行伦理认定、健全相关的法律制度、培养医护人员的医学伦理道德等。
目前多数研究人员着重于新型冠状病毒肺炎及ARDS的研究,很少关注其他病毒性肺炎、细菌性肺炎、支原体肺炎、真菌性肺炎,后者可成为研究的切入点和新方向。此外,许多学习仅停留于区分病灶、识别与诊断肺炎,对于区分肺炎类型、亚型给予的关注度不够,需要填补。再者,目前深度学习算法参数量及计算量极大,需要高精的设备支持,在一定方面上加大了科研成本,同时速度较慢,因此研究人员需要在算法方面进行创新。
因此,未来应建立儿童肺部感染的大样本数据集,开展医学生、医务人员对AI的学习,探索AI在儿童肺部感染中的更多价值,以推动其在诊疗相关临床决策时的辅助作用。AI在影像医学、临床医学领域的应用研究才刚刚开始,根据不同医学领域的实际情况,需要投入更多的人力和物力,其在图像信息处理方面具有卓越的表现能力,未来可能成为影像医学临床诊疗中的得力辅助工具。
所有作者均声明不存在利益冲突



























