
目前我国乙型肝炎病毒(hepatitis B virus,HBV)感染者诊断率和治疗率与世界卫生组织提出的“2030年消除病毒性肝炎作为公共卫生危害”目标仍有较大差距。为实现乙型肝炎全人群治疗,中国医师协会感染科医师分会、国家感染性疾病临床医学研究中心组织国内感染病和肝炎疾病领域相关专家,在充分复习国内外相关指南与文献的基础上,共同撰写《乙型肝炎全人群管理专家共识(2023)》,以进一步扩大乙型肝炎社区筛查,规范抗病毒治疗适应群体,细化各类特殊人群乙型肝炎患者治疗,针对《慢性乙型肝炎防治指南(2022年版)》未覆盖人群进行临床管理,从而达到乙型肝炎的扩大筛查、应治尽治、全程管理及降本增效的目的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
据世界卫生组织(World Health Organization,WHO)报道,2019年全球约有3.16亿慢性乙型肝炎(chronic hepatitis B,CHB)感染者,82万人死于乙型肝炎病毒(hepatitis B virus,HBV)感染所致肝硬化、肝细胞癌(hepatocellular carcinoma,HCC)或肝衰竭等相关疾病[1],在未干预情况下死亡人数在2035年将达到114万人[2],因此WHO呼吁实现“2030年消除病毒性肝炎作为公共卫生危害”目标。我国是全球乙型肝炎负担最大的国家,据Polaris Observatory Collaborators公布数据显示,2022年我国HBV感染者达7 974万人[3]。30余年来,随着国家政策的推动与支持,抗病毒药物可负担性与可及性不断提高,我国HBV感染诊疗取得巨大进步,但目前HBV感染者诊断率和治疗率分别为24%和15%[3],与WHO提出的“至2030年肝炎病毒诊断率和治疗率分别达到90%和80%”仍有较大差距[4]。
扩大筛查、全人群治疗对于实现早期诊断、早期治疗,并在2030年达到消除病毒性肝炎的目标至关重要[5, 6]。2022年我国发布《慢性乙型肝炎防治指南(2022年版)》[7],建议放宽治疗适应证,以扩大治疗、提高治疗覆盖率。为进一步简化抗病毒治疗适应证,细化免疫耐受期、特殊人群等患者的治疗,指导《慢性乙型肝炎防治指南(2022年版)》[7]未覆盖人群的临床管理,我国感染病和肝病领域相关专家基于国内外权威指南、最新研究证据及临床经验,撰写了《乙型肝炎全人群管理专家共识(2023)》,旨在达到乙型肝炎的扩大筛查、应治尽治、全程管理及降本增效等目的。
本共识主要参考WHO推荐分级评估、制定与评价系统(Grading of Recommendations Assessment,Development and Evaluation,GRADE)循证医学推荐强度和证据质量分级标准,并结合中国现阶段实际情况,判断证据质量,确定推荐意见等级,见表1。

推荐意见的证据等级和推荐强度
推荐意见的证据等级和推荐强度
| 级别 | 详细说明 |
|---|---|
| 证据等级 | |
| 高质量(A) | 进一步研究不大可能改变对该评估结果的信心 |
| 中等质量(B) | 进一步研究有可能对该评估结果的信心产生重要影响 |
| 低质量(C) | 进一步研究很有可能影响该评估结果,且该评估结果很可能改变 |
| 推荐强度 | |
| 强推荐(1) | 充分考虑到证据的质量、患者可能的预后及预防、诊断和治疗效果,有较高的成本效益比 |
| 弱推荐(2) | 证据价值参差不齐,推荐意见存在不确定性,或推荐的意见可能会有较差的成本效益比等,更倾向于较低等级的推荐 |
多项大规模流行病学调查表明,对成年人进行普遍筛查HBV感染可以提高早期发现和干预的机会,有助于减轻疾病负担,并为患者管理提供更好的方案[8, 9, 10]。2023年3月,美国疾病预防控制中心首次出台了《HBV感染筛查和检测的建议》,该推荐意见基于2018年提出的对孕妇筛查的建议,另明确提出3条建议:(1)成年人(≥18岁)一生中至少进行1次HBV筛查;(2)对有HBV检测意愿的所有人进行检测;(3)筛查3项HBV指标,即乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎表面抗体(hepatitis B surface antibody,抗-HBs)和乙型肝炎核心抗体(hepatitis B core antibody,抗-HBc)。同时列出了针对HBV感染筛查结果的解释和进一步有效管理的建议,如HBsAg阳性的患者,可能存在急性或慢性感染,需要进一步诊疗[11]。美国一项针对现行筛查策略和一次性普遍筛查策略进行的成本效益分析研究显示,在成年人中普遍筛查HBV感染具有良好的经济和社会效益,可使代偿期肝硬化发生率降低30%,失代偿期肝硬化发生率降低43%,肝移植发生率减少24%,以及HBV相关的病死率减少27%[12]。最新亚太肝病研究学会(Asian Pacific Association for the Study of the Liver,APASL)临床实践指南《与免疫治疗相关的乙肝再激活》强调,所有计划接受免疫抑制治疗的患者均应接受筛查,筛查项目包括HBsAg、抗-HBs和总抗-HBc[13]。同时,HBV感染筛查后阳性患者的临床管理也非常重要,筛查后临床管理的比例越高,筛查的价值越高。2023年3月发表的最新数据显示,与现行HBV筛查策略相比,普遍筛查联合有效的管理,至2030年,新发HCC的比例将减少6.3%,因CHB导致的死亡下降8.5%,且累计HBV相关病死率将下降5%[14]。我国一项针对普遍筛查HBV感染的最新效益分析显示,对18~70岁人群进行血清HBsAg/抗-HBs/乙型肝炎e抗原(hepatitis B e antigen,HBeAg)/乙型肝炎e抗体(hepatitis B e antibody,抗-HBe)/抗-HBc五项检测是最具有价值的筛查策略,也是未来10年我国最佳的HBV筛查策略[15]。与此同时,根据WHO的指导原则,乙型肝炎疫苗免疫规划应该包括在出生后24 h内给予新生儿乙型肝炎疫苗(乙肝疫苗)的首剂接种,并在特定时间点进行多次补充接种,以确保免疫力的形成和维持。而对于抗-HBs阴性的成年人群,也建议接种乙肝疫苗。有研究显示,≥40岁成人按0、1、6个月,或0、1、2个月免疫程序接种乙肝疫苗均可产生良好的免疫应答[16]。
推荐意见1:建议未接种乙肝疫苗的普通人群进行HBV感染的筛查;对任何有HBV检测意愿的人进行检测;所有计划接受免疫抑制治疗的患者均应接受筛查(A1)。主要筛查项目有HBsAg、抗-HBs和抗-HBc(B1)。
对于儿童及青少年乙型肝炎患者,抗病毒治疗是一种有效控制病情的策略[17]。婴幼儿和儿童及青少年HBV感染者抗病毒治疗的共同和主要目标是有效且持续地抑制HBV复制,从而降低疾病进展为肝硬化和HCC的风险。研究显示,免疫耐受期的患儿中,90%的肝组织存在一定程度的炎症活动和/或纤维化,其中重度肝纤维化和肝硬化发生率可达10.9%[18]。数据表明,儿童HBV感染抗病毒治疗安全有效,1~7岁的患儿接受治疗后可显著提高HBV DNA阴转率、HBeAg血清学转换率和HBsAg清除率,此类患者在充分沟通和知情同意的前提下,也可考虑抗病毒治疗[19, 20]。治疗决策需要全面评估,包括组织学检查、无创肝纤维化检查和动态肝功能评估等。特别要注意,即使丙氨酸转氨酶(alanine aminotransferase,ALT)≤1×正常值上限(upper limit of normal,ULN),但组织学检查显示存在肝脏炎症的患儿(如肝脏组织学分级G≥1)应及时进行抗病毒治疗。
干扰素(interferon,IFN)α-2b、聚乙二醇干扰素α(Peg IFNα)具有抗病毒和免疫调节作用,皮下注射用IFNα-2b已经被欧洲药品管理局(European Medicines Agency,EMA)和美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于治疗HBV感染的儿童及青少年[17]。Peg IFNα-2a治疗儿童HBV感染的疗效和益处已被证实[21]。多项临床研究支持核苷(酸)类似物(nucleotide analogues,NAs)可以抑制HBV复制,且长期使用具有较高的安全性[22, 23]。恩替卡韦(entecavir,ETV)被EMA和美国FDA批准用于治疗2岁及以上CHB儿童,大型研究也已证实ETV的疗效[24]。对于HBeAg阴性患者,IFNα联合或不联合NAs进行抗病毒治疗都是有效的[25]。对于CHB的婴幼儿及儿童,应定期进行肝功能检查和HBV DNA监测,及时调整治疗方案[26, 27]。对于乙型肝炎相关进展期肝病或肝硬化患儿,无论年龄大小应及时进行抗病毒治疗,但须考虑长期治疗的安全性及耐药问题。以下是针对不同年龄儿童的推荐治疗选项:(1)≥1岁儿童可考虑普通IFNα治疗;(2)≥2岁儿童可选用ETV或富马酸替诺福韦(tenofovir disoproxil fumarate,TDF)治疗;(3)≥5岁儿童可选用Peg IFNα-2a;(4)≥12岁儿童可选用丙酚替诺福韦(tenofovir alafenamide,TAF)治疗。ALT升高的HBeAg阳性CHB儿童可选择有限疗程的普通IFNα或Peg IFNα-2a治疗,也可选用ETV、TDF或TAF治疗,以实现临床治愈[28, 29]。此外,对于HBeAg阳性母亲或7月龄时抗-HBs低水平的儿童,应在2岁前及时加强免疫接种,不要等到其抗-HBs阴转再加强免疫注射[30]。
推荐意见2:建议对HBsAg阳性,或者不确定是否携带HBV母亲所生儿童,于接种第3剂乙型肝炎疫苗后1~2个月时进行HBsAg和抗-HBs检测。若HBsAg阴性、抗-HBs<10 mIU/mL,可按 0、1、6 个月免疫程序再接种3剂乙肝疫苗;若HBsAg阳性,为免疫失败,应定期监测(A1)。
推荐意见3:对于乙型肝炎相关进展期肝病或肝硬化患儿,无论年龄大小,均应及时进行抗病毒治疗,但须考虑长期治疗的安全性及耐药问题。≥1岁儿童可考虑普通IFNα治疗;≥2岁儿童可选用ETV或TDF治疗;≥5岁儿童可选用Peg IFNα-2a;≥12岁儿童可选用TAF治疗(A1)。
推荐意见4:对于HBV DNA阳性,ALT<1× ULN的患儿须动态监测或进行肝组织学评估,如有肝病进展的表现或肝脏组织学分级G≥1,建议抗病毒治疗(B1);对于年龄1~7岁的患儿,即使缺少肝脏病理学检查结果,在充分沟通及知情同意的前提下,也可考虑抗病毒治疗。使用的抗病毒药物和方案参照儿童进展期CHB(C1)。
根据一项关于中国的流行病学调查,乙型肝炎在18~30岁的成年人中感染率较高。对于有肝硬化或HCC家族史的患者,抗病毒治疗可以降低他们发生肝功能衰竭、HCC和死亡的风险。无创或肝组织学检查提示纤维化(F)≥2/炎症(G)≥2的患者其肝脏已经有较高的纤维化程度和炎症活动,这些患者的疾病进展较快,预后不良。长期以来,人们一直忽视HBV感染的肝外表现,然而,约20%的患者会伴随肝外表现,包括肾小球肾炎、关节炎、皮肤损伤和神经系统病变等,将直接影响患者的发病率、生活质量和病死率[31, 32]。这些患者的治疗应以控制病毒复制并减轻肝外表现为主要目标。抗病毒治疗可以有效缓解肝外表现和改善生活质量,NAs类药物可改善较为轻微的肝外症状,但需要免疫调节和免疫抑制剂(如高剂量IgG、利妥昔单抗,皮质类固醇和血浆置换)来处理肾脏、神经系统和血液学的主要症状和体征,针对HBV的抗病毒方案是必要的,以避免HBV重新激活或复发[32]。对于乙型肝炎患者,特别是18~30岁的成年患者,早期诊断和及时抗病毒治疗非常重要,可有效降低疾病的进展风险,并改善患者的预后和生活质量。国际多部指南将ALT治疗阈值定为男性30 U/L、女性19 U/L[7]。
推荐意见5:对于年龄≤30岁乙型肝炎患者,血清HBV DNA阳性,如满足以下任一条件:(1)有乙型肝炎肝硬化家族史或HCC家族史;(2)无创或肝组织学检查提示肝脏存在G≥2或F≥2;(3)HBV相关肝外表现(如HBV相关性肾小球肾炎等);则进行抗病毒治疗(A1)。否则,间隔≥3个月后,连续3次ALT检测高于治疗阈值等肝病进展表现,则进行抗病毒治疗(B1)。对于ALT>30 U/L的男性患者和ALT>19 U/L的女性患者,建议抗病毒治疗(A1)。
一项流行病学调查显示,在中国30~59岁的人群中,HBsAg阳性率为27.7%。另一项研究表明,中国是HBV感染最多的国家,占全世界感染人口的1/3,大约有9 000万人患有CHB,估计每年有30万人死于HBV相关疾病[15]。这些数据表明,年龄>30岁的人群中,HBV感染和慢性HBV感染的风险较高。多项临床研究表明,对于血清HBV DNA阳性的CHB患者,抗病毒治疗可以显著改善肝功能、减轻肝病症状、降低肝硬化和HCC的发生率。2022年,中华医学会肝病学分会发布《扩大慢性乙型肝炎抗病毒治疗的专家意见》[33],对于CHB抗病毒治疗适应证做了进一步扩大,强调HBV DNA检测灵敏度、ALT治疗阈值、年龄、家族史、不确定期,以及低病毒血症等问题,以帮助更多患者获益。HBV DNA阳性是CHB患者抗病毒治疗的首要条件,要提高HBV DNA检测灵敏度,对基线或治疗后低病毒载量患者及时干预[34]。我国的一项研究也显示,在接受ETV治疗78周的CHB患者中,低病毒血症组较HBV DNA阴转组出现肝纤维化进展的发生率明显升高[35]。我国另一项真实世界研究表明,在72周的抗病毒治疗后,治疗组的HBV DNA清除率为47.9%,明显高于对照组的1.9%[36]。降低CHB患者的ALT治疗阈值,同样有利于CHB患者治疗。我国的一项研究共纳入327例未接受抗病毒治疗的HBeAg阴性CHB患者(ALT<40 U/L),其中ALT≤20 U/L组(132例)与ALT>20 U/L组(195例)相比,肝组织中出现G>2、F>2的比例升高;同时HBV DNA≥2 000 IU/mL组与<2 000 IU/mL组相比,肝组织中出现G>2、F>2的比例升高。因此,降低CHB患者的ALT治疗阈值,有利于尽早启动抗病毒治疗,进而降低肝硬化和HCC的发生率[37]。
对于代偿期或失代偿期肝硬化患者,抗病毒治疗可以显著提高生存率[38]。这是因为抗病毒治疗可以降低病毒载量,减轻病毒对肝脏的毒性作用,从而改善肝功能,防止肝硬化和HCC的发生。一项系统评价表明,对于代偿期和失代偿期肝硬化患者,抗病毒治疗可以显著降低肝硬化进展和肝癌的发生率[39]。在实践中,临床医师和指南也建议对其进行抗病毒治疗。《慢性乙型肝炎防治指南(2022年版)》指出,对于代偿期或失代偿期肝硬化患者,无论其ALT和HBV DNA水平如何,都应进行抗病毒治疗[7]。因此,对于临床确诊为代偿期或失代偿期乙型肝炎肝硬化患者,无论其ALT和HBV DNA水平及HBeAg阳性与否,均建议进行抗病毒治疗,以达到减轻病情、防止并发症的目的。
推荐意见6:对于年龄>30岁者,只要血清HBV DNA阳性,无论ALT水平高低,均推荐抗病毒治疗,具体建议参照《慢性乙型肝炎防治指南(2022年版)》(A1)。对于临床确诊为代偿期或失代偿期乙型肝炎肝硬化患者,无论其ALT和HBV DNA水平及HBeAg阳性与否,均建议抗病毒治疗)(A1)。
目前,一些患者在使用NAs治疗后仍然无法完全清除HBV,HBV处于低水平复制,可导致疾病进展,这意味着需要调整治疗方案[40]。国内外多项研究结果提示,抗病毒治疗后低病毒血症与CHB肝纤维化进展、发生失代偿期肝硬化及HCC风险,以及长期生存率降低密切相关。因此,对于这些患者需要调整治疗方案以减少疾病进展[35,41]。其中,在转换治疗方案时,要兼顾新方案的抗病毒治疗效果与长期用药安全性问题,选择有效与安全的“双优”治疗方案。部分研究显示TDF优于ETV,可进一步降低HCC发生率[42]。回顾性研究表明,对于TDF治疗失败的乙型肝炎患者,换用TAF可以提高治疗效果[43]。
推荐意见7:乙型肝炎患者经ETV、TDF或TAF治疗48周,或乙型肝炎肝硬化患者治疗24周,若HBV DNA仍可检出(HBV DNA>20 IU/mL),排除依从性和检测误差后,可调整NAs治疗(应用ETV者换用TDF或TAF,应用TDF或TAF者换用ETV,或两种药物联合使用)(B1),如无IFN使用禁忌证,患者也可联合Peg IFNα治疗(B1)。
在乙型肝炎妊娠患者中,抗病毒治疗对于阻断母婴传播和改善孕妇和胎儿的健康状况非常重要。其中,TDF是妊娠期乙型肝炎患者抗病毒治疗的首选药物,可以有效抑制HBV的复制,从而降低病毒载量和减少肝脏炎症[44]。与其他药物相比,TDF在妊娠期间使用的安全性更高。TDF是一种口服药物,便于患者使用,并且剂量可调整,具有更好的个性化治疗效果[45]。TDF可以降低孕妇的病毒载量,减少母婴传播的风险[46]。
TAF相较于TDF具有更低的肾毒性。我国一项临床试验显示,TAF和TDF均能有效阻断乙型肝炎的母婴传播,但尿视黄醇结合蛋白和β2-微球蛋白水平在TDF治疗后显著升高,在TAF治疗后无显著变化,且TAF治疗组母乳样品中的药物浓度更低,因此,TAF在肾安全性和母乳喂养方面优于TDF[47]。针对妊娠合并肾功能不全的患者,使用TAF可能是一个更安全的选择。与TDF相比,TAF可以提供相似的抗病毒效果,但其使用的剂量更低,从而显著降低了骨密度减少的风险[48]。此外,一项研究表明,TAF治疗可以在不影响骨代谢的情况下,提高骨密度[45]。因此,对于妊娠合并骨质疏松的患者,使用TAF可能是一个更好的选择。
推荐意见8:妊娠期乙型肝炎患者的抗病毒治疗主要推荐使用TDF(A1),应用TDF治疗者,母乳喂养不是禁忌证(C2),具体建议可参照《慢性乙型肝炎防治指南(2022年版)》。如患者准备近期妊娠,或妊娠期间有抗病毒治疗指征时,在充分沟通并知情同意后,可以使用TDF治疗(B1);如妊娠合并肾功能不全,可考虑使用TAF治疗(B2)。
在HBsAg阳性的HCC患者中,无论HBV DNA水平,建议立即使用ETV、TDF或TAF进行抗病毒治疗。因为在HBsAg阳性的HCC患者中,即使HBV DNA水平低于检测下限,仍有持续病毒复制和肝病进展的风险。而抗病毒治疗可以有效地抑制病毒复制、减少肝病进展和提高患者的生存率[49, 50]。在HBsAg阴性、抗-HBc阳性需要开展化疗/靶免治疗的患者中,建议进行抗病毒治疗。因为在这类患者中,潜伏感染的HBV会导致HBV复发和肝损害,甚至可能引起肝功能衰竭和死亡。抗病毒治疗可以有效地延缓肝病进展和提高患者的生存率[51]。
推荐意见9:对于所有确诊HCC患者,应常规筛查HBsAg、抗-HBs和抗-HBc(A1)。HBsAg阳性的HCC患者,无论HBV DNA水平,建议立即应用ETV、TDF或TAF进行抗病毒治疗(A1)。对于HBsAg阴性、抗-HBc阳性,需开展化疗/靶免治疗的患者,建议抗病毒治疗(A1)。
HBV相关急性、亚急性、慢加急性和慢性肝衰竭患者的病死率高,若HBsAg阳性建议进行抗病毒治疗。抗HBV治疗可改善HBV相关慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)的长期预后[52, 53]。一项临床研究显示,由于HBV自发激活导致的ACLF病例,使用TDF治疗可显著减少HBV DNA载量,改善肝功能评分(child-turcotte-pugh,CTP;model end-stage liver disease,MELD),并降低病死率。同时,2周内HBV DNA载量降低100倍也被证实是患者存活的独立预测因子。因此,抗病毒治疗对于CHB导致的ACLF具有重要的治疗效果和临床意义[54]。此外,另一项研究结果表明,TAF、TDF和ETV 3种一线抗HBV药物在HBV-ACLF患者短期和长期治疗中的疗效和安全性相似:在48周时,3组患者的生存率差异无统计学意义,但在4周内都显示出HBV DNA水平的下降;在生化学反应方面,3组在第4周时表现出类似的结果,但接受TAF治疗的患者在降低总胆红素、维持白蛋白和胆固醇方面具有优势。总体而言,NAs治疗耐受性良好,未报告与药物相关的严重不良事件[55]。与TDF相比,TAF在保持抗病毒疗效的同时可减轻肾脏毒性[53]。早期快速降低HBV DNA水平是治疗的重要部分,若HBV DNA水平在2~4周内能下降2 lg IU/mL,患者生存率可提高[53, 54]。抗病毒药物应选择快速、强效、低耐药的NAs(ETV、TDF或TAF)[56]。肝衰竭患者恢复后,抗病毒治疗应长期坚持。
推荐意见10:HBV相关急性、亚急性、慢加急性和慢性肝衰竭患者,若HBsAg阳性建议应用ETV、TDF或TAF抗病毒治疗(A1)。
大量流行病学和临床研究表明,肿瘤化疗、靶向治疗和免疫抑制剂治疗的患者存在HBV相关肝病急性发作的风险,而HBV感染与肝功能损伤、肝炎恶化、化疗的毒性增加,以及免疫抑制治疗中的肝损伤恶化相关。因此,在进行肿瘤治疗前应常规筛查HBsAg、抗-HBc和/或HBV DNA,并在发现HBsAg阳性的患者中启动抗病毒治疗[57, 58, 59, 60]。研究显示,HBsAg阳性患者的HBV再激活发生率明显高于HBsAg阴性患者,在HBsAg阳性患者中,HCC和非HCC患者的HBV再激活率高达0.5%和2.9%。而在进行抗病毒预防和未进行抗病毒预防的患者中,HBV再激活率分别为0.4%和6.4%[61]。HBsAg和/或HBV DNA阳性者在开始化学治疗、靶向药物及免疫抑制剂治疗前至少1周应用ETV、TDF或TAF等抗病毒药物治疗,这样可以有效地抑制HBV复制,减少肝炎恶化和肝功能损害的风险[43]。
推荐意见11:接受化疗、靶向治疗和免疫抑制剂治疗者,在治疗前均应常规筛查HBsAg、抗-HBc和/或HBV DNA(A1)。对于HBsAg和/或HBV DNA阳性者,在开始化学治疗、靶向药物及免疫抑制剂治疗前至少1周应用ETV、TDF或TAF抗病毒治疗(A1)。对于HBsAg阴性、抗-HBc阳性患者,若使用B淋巴细胞单克隆抗体或进行造血干细胞移植,或伴进展期肝纤维化/肝硬化,在开始化学治疗、靶向药物及免疫抑制剂治疗的同时建议应用ETV、TDF或TAF抗病毒治疗(B1)。
肝移植后存在HBV感染复发风险,且HBV感染复发与严重的肝损伤和肝硬化发展有关。HBV复发可导致不同程度的肝病理损伤,包括轻度自限性肝炎、慢性活动性肝炎、暴发性肝炎和纤维化胆汁淤积性肝炎。ETV、TDF和TAF等作为CHB的一线治疗药物,在预防肝移植后HBV感染复发中发挥着重要作用[61, 62, 63, 64]。
推荐意见12:进行肝、肾、心及肺等实体器官移植和骨髓移植的HBV感染者,若HBsAg阳性,建议在肝移植前开始应用ETV、TDF或TAF进行抗病毒治疗(A1)。HBsAg阴性患者,接受HBsAg阳性或者HBsAg阴性但抗-HBc阳性移植物时,应当接受长期抗病毒治疗以预防病毒再激活(A1)。
风湿性疾病如类风湿性关节炎、系统性红斑狼疮等患者在免疫抑制治疗前需要筛查HBV相关指标,主要目的是预防或减少免疫抑制治疗引起的HBV再激活或肝炎急性加重[65]。免疫抑制治疗可导致患者免疫功能受损,使得潜伏感染的HBV重新激活。HBV再激活可能导致严重的肝炎恶化,甚至导致急性肝功能衰竭[66, 67]。根据国际指南,类风湿性关节炎、系统性红斑狼疮等风湿性疾病在确诊时应进行HBsAg、抗-HBc和/或HBV DNA的筛查。筛查结果可作为决定是否需要采取预防性抗病毒治疗的依据[68]。对于HBsAg阳性、抗-HBc阳性或HBV DNA阳性的患者,在开始免疫抑制治疗前,应考虑采取预防性抗病毒治疗,以降低HBV激活的风险。抗病毒治疗方案应根据患者的HBV感染状态、免疫抑制治疗方案和个体化因素来确定[69]。
建议在进行免疫抑制治疗前或同时进行HBV筛查,并在发现HBsAg阳性的患者中启动抗病毒治疗。在进行肿瘤治疗的患者中,HCV感染与肝炎恶化、肝功能下降、肿瘤治疗反应差,以及生存率降低相关。因此,建议在进行肿瘤治疗前或同时进行HCV筛查,并考虑在HCV感染阳性患者中启动抗病毒治疗[70]。肿瘤患者合并HIV感染时,抗病毒治疗对于改善艾滋病进展、提高生存率和化疗耐受性具有重要作用。早期启动抗反转录病毒治疗(anti-retroviral therapy,ART)可以降低艾滋病相关疾病的发生和死亡风险[71, 72]。
推荐意见13:类风湿性关节炎、系统性红斑狼疮等风湿性疾病在确诊时,以及自身免疫性肝病等在免疫抑制(如糖皮质激素、生物制剂、靶向药物)治疗前,均应筛查HBsAg、抗-HBc和/或HBV DNA(A1)。根据筛查结果决定是否进行抗病毒治疗,具体建议可参照肿瘤化疗、靶向治疗和免疫抑制剂治疗人群。对于这类患者,无论是否进行免疫抑制治疗,在患者充分知情和同意情况下,建议抗病毒治疗(A1)。
HBV、HCV和HIV是常见的病毒感染,三者之间存在相互影响。合并感染HBV、HCV和HIV的个体在疾病进展、治疗反应和预后方面可能面临更大的风险。因此,在对HBsAg阳性者进行初次评估时,须检测是否合并HCV与HIV感染,以便及早发现并采取合适的管理措施。多项临床研究表明,HBV、HCV和HIV的合并感染会增加肝病的发展风险,并对抗病毒治疗效果产生影响。因此,在对HCV与HIV感染者进行治疗前,同样需要检测HBsAg,以了解是否合并HBV感染,从而决定最合适的治疗方案[73]。流行病学研究表明,早期启动ART可使合并HIV感染者在艾滋病进展、免疫功能恢复和生存率方面获益。无论CD4+T淋巴细胞水平如何,只要没有抗HIV暂缓治疗的指征,早期启动ART可以降低HIV相关疾病的发生和死亡风险[74]。临床试验和研究证实,早期启动ART可以显著降低合并HIV感染者的疾病进展风险,并改善患者的生活质量。早期治疗还可以减少HIV在个体和群体水平的传播,并有助于控制艾滋病的流行[75]。针对合并HIV和HBV感染者,推荐选择对两种病毒均有效的抗病毒药物组合。基于TAF或TDF的联合方案被推荐作为首选治疗方案,因为它们已经被证明在控制HIV和HBV感染方面具有高效性和安全性[76]。
推荐意见14:所有HBsAg阳性者初次评估时须检测是否合并HCV和(或)HIV感染(B1);HCV与HIV感染者治疗前同样须检测HBsAg以了解有无合并HBV感染(B1)。对于合并HCV感染者的抗病毒治疗,具体建议参照《慢性乙型肝炎防治指南(2022年版)》。对于合并HIV感染者,不论CD4+T淋巴细胞水平如何,只要无抗HIV暂缓治疗的指征,均建议尽早启动ART;建议选择对HIV和HBV均有效的抗病毒药物组合,推荐基于TAF或TDF的联合方案(A1)。
肝细胞核内共价闭合环状DNA(covalently closed circular DNA,cccDNA)的存在是HBV持续感染的标志[77]。尽管NAs如替诺福韦和ETV能够快速有效地抑制HBV DNA复制,但它们并不能直接作用于cccDNA,对cccDNA无直接抑制和清除作用,因此在肝脏中仍会持续存在一定水平的病毒复制[78]。低水平的肝内病毒产物和残存的不间断病毒复制,使得NAs药物长期治疗的患者仍有一部分会发展至终末期肝病[79]。这种情况在隐匿性HBV感染患者中常见,研究发现体外受植物血凝素(phytohaemagglutinin,PHA)和IL-2刺激增殖的外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中HBV DNA在细胞和细胞悬液中显著增加,有助于隐匿性HBV感染患者的诊断。对于HBV DNA低于检测值下限但肝功能持续异常的患者,需要进一步诊断和评估,以找出导致肝功能异常的原因。这可能涉及排除其他肝病、药物毒性、酒精滥用和代谢紊乱等因素的可能性。因此,在排除其他因素后,应当采用最灵敏的检测试剂进行动态检测,设置检测下限为10 IU/mL,以提高检测的准确性和敏感性。这样的检测方法可以帮助确定HBV的持续感染程度,进一步评估病毒活动性的程度,从而指导后续治疗策略的制订。此外,另一种推荐的方法是采用TDF联合ETV进行诊断性治疗。TDF和ETV都是具有抑制HBV复制能力的药物,联合使用这两种药物可以进一步抑制病毒的复制,评估治疗的效果,并帮助确定HBV是否是导致肝功能异常的主要原因。
推荐意见15:建议在排除其他因素后,采用最灵敏的检测试剂(检测下限为10 IU/mL)动态检测,或采用TDF联合ETV进行诊断性治疗,并进一步排查其他原因引起的肝损伤(B1)。
长期使用抗病毒药物存在肾功能异常与骨密度下降可能[80, 81],因此对于存在肾功能异常或高危风险(年龄≥50岁、糖尿病、高血压、合并代谢综合征、失代偿期肝硬化、肾脏病家族史、伴随使用肾毒性药物或接受实体器官移植等),和/或存在骨密度下降或高危风险(女性、年龄≥50岁、使用糖皮质激素等)的患者,在启动抗病毒治疗时应选择骨、肾安全性更高的TAF或ETV[7,82, 83, 84, 85]。
在两项设计类似的全球双盲、随机(2∶1)及3期临床研究[108研究:HBeAg阴性患者(n=425);110研究:HBeAg阳性患者(n=873)]中,第96周时,TAF具有更好的肾脏和骨骼安全性的双优特质。在完成双盲治疗后,所有患者均可接受开放标签的TAF治疗直至第8年[86]。8年随访数据显示,持续TAF治疗者的估算肾小球滤过率(estimated glomerular filtration rate,eGFR)中位数下降约5 mL/min,与正常衰老的eGFR下降一致,β2-微球蛋白∶尿肌酐值(β2-MG∶Cr)保持相对稳定,且髋部、脊柱骨密度变化较小,分别下降1.64 L/min与0.64 mL/min。108/110研究在中国人群中的5年随访数据显示出与全球研究一致性的结果[87]。
若患者在TDF治疗过程中出现肾功能异常或骨密度下降,或存在高危风险时,应考虑转换为TAF或ETV治疗[7,88]。108/110研究8年随访数据显示[86],TDF转换为TAF接受开放标签治疗5年或6年,在维持较高病毒抑制率(HBeAg阴性患者中病毒抑制率达91%或98%,HBeAg阳性患者中病毒抑制率达96%或98%)的同时,中位eGFR水平、β2MG∶Cr值以及髋部、脊柱骨密度均得到改善。在另一项3期非劣效性转换临床试验中[89],第48周从TDF转换为TAF的患者与继续TDF治疗的患者相比,肾功能(相较基线中位变化分别为0.94 mL/min比-2.74 mL/min)和骨密度[相较基线中位变化分别为0.66%比-0.51%(髋关节);1.74%比-0.11%(脊柱)]均有所改善。
推荐意见16:对于初治患者,合并肾功能异常/骨骼疾病,或存在高危风险时,优先选用TAF或ETV,避免使用TDF(A1)。
对于TDF经治患者,发生肾功能异常/骨骼疾病,或存在高危风险时,建议改用TAF或ETV(A1)。
CHB与代谢综合征之间存在一定的相互关联。研究表明,合并代谢综合征的患者中,HBV感染的概率更高。代谢综合征包括肥胖、高血糖、高血压和血脂异常,这些病症可导致脂肪堆积、胰岛素抵抗和慢性炎症等病理生理过程,进而增加了HBV感染的风险。肝脏在脂质代谢中起着关键作用,而肥胖和血脂异常会导致脂质在肝脏内的堆积,引发非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)。NAFLD是一种常见的肝脏疾病,与HBV感染的严重程度和疾病进展相关。研究发现,合并NAFLD的CHB患者更容易发展为肝纤维化和肝硬化[90, 91]。高血糖是另一个与乙型肝炎感染相关的代谢综合征。高血糖患者在免疫功能和炎症反应方面存在异常,这可能导致对HBV的免疫应答受损,使得病毒更容易在体内复制和持续感染[92, 93]。因此,对于CHB患者,筛查和管理代谢合并症是非常重要的,以减少疾病的进展和提高患者的整体健康状况。2022年澳大利亚HBV感染管理共识建议中推荐在CHB患者中筛查代谢综合征,包括肥胖、高血糖、高血压和血脂异常,并在CHB患者中给予最佳管理[94]。目前多项研究证实,代谢综合征是乙型肝炎患者发生基因型耐药、HCC、疾病进展、整体不良转归和死亡的独立预后不良因素[95, 96]。因此认为在合并代谢综合征的患者中,若存在肝脏损伤高风险,且HBV DNA阳性,建议积极抗病毒治疗。
推荐意见17:应筛查代谢综合征,包括肥胖、糖尿病、高血压和血脂异常,并在CHB患者中给予最佳管理(C1)。其中血脂的常规筛查指标包括总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)(A1);筛查频次可参考《中国血脂管理指南(2023年)》,<40岁成年人每2~5年进行1次血脂检测,≥40岁成年人每年至少应进行1次(C1)。
对于合并代谢综合征的患者,若存在肝脏损伤高风险,且HBV DNA阳性者,建议积极抗病毒治疗(C1)。
针对慢性HBV携带状态和非活动性HBsAg携带状态患者,在进行抗病毒治疗过程中,应在基线及随访过程中定期监测相关指标[97]。HBV DNA水平是用来评估病毒复制水平和治疗效果的关键指标,通过定期检测HBV DNA水平,可以了解病毒活跃程度以及抗病毒治疗的效果;肝功能指标包括血清ALT、天冬氨酸转氨酶(aspartate aminotransferase,AST)等,可以反映肝脏炎症和损伤的程度,监测疾病的进展和治疗效果;腹部B超用于检查肝脏大小、结构、形态等情况;HBsAg水平用于评估病毒感染的状态和活动性。进行抗病毒治疗过程中监测HBV血清学标志物:包括HBsAg、HBeAg、抗-HBs及抗-HBe等指标,对于HBeAg阳性的患者,监测HBeAg和抗-HBe抗体的转换可以提示病毒复制水平和疾病进展的变化,用于评估病毒感染的状态和活动性;通过非侵入性的方法,如FibroScan或血清肝纤维化指标(如APRI、FIB-4等),可以评估肝纤维化程度,指导治疗策略和判断预后。
推荐意见18:慢性HBV携带状态和非活动性HBsAg携带状态患者,在进行抗病毒治疗过程中,应在基线及随访过程中定期监测相关指标,HBV DNA检测建议采用高灵敏检测方法。详见表2(A1)。
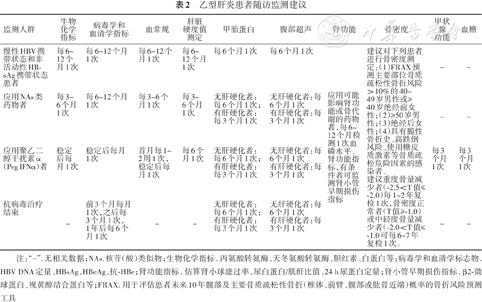
乙型肝炎患者随访监测建议
乙型肝炎患者随访监测建议
| 监测人群 | 生物化学指标 | 病毒学和血清学指标 | 血常规 | 肝脏硬度值测定 | 甲胎蛋白 | 腹部超声 | 肾功能 | 骨密度 | 甲状腺功能 | 血糖 |
|---|---|---|---|---|---|---|---|---|---|---|
| 慢性HBV携带状态和非活动性HBsAg携带状态患者 | 每6~12个月1次 | 每6~12个月1次 | 每6~12个月1次 | 每6~12个月1次 | 每6个月1次 | 每6个月1次 | 应用可能影响肾功能或骨代谢的药物者,每6~12个月检测1次血磷水平、肾功能指标,有条件者可监测肾小管早期损伤指标 | 建议对下列患者进行骨密度测定:(1)FRAX预测主要部位骨质疏松性骨折风险>10%的40~49岁男性或≥40岁绝经前女性;(2)≥50岁男性;(3)绝经后女性;(4)具有脆性骨折史、高跌倒风险、使用糖皮质激素等骨质疏松危险因素的感染者。 建议重度骨量减少者(-2.5<T值≤-2.0)每1~2年复检1次,骨密度正常者(T值≥-1.0)或中轻度骨量减少者(-2.0<T值≤-1.0可每6~7年复检1次。 | - | - |
| 应用NAs类药物者 | 每3~6个月1次 | 每6~12个月1次 | 每3~6个月1次 | 每3~6个月1次 | 无肝硬化者:每6个月1次; 有肝硬化者:每3个月1次 | 无肝硬化者:每6个月1次 有肝硬化者:每3个月1次 | - | - | ||
| 应用聚乙二醇干扰素α(Peg IFNα)者 | 稳定后每月1次 | 稳定后每月1次 | 首月每1~2周1次,稳定后每月1次 | 每6个月1次 | 无肝硬化者:每6个月1次; 有肝硬化者:每3个月1次 | 无肝硬化者:每6个月1次 有肝硬化者:每3个月1次 | 每3个月1次 | 每3个月1次 | ||
| 抗病毒治疗结束 | - | 前3个月每月1次,之后每3个月1次, 1年后每6个月1次 | - | - | 无肝硬化者:每6个月1次; 有肝硬化者:每3个月1次 | 无肝硬化者:每6个月1次 有肝硬化者:每3个月1次 | - | - |
注:“-”.无相关数据;NAs.核苷(酸)类似物;生物化学指标. 丙氨酸转氨酶、天冬氨酸转氨酶、胆红素、白蛋白等;病毒学和血清学标志物. HBV DNA定量、HBsAg、HBeAg、抗-HBe;肾功能指标. 估算肾小球滤过率、尿白蛋白/肌酐比值、24 h尿蛋白定量;肾小管早期损伤指标. β2-微球蛋白、视黄醇结合蛋白等;FRAX. 用于评估患者未来10年髋部及主要骨质疏松性骨折(椎体、前臂、髋部或肱骨近端)概率的骨折风险预测工具
期待未来有更多的标志物或检测手段用以鉴别免疫耐受期与免疫激活期,以指导启动治疗的时机。及时有效的抗病毒治疗,可以阻止或延缓乙型肝炎进展为肝硬化、肝衰竭或HCC,延长患者的生存期和提高患者的生活质量。随着对疾病的认识越来越深入,以及抗病毒药物有效性和安全性的不断提高,启动抗病毒治疗的标准将逐步简化(降低复杂性和异质性),治疗方案也将不断追求疗效与安全性兼具的双优特性,最终实现乙型肝炎的应治尽治。筛查后乙型肝炎患者管理平台的开发和临床应用将提升患者依从性和治疗有效性,并将对我国乙型肝炎队列和真实世界研究产生重要价值,期待有更多基于人工智能、大数据的平台开发和应用。
执笔专家:
盛国平、王贵强、谢青、李用国、李家斌、李智伟、尚佳、高志良、唐红、赵英仁
撰写组专家(按姓氏笔画排序):
毛青(陆军军医大学第一附属医院)、王贵强(北京大学第一医院)、韦嘉(云南大学附属医院)、宁琴(华中科技大学同济医学院附属同济医院)、阮冰(浙江大学医学院附属第一医院)、朱传龙(南京医科大学第一附属医院)、肖永红(浙江大学医学院附属第一医院)、李用国(重庆医科大学附属第一医院)、李兰娟(浙江大学医学院附属第一医院)、张权(贵州医科大学附属医院)、张晓红(中山大学附属第三医院)、李家斌(安徽医科大学第一附属医院)、李强(山东大学附属济南市传染病医院)、李智伟(中国医科大学附属盛京医院)、张缭云(山西医科大学第一医院)、杨永峰(南京市第二医院)、尚佳(河南省人民医院)、赵英仁(西安交通大学第一附属医院)、党双锁(西安交通大学第二附属医院)、唐红(四川大学华西医院)、高志良(中山大学附属第三医院)、黄建荣(浙江大学医学院附属第一医院)、黄燕(中南大学湘雅医院)、盛吉芳(浙江大学医学院附属第一医院)、盛国平(浙江树人学院树兰国际医学院附属树兰(杭州)医院全省人口器官与计算医学重点实验室)、谢青(上海交通大学医学院瑞金医院)、蔡大川(重庆医科大学附属第二医院)
中国医师协会感染科医师分会,国家感染性疾病临床医学研究中心. 乙型肝炎全人群管理专家共识(2023)[J]. 中华临床感染病杂志,2024,17(1):1-13. DOI:10.3760/cma.j.issn.1674-2397.2024.01.001.
所有作者均声明不存在利益冲突



























