2024年新年伊始,《2024年国际共识标准:儿童脓毒症和脓毒性休克》(简称“2024年儿童共识”)发布。本文对2024年版儿童共识提出的脓毒症及脓毒性休克标准进行解读,并比较2005版儿童共识及2016版成人指南的诊断标准。2024年儿童共识更新并评估了儿童脓毒症和脓毒性休克的标准,采用新型菲尼克斯脓毒症评分(Phoenix Sepsis Score,PSS)(包括呼吸、心血管、凝血和神经系统的功能障碍)至少2分,可以确定疑似感染的儿童[<18岁(排除围生期住院的新生儿及早产儿(<37周)]是否存在脓毒症;脓毒性休克定义为PSS心血管评分至少1分的脓毒症。该标准不再使用全身炎症反应综合征,也取消了严重脓毒症诊断,并提出出现远隔感染部位器官功能障碍的儿童脓毒症患者存在更高的死亡风险。2024年儿童共识新标准强调了脓毒症相关的器官损伤,可促进全球疾病流行病学数据的统一收集,为持续管理提供了基础,从而改善患儿结局,并为未来的研究提供信息。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2017年,全球约有2 500万儿童罹患脓毒症,导致超过300万人死亡。许多儿童脓毒症的幸存者伴有持续的躯体、认知、情感和心理方面的后遗症,这可能对他们及其家庭产生长期影响。儿童发展为脓毒症的风险超过其他任何年龄群体,尤其是在资源有限地区影响最为严重。2016至2020年在非洲和亚洲,5岁以下儿童的主要直接死亡原因为脓毒症(36.7%)[1]。世界卫生组织有关脓毒症的决议呼吁促进脓毒症的诊断、预防和治疗,但需要准确识别脓毒症高风险儿童,然而,目前缺乏相应标准。
2005年国际儿科脓毒症共识会议(International Pediatric Sepsis Consensus Conference,IPSCC)根据2001年成人脓毒症指南提出了儿童脓毒症标准(简称“2005年儿童共识”),目前广泛应用于临床实践、研究及质量改进和政策工作中[2]。该标准虽根据年龄、发育等因素对相关指标进行了修改,但仍以感染相关的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)作为儿童脓毒症标准。然而研究表明,SIRS相对儿童序贯器官功能衰竭评分(pediatric sequential organ failure assessment,pSOFA)和儿童器官功能障碍评分2(pediatric logistic organ dysfunction-2,PELOD-2)识别具有高死亡风险的感染患儿特异性较低[3]。2016年成人脓毒症指南(简称“2016年成人指南”)将脓毒症定义为机体对感染反应失调导致的危及生命的器官功能障碍,将脓毒症和单纯感染区分开,并且在疑似感染患者中,采用序贯器官功能衰竭评分(sequential organ failure assessment,SOFA)增加至少2分来确定脓毒症[4]。但此指南并不涉及儿童,儿童由于生命体征的年龄特异性、发育相关的免疫功能以及儿科特定的合并症、流行病学和预后差异,与成人有重要的不同之处,且儿童的器官功能障碍评分的敏感性和阳性预测值尚不清楚。因此,儿童脓毒症标准应专门针对该特定人群进行推导和验证,以提高诊断的准确性。
2019年美国重症医学会组建了一个来自6大洲的35名专家组成的工作组。该工作组基于以下3种方法制定标准:(1)通过对2 835名临床医生进行全球调查,脓毒症定义为由感染导致的危及生命的器官功能障碍,脓毒性休克定义为脓毒症导致心血管功能障碍被广泛认可;(2)系统综述和荟萃分析证实了器官功能障碍评分与脓毒症发展或不良结局风险增加的关联性,因此需要用器官功能评价来制定儿童脓毒症和脓毒性休克的标准[5];(3)通过在不同资源地区建立国际多中心回顾性队列,将其分为推导数集和验证数集,以8种现有儿科器官功能障碍评分的器官特异性亚分数预测可疑感染儿童预后,并建立回归模型。最终模型包含了心血管、呼吸、神经和凝血四个系统的功能障碍水平,并将其转化为基于整数的评分,即菲尼克斯脓毒症评分(Phoenix Sepsis Score,PSS)(表1)。最后工作组根据改良德尔菲法,以80%以上的工作组成员达成80%以上的一致意见形成共识(简称“2024年儿童共识”)[6]。
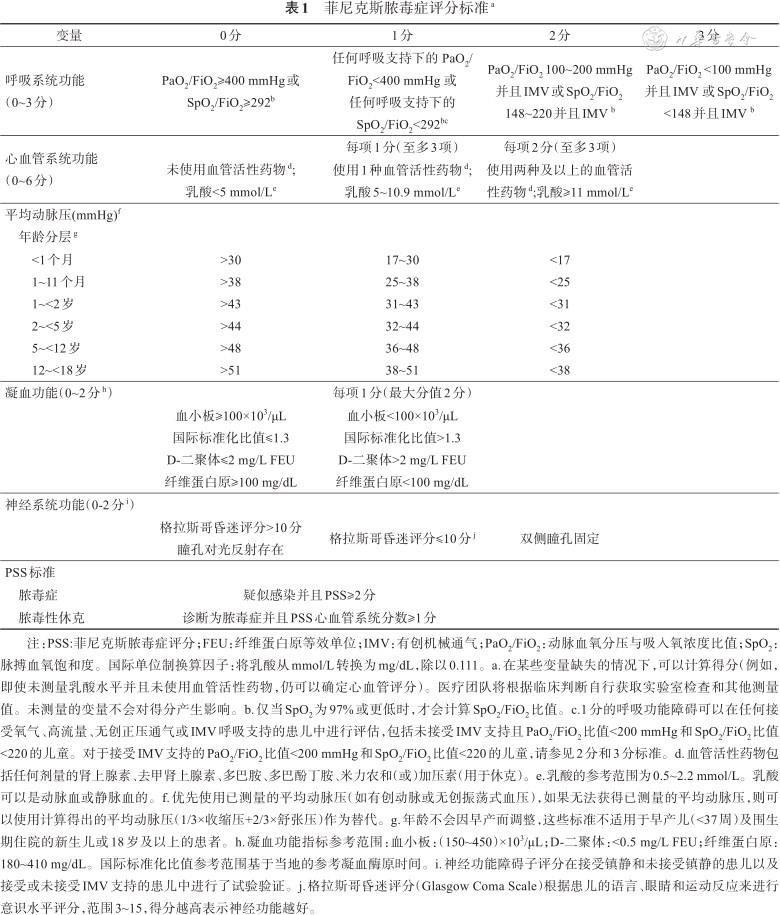
菲尼克斯脓毒症评分标准a
菲尼克斯脓毒症评分标准a
| 变量 | 0分 | 1分 | 2分 | 3分 |
|---|---|---|---|---|
| 呼吸系统功能(0~3分) | PaO2/FiO2≥400 mmHg或 SpO2/FiO2≥292b | 任何呼吸支持下的 PaO2/FiO2<400 mmHg 或 任何呼吸支持下的 SpO2/FiO2<292bc | PaO2/FiO2 100~200 mmHg并且IMV或SpO2/FiO2 148~220并且IMV b | PaO2/FiO2 <100 mmHg并且IMV 或SpO2/FiO2<148并且IMV b |
| 心血管系统功能(0~6分) | 未使用血管活性药物d; 乳酸<5 mmol/Le | 每项1分(至多3项) | 每项2分(至多3项) | |
使用1种血管活性药物d; 乳酸5~10.9 mmol/Le | 使用两种及以上的血管活性药物d;乳酸≥11 mmol/Le | |||
| 平均动脉压(mmHg)f 年龄分层g | ||||
<1个月 1~11个月 1~<2岁 2~<5岁 5~<12岁 12~<18岁 | >30 >38 >43 >44 >48 >51 | 17~30 25~38 31~43 32~44 36~48 38~51 | <17 <25 <31 <32 <36 <38 | |
| 凝血功能(0~2分h) | 每项1分(最大分值2分) | |||
血小板≥100×103/μL 国际标准化比值≤1.3 D-二聚体≤2 mg/L FEU 纤维蛋白原≥100 mg/dL | 血小板<100×103/μL 国际标准化比值>1.3 D-二聚体>2 mg/L FEU 纤维蛋白原<100 mg/dL | |||
| 神经系统功能(0-2分i) | ||||
格拉斯哥昏迷评分>10分 瞳孔对光反射存在 | 格拉斯哥昏迷评分≤10分j | 双侧瞳孔固定 | ||
| PSS标准 | ||||
| 脓毒症 | 疑似感染并且PSS≥2分 | |||
| 脓毒性休克 | 诊断为脓毒症并且PSS心血管系统分数≥1分 | |||
注:PSS:菲尼克斯脓毒症评分;FEU:纤维蛋白原等效单位;IMV:有创机械通气;PaO2/FiO2:动脉血氧分压与吸入氧浓度比值;SpO2:脉搏血氧饱和度。国际单位制换算因子:将乳酸从mmol/L转换为mg/dL,除以0.111。a.在某些变量缺失的情况下,可以计算得分(例如,即使未测量乳酸水平并且未使用血管活性药物,仍可以确定心血管评分)。医疗团队将根据临床判断自行获取实验室检查和其他测量值。未测量的变量不会对得分产生影响。b.仅当SpO2为97%或更低时,才会计算SpO2/FiO2比值。c.1分的呼吸功能障碍可以在任何接受氧气、高流量、无创正压通气或IMV呼吸支持的患儿中进行评估,包括未接受IMV支持且PaO2/FiO2比值<200 mmHg和SpO2/FiO2比值<220的儿童。对于接受IMV支持的PaO2/FiO2比值<200 mmHg和SpO2/FiO2比值<220的儿童,请参见2分和3分标准。d.血管活性药物包括任何剂量的肾上腺素、去甲肾上腺素、多巴胺、多巴酚丁胺、米力农和(或)加压素(用于休克)。e.乳酸的参考范围为0.5~2.2 mmol/L。乳酸可以是动脉血或静脉血的。f.优先使用已测量的平均动脉压(如有创动脉或无创振荡式血压),如果无法获得已测量的平均动脉压,则可以使用计算得出的平均动脉压(1/3×收缩压+2/3×舒张压)作为替代。g.年龄不会因早产而调整,这些标准不适用于早产儿(<37周)及围生期住院的新生儿或18岁及以上的患者。h.凝血功能指标参考范围:血小板:(150~450)×103/μL;D-二聚体:<0.5 mg/L FEU;纤维蛋白原:180~410 mg/dL。国际标准化比值参考范围基于当地的参考凝血酶原时间。i.神经功能障碍子评分在接受镇静和未接受镇静的患儿以及接受或未接受IMV支持的患儿中进行了试验验证。j.格拉斯哥昏迷评分(Glasgow Coma Scale)根据患儿的语言、眼睛和运动反应来进行意识水平评分,范围3~15,得分越高表示神经功能越好。
2.1 儿科脓毒症标准适用于18岁以下的儿童,但不适用于围生期住院的新生儿及早产儿(胎龄<37周)。2024年儿童共识与2005年儿童共识均提出儿童脓毒症标准适用于18岁以下的儿童,但2024年儿童共识则在2005年排除早产儿的基础上,进一步提出排除围生期住院的新生儿。排除早产儿主要是由于早产儿的器官功能障碍评估与儿童不同,而排除围生期住院的新生儿则由于围生期感染的特殊性,涉及新生儿免疫功能改变及潜在的宫内感染风险。
2.2 以SIRS为基础的标准不适用于儿童脓毒症的诊断。2005年儿童共识沿用成人脓毒症标准,以感染相关的SIRS为诊断标准,但由于SIRS特异性较低,2016年成人指南将SIRS废除,定义脓毒症为感染导致的危及生命的器官功能障碍,并引入SOFA评分作为脓毒症诊断标准之一。2024年儿童共识则参考2016年成人指南对脓毒症的定义,同样不再使用SIRS,而使用推导及验证后的PSS作为儿童脓毒症诊断标准。
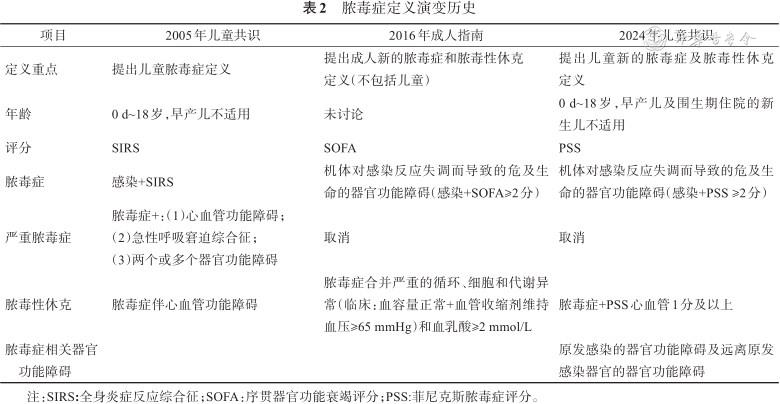
脓毒症定义演变历史
脓毒症定义演变历史
| 项目 | 2005年儿童共识 | 2016年成人指南 | 2024年儿童共识 |
|---|---|---|---|
| 定义重点 | 提出儿童脓毒症定义 | 提出成人新的脓毒症和脓毒性休克 定义(不包括儿童) | 提出儿童新的脓毒症及脓毒性休克定义 |
| 年龄 | 0 d~18岁,早产儿不适用 | 未讨论 | 0 d~18岁,早产儿及围生期住院的新生儿不适用 |
| 评分 | SIRS | SOFA | PSS |
| 脓毒症 | 感染+SIRS | 机体对感染反应失调而导致的危及生命的器官功能障碍(感染+SOFA≥2分) | 机体对感染反应失调而导致的危及生命的器官功能障碍(感染+PSS ≥2分) |
| 严重脓毒症 | 脓毒症+:(1)心血管功能障碍; (2)急性呼吸窘迫综合征; (3)两个或多个器官功能障碍 | 取消 | 取消 |
| 脓毒性休克 | 脓毒症伴心血管功能障碍 | 脓毒症合并严重的循环、细胞和代谢异常(临床:血容量正常+血管收缩剂维持血压≥65 mmHg)和血乳酸≥2 mmol/L | 脓毒症+PSS心血管1分及以上 |
| 脓毒症相关器官功能障碍 | 原发感染的器官功能障碍及远离原发感染器官的器官功能障碍 |
注:SIRS:全身炎症反应综合征;SOFA:序贯器官功能衰竭评分;PSS:菲尼克斯脓毒症评分。
2.3 以前的术语“严重脓毒症”不再使用,因为脓毒症是与感染相关的危及生命的器官功能障碍,已表明疾病的严重程度。2005年儿童共识将脓毒症合并心血管功能障碍、急性呼吸窘迫综合征或合并两个及以上器官功能障碍定义为严重脓毒症。而2016年成人指南提出脓毒症即为感染诱导的器官功能障碍,覆盖了原先“严重脓毒症”标准,不再使用“严重脓毒症”。2024年儿童共识参考2016年成人指南脓毒症定义,也取消了“严重脓毒症”标准。
2.4 不同资源地区可以通过至少2分的PSS来确定疑似或确诊感染的儿童是否存在危及生命的器官功能障碍。新的PSS是一个涉及4个器官系统的复合评分模型,包括心血管、呼吸、神经和凝血系统功能障碍标准。2024年儿童共识是参考2016年成人指南提出了儿童脓毒症标准,将器官功能障碍同样引入儿童脓毒症诊断,并根据现有8种儿科器官功能障碍评分的亚分数通过回归模型及转化产生新的器官功能障碍评分,即Phoenix-8和PSS。PSS涉及心血管、呼吸、神经和凝血4个系统,而Phoenix-8则在PSS基础上增加肾脏、肝脏、免疫及内分泌系统(表3)。相对于其他器官功能障碍评分,在受试者工作特征曲线下面积(area under the receiver operating characteristic curve,AUROC)相似的情况下,PSS有更高的精确率召回率曲线下面积(area under the precision recall curve,AUPRC)(表3)[7]。AUPRC以灵敏度及阳性预测值为主要性能指标,相对于AUROC,对于分布不平衡的数据评估更准确。根据表3,PSS相对于其他评分(包括PELOD-2、pSOFA等)有更高的灵敏度和阳性预测值。PSS评分阈值≥2分时,确诊或疑似感染儿童前24 h内的院内病死率的阳性预测值较高,灵敏度也与Phoenix-8相当甚至较高,并且可适用于不同资源地区的患儿。由于PSS评分只涉及4个系统,当合并肾、肝等其他脏器功能障碍时,临床医生和研究人员可以使用Phoenix-8[7]。
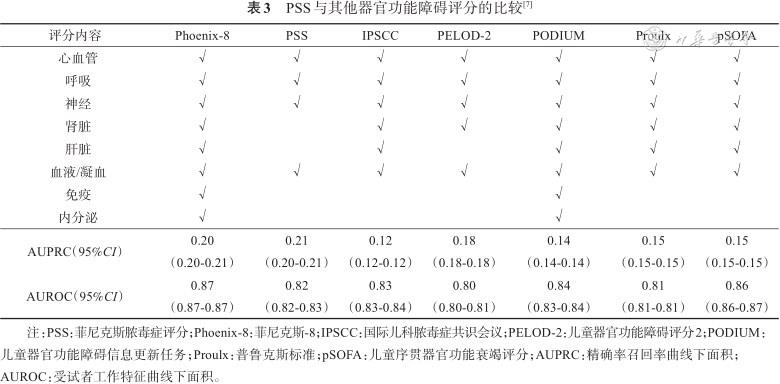
PSS与其他器官功能障碍评分的比较[7]
PSS与其他器官功能障碍评分的比较[7]
| 评分内容 | Phoenix-8 | PSS | IPSCC | PELOD-2 | PODIUM | Proulx | pSOFA | |
|---|---|---|---|---|---|---|---|---|
| 心血管 | √ | √ | √ | √ | √ | √ | √ | |
| 呼吸 | √ | √ | √ | √ | √ | √ | √ | |
| 神经 | √ | √ | √ | √ | √ | √ | √ | |
| 肾脏 | √ | √ | √ | √ | √ | √ | ||
| 肝脏 | √ | √ | √ | √ | √ | |||
| 血液/凝血 | √ | √ | √ | √ | √ | √ | √ | |
| 免疫 | √ | √ | ||||||
| 内分泌 | √ | √ | ||||||
| AUPRC(95%CI) | 0.20 (0.20-0.21) | 0.21 (0.20-0.21) | 0.12 (0.12-0.12) | 0.18 (0.18-0.18) | 0.14 (0.14-0.14) | 0.15 (0.15-0.15) | 0.15 (0.15-0.15) | |
| AUROC(95%CI) | 0.87 (0.87-0.87) | 0.82 (0.82-0.83) | 0.83 (0.83-0.84) | 0.80 (0.80-0.81) | 0.84 (0.83-0.84) | 0.81 (0.81-0.81) | 0.86 (0.86-0.87) | |
注:PSS:菲尼克斯脓毒症评分;Phoenix-8:菲尼克斯-8;IPSCC:国际儿科脓毒症共识会议;PELOD-2:儿童器官功能障碍评分2;PODIUM:儿童器官功能障碍信息更新任务;Proulx:普鲁克斯标准;pSOFA:儿童序贯器官功能衰竭评分;AUPRC:精确率召回率曲线下面积;AUROC:受试者工作特征曲线下面积。
2.5 脓毒性休克是儿童脓毒症的一种亚型,表现为心血管功能障碍,与更高的病死率相关。PSS评分的心血管系统至少为1分的脓毒症可以确定为脓毒性休克。脓毒性休克自2005年至2024年儿童共识均认为是脓毒症合并心血管功能障碍。2005年儿童脓毒性休克标准的心血管功能障碍为经充分液体复苏后仍存在低血压(收缩压)或需要血管活性药物维持血压或存在2项以上组织灌注异常指标,其中乳酸大于正常上限的2倍作为组织灌注异常指标之一。相对于2005年儿童共识,2024年儿童共识的心血管功能障碍并未强调需要充分液体复苏,而以年龄相关的低平均动脉压,需要1种及以上的血管活性药物或乳酸≥5 mmol/L作为标准,符合其中1项的脓毒症则为脓毒性休克。2024年儿童共识的低血压标准以平均动脉压代替原来的收缩压作为血压评估指标,血管活性药物维持并未强调剂量(包括多巴胺),并将乳酸单独作为评估心血管功能障碍的指标之一,提高了乳酸在脓毒性休克诊断中的价值。
2.6 出现远隔感染部位器官功能障碍的脓毒症患儿存在更高的死亡风险,提示存在危及生命的全身累及的疾病进程。2005年儿童共识的严重脓毒症为脓毒症基础上合并器官功能障碍,而2024年儿童共识则将脓毒症定义为与感染相关的器官功能障碍。器官功能障碍与脓毒症预后密切相关。然而,存在远离原发感染部位器官功能障碍的脓毒症患儿病死率较高(在高资源和低资源环境中分别为8.0%和32.3%)。相比之下,器官功能障碍仅限于原发感染部位的脓毒症患儿病死率较低(在高资源和低资源环境中的病死率分别为1.7%和6.1%)。因此,存在远离原发感染部位的器官功能障碍的患儿存在更高死亡风险。
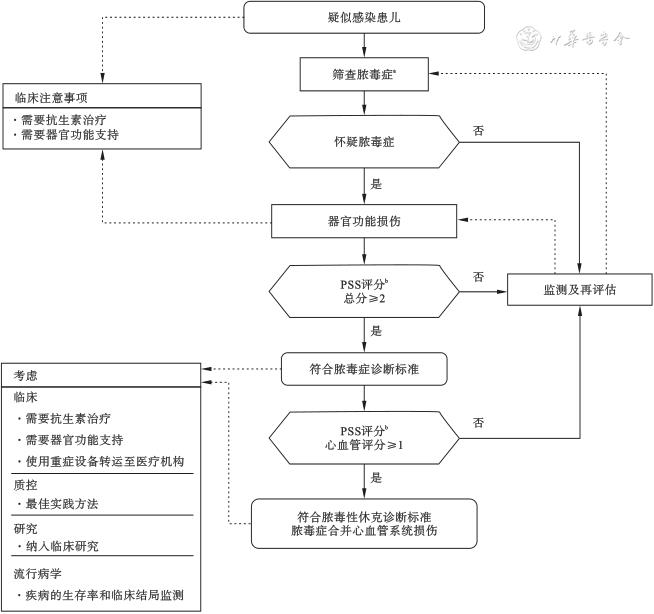
根据新版标准,感染合并PSS≥2分则诊断脓毒症,若脓毒症合并心血管功能障碍,诊断脓毒性休克。临床实践中,可以参照图1流程使用PSS评分对疑似感染的患儿进行抗生素治疗、监测及评估筛查脓毒症,对怀疑脓毒症的患儿评估器官功能损伤并及时进行必要的器官功能支持。
2024年儿童共识参考2016年成人指南,将以感染引起的器官功能障碍作为脓毒症诊断标准,引入评分系统对死亡风险进行预测,同时考虑了欠发达地区以SpO2、格拉斯哥昏迷评分等作为诊断依据具有积极意义;相对于2005年诊断标准,心血管功能障碍评价更简单易行,适用于广泛临床应用,但选取神经及凝血系统进行器官功能障碍评价是否足够具有代表性,需要在临床实践中进一步检验。同时,该指南的评分制定为入院24 h的时间窗口,是否适用于院内感染需要进一步推敲。但总而言之,新版儿童脓毒症标准的使用有可能改善全球儿童脓毒症和脓毒性休克的临床救治、流行病学评估和研究。未来仍需要大规模流行病学研究验证其在中国儿童人群中的临床价值。
所有作者声明无利益冲突