
评价酪酸梭菌二联活菌(常乐康)对因感染性疾病住院儿童抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)的预防作用,并与布拉氏酵母菌(亿活)的疗效进行比较。
采用前瞻性、随机病例对照研究方法,纳入2011年5月至2012年5月在中国医科大学附属盛京医院儿科病房因各种感染性疾病住院,需用抗生素治疗的患儿552例,完成480例。其中试验组又分为2个亚组:常乐康组80例:口服常乐康840 mg/次,2次/d,疗程1周;亿活组160例:口服亿活250 mg/次,2次/d,疗程1周;对照组:未给予任何益生菌制剂。两组患儿均常规给予抗生素类药物及对症治疗原发病。每日观察记录大便次数,根据Bristol粪便评估量表评价粪便性状,统计腹泻发生率和药物相关不良反应。
观察7 d内试验组AAD发生率为4.2%(10/240),对照组为20.4%(49/240),两组比较差异有统计学意义(χ2=5.584,P=0.006)。与对照组比较,试验组发生AAD的风险下降了58.5%,其中常乐康组下降64.7%(RR=0.394,95%CI 0.183~0.875,P=0.008),亿活组下降51.6%(RR=0.484,95%CI 0.276~0.774,P=0.007),常乐康组较亿活组下降38.2%(RR=0.728,95%CI 0.257~0.784,P=0.009)。试验组较对照组AAD患儿平均便次减少,腹泻持续时间缩短,差异有统计学意义(P均<0.01)。观察期间未见药物相关不良反应。
酪酸梭菌二联活菌和布拉氏酵母菌均能有效降低感染性疾病住院患儿发生AAD的风险,减轻腹泻症状,缩短腹泻持续时间,未发现不良反应。酪酸梭菌二联活菌和布拉氏酵母菌对中国北方儿童AAD的保护效力相当。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)是应用广谱抗生素后所致急性肠道黏膜炎症。Bartlett等[1]将其定义为伴随着抗生素的使用而发生的无法用其他原因解释的腹泻。几乎所有的抗生素均可引起腹泻,尤其是氨苄青霉素、头孢菌素及克林霉素等[2,3]。国外有报道称AAD的发生率达5%~39%[4]。近年来,儿科临床抗生素使用十分广泛,滥用抗生素现象也非常严重。国外报道门诊儿童患者AAD的发生率达6.2%[5],国内报道儿科肺炎使用抗生素后腹泻的发生率甚至高达50%[6]。因此必须引起儿科医师的足够重视。
抗生素在杀灭病原菌的同时,也对患者肠道微生态系统造成了破坏,从而引起肠道正常菌群平衡失调。因此,肠道菌群紊乱是发生AAD的基础和根本原因。国外多项荟萃分析显示,益生菌药物可使儿童AAD发生率降低50%~60%[7,8,9,10],尤其是布拉氏酵母菌对AAD的预防和治疗效果具有循证医学证据[7]。但益生菌药物作用的显著特点是其具有菌株特异性和剂量依赖性,国外的菌株和药物作用不能代表国内使用的药物,因此,国内7家三级医院联合组成协作组,采用前瞻性、多中心、中心分层区组随机、空白对照试验设计的方法,对国内分离菌株酪酸梭菌和婴儿双歧杆菌二联活菌预防肺炎儿童AAD的疗效和安全性进行了评价,证明该菌株可有效降低肺炎住院患儿发生AAD的风险,未发现其不良反应[11]。本课题组为该协作组成员单位之一,在原研究基础上,扩大样本、扩大病种,持续观察了酪酸梭菌二联活菌对因各种细菌感染性疾病住院患儿AAD的预防作用,同时与布拉氏酵母菌疗效进行比较,现报告如下。
2011年5月至2012年5月在中国医科大学附属盛京医院儿科病房因各种细菌感染性疾病住院,需用抗生素治疗的患儿,入组552例,其中男316例,女236例。入选标准:(1)3个月~14岁患儿;(2)入组前无腹泻;(3)使用抗生素≥2 d;(4)入组前2周未使用过微生态制剂。排除标准:(1)入组时出现腹泻,或入组前2周曾发生腹泻的患儿;(2)病情危重需入住ICU的患儿;(3)有其他消化系统疾病的患儿;(4)行中央静脉插管、使用抗真菌药或其他微生态制剂的患儿;(5)罹患慢性心血管系统疾病、血液系统疾病等患儿;(6)营养不良患儿。
参考我国2001年发布的《医院感染诊断标准(试行)》及1998年颁布的《中国腹泻病诊断治疗方案》,具体如下:(1)抗生素应用后至少24 h发生显著大便性状改变,如稀便、水样便、血便、黏液脓血便或见斑块条索状伪膜;日大便次数超过入组前平均次数2次或以上;(2)水样便者需进行实验室检查,排除轮状病毒性腹泻;(3)血便、脓血便者需进行粪便培养,为难辨梭状芽孢杆菌生长或便培养阴性[1]。
本研究为前瞻性、随机病例对照临床试验。入组患儿采用随机法按1∶1比例分配,利用SAS软件产生随机数字表,由主要研究者负责,按照需用抗生素治疗的住院患儿入院顺序,由随机表告知治疗分配编号,确定空白对照或研究药物治疗。本项研究通过了中国临床试验注册中心医学伦理委员会的书面批准(伦理审查号:ChiECRCT-2011025)。每例患儿入组前,与其父母任一方充分告知本研究目的和试验方法,获得患儿家长的知情同意,并且签署知情同意书。
随机分为2组:试验组和对照组。试验组依入院时间口服酪酸梭菌二联活菌胶囊(商品名:常乐康,山东科兴生物制品有限公司生产,2011年5月至2011年9月)或布拉氏酵母菌粉剂(商品名:亿活,法国Biocodex公司生产,2011年10月至2012年5月),对照组不给予任何益生菌制剂。
试验组分为2个亚组:常乐康组:口服常乐康840 mg/次,2次/d,疗程1周;亿活组:口服亿活250 mg/次,2次/d,疗程1周;对照组:未给予任何益生菌制剂。两组患儿均常规给予抗生素类药物及对症治疗原发病。观察期间禁用其他益生菌制剂或含益生菌的食物(如酸奶);禁用具有收敛止泻的药物;禁用清热解毒具有导致腹泻不良反应的药物。
入组后治疗前记录患儿基本信息:性别、年龄、身高、体重、既往病史、入组前诊断、入组前抗生素治疗史等。研究期内采用Bristol粪便评估量表(BSS)[12]评价粪便性状,记录每日大便次数,同时记录腹泻伴随症状、脱水程度以及使用抗生素的种类及总疗程等。
包括不良事件及药物毒副反应。试验期间如实填写不良事件记录表,记录不良事件的发生时间、严重程度、持续时间、采取的有效措施和转归。根据不良事件与研究药物之间可能存在的关联评定为肯定有关、很可能有关、可能有关、可能无关、肯定无关。同时记录有无全身过敏反应、皮疹、荨麻疹、胃部不适、便秘、口干等药物不良反应。
数据采用SPSS 18.0软件统计分析,计量资料以均数±标准差( ±s)表示,采用方差分析;计数资料以百分比表示,采用卡方检验或Fisher精确概率检验,并计算其相对危险度(relative risk,RR)和95%CI,P<0.05为差异有统计学意义。
±s)表示,采用方差分析;计数资料以百分比表示,采用卡方检验或Fisher精确概率检验,并计算其相对危险度(relative risk,RR)和95%CI,P<0.05为差异有统计学意义。
共552例患儿入组进行观察,其中试验组及对照组各276例,入组时两组患儿性别比、年龄、疾病种类分布差异无统计学意义(P>0.05),见表1。
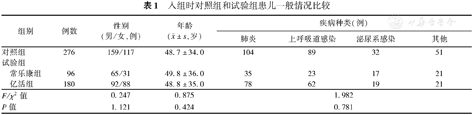
入组时对照组和试验组患儿一般情况比较
入组时对照组和试验组患儿一般情况比较
| 组别 | 例数 | 性别(男/女,例) | 年龄( ±s,岁) ±s,岁) | 疾病种类(例) | ||||
|---|---|---|---|---|---|---|---|---|
| 肺炎 | 上呼吸道感染 | 泌尿系感染 | 其他 | |||||
| 对照组 | 276 | 159/117 | 48.7±34.0 | 104 | 89 | 32 | 51 | |
| 试验组 | ||||||||
| 常乐康组 | 96 | 65/31 | 49.8±36.0 | 35 | 23 | 17 | 21 | |
| 亿活组 | 180 | 92/88 | 48.8±35.0 | 78 | 62 | 19 | 21 | |
| F/χ2值 | 0.247 | 0.875 | 1.982 | |||||
| P值 | 1.121 | 0.424 | 0.781 | |||||
观察期间共72例(13%)患儿脱落,试验组36例(13%)[常乐康组16例(16.7%),亿活组20例(11.1%)],对照组36例(13%)。32例为监护人拒绝试验,中途退出;15例抗生素应用时间<48 h;10例发生轮状病毒性腹泻;8例剔除(病例报告表填写不规范);7例病情加重,转入ICU继续治疗。实际完成480例,试验组240例(常乐康组80例,亿活组160例),对照组240例。均衡性分析结果显示,入组前及入组后两组患儿在抗生素使用种类、平均给药时间和给药途径的分布差异无统计学意义(P>0.05),见表2。
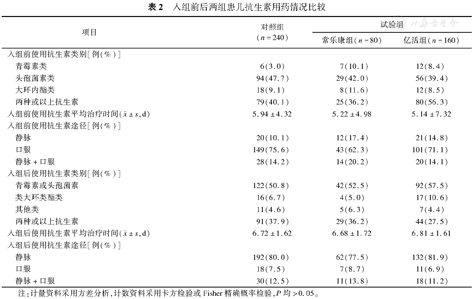
入组前后两组患儿抗生素用药情况比较
入组前后两组患儿抗生素用药情况比较
| 项目 | 对照组(n=240) | 试验组 | ||
|---|---|---|---|---|
| 常乐康组(n=80) | 亿活组(n=160) | |||
| 入组前使用抗生素类别[例(%)] | ||||
| 青霉素类 | 6(3.0) | 7(10.1) | 12(8.4) | |
| 头孢菌素类 | 94(47.7) | 29(42.0) | 56(39.4) | |
| 大环内酯类 | 18(9.1) | 8(11.6) | 12(8.5) | |
| 两种或以上抗生素 | 79(40.1) | 25(36.2) | 80(56.3) | |
入组前使用抗生素平均治疗时间( ±s,d) ±s,d) | 5.94±4.32 | 5.22±4.98 | 5.14±7.32 | |
| 入组前使用抗生素途径[例(%)] | ||||
| 静脉 | 20(10.1) | 12(17.4) | 21(14.8) | |
| 口服 | 149(75.6) | 43(62.3) | 101(71.1) | |
| 静脉+口服 | 28(14.2) | 14(20.2) | 20(14.1) | |
| 入组后使用抗生素类别[例(%)] | ||||
| 青霉素或头孢菌素 | 122(50.8) | 42(52.5) | 92(57.5) | |
| 类大环类酯类 | 16(6.7) | 4(5.0) | 17(10.6) | |
| 其他类 | 11(4.6) | 5(6.3) | 7(4.4) | |
| 两种或以上抗生素 | 91(37.9) | 29(36.2) | 44(27.5) | |
入组后使用抗生素平均治疗时间( ±s,d) ±s,d) | 6.72±1.62 | 6.68±1.72 | 6.81±1.61 | |
| 入组后使用抗生素途径[例(%)] | ||||
| 静脉 | 192(80.0) | 62(77.5) | 132(81.9) | |
| 口服 | 18(7.5) | 7(8.7) | 11(6.9) | |
| 静脉+口服 | 30(12.5) | 11(13.8) | 18(11.2) | |
注:计量资料采用方差分析,计数资料采用卡方检验或Fisher精确概率检验,P均>0.05。
试验组7 d内AAD发生率显著低于对照组(χ2=5.584,P=0.006)。与对照组比较,试验组发生AAD的风险下降了58.5%,其中常乐康组下降64.7%(χ2=3.841,P=0.008),亿活组下降51.6%(χ2=6.841,P=0.007)。同时,常乐康组较亿活组AAD发生风险降低38.2%(RR=0.728,95%CI 0.257~0.784,P=0.009),见表3。
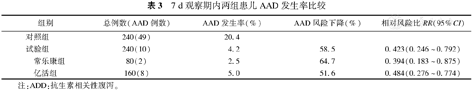
7 d观察期内两组患儿AAD发生率比较
7 d观察期内两组患儿AAD发生率比较
| 组别 | 总例数(AAD例数) | AAD发生率(%) | AAD风险下降(%) | 相对风险比RR(95%CI) | |
|---|---|---|---|---|---|
| 对照组 | 240(49) | 20.4 | |||
| 试验组 | 240(10) | 4.2 | 58.5 | 0.423(0.246~0.792) | |
| 常乐康组 | 80(2) | 2.5 | 64.7 | 0.394(0.183~0.875) | |
| 亿活组 | 160(8) | 5.0 | 51.6 | 0.484(0.276~0.774) | |
注:ADD:抗生素相关性腹泻。
试验组患儿在治疗第1、4、7天平均排便次数较对照组显著减少(P均<0.01)。试验组平均腹泻持续时间明显短于对照组(P<0.01)。见表4。
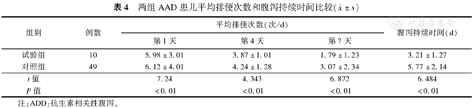
两组AAD患儿平均排便次数和腹泻持续时间比较( ±s)
±s)
两组AAD患儿平均排便次数和腹泻持续时间比较( ±s)
±s)
| 组别 | 例数 | 平均排便次数(次/d) | 腹泻持续时间(d) | ||
|---|---|---|---|---|---|
| 第1天 | 第4天 | 第7天 | |||
| 试验组 | 10 | 5.98±3.01 | 3.87±1.01 | 1.79±1.23 | 3.21±1.27 |
| 对照组 | 49 | 6.12±4.01 | 4.24±1.28 | 3.07±2.34 | 5.77±2.14 |
| t值 | 7.24 | 4.343 | 6.872 | 6.484 | |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | |
注:ADD:抗生素相关性腹泻。
四代头孢:1/59(1.7%),三代头孢:3/59(5.1%),二代头孢:24/59(40.6%),阿奇霉素18/59(30.5%),红霉素8/59(13.6%),其他5/59(8.5%),因为样本选取中各种药物使用所占比例不同,因此未行统计学分析。
7 d观察治疗期间,两组患儿均未出现不良事件和药物相关不良反应。
与成人比较,儿童期更易感染,儿童抗生素的使用率甚至3倍于成人[13],抗生素破坏肠道菌群平衡后引起的AAD在儿科临床相当常见,甚至有可能给患儿带来灾难性后果,因此有必要引起儿科医师对AAD的足够重视。本研究对照组240例患儿,7 d观察期内发生AAD 49例,发生率为20.4%,与国外文献报道基本一致[14]。
除了严格掌握抗生素用药指征,合理使用外,益生菌药物对AAD的预防作用已经获得多项荟萃分析结果的支持[9,10],但纳入的RCT研究全部采用的是国外研究,所应用的益生菌药物也几乎均为国外临床应用的药物。肠道菌群的种类及数量与人的饮食有关,而且益生菌的疗效具有明显的菌株特异性,因此,本研究分别应用国内分离菌株--酪酸梭菌和婴儿型双歧杆菌的二联活菌剂(常乐康)和国外布拉氏酵母菌(亿活)作为研究药物,采用前瞻性、随机病例对照研究方法观察了益生菌对儿童AAD的预防作用。结果发现,与对照组比较,常乐康组AAD发生率下降64.7%;亿活组AAD发生率下降51.6%;试验组患儿(常乐康组+亿活组)AAD发生率较对照组降低58.5%,差异有统计学意义。结果还显示,试验组患儿在治疗第1、4、7天平均便次较对照组显著减少,平均腹泻持续时间也明显短于对照组,差异有统计学意义(P<0.01)。说明小儿在使用抗生素期间服用益生菌制剂能有效防止AAD的发生或减轻腹泻症状,缩短腹泻持续时间,证实了国外学者研究结果[15]。
亿活对AAD的预防作用已经获得了共识。Szajewska和Mrukowicz[7]基于16项RCT的荟萃分析结果显示,布拉氏酵母菌可使儿童AAD风险下降57%(RR=0.43,95%CI 0.23~0.78)。本研究同时比较了常乐康和亿活对AAD的疗效,结果显示,常乐康组较亿活组AAD发生率降低38.2%(RR=0.728,95%CI 0.257~0.784,P=0.009)。提示常乐康对儿童AAD的保护效力与国外益生菌药物的效力相当,甚至优于国外益生菌,可能国内的酪酸梭菌二联活菌菌株更适合我国北方儿童。这为国内益生菌的研发和应用提供了广阔的前景,但目前尚缺乏系统的大样本多中心临床有效性研究,有待于今后进一步增加样本量证实。
本研究所应用的常乐康是婴儿双歧杆菌与酪酸梭菌二联活菌制剂,它们均是原籍菌,防治AAD的可能机制有:酪酸梭菌能促进双歧杆菌等优势菌属的生长而抑制致病菌或条件致病菌的生长繁殖,平衡肠道菌群[16];酪酸梭菌能分泌酪酸及酪酸菌素,酪酸是肠黏膜细胞的主要能量来源和营养物质,能快速修复损伤的肠黏膜,有效保护肠黏膜,还能调节核因子-κB活性,抑制炎症因子过度表达,消除其对肠黏膜的损伤;酪酸菌素能有效抑制肠道有害菌,清除肠道内的有害菌及其毒素,同时还能分解多糖为低聚糖,促进有益菌的生长,快速恢复肠道菌群平衡[17];酪酸梭菌促进肠黏膜分泌sIgA,提高肠腔sIgA水平,参与调节免疫应答,从而提高抗病能力,对治疗有辅助作用[18]。研究期间未观察到常乐康及亿活的不良反应,也未见任何不良事件发生。
本研究进一步证实了益生菌对儿童AAD的预防作用,也观察到国内益生菌制剂甚至有优于国外菌株的疗效。进一步的效果和安全性评价有待于今后大量的多中心、随机、双盲临床研究和总结。



























