版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近几年,血液学、细胞遗传学和分子学监测已成为慢性髓性白血病(CML)治疗的重要组成部分。中华医学会血液学分会、中国CML联盟组织专家根据国外指南或推荐,结合国内研究经验,起草制定了中国CML诊疗监测规范,以期为国内血液科医师提供有关CML诊疗的重要参考。
CML是首个被识别的发病与特定染色体或基因相关的肿瘤性疾病,其标志性特征为Ph染色体,即t(9;22)(q34;q11),致病基础为位于9q34上的c-ABL易位至22q11上BCR基因3'端,形成BCR-ABL融合基因。CML治疗从化疗时代的追求缓解症状或血液学反应,到干扰素时代的追求细胞遗传学反应,转变为造血干细胞移植(HSCT)和酪氨酸激酶抑制剂(TKI)时代的追求分子学反应,体现了CML诊疗和监测理念的变更。
干扰素使得少数Ph染色体减少或消失的患者生存期显著延长,显示了细胞遗传学监测的意义。HSCT后BCR-ABL基因转录本持续阳性或高水平表达、由阴性变为阳性或表达水平逐渐升高预示疾病复发,体现了分子学监测的重要性。在接受TKI治疗后,80%~90%新诊断CML慢性期(CP)患者获得了完全细胞遗传学反应(CCyR),高度敏感的实时定量PCR(RQ-PCR)技术成为评估CCyR患者体内白血病负荷的唯一手段。大量研究证实,TKI治疗早期(3、6和12个月)的细胞遗传学或分子学反应程度与患者远期的无疾病进展生存(PFS)和总生存(OS)有显著相关性:治疗3个月时能否达到国际标准化BCR-ABL(BCR-ABLIS)<10%被证实为早期识别预后不良患者的独立预后指标,6个月达到CCyR预示最佳疗效,12个月获得CCyR与OS期显著延长相关,12或18个月获得主要分子学反应(MMR)与长期无事件生存显著相关;治疗中如丧失曾经获得的最佳血液学、细胞遗传学或分子学反应、出现新的Ph阳性染色体克隆演变或ABL突变,提示治疗失败或疾病进展。在导致TKI治疗失败或耐药的机制中,BCR-ABL酪氨酸激酶区点突变最为多见,占耐药患者的30%~80%,耐药细胞的突变类型与TKI克服耐药的能力密切相关,因此需要根据ABL突变检测结果调整治疗策略。目前,TKI治疗中3、6、12个月以及之后任意时间点的血液学、细胞遗传学和分子学反应已被列入国内外CML诊疗推荐或指南的TKI反应评估标准,不仅用于评估疗效,更重要的是为了早期识别耐药或疾病进展,从而指导干预治疗。下文将对血液学、细胞遗传学及分子学监测予以分别阐述。
CML-CP患者就诊时外周血细胞分析可见WBC显著升高,PLT正常或升高。人工分类可见各阶段粒细胞,以中、晚幼粒细胞为主,嗜碱和嗜酸粒细胞比例多增高。进入加速期(AP)或急变期(BC)后,患者可出现WBC增高并难以控制,HGB进行性下降,PLT增高或减低,外周血分类可出现原始细胞或者嗜碱粒细胞增高。血液学监测对于准确判断病情、评估疗效、识别药物的血液学不良反应并及时进行相应处理有重要的意义。CML患者的血液学监测以外周血细胞计数和人工分类为主,在初次诊断及病情可能出现进展时必须进行骨髓细胞学的分析,进展期患者应定期进行骨髓细胞学检测。
CHR是CML患者最基本的治疗目标之一,其定义为外周血WBC<10 × 109/L,PLT<450×109/L,外周血人工分类无不成熟粒细胞,嗜碱粒细胞<0.05,无CML的症状和体征,脾脏不能触及。接受TKI治疗后3个月未获得CHR为治疗失败的指征之一。
CML患者确诊后通常每1~2周进行1次外周血细胞计数和分类检测,获得CHR后可每3个月监测1次。CML患者接受TKI治疗初期,为早期识别TKI的血液学不良反应,可适当增加血液学监测的频率。进展期患者或CML-CP患者病程中出现可疑的疾病进展迹象时,应及时进行血液学监测。
约95%的CML患者经常规核型分析可检出t(9;22)(q34;q11),其余5%的患者需经荧光原位杂交(FISH)或RT-PCR检测检出BCR-ABL融合基因。约90%的CML-CP患者为46, t(9;22)假二倍体核型,10%的患者除t(9;22)外还有-Y、+8、i(17q)或+Ph等附加染色体异常。CML-AP和CML-BC患者伴有附加染色体异常的比例达40%~70%。CML-CP患者病程中出现染色体克隆演变,也是进入AP的诊断依据之一。
CML患者的细胞遗传学反应应根据患者骨髓细胞中期分裂象中Ph染色体的比例确定,可分为以下5个级别:①CCyR:无Ph中期分裂象;②部分细胞遗传学反应(PCyR):Ph染色体中期分裂象比例为1%~ 35%;③次要细胞遗传学反应(minorCyR):Ph染色体中期分裂象比例为36%~65%;④微小细胞遗传学反应(miniCyR):Ph染色体中期分裂象比例为66%~95%;⑤无细胞遗传学反应(noCyR):Ph染色体中期分裂象比例>95%。
CML患者细胞遗传学检测方法包括显带法染色体检测和FISH。染色体检测的标本来源以骨髓为宜,当骨髓穿刺失败时,如外周血WBC >10× 109/L且原始细胞+幼稚细胞比例>0.100,也可采用外周血细胞作为检测标本。FISH检测通常以外周血或骨髓制备的染色体悬液为标本来源,新鲜的骨髓涂片或外周血涂片也作为FISH的标本来源。抗凝剂通常选择肝素钠,肝素锂尤其是EDTA可对细胞的活性产生不利影响。标本从患者体内抽取后应尽快送至实验室进行处理,以当天或24 h内送达为宜,夏季和冬季应采取措施防止运输过程中标本温度过低或过高。
标本按常规方法计数、接种、培养和收获,并以热变性R显带技术或G显带技术进行显带。核型分析需分析≥20个中期分裂象。核型结果需遵循《人类细胞遗传学国际命名体制(ISCN)2013》进行描述。
CML患者初诊时应进行骨髓细胞遗传学分析。疑诊CML的患者核型分析失败或未检出Ph染色体时,应用BCR-ABL探针进行FISH检测有助于确定CML的诊断。在TKI治疗开始后3、6、12个月应进行细胞遗传学反应的评估。获得CCyR后,无法通过国际标准化RQ-PCR进行BCR-ABL监测的患者应每12个月进行骨髓细胞遗传学监测,采用RQ-PCR(以BCR-ABLIS表示)监测的患者,若持续保持MMR可忽略骨髓细胞遗传学检测,而未达MMR或丧失MMR的患者应每12~18个月检测1次。根据ELN2013年推荐,CML患者在获得CCyR后,可采用FISH检测外周血间期细胞替代常规骨髓染色体检查,通常需分析> 200个细胞,CCyR的定义为Ph阳性细胞<1 %。
CML患者TKI治疗失败或出现疾病进展时,应及时进行包括骨髓细胞遗传学检测在内的全面评估。CML患者TKI疗效未达最佳反应时,应增加细胞遗传学和分子学监测的频率。接受TKI治疗的CML患者出现骨髓病态造血或不能用其他原因解释的血细胞减少等骨髓增生异常综合征(MDS)表现时,应进行骨髓细胞遗传学及其他相关检测。2.4%~10.0%的CML患者接受TKI治疗后,可出现Ph-的克隆性染色体异常,其中伴有累及7号染色体异常的患者易向MDS进展,需提高骨髓细胞遗传学检测的频率。
分子学监测包括采用RQ-PCR技术检测BCR-ABL转录本水平及PCR结合直接测序技术检测BCR-ABL酪氨酸激酶区点突变。
CML患者的骨髓和外周血均可用于诊断及治疗过程中的分子学监测,但建议治疗过程中一直采用外周血监测BCR-ABL转录本水平。标本采集量根据白细胞计数相应调整,对于白细胞计数正常的患者,抽取不少于8 ml的外周血标本。采用EDTA或枸橼酸钠抗凝标本。标本抽取后4 ℃运输和存放,并于24 h内处理。
通过裂解红细胞获得有核细胞来提取RNA,采用合适的裂解配方和裂解时间。RNA提取建议采用经典的TRIzol法。逆转录时建议采用M-MLV或Superscript逆转录酶,并选择随机六聚体引物。
CML患者均具有BCR-ABL融合基因,95%以上为P210型BCR-ABL,其余为P230、P190或变异型。患者初诊时需采用定性或RQ-PCR确定BCR-ABL类型。治疗随访时需采用相应反应体系检测BCR-ABL转录本水平。
建议采用探针法进行RQ-PCR。内参基因可以选择ABL、BCR或GUS。分子学反应定义见表1。为评价患者是否获得MR4.0、MR4.5和MR5.0,ABL拷贝数分别要高于10 000、32 000和100 000。每批RQ-PCR实验中均需以质粒为标准品制作标准曲线,质粒标准品拷贝数应介于102~106。每一批RQ-PCR实验均需要有阳性和阴性对照。阳性对照同时作为室内批间质控样品,包括高拷贝及低拷贝两种,二者的BCR-ABL转录本水平差别应在3个对数级左右。通过每批实验使用相同的质控样品来监测RQ-PCR稳定性。每份待测样品的BCR-ABL及ABL均应做平行管检测或至少低拷贝样品重复检测。
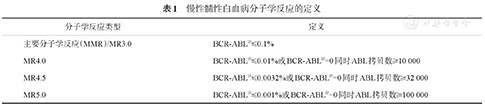
慢性髓性白血病分子学反应的定义
慢性髓性白血病分子学反应的定义
| 分子学反应类型 | 定义 |
|---|---|
| 主要分子学反应(MMR)/MR3.0 | BCR-ABLIS≤0.1% |
| MR4.0 | BCR-ABLIS≤0.01%或BCR-ABLIS=0同时ABL拷贝数≥ 10 000 |
| MR4.5 | BCR-ABLIS≤0.0032%或BCR-ABLIS=0同时ABL拷贝数≥32 000 |
| MR5.0 | BCR-ABLIS≤0.001%或BCR-ABLIS=0同时ABL拷贝数≥100 000 |
使用BCR-ABLIS来反映BCR-ABL(P210)转录本水平以正确评价患者疗效。建议实验室在检测体系稳定后尽早获得有效的转换系数(CF)以转换BCR-ABLIS,并通过定期的评估即室间质控样品比对校正来保证CF持续准确。此外,CF仅适用于具有P210型BCR-ABL、转换后BCR-ABLIS≤10% CML患者的转换。
只有高质量的cDNA样本才能保证突变检测结果的可靠性。建议选用巢式PCR扩增,首先扩增BCR- ABL,再扩增BCR-ABL上的ABL。PCR产物尽可能覆盖目前已报道的有临床意义的突变,建议至少能够准确检测ABL上第240~490号氨基酸密码子。选用高保真的DNA聚合酶。建议采用直接测序法双向测序,测序图谱应完整且背景干净。根据与参比序列比对的结果及测序图谱判定点突变结果,排除SNP位点及非特异性结果。
除了患者的基本信息外,BCR-ABL转录本水平报告的内容还应包括:①结果是否正常(阳性/阴性);② BCR-ABL和ABL的拷贝数;③BCR-ABL转录本水平检测值,以(BCR-ABL拷贝数/ABL拷贝数)×100%的百分数形式表示;④在获得有效CF后,通过BCR-ABL检测值×CF得出BCR- ABLIS,在BCR- ABLIS≤10%时报告,若>10%,可以以BCR-ABLIS>10%形式而不以具体数值报告;⑤对于ABL拷贝数不合格及有质量问题的标本,要提示;⑥建议报告中包括不同治疗时间点BCR-ABLIS动态变化曲线。BCR-ABL酪氨酸激酶区点突变的报告内容还应包括:①是否检测到突变;②突变的氨基酸位点及类型;③突变的碱基类型。
(1)BCR-ABL转录本水平检测时机:TKI开始治疗时每3个月1次;获得MMR后,每3~6个月进行监测;当BCR-ABL转录本水平介于最佳反应及治疗失败之间,即"警告"时,应增加检测的频率;当BCR-ABL转录本水平明显增高并丧失MMR时,患者应尽早接受复查。
(2)BCR-ABL酪氨酸激酶区点突变检测的时机:初诊CML-CP患者可以不进行突变检测,AP和BC患者可在TKI治疗前进行突变检测;CML患者在TKI治疗中,未获得最佳疗效、治疗失败或出现病情进展时,应进行BCR-ABL激酶区突变检测,特别是在考虑选择尼洛替尼或达沙替尼作为二线治疗前,以指导选择敏感的TKI。二线治疗后未达到最佳疗效的患者亦应进行突变检测。
(3)BCR-ABL酪氨酸激酶区点突变类型对TKI药物选择的指导意义:BCR-ABL激酶区突变类型繁多,目前已超过80种。伊马替尼、尼洛替尼和达沙替尼对部分BCR-ABL激酶区突变类型有不同的敏感性。目前已发现的突变类型中,T315I对三种TKI均耐药;超过一半的突变型对伊马替尼耐药;V299L、F317L/V/I/C和T315A对达沙替尼耐药;Y253F/H、E255K/V和F359V/I/C对尼洛替尼耐药。对于其他突变类型,可以参考已报道的IC50数据及患者的其他因素选择TKI。
未来应重视在TKI治疗中的规范化监测,并将这一理念在国内血液科医师和患者中大力普及,使之常规监测。应进一步推进中国RQ-PCR国际标准化项目,在各地区建立技术可靠的标准实验室,以方便医师和患者进行监测,并且方便交流或共享检测结果。期待更方便、快捷、敏感、精确的定量PCR和突变检测技术的日臻成熟,进一步提高CML治疗中的监测效能,以指导或干预治疗。TKI的问世使CML已从一个恶性血液肿瘤转成为一种慢性可控制性疾病,未来有望逐渐走入社区医院。普及和推广CML的标准化、规范化监测,将为这一疾病的新型管理模式提供支撑和保障。
(执笔:陈苏宁、秦亚溱、江倩)
参加规范讨论的专家:北京大学人民医院、北京大学血液病研究所(黄晓军、江倩、秦亚溱);中国医学科学院血液学研究所、血液病医院(王建祥);苏州大学附属第一医院(吴德沛、陈苏宁);南京医科大学第一附属医院(李建勇);华中科技大学同济医学院附属协和医院(胡豫);山东大学齐鲁医院(侯明);福建医科大学附属协和医院(胡建达);华中科技大学同济医学院附属同济医院(周剑峰)
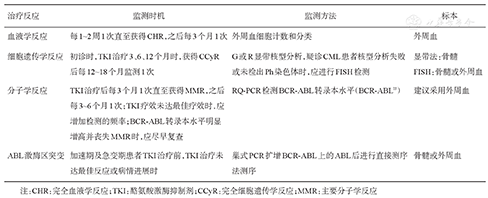
| 治疗反应 | 监测时机 | 监测方法 | 标本 |
|---|---|---|---|
| 血液学反应 | 每1~2周1次直至获得CHR,之后每3个月1次 | 外周血细胞计数和分类 | 外周血 |
| 细胞遗传学反应 | 初诊时,TKI治疗3、6、12个月时,获得CCyR后每12~18个月监测1次 | G或R显带核型分析,疑诊CML患者核型分析失败或未检出Ph染色体时,应进行FISH检测 | 显带法:骨髓 |
| FISH:骨髓或外周血 | |||
| 分子学反应 | TKI治疗后每3个月1次直至获得MMR,之后每3~6个月1次;TKI疗效未达最佳疗效时,应增加检测的频率;BCR-ABL转录本水平明显增高并丧失MMR时,应尽早复查 | RQ-PCR检测BCR-ABL转录本水平(BCR-ABLIS) | 建议采用外周血 |
| ABL激酶区突变 | 加速期及急变期患者TKI治疗前,TKI治疗未达最佳反应或病情进展时 | 巢式PCR扩增BCR-ABL上的ABL后进行直接测序法测序 | 骨髓或外周血 |
注:CHR:完全血液学反应;TKI:酪氨酸激酶抑制剂;CCyR:完全细胞遗传学反应;MMR:主要分子学反应