
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴瘤是一组起源于淋巴结和其他淋巴组织的恶性肿瘤,可分为霍奇金淋巴瘤(Hodgkin lymphoma ,HL)和非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)。NHL在全球最常见肿瘤中排第10位,在中国最常见的肿瘤类型中排第11位[1]。近期一项回顾性分析结果显示,我国人群最常见的淋巴瘤类型是B细胞淋巴瘤,占所有淋巴瘤的66.3%。其中,弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)为最常见的亚型,占B细胞NHL的54%[2]。近年来,随着靶向药物利妥昔单抗(rituximab)的应用,淋巴瘤的治疗取得了突破性进展,目前,DLBCL患者的10年总生存率可达44%[3]。
然而,淋巴瘤合并乙型肝炎病毒(HBV)感染的患者在接受化疗或免疫抑制治疗时可能会诱发HBV再激活。HBV再激活一方面会增加患者的肝炎发病率及相关病死率,另一方面可能会导致针对淋巴瘤的有效治疗中断,从而间接影响患者生存及预后。我国是乙型肝炎中高流行地区,且淋巴瘤在我国也属常见肿瘤之一,因此,淋巴瘤合并HBV感染者的HBV再激活问题值得高度重视。已有证据显示,淋巴瘤患者接受预防性抗病毒治疗可有效预防HBV再激活[4,5],但在目前国内临床实践中,淋巴瘤合并HBV感染患者的管理仍亟待进一步规范化。
为此,中华医学会血液学分会、中国抗癌协会淋巴瘤专业委员会和中华医学会肝病学分会组织有关专家进行了讨论,在回顾大量国内外文献的基础上,结合中国的实际情况,就淋巴瘤合并HBV感染患者的管理达成了共识意见,旨在为血液科、肿瘤科及相关专科的医师提供临床指导。
我国属于HBV感染中高流行地区。2006年的一项全国性调查显示,1~60岁人群中乙型肝炎病毒表面抗原(HBsAg)阳性率为7.2%,约占全球范围内HBV感染者的三分之一[6]。淋巴瘤患者的HBsAg阳性率(12%)较高,尤其是NHL患者(12%~30%),明显高于一般人群(7%)[1,7,8,9,10]。B细胞NHL患者的HBsAg阳性率(30%)显著高于T细胞NHL患者(20%)和其他肿瘤患者(15%)[1];DLBCL和滤泡淋巴瘤(follicular lymphoma,FL)患者的HBsAg阳性率分别为25%~61%和20%~40%[7,10]。HBsAg是HBV现症感染的标志,而乙肝核心抗体(抗-HBc)为是否经历过HBV感染的标志。血清HBsAg持续阳性达6个月即可诊断为慢性HBV感染[11]。参照中国《慢性乙型肝炎防治指南(2010年版)》,婴幼儿期感染HBV的自然史一般可划分为4期,即免疫耐受期、免疫清除期、非活动或低(非)复制期和再活动期[12]。非活动性或低(非)复制期患者的肝组织内仍有HBV DNA存在,在免疫抑制及化疗时可发生HBV再激活。此外,部分既往HBV感染患者表现为血清HBsAg阴性、抗-HBc阳性、HBV DNA不可测,在接受引起免疫抑制治疗时也可能发生HBV再激活[11]。DLBCL患者中HBsAg阴性/抗-HBc阳性的比例为20%~44%,因此, HBsAg阴性淋巴瘤患者发生HBV再激活的风险也应当引起重视[13,14]。
迄今为止,各主要指南所采用的HBV再激活定义不尽相同[11,15,16]。美国肝病学会(AASLD)在2009年更新的慢性乙型肝炎指南中将HBV再激活定义为"非活动性HBV携带者或HBsAg阴性/抗-HBc阳性者再次出现活动性肝脏炎症坏死"[16]。日本专家则于2012年建议:对于HBsAg阳性患者,将HBV再激活定义为HBV DNA超过基线水平10倍或乙型肝炎e抗原(HBeAg)阴性患者血清HBeAg转阳;对于HBsAg阴性患者,HBV再激活则定义为血清HBsAg转阳;对于基线HBV DNA不可测的患者, HBV再激活的定义为血清HBV DNA可测到[17]。
高达60%的肿瘤患者在接受化疗时会发生HBV再激活,其中以淋巴瘤患者的HBV再激活率最高[18,19,20,21]。在中国,HBsAg阳性的淋巴瘤患者接受化疗时的HBV再激活率为21%~60%[18,20,22,23]。关于HBsAg阴性的淋巴瘤患者HBV再激活的发病率多为小样本临床报道,其范围从2%~25%不等[13,14]。
接受化疗的肿瘤患者发生HBV再激活的风险取决于多种因素,主要包括肿瘤的类型及所接受的治疗方案、宿主因素、病毒学因素等。HBV再激活最常见于接受化疗的淋巴瘤患者和造血干细胞移植后接受免疫抑制治疗的患者[17]。其他肿瘤(包括乳腺癌、肝细胞癌、鼻咽癌、小细胞肺癌和神经分泌性肿瘤等)患者也可能发生HBV再激活。
治疗方案可能影响宿主对病毒的免疫应答,因此也是HBV再激活的危险因素。蒽环类和类固醇类药物为HBV再激活的已知高危因素。曾有研究指出,类固醇药物可通过HBV基因组中的糖皮质激素应答元件直接刺激病毒复制而增加HBV再激活的风险。当然,这也取决于患者免疫抑制的程度[20,24]。阿仑单抗(alemtuzumab)及利妥昔单抗可耗竭循环中的B细胞,尤其是前者还可耗竭T细胞,从而导致机体抗HBV免疫失调,因而在HBsAg阴性/抗-HBc阳性的患者也可引起HBV再激活[17,25]。目前已知可能导致HBV再激活的抗肿瘤药物见表1。
有关患者个体因素对HBV再激活的影响研究较少,但文献报道男性与年龄较轻者较易发生HBV再激活[18,26]。影响HBV再激活发病率的病毒相关因素包括:治疗前血清HBV载量、HBeAg/乙肝表面抗体(抗-HBs)状态、ALT水平及肝内共价闭合环状DNA (cccDNA)等[27]。血清HBsAg阳性且化疗前可检测到HBV DNA的淋巴瘤患者,若不采用预防性抗病毒治疗则发生HBV再激活的风险较高。然而,国内外研究发现,对于接受利妥昔单抗联合化疗的患者,化疗前采用预防性抗病毒治疗可有效预防HBV再激活[10,28,29,30]。
HBV再激活的典型临床表现为:化疗期间或完成化疗后出现血清HBV DNA水平升高,进而出现ALT水平升高,并伴有不同程度的肝细胞损伤,严重者出现肝衰竭;部分患者在出现肝炎临床表现时, HBV DNA可能已降至不可测水平[19,31]。
HBV再激活临床表现不一,程度较轻者可表现为无症状性肝酶增高,严重者可出现肝衰竭征象。日本学者报道111例淋巴瘤患者化疗后发生HBV再激活并继发肝炎的临床预后如下:30%痊愈,22%缓解,1%发生肝硬化,7%未痊愈;其中31%发生重症肝炎,病死率高达38%[32]。相比一过性感染或慢性乙型肝炎急性发作的患者,HBV再激活患者临床上更倾向于表现为亚急性肝衰竭或迟发性肝衰竭,ALT水平较低,胆红素及HBV DNA水平均较高[33]。HBV再激活相关病死率报道差异较大,其范围为4%~89%[33,34,35]。
淋巴瘤患者一旦发生HBV再激活,可影响淋巴瘤的治疗及患者预后。在发生HBV再激活的淋巴瘤患者中,68%~71%化疗延迟、中断或提前终止,而未发生HBV再激活的淋巴瘤患者类似情况的发生率仅为19%~33%[19,36],因此,HBV再激活可能降低淋巴瘤患者的总生存率。已有肝脏疾病的患者更易发生潜在的疾病恶化,药物引起的肝脏毒性反应也会有所增加。
已有明确证据表明,预防性抗病毒治疗可减少HBV再激活的风险[4,5]。因此,化疗前识别HBV再激活的高风险患者至关重要。亚太肝病学会(APASL)建议对所有接受免疫抑制治疗或化疗的患者进行HBsAg筛查[11],其他主要国际指南也建议对高危患者或所有患者进行筛查[11,12,15,16,27,37,38,39]。虽然不同指南一致认为应进行HBsAg筛查,但对是否应进行其他血清标志物和HBV DNA筛查尚未达成一致意见。
根据患者的不同病毒学状况,预防化疗期间HBV再激活的策略有所不同。目前所有指南均推荐化疗前对HBsAg阳性患者采取预防性抗病毒治疗[11,12,15,16,27,37,38,39]。与HBsAg阳性患者相比,HBsAg阴性/抗-HBc阳性患者发生HBV再激活的风险较低,对这类患者也可采用化疗前预防性抗病毒治疗[14],但治疗的成本效益可能不佳。因此,有人建议对HBsAg阴性/抗-HBc阳性患者监测血清HBV DNA水平,一旦出现上升,则立即开始抗病毒治疗。目前仅欧洲肝病学会(EASL)的慢性乙型肝炎指南、美国国家综合癌症网络(NCCN)的NHL指南和一项日本相关指南建议对这类患者进行预防性抗病毒治疗[15,27,40]。中国《慢性乙型肝炎防治指南(2010版)》推荐在给予长期或大剂量免疫抑制剂或细胞毒药物(特别是针对B或T淋巴细胞的单克隆抗体)治疗时,应密切监测HBsAg阴性/抗-HBc阳性患者的HBV DNA和HBsAg,若转阳则应及时采取抗病毒治疗[12]。对于伴有活动性乙型肝炎者,应当接受抗病毒治疗,已经开始治疗者则应继续治疗;因这类患者大多需要长期治疗,故应优先考虑选择强效、低耐药的核苷(酸)类抗病毒药物。
①抗病毒药物的选择:在有关化疗患者预防HBV再激活的文献中,所采用的药物大多为拉米夫定(lamivudine),其安全性和有效性已得到证实。然而拉米夫定的主要问题是其耐药率很高[15]。考虑到化疗过程中HBV再激活患者的相关死亡率很高,因此推荐有条件者尽可能采用高效、低耐药的抗病毒药物进行预防。恩替卡韦(entecavir)和替诺福韦酯(tenofovir disoprox)都为强效抗病毒药物,且耐药率极低[41],是颇具前景的预防用药新选择。国内一项近期研究表明,在HBsAg阳性淋巴瘤患者中,恩替卡韦比拉米夫定更能有效地预防HBV的再激活(HBV再激活率:0比12.4%)[42]。②抗病毒治疗的启动及停药时机:各主要指南在预防用药和停药时机方面,尚无一致的推荐意见。HBsAg阳性的淋巴瘤患者HBV再激活通常发生在接受化疗期间[43],而HBsAg阴性/抗-HBc阳性的淋巴瘤患者, HBV再激活通常发生在停止化疗之后(自末次化疗给药至肝炎发作的中位时间为9.6周;发作最晚的病例报道为8.5个月)[32]。因此,多数专家认为抗病毒治疗在化疗结束后至少需维持6个月。对于化疗前已具有高水平病毒复制的患者,其治疗方案应和慢性乙型肝炎患者一致。
①血清HBV DNA由不可测变为可测或超过基线水平≥1 log10;②HBeAg阴性患者血清HBeAg转阳。
①血清HBsAg转阳;②血清HBV DNA由不可测变为可测。
1.对于即将接受免疫抑制剂和化疗药物治疗的淋巴瘤患者,应检测乙型肝炎血清标志物(HBsAg、抗HBs、HBeAg、抗HBe和抗-HBc)和肝功能试验。若患者血清HBsAg阳性和(或)抗-HBc阳性,应进一步检测血清HBV DNA。
2.建议HBV DNA检测结果统一使用IU/ml表示,也可同时注明相应拷贝/ml。HBV DNA定量单位的换算:1 IU/ml≈5~6拷贝/ml,不同试剂盒转换系数略有差异。HBVDNA水平不可测是指血清HBV DNA低于PCR检测下限。不同试剂盒的检测下限不同,因此最好注明所使用试剂盒的检测下限。
1.对于HBsAg阳性者,应在接受化疗前开始抗病毒治疗。如果患者已经接受抗病毒治疗,则应继续治疗。建议肝病科或传染病科医师定期会诊,根据抗病毒疗效及耐药情况及时调整和优化抗病毒治疗方案。
2.对于HBsAg阴性患者,若能保障患者对监测的依从性,可以严密监测,一旦HBV DNA由不可测变为可测,则立即给予抗病毒治疗;若不能进行严密监测,患者应在接受化疗前开始抗病毒治疗。考虑到目前的化疗方案能够有效控制淋巴瘤进展,而一旦发生HBV再激活则会给患者带来严重不良后果,因此鼓励采取预防性抗病毒治疗。对于HBV再激活的高危人群,包括接受利妥昔单抗治疗、造血干细胞移植或伴有肝硬化的患者,更应积极采取抗病毒预防以减少HBV再激活风险。
①对于基线HBV DNA≥2000 IU/ml和(或)预期疗程>12个月的患者,有条件者应尽可能选用高效、低耐药的抗病毒药物,如恩替卡韦。在替诺福韦酯获得慢性乙型肝炎治疗的适应证获批后,也可采用。另外也可选用拉米夫定或替比夫定(telbivudine)。②对于基线HBV DNA<2000 IU/ml且预期疗程≤12个月的患者,可选用拉米夫定、替比夫定、恩替卡韦、替诺福韦酯等核苷(酸)类抗病毒药物。
①对于HBsAg阳性患者,原则上应尽早给予抗病毒治疗,至少在启动化疗同时给予抗病毒治疗;对于HBsAg阴性/抗-HBc阳性患者患者,若能保障患者对监测的依从性,可以严密监测,一旦HBV DNA水平可测则立即给予抗病毒治疗;若不能严密监测,原则上应尽早给予抗病毒治疗,至少在启动化疗的同时给予抗病毒治疗。②启动化疗前已经出现明显活动性乙型肝炎症状的淋巴瘤患者,应积极采取抗病毒治疗以控制病情。活动性乙型肝炎的定义需同时满足以下3个条件:a :HBV DNA≥2000 IU/ml ;b :ALT≥2倍正常上限值;c:排除由于淋巴瘤本身、药物等其他原因所致的肝炎。在活动性乙型肝炎得到有效控制情况下,即HBV DNA<2000 IU/ml且ALT<2倍正常上限值,才可启动可引起HBV再激活的高风险治疗方案。
①对于基线HBV DNA≥ 2000 IU/ml的患者,建议肝病科或传染病科医师根据最新慢性乙型肝炎相关指南决定停药时间;对于基线HBV DNA< 2000 IU/ml的患者,在完成化疗或免疫抑制治疗后,抗病毒治疗应至少持续6~12个月。②根据患者免疫功能受抑制程度及其他高危因素决定具体停药时间。对于高危人群,如接受免疫化疗、造血干细胞移植或伴有肝硬化的患者,抗病毒治疗应至少持续12个月;对于接受利妥昔单抗维持治疗的患者,则应维持抗病毒治疗。
1.化疗期间严密监测,停药后密切随访,尤其注重停药初期,以及时发现并处理病毒学突破。参照《慢性乙型肝炎防治指南(2010年版)》,病毒学突破定义为在未更改治疗方案的情况下,HBV DNA水平比治疗过程中最低点上升1 log10值,或一度转阴后又转为阳性,可伴或不伴ALT升高[12]。
2.化疗期间,所有患者应至少每个化疗周期检测1次乙型肝炎血清标志物、HBV DNA和肝功能;化疗结束后,所有患者应至少每3个月检测1次乙型肝炎血清标志物、HBV DNA和肝功能。
3.对于接受抗病毒治疗的患者,应定期请肝病科或传染科医师会诊。抗病毒治疗结束后继续监测至少12个月;对于未接受抗病毒治疗的HBsAg阴性/抗-HBc阳性患者,化疗结束后继续监测至少12个月。
4.若出现病毒学突破应立即请肝病科或传染科医师会诊,综合评估患者病情,及时调整抗病毒方案。化疗期间若出现肝衰竭倾向(如血清胆红素快速上升、血清白蛋白或凝血酶原活动度动态下降),应考虑调整淋巴瘤治疗方案。
关于淋巴瘤合并HBV感染患者的管理流程参见图1。
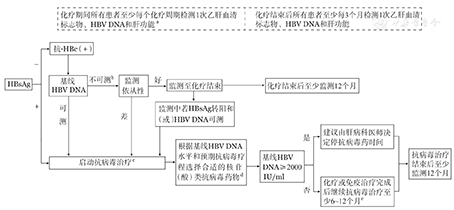

注:a:若出现病毒学突破应立即与肝病科医师会诊,综合评估患者病情,及时调整抗病毒治疗方案;b:HBV DNA水平不可测是指血清HBV DNA低于PCR检测下限。不可测下限则取决于不同检测试剂盒的敏感性;c:启动治疗前已经出现明显活动性肝炎症状的淋巴瘤患者,应积极采取抗病毒治疗以控制病情,活动性乙型肝炎的定义需同时满足以下3个条件:①HBV DNA≥2000 IU/ml;②ALT≥2倍正常上限值; ③排除由于淋巴瘤本身、药物等其他原因所致的肝炎,在活动性肝炎得到有效控制情况下,即HBV DNA<2000 IU/ml且ALT<2倍正常上限值,才可启动可引起HBV再激活的高风险治疗方案;d:基线HBV DNA≥2000 IU/ml和(或)预期疗程>12个月的患者,有条件者应尽可能选用高效、低耐药的抗病毒药物,如恩替卡韦或替诺福韦酯,也可选用拉米夫定或替比夫定;基线HBV DNA<2000 IU/ml且预期疗程≤12个月的患者可选用拉米夫定、替比夫定、恩替卡韦、替诺福韦酯等核苷(酸)类抗病毒药物;e:对于高危人群,如接受免疫化疗、骨髓移植或伴有肝硬化的患者,抗病毒治疗应至少持续12个月;对于接受利妥昔单抗维持治疗的患者,则应维持抗病毒治疗
参加共识讨论及制定的专家(以姓氏笔画排序):中国医学科学院肿瘤医院(石远凯);北京大学肿瘤医院(朱军);福建医科大学附属第一医院(江家骥);四川大学华西医院(刘霆);北京大学肿瘤医院(宋玉琴);上海交通大学附属瑞金医院(李军民);上海交通大学附属瑞金医院(沈志祥);中国医学科学院血液病医院(血液学研究所)(邱录贵);南京医科大学第一附属医院(江苏省人民医院)(李建勇);浙江大学附属第一医院(金洁);华中科技大学附属同济医院(周剑峰);复旦大学附属肿瘤医院(洪小南);中山大学附属肿瘤医院(姜文奇);南方医科大学南方医院(侯金林);南京医科大学第一附属医院(江苏省人民医院)(徐卫);复旦大学附属肿瘤医院(郭晔);首都医科大学附属北京友谊医院(贾继东);复旦大学附属肿瘤医院(曹军宁);中山大学附属肿瘤医院(黄慧强);上海交通大学附属瑞金医院(谢青);北京大学人民医院(魏来)
主审专家:沈志祥、姜文奇、魏来
声明:本共识由中华医学会血液学分会、中国抗癌协会淋巴瘤专业委员会和中华医学会肝病学分会共同制订,于2013年11月同时发表在本刊和《中华肝脏病杂志》






























