
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
三碘苯环衍生物:碘原子量大,吸收X线性能较强;碘与苯环键合,结构非常稳定;苯环结构具备多个有效侧链结合点,提供了不断改进整个分子结构,提高亲水性能和降低毒副作用的可能性。三碘苯环衍生物结构式见图1。


离子型和非离子型;单体和双体;高渗、次高渗和等渗。
备注:本次修订用"次高渗"对比剂概念替代"低渗"对比剂概念。次高渗对比剂(原低渗对比剂)是相对高渗对比剂而言,而等渗对比剂是相对于血浆渗透压而言;事实上,次高渗对比剂的渗透压仍高于血浆渗透压的数倍(表1)[1,2]。
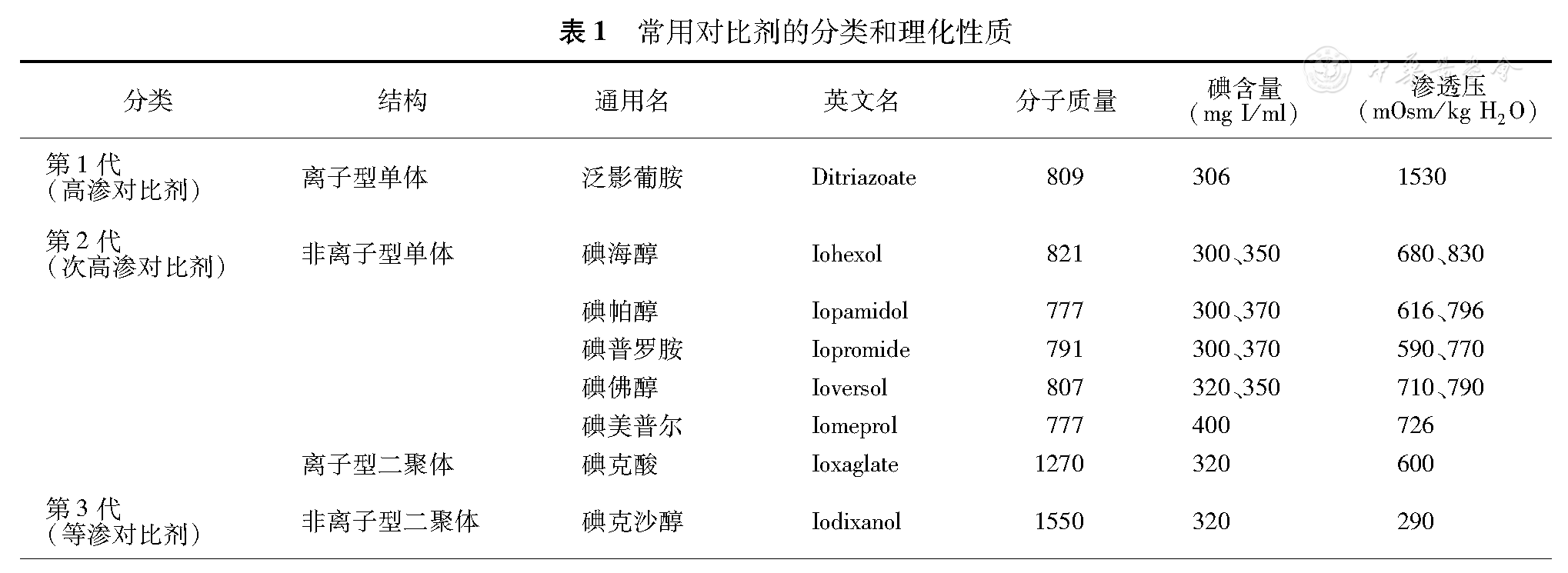
常用对比剂的分类和理化性质
常用对比剂的分类和理化性质
| 分类 | 结构 | 通用名 | 英文名 | 分子质量 | 碘含量(mg I/ml) | 渗透压(mOsm/kg H2O) |
|---|---|---|---|---|---|---|
| 第1代(高渗对比剂) | 离子型单体 | 泛影葡胺 | Ditriazoate | 809 | 306 | 1530 |
| 第2代(次高渗对比剂) | 非离子型单体 | 碘海醇 | Iohexol | 821 | 300、350 | 680、830 |
| 碘帕醇 | Iopamidol | 777 | 300、370 | 616、796 | ||
| 碘普罗胺 | Iopromide | 791 | 300、370 | 590、770 | ||
| 碘佛醇 | Ioversol | 807 | 320、350 | 710、790 | ||
| 碘美普尔 | Iomeprol | 777 | 400 | 726 | ||
| 离子型二聚体 | 碘克酸 | Ioxaglate | 1270 | 320 | 600 | |
| 第3代(等渗对比剂) | 非离子型二聚体 | 碘克沙醇 | Iodixanol | 1550 | 320 | 290 |
建议:签署"碘对比剂使用患者知情同意书"(附后)。
(1)既往有无使用碘对比剂出现中、重度不良反应史;(2)有无哮喘;(3)有无糖尿病;(4)有无肾脏疾病;(5)有无肾脏手术;(6)有无使用肾毒性药物或其他影响肾小球滤过率(GFR)的药物;(7)有无高血压;(8)有无痛风病史;(9)有无其他药物不良反应或过敏史;(10)有无脱水、充血性心衰现象。
(1)甲状腺功能亢进:甲状腺功能亢进尚未治愈者禁忌使用碘对比剂[4];(2)糖尿病肾病:使用碘对比剂需要咨询内分泌专科医师和肾脏病专科医师。
碘对比剂存放条件必须符合产品说明书要求;使用前建议加温至37 ℃[1]。
建议在使用碘对比剂前6~12 h至使用后24 h内,对患者给予水化。
增加肾血流量;降低肾素血管紧张素系统的活性;降低对比剂相关的血液黏滞度和渗透性;等渗性生理盐水可扩充血管内容积;用碳酸氢钠可使肾小管内液体碱性化,可降低肾小管损害。
(1)动脉内用药者:推荐:对比剂注射前6~12 h静脉内补充0.9%生理盐水,或5%葡萄糖加154 mmol/L碳酸氢钠溶液,不少于100 ml/h;注射对比剂后亦应连续静脉补液,不少于100 ml/h,持续24 h;提倡联合应用静脉补液与口服补液以提高预防对比剂肾病效果。(2)静脉内用药者:口服补液方式:注射对比剂前4~6 h开始,持续到使用对比剂后24 h口服水或生理盐水,使用量100 ml/h;条件允许者,建议采用前述条款中动脉内用药者水化方法。
遵循产品说明书中规定的剂量和适应证范围。
静脉内注射和动脉内注射。
口服;经自然或人工或病理通道输入。
注意:对比剂经血管外各种通道输入,有可能被吸收进入血液循环,产生与血管内用药相同的不良反应。
1.给患者补充足够的液体,按前述条款给患者水化。天气炎热或气温较高的环境下,根据患者液体额外丢失量的多少,适当增加液体摄入量。关于补液量,在特殊情况下(如心功能不全等),建议咨询相关临床医师。
2.有使用肾毒性相关药物者,需停用肾毒性药物至少24 h再使用碘对比剂。
3.严重肾功能不全者,尽量选用不需要含碘对比剂的影像检查方法或可以提供足够诊断信息的非影像检查方法。
4.尽量避免使用高渗对比剂及离子型对比剂。
5.如果确实需要使用碘对比剂,建议使用能达到诊断目的最小剂量。
6.避免短时间内重复使用诊断剂量碘对比剂。如果确有必要重复使用,建议2次使用碘对比剂间隔时间≥14 d[5]。
7.避免使用甘露醇和利尿剂,尤其是髓袢利尿剂。
对比剂肾病(CIN)是指排除其他原因的情况下,血管内途径应用碘对比剂后2~3 d内血清肌酐升高至少44 μmol/L(0.5 mg/dl)或超过基础值25%。
碘对比剂肾毒性包括化学毒性(离子性、含碘物质)、渗透毒性、组分中与黏滞度相关毒性。关于对肾毒性的相关机制,目前尚无足够证据达成共识。
肾功能不全者,在使用碘对比剂前,建议采用肾脏病饮食调整研究(MDRD)公式计算估算的肾小球滤过率(eGFR)。
MDRD公式(适合中国人的改良形式)[33]:
eGFR[ml·min–1·(1.73 m2)–1]=175×Scr(mg/dl)–1.234×年龄–0.179×(0.79女性)
紧急时,可在没有评估肾功能情况下进行使用碘对比剂。
目前多数观点认为,两者在对比剂肾病的发生发展过程中均起作用。
重复使用碘对比剂造影,每次给予诊断剂量,是CIN发生的危险因素;72 h内重复应用诊断剂量对比剂是发生CIN的独立预测因子。
建议:两次对比剂应用间隔时间最好为14 d[5]。
使用高压注射器;注射流率过高。
不能进行有效沟通配合;被穿刺血管情况不佳,如下肢和远端小静脉,或化疗、老年、糖尿病患者血管硬化等;淋巴和(或)静脉引流受损。
1.静脉穿刺选择合适的血管,细致操作。
2.使用高压注射器时,选用与注射流率匹配的穿刺针头和导管。
3.对穿刺针头进行恰当固定。
4.与患者沟通,取得配合。
多数损伤轻微,无需处理。嘱咐患者注意观察,如外渗加重,应及时就诊;对个别疼痛明显者,局部给予普通冷湿敷。
这可能造成外渗局部组织肿胀、皮肤溃疡、软组织坏死和间隔综合征。
建议对于中、重度外渗患者的处理措施:(1)抬高患肢,促进血液回流;(2)早期使用50%硫酸镁保湿冷敷,24 h后改硫酸镁保湿热敷;或者用黏多糖软膏等外敷;或者用0.05%的地塞米松局部湿敷;(3)碘对比剂外渗严重者,在外用药物基础上口服地塞米松5 mg/次,3次/d,连用3 d;(4)必要时,咨询临床医师用药。
1.既往有使用碘对比剂全身不良反应病史,症状包括荨麻疹、支气管痉挛、明显的血压降低、抽搐、肺水肿等。
2.哮喘。
3.与治疗现疾病有关药物引起的过敏反应。
装有复苏药物(必须定期更换)和器械的抢救车;必须备有医用氧气管道或氧气瓶或氧气袋;血压计、吸痰设备、简易呼吸器等。
1∶1 000肾上腺素;组胺H1受体阻滞剂(抗组胺药,如异丙嗪、苯海拉明);地塞米松;阿托品;生理盐水或林格氏液;抗惊厥药(如地西泮等)。
建议建立与急诊室或其他临床相关科室针对碘对比剂不良反应抢救的应急快速增援机制,确保不良反应发生后,需要的情况下,临床医师能够及时赶到抢救现场进行抢救。
定义:对比剂注射后1 h内出现的不良反应。
一过性的:支持疗法;重度的、持续时间长的:应考虑适当的止吐药物。
散发的、一过性的:包括观察在内的支持性治疗;散发的、持续时间长的:应考虑适当的组胺H1受体阻滞剂肌肉内或静脉内注射。可能会发生嗜睡和(或)低血压;严重的:考虑使用肾上腺素(1∶1 000),成人0.1~0.3 ml(0.1~0.3 mg)肌肉注射;6~12岁儿童注射成人剂量的1/2(50%),6岁以下儿童注射成人剂量的1/4(25%)。必要时重复给药。
氧气面罩吸氧(6~10 L/min);β2受体激动剂定量吸入剂(深吸2~3次);肾上腺素:①血压正常时:肌肉注射:1∶1 000,0.1~0.3 ml(0.1~0.3 mg)(对有冠状动脉疾病的患者或老年患者使用较小的剂量);儿童患者:0.01 mg/kg,最多不超过0.3 mg。②血压降低时:肌肉注射:1∶1 000, 0.5 ml(0.5 mg);儿童患者:6~12岁:0.3 ml(0.3 mg)肌肉注射;6岁以下:0.15 ml(0.15 mg)肌肉注射。
氧气面罩吸氧(6~10 L/min);肌肉注射肾上腺素(1∶1 000),成人0.5 ml(0.5 mg),必要时重复给药;儿童患者:6~12岁:0.3 ml(0.3 mg)肌肉注射;6岁以下:0.15 ml(0.15 mg)肌肉注射。
①单纯性低血压:抬高患者的双腿;氧气面罩吸氧(6~10 L/min);静脉补液:快速,普通生理盐水或林格氏乳酸盐;如果无效:肌肉注射1∶1 000肾上腺素,0.5 ml(0.5 mg),必要时重复给药。儿童患者:6~12岁:0.3 ml(0.3 mg)肌肉注射;6岁以下:0.15 ml(0.15 mg)肌肉注射。②迷走神经反应(低血压和心动过缓):抬高患者的双腿;氧气面罩吸氧(6~10 L/min);静脉注射阿托品0.6~1.0 mg,必要时于3~5 min后重复给药,成人总剂量可达3 mg(0.04 mg/kg)。儿童患者静脉注射0.02 mg/kg(每次最大剂量0.6 mg),必要时重复给药,总量可达2 mg;静脉内补液:快速,普通生理盐水或林格氏乳酸盐。
求助复苏小组;必要时,气道吸引;出现低血压时抬高患者的双腿;氧气面罩吸氧(6~10 L/min);肌肉注射肾上腺素(1∶1 000),成人0.5 ml(0.5 mg),必要时重复给药。儿童患者:6~12岁:0.3 ml(0.3 mg)肌肉注射;6岁以下:0.15 ml(0.15 mg)肌肉注射;静脉补液(如:普通生理盐水,林格氏乳酸盐);H1受体阻滞剂,如:苯海拉明25~50 mg静脉给药。
定义:对比剂注射后1 h至1周内出现的不良反应。对比剂给药后可出现各种迟发性症状(例如恶心、呕吐、头痛、骨骼肌肉疼痛、发热),但许多症状与对比剂应用无关,临床须注意鉴别。与其他药疹类似的皮肤反应是真正的迟发性不良反应,它们通常为轻度至中度,并且为自限性。迟发性不良反应处理措施:对症治疗,与其他药物引起的皮肤反应的治疗相似。
定义:通常在对比剂注射1周后出现的不良反应。晚迟发性不良反应类型:或可引起甲状腺功能亢进,偶见于未经治疗的Graves病或结节性甲状腺肿患者[年老和(或)缺碘者]。
窦道或瘘管造影;其他体腔造影,如关节腔造影、子宫输卵管造影、间接淋巴管造影、胆道T管造影(T–tube)、逆行胰胆管造影(ERCP)、经皮肝脏穿刺胆道造影(PTC)、消化道口服造影等。
既往对碘对比剂有严重过敏反应者;甲状腺功能亢进患者。
碘对比剂血管外应用可能被吸收,产生与血管内给药相同的不良反应。处理措施:轻微症状可以在数天内自动消失,可不予以处理;反应严重者,处理措施同血管内用药。
附
推荐《碘对比剂使用患者知情同意书》内容
1.既往无使用碘剂发生不良反应的病史。
2.无甲状腺功能亢进、严重肾功能不全、哮喘病史。
3.使用碘对比剂,可能出现不同程度的不良反应:(1)轻度不良反应:咳嗽、喷嚏、一过性胸闷、结膜炎、鼻炎、恶心、全身发热、荨麻疹、瘙痒、血管神经性水肿等。(2)中度不良反应:严重呕吐、明显的荨麻疹、面部水肿、咳嗽、呼吸困难、血管迷走神经反应等。(3)重度不良反应:喉头水肿、惊厥、震颤、抽搐、意识丧失、休克等,甚至死亡或其他不可预测的不良反应。(4)迟发性不良反应:注射碘对比剂1 h至1周内也可能出现各种迟发性不良反应,如恶心、呕吐、头痛、骨骼肌肉疼痛、发热等。
4.注射部位可能出现碘对比剂漏出,造成皮下组织肿胀、疼痛、麻木感,甚至溃烂、坏死等。
5.使用高压注射器时,存在注射针头脱落、局部血管破裂的潜在危险。
6.如果出现上述任何不良反应的症状,请及时与相关医师联系,联系电话。
7.我已详细阅读以上告知内容,对医护人员的解释清楚和理解,经慎重考虑,同意做此项检查。
8.签署人:患者或其监护人;如果是监护人:监护人与患者关系。谈话医护人员。
9.签署时间。
备注:不符合上述内容包括条件,又需要使用碘对比剂者,建议签署"患者使用碘对比剂知情同意书"时,在上述内容基础上增加针对该患者具体情况的相关条款。
工作组成员:广东省人民医院广东省医学科学院放射科(梁长虹);复旦大学华山医院放射科(冯晓源);中国医科大学附属盛京医院放射科(郭启勇、刘兆玉);中国医科大学附属第一医院放射科(徐克、任克、戴旭);北京医院放射科(周诚);中华放射学杂志编辑部(高宏);四川大学华西医院放射科(陈卫霞);南方医科大学南方医院放射科(许乙凯);海南省人民医院放射科(陈峰);广州市番禺中心医院放射科(陈汉威);东南大学中大医院放射科(邓刚);河北医科大学第二医院放射科(李彩英);大连医科大学第一医院放射科(刘爱连);解放军总医院肿瘤介入科(刘凤永);湖北省肿瘤医院放射科(刘玉林);中山大学第三医院放射科(孟晓春);北京大学肿瘤医院暨北京市肿瘤防治研究所放射科(孙应实);新疆医科大学第二医院放射科(王红);上海同济大学同济医院放射科(王培军);贵州省人民医院放射科(王荣品);山东省医学影像学研究所放射科(徐卓东);北京协和医院放射科(薛华丹);福建医科大学附属协和医院放射科(薛蕴菁);西安交通大学第一医院放射科(杨健);中南大学第三医院放射科(叶斌);浙江大学第二医院放射科(余日胜);山西医科大学第二医院介入治疗科(于世平);北京朝阳医院放射科(翟仁友);山西医科大学附属第一医院放射科(张瑞平);内蒙古自治区医院放射科(张晓琴);第三军医大学大坪医院放射科(张伟国);郑州大学第一医院放射科(张勇);昆明医学院第一医院放射科(赵卫);中南大学湘雅二院放射科(周顺科);解放军第一○五医院放射科(朱友志)






























