
观察溃疡性结肠炎(UC)患者的肠道屏障功能,并探讨其临床意义。
收集2010年3月至2013年6月天津医科大学总医院诊断的200例UC患者肠黏膜标本,以40份正常肠黏膜组织为对照。200例UC患者依据Mayo评分分为轻度(68例)、中度(70例)和重度(62例)。以咬合蛋白(occludin)、分泌型免疫球蛋白A(sIgA)和β防御素(β-defensin)分别代表肠道机械屏障、免疫屏障和化学屏障,采用免疫组化法检测肠黏膜组织中3种蛋白表达,并与相关临床指标进行统计学分析。
与对照相比,UC患者肠黏膜中occludin、sIgA表达显著减少(28.53%±2.21%比44.28%±1.94%,19.26%±1.09%比28.36%±2.36%,均P<0.05),β-defensin表达显著增加(29.13%±1.75%比19.71%±1.83%,P<0.05)。轻、中、重度UC患者间肠黏膜occludin、β-defensin表达差异均有统计学意义(均P<0.05);随着UC分级增加occludin表达明显减少(r=-0.753,P<0.05),β-defensin表达明显增多(r=0.698,P<0.05)。而轻、中、重度UC患者间sIgA表达差异无统计学意义(P>0.05)。UC患者中3种蛋白在不同性别、年龄、病变部位的表达差异无统计学意义(均P>0.05)。
UC患者出现肠道屏障功能损伤,随着临床分级增加,肠道机械屏障、化学屏障损伤更加明显。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
溃疡性结肠炎(UC)是一种非特异性的结直肠炎性病变,发病率呈逐年上升趋势。目前肠屏障功能在UC发生发展中的作用越来越引起人们的重视[1]。研究表明咬合蛋白(occludin)、β-防御素(β-defensin)和分泌型免疫球蛋白A(sIgA)分别是肠道机械屏障、化学屏障和免疫屏障的重要组成部分。本研究通过免疫组化法检测UC组和对照组肠黏膜occludin、β-defensin和sIgA表达,研究UC患者肠道机械屏障、化学屏障、免疫屏障变化及与病情严重程度相关性,探讨肠道屏障功能变化在UC发生发展中的作用和临床意义。
收集2010年3月至2013年6月因具有UC症状而在天津医科大学总医院内镜室行电子结肠镜检查且肠镜表现及黏膜组织学检查诊断UC的200例患者肠黏膜标本。诊断标准参照《炎症性肠病诊断与治疗的共识意见(2012,广州)》[2],其中男107例,女93例,年龄20~82岁,平均年龄45岁。根据Mayo[2,3]分级方法分为轻度68例、中度70例和重度62例。收集2011年5月至2014年8月天津医科大学总医院普通外科40例行结肠切除术的非UC患者肠标本中正常肠黏膜组织为对照组。其中男18例,女22例,年龄38~77岁,平均年龄57岁。两组间性别、年龄构成差异无统计学意义(均P>0.05)。本研究已通过天津医科大学总医院伦理委员会批准,所有患者均签署知情同意书。
兔抗人occludin多克隆抗体、兔抗人β-defensin多克隆抗体均购自英国Abcam公司;小鼠抗人sIgA单克隆抗体购自美国Novus公司;含5%牛血清白蛋白(BSA)封闭液和链霉亲和素-生物素复合物(SABC)羊抗兔/羊抗小鼠二抗试剂盒、3,3 -二氨基联苯胺(DAB)试剂盒购自中国武汉博士德生物工程有限公司。
实验步骤严格按试剂盒说明书进行。3名病理科医师采用独立双盲法在低倍镜(40倍)下选取阳性细胞最密集区,然后在100倍视野下计数1 000个细胞,计算阳性细胞的百分率,最终以平均百分数字作为每张切片的结果[4]。
采用SPSS 17.0统计软件包进行数据分析处理,定量资料采用 ±s表示,组间比较采用方差分析或t检验,等级资料采用Spearman等级相关性分析。P<0.05为差异有统计学意义。
±s表示,组间比较采用方差分析或t检验,等级资料采用Spearman等级相关性分析。P<0.05为差异有统计学意义。
occludin主要分布于肠道黏膜上皮细胞膜顶端,细胞表面和细胞间可见棕黄色染色颗粒;β-defensin表达阳性细胞主要定位于结肠黏膜上皮细胞和肠腺之间的间质细胞的细胞质,少量表达在细胞核;sIgA主要表达在细胞质中,阳性细胞定位于上皮细胞及固有层内的浆细胞(图1)。与对照相比,UC患者肠黏膜occludin和sIgA蛋白表达减少(28.53%±2.21%比44.28%±1.94%,19.26%±1.09%比28.36%±2.36%,均P<0.05),β-defensin表达增加(29.13%±1.75%比19.71%±1.83%,P<0.05)。
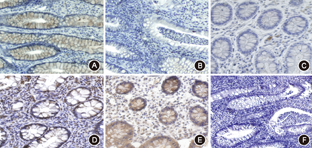

轻、中、重度UC患者间肠黏膜occludin、β-defensin的表达差异有统计学意义(occludin:41.69%±3.14%比27.03%±2.29%比17.04%±1.73%;β-defensin:20.94%±2.04%比29.52%±2.12%比37.11%±2.82%,均P<0.05),而sIgA的表达差异无统计学意义(20.54%±3.68%比18.90%±4.68%比18.35%±2.31%,P>0.05);Spearman秩相关分析显示UC患者肠黏膜occludin表达水平与Mayo分级呈负相关(r=-0.753,P<0.05),β-defensin表达水平与Mayo分级呈正相关(r=0.698,P<0.05)。不同性别、年龄、病变部位间肠黏膜occludin、β-defensin、sIgA表达差异均无统计学意义(均P>0.05)(表1)。
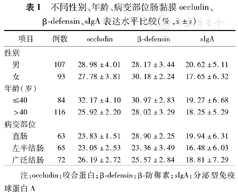
不同性别、年龄、病变部位肠黏膜occludin、β-defensin、sIgA表达水平比较(%, ±s)
±s)
不同性别、年龄、病变部位肠黏膜occludin、β-defensin、sIgA表达水平比较(%, ±s)
±s)
| 项目 | 例数 | occludin | β-defensin | sIgA | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 107 | 28.98±4.01 | 28.17±3.44 | 20.62±5.11 | |
| 女 | 93 | 27.78±3.81 | 30.18±2.24 | 17.65±6.32 | |
| 年龄(岁) | |||||
| ≤40 | 84 | 32.17±4.10 | 30.97±2.83 | 19.27±6.68 | |
| >40 | 116 | 25.92±2.20 | 28.02±3.29 | 18.25±5.29 | |
| 病变部位 | |||||
| 直肠 | 63 | 23.83±1.51 | 28.90±2.25 | 19.94±6.31 | |
| 左半结肠 | 65 | 23.05±2.53 | 23.36±3.49 | 16.48±6.03 | |
| 广泛结肠 | 72 | 26.19±2.72 | 25.57±2.84 | 18.81±7.29 | |
注:occludin:咬合蛋白;β-defensin:β-防御素;sIgA:分泌型免疫球蛋白A
occludin是一种控制大分子物质通过肠道上皮紧密连接的跨膜蛋白,通过调节细胞离子选择性和通透性从而维持上皮细胞两侧物质的差异并保持细胞极性,是肠道机械屏障的重要组成部分[5]。本结果显示UC患者肠黏膜occludin表达水平明显降低,并且随着UC分级增加表达量进一步减少。其机制可能是occludin受到肠道内多种炎症因子作用,结构和分布发生改变,导致紧密连接受损,肠屏障出现损伤。
β-defensin是一种主要由上皮细胞及上皮间质细胞合成和分泌的具有广谱高效抗菌作用的抗菌肽,并且能启动获得性免疫系统从而提高机体抵抗病原微生物的获得性免疫能力[6]。在正常机体的肠组织β-defensin的表达较少,而在炎症时大量表达并附着于肠道黏液层中,是肠道化学屏障的重要组成部分[7]。有研究表明UC患者肠道浆细胞可分泌大量β-defensin,并通过强大的募集中性粒细胞至炎症部位的作用,最终导致局部炎症加重[8]。本研究中UC组β-防御素表达量明显高于对照组,且随着疾病加重而增加,提示β-防御素可能在疾病早期参与了肠道炎症反应,并在UC进展过程中发挥重要作用。
sIgA由黏膜和外分泌腺局部的浆细胞合成,主要通过诱导细菌凝集、中和病原体,阻断病原体对黏膜的黏附,并通过调节微生物群的组成维持肠腔内稳态,在肠道黏膜免疫中发挥主要作用[9]。本研究发现UC组sIgA表达水平较对照组明显降低,这一结果表明UC患者肠道免疫屏障出现损伤。我们认为UC患者可能存在肠上皮分泌sIgA功能缺陷,导致肠道免疫屏障受损进而出现病原体黏附增加,最终引起肠道稳态平衡失调。本结果显示sIgA在不同病期UC患者肠黏膜表达差异无统计学意义,我们认为sIgA可能主要作为局部免疫因素参与了疾病的启动阶段,随着病变加重其表达量变化并不明显,对UC病程进展作用相对有限,但不能除外因样本含量的局限导致未能发现sIgA在不同组间的差异。
有学者[9]认为肠屏障是一个完整的系统,通过协调的相互作用共同维持肠道稳态。因而我们推测,基因或环境因素导致的某一屏障一定程度的损伤必然会影响其他屏障的功能。本研究结果显示UC患者肠道机械屏障、化学屏障、免疫屏障出现明显的损伤,通过相互作用促进了UC的发病和进展。sIgA可能参与了UC的发生,但对病程进展作用相对较小,具体机制有待进一步研究。通过联合检测肠屏障相关蛋白有利于临床更好地评估肠黏膜屏障功能判断UC严重性,也可为临床针对性地治疗不同病程UC提供理论依据。



























