
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
过去20年,随着对心肌病认识的不断进步和深入,心肌病的定义得到了多次修订,早期理解为与心肌功能障碍有关的心肌疾患,逐渐发展到必须排除冠心病、高血压、瓣膜病等其他病因,进而将心电障碍也涵盖在定义中[1]。超声心动图、心脏CT及心血管造影等检查方法在心肌病的形态与功能、诊断与鉴别诊断方面有一定价值。然而上述影像学检查具有一定的局限性,如电离辐射、有创以及缺乏风险预测等。心脏磁共振(cardiovascular magnetic resonance, CMR)通过多参数、多平面、多序列成像可同时对心脏的解剖结构、运动功能、血流灌注和组织特性进行"一站式"评估,在心肌病病因诊断、危险分层及预后判断上具有独特价值,已成为心肌病最理想的无创性检查手段[2]。尽管发达国家CMR在心肌病中的应用已非常普遍,各种新的序列技术及临床研究成果日新月异,但国内CMR发展仍受到设备投入、技术规范、专业人才及临床认识等多方面因素的制约,尚未广泛应用。为发挥CMR的优势,便于医疗人员加深对心肌病诊治领域新技术的认识,由中华医学会心血管病学分会、中国医师协会心血管内科医师分会和中华心血管病杂志编辑委员会等共同组织并邀请国内心血管及心血管影像专业临床专家,经前期咨询、反复讨论、共同起草、多次修改并最终完成国内首个心肌病CMR临床应用的专家共识。
本专家组编写此共识主要目的:(1)总结国内CMR的临床应用经验和研究成果,并结合国际上CMR的重要临床研究和指南,提出适合我国国情的心肌病CMR临床应用建议;(2)制定心肌病CMR检查规范化操作方案,便于有条件开展CMR检查的医疗机构参照借鉴;(3)推动我国CMR的科学研究和临床应用,使更多的患者受益。
1.确定无磁共振检查禁忌证:起搏器或植入式复律除颤器(ICD)仍是CMR检查的绝对禁忌证;体内铁磁性物体植入,但目前大部分冠状动脉支架系非铁磁性或弱铁磁性,在CMR检查中是安全的,其他金属性植入物需咨询或核对该具体金属性物质在磁共振检查中的安全性;慢性肾病4期或5期患者(估算肾小球滤过率<30 ml·min–1·1.73 m–2)禁用含钆对比剂,急性肾功能衰竭和慢性肝病患者由于可能产生肾原性纤维化的危险也不宜使用;幽闭恐惧症。
2.向患者解释检查过程,消除其恐惧心理,保证患者能顺利配合检查。
3.呼吸训练:CMR序列通常需要患者吸气末或呼气末屏气,以保持膈肌位置的相对恒定。
1.设备:1.5 T或3.0 T高场超导磁共振成像仪。
2.心电门控设备:根据厂家与机器型号的不同,按说明书贴好电极。如果常规电极位置无法获得准确的R波触发,又非心律失常所致,则需调整电极位置,直至获得真实准确的心电信号。对于心电门控效果不佳的患者,若非心律失常所致,可考虑使用脉搏门控作为替代方法。
3.磁共振兼容高压注射器。
4.静脉穿刺:建议使用20 G及以上的留置针,不推荐使用24 G的静脉留置针(头皮针)。
5.磁共振兼容的监护仪(药物负荷试验必备):危重患者、麻醉患者或行药物负荷试验检查患者需监测血压、心律、心率、呼吸及血氧饱和度等。
6.急救药品:常规准备:(1)β受体阻滞剂(艾司洛尔,美托洛尔等)、硝酸甘油、氨茶碱;(2)急救包:全套的急救药物,包括肾上腺素、去甲肾上腺素、多巴胺、阿托品、支气管扩张剂、抗心律失常药等。
(1)检查前准备,患者仰卧位,胸前贴心电电极,连接心电门控,调整心电信号至R波清晰可见,心前区覆盖相控阵线圈,扫描中心定位。(2)形态学检查:主要分为黑血和亮血技术两大类。扫描覆盖范围一般为从主动脉弓至心脏膈面,旨在观察心脏解剖结构,初步显示心房、心室和大血管结构。(3)功能学检查:最常用的采集方法是稳态自由进动梯度回波(SSFP)电影序列。扫描层面一般采用左心室两腔心、四腔心、左心室流出道及左心室短轴等层面。旨在观察心脏整体和节段性运动以及房室瓣及主肺动脉瓣活动等,并获得左心室舒张末直径、射血分数、舒张末期容积、收缩末期容积、心搏量、心输出量、心肌质量等参数。(4)首过法心肌灌注:通常采用Turbo FLASH(快速损毁梯度回波)序列,钆对比剂剂量为0.1 mmol/kg,3~7 ml/s流速,经肘前静脉注入对比剂后追加同流速20 ml生理盐水。(5)钆对比剂延迟强化(late gadolinium enhancement, LGE):采用心电门控屏气相位敏感反转恢复Turbo FLASH序列,通常需在首过心肌灌注后追加对比剂0.05~0.10 mmol/kg,于对比剂注射5~15 min后开始扫描,旨在用于识别心肌纤维化。
(1)负荷心肌灌注成像:在需要判断有无心肌缺血时需加做负荷-静息态心肌灌注成像,可采用腺苷心肌负荷灌注(腺苷用量:140 μg·kg–1·min–1,若使用药物2~3 min后心率净增值未达到10次/min以上和(或)血压下降净值未超过10 mmHg(1 mmHg=0.133 kPa),可酌情增加药量最多可达210 μg·kg–1·min–1);也可采用多巴酚丁胺负荷功能成像(多巴酚丁胺标准最大剂量40 μg·kg–1·min–1)。(2)高级心肌组织学定性方案:T2加权成像:可采用反转恢复T2加权自旋回波序列成像,通常采集左心室短轴基底部、中段、远端和四腔心长轴切面。有条件的单位也可使用亮血T2加权序列成像。T2*成像:在怀疑有血色素性心肌病时需做,扫描序列为单次屏气的梯度回波序列。T1或T2-mapping:通常采用Look Locker成像(MOLLI或SHMOLLI或类似序列)。(3)磁共振血流测定:一般采用磁共振相位对比流速编码电影成像法,可对心肌病左心室流出道的流速进行估计,并根据流速计算出峰值压差。
心肌病的分类及定义在不同的时期有所变化,早期单纯以形态学为依据,此后随着分子遗传学的发展,将家族遗传性因素作为主要的分类标准,最新的分类综合了形态功能、器官累及、基因遗传模式和病因以及心功能状态多种因素。目前国内多参照2006年美国心脏病协会对心肌病的分类,结合临床应用体会,这种分型的接受程度广泛,临床应用熟悉,表述简明合理,因此本共识对病变的陈述结构主要按照这一分类进行[1,4]。
HCM是以左心室心肌异常肥厚、舒张功能受损、心肌纤维化以及可能伴随左心室流出道梗阻为主要特征的一种家族多基因遗传性疾病,人群发病率约1/500。
疑诊或确诊的HCM患者,有如下情况时,建议行CMR检查:(1)可疑HCM,超声诊断不明确时;(2)可疑心尖部或侧壁肥厚以及非缺血性心尖室壁瘤的患者;(3)需进一步评估左心室结构(乳头肌病变等)以及心肌纤维化时;(4)与其他类型左心室肥厚表现心肌病(心肌淀粉样变等)的鉴别诊断;(5)室间隔化学消融及切除术术前指导与预后评估。
非对称性室间隔HCM是HCM最常见类型,室间隔肥厚伴LGE与继发性左心房扩大是其常见征象[2]。
CMR可测量左心室任意节段室壁厚度,对于心尖部或前侧壁肥厚、心尖室壁瘤及附壁血栓的诊断CMR优于超声[6,7,8]。目前的诊断标准为成人舒张末期最大室壁厚度≥15 mm或有明确家族史患者室壁厚度≥13 mm,并排除其他能引起室壁肥厚的心血管疾病或者全身性疾患。有研究表明左心室心肌质量是HCM不良预后的独立预测因子[9]。
梗阻性HCM在CMR电影序列上显示最佳,表现为收缩末期左心室流出道变窄、流出道喷射性血流以及二尖瓣前叶收缩期前向运动即SAM征。应用速度编码电影序列可测量左心室流出道狭窄处的最大流速,并推算出相应的压力梯度,当压力差≥20 mmHg有临床意义,可诊断为梗阻性HCM[10]。
室间隔射频消融和切除术是治疗梗阻性HCM的两种常用方法,CMR可评估术后疗效及随访,结合LGE可以进一步评估消融术后组织坏死的范围和程度,以及心肌质量的改变[11,12]。
一项汇总了1 063例HCM患者的荟萃分析结果显示LGE与心原性死亡、心力衰竭及全因死亡均显著相关,但与心脏性猝死(sudden cardiac death,SCD)无明显相关[19]。最新的单中心大样本研究(n=471)则提示LGE总量与SCD显著相关[20]。
HCM需与一些病理或生理性心肌肥厚鉴别。根据这些疾病CMR的表型尤其是LGE表现,结合临床资料,可做出合理的判断(表1)。

CMR用于肥厚型心肌病及其他左心室肥厚性心肌病鉴别诊断
CMR用于肥厚型心肌病及其他左心室肥厚性心肌病鉴别诊断
| 疾病 | CMR表现 |
|---|---|
| 肥厚型心肌病 | 局部增厚(≥15 mm),非对称性多见,多无心室扩张,基底段室间隔受累常合并左心室流出道狭窄,LGE以肥厚心肌内局限性或斑驳状多见 |
| Anderson-Fabry病 | 左心室心肌自然T1值减低、LGE多见于基底部后侧壁肌壁中层[24] |
| 心肌淀粉样变 | 左心室心肌弥漫性延迟强化,以内膜下环形强化多见[25] |
| 高血压、左心室射血受阻疾患 | 左心室心肌普遍向心性增厚,但多数为轻至中度肥厚,一般无左心室流出道狭窄,LGE可无或非特征性 |
| 运动员型心肌肥厚 | 左心室心肌普遍性增厚,程度较轻,通常<15 mm,左心室腔常增大(>55 mm),心肌多无LGE[26] |
注:CMR:心脏磁共振,LGE:钆对比剂延迟强化
DCM是以左心室收缩功能障碍为主要特征,伴心室腔的扩大和心肌质量的增加,自然病史的发展过程中会出现进行性的心力衰竭和SCD[21]。CMR能够为DCM的鉴别诊断、预后判断及治疗选择提供有价值的影像学证据[22]。
在心脏超声提示DCM患者中,在以下情况下可考虑进行CMR检查:新发或新诊断DCM(病程半年内)潜在的病因学诊断;DCM患者进行ICD或心脏再同步化治疗(CRT)前可准确评价左右心脏功能;DCM心肌组织学特征定性协助评价预后风险;DCM标准抗心力衰竭药物治疗后或病情急剧变化时。
左心室腔扩大、室壁变薄以及运动功能减低伴室间隔壁间强化是DCM常见的CMR征象。
左心房室腔扩大,左心室舒张末期横径>55 mm,部分可>80 mm,晚期右心房室腔亦扩大。早期左心室壁可正常,典型者一般普遍变薄(<8 mm)。多数患者左心室侧壁可出现不同程度小梁化;部分患者室间隔心肌壁内出现脂肪沉积;继发性二尖瓣环扩大导致相对性关闭不全。
DCM的心功能异常通常包括:(1)左心室收缩功能显著降低,表现为左心室各节段弥漫性收缩运动降低,LVEF值常低于40%,严重者可达20%以下;(2)左心室各节段的心肌收缩增厚率梯度消失;(3)流速编码相位对比序列能够定量评估舒张功能的减低及瓣膜关闭不全的程度。
LVEF是DCM临床最常用的危险分层指标,可预测心力衰竭的进展。左心房容积指数>72 ml/m2是DCM心脏移植后存活的独立预测因子[31]。
LGE与DCM疾病进展中的主要心脏事件密切相关,是DCM不良预后最强的独立预测因子[27]。而肌壁间强化无论在全因死亡、心血管死亡或心脏移植、SCD及严重心力衰竭入院治疗等多种心脏不良事件中均有独立预测价值[28,31]。此外,LGE对早期DCM的左心室逆转重构有独立预测价值,可以为临床抗心室重构治疗方案的制定提供依据[29]。
CRT症状性DCM合并心室不同步患者(主要表现为完全性左束支阻滞),LGE不仅可以指导CRT电极在冠状静脉窦的准确定位,且其程度与CRT治疗效果明显相关[32]。ICD植入是DCM恶性室性心律失常的预防措施,LGE是DCM心脏不良事件强有力的独立预测因子,可能成为DCM尤其是家族性DCM患者ICD的植入指征[33,34]。
1.与缺血性心脏病的鉴别:(1)DCM以肌壁间强化最常见,约占1/3,多见于室间隔,而缺血性心肌病LGE典型表现为内膜下或透壁性强化,与受累冠状动脉分布一致,LGE鉴别两者的敏感性可达81%~100%[35];(2)DCM的室壁普遍变薄,运动减弱,而缺血性心肌病多表现为梗死心肌的室壁变薄及节段运动异常[36]。
2. DCM左心室壁过度小梁化时需与孤立性左心室致密化不全(left ventricular noncompaction,LVNC)相鉴别。基于国内人群研究,游离壁中≥2个节段舒张期内层致密化不全心肌厚度/外层致密化心肌厚度(NC/C)比值>2.5,尤以心尖段明显,支持LVNC诊断[37]。
ARVC是以纤维脂肪进行性替代右心室心肌为特征的一种遗传性心肌病[38]。其临床诊断由一套复杂的诊断标准构成,内容包括形态结构、除极化、复极化、心律失常、组织学和家族史等[39]。CMR是无创性评估右心室形态和功能的金标准,在2010年重新修订的ARVC诊断标准中,CMR首次被纳入,并给予具体量化指标。
基于目前国内外大量研究支持CMR在ARVC诊断中的敏感性显著优于常规心脏超声,同时CMR作为ARVC诊断中的主要标准之一,建议对所有疑诊ARVC患者进行CMR检查。
黑血序列可见右心室流出道扩张,右心室壁变薄,右心室腔扩张,晚期双心室受累或以左心室受累为主的患者可见左心室壁变薄,左心室腔扩张。
电影序列可见右心室壁运动异常和心功能下降。室壁整体异常改变包括右心室舒张和收缩功能下降,局部异常改变包括室壁无运动、运动异常或收缩不协调。疾病早期三尖瓣下区域局部收缩不协调可见典型的"手风琴征"[40]。CMR诊断标准依据室壁运动异常结合容积和功能参数分为主要标准和次要标准。右心室舒张末期容积指数≥110 ml/m2(男)、≥100 ml/m2(女)或右心室射血分数≤40%构成主要诊断标准,其诊断ARVC特异度为95%,敏感度为68%~76%;100≤右心室舒张末容积指数<110 ml/m2(男)、90≤右心室舒张末容积指数<100 ml/m2(女)或40%<右心室射血分数≤45%构成次要标准,其诊断ARVC特异度为85%~97%,敏感度为79%~89%[39]。
CMR采用T1加权自旋回波黑血序列及抑脂技术相结合可对心肌脂肪浸润进行准确识别,水脂分离技术进一步提高对于心肌脂肪浸润检测的敏感性,但是由于部分正常人中也可发现右心室脂肪浸润,因此孤立的脂肪浸润目前不能作为诊断ARVC的影像诊断标准。LGE可以识别右心室纤维化,然而由于右心室壁薄,常规LGE对右心室壁纤维化的判断准确性不佳,故目前LGE尚未纳入现有的ARVC诊断标准。LGE还可评估ARVC患者左心室壁纤维化,其多位于左心室下壁和侧壁,亦可存在于室间隔[41]。
ARVC有时需要与导致右心室扩张和右心室功能下降的先天性心脏病如房间隔缺损和三尖瓣下移畸形相鉴别,结合病史、体格检查、其他辅助检查及典型CMR特征有助于鉴别诊断。
LVNC是以突出的左心室肌小梁、深陷的小梁间隐窝和变薄的致密化心肌为特征的心肌病[45],可与先天性心脏病或其他类型心肌病并存,亦可单独发病。CMR凭借其高度的软组织分辨力及大视野、无死角等优势,对显示小梁化心肌有独特价值。
CMR适用于所有怀疑LVNC的患者明确诊断,特别是在心脏超声成像质量不佳或难以确诊时。
黑血序列可清楚显示LVNC的三大特征:突出的肌小梁、深陷的小梁间隐窝和变薄的致密化心肌,并可以准确判断小梁化心肌受累节段。小梁化心肌以心尖段、左心室中段侧壁最易受累,而基底段和室间隔较少受累[46]。
亮血电影序列可观察左心室腔容积扩大和功能下降,可清晰显示小梁间和左心室腔内的附壁血栓,同时可准确评估右心室有无受累。
LVNC的LGE无典型特征,左心室致密化和非致密化心肌均可出现非特征性延迟强化[47]。
RCM是以双侧心室或某一心室充盈、舒张受限,而室壁厚度和收缩功能正常或轻度受损为主要特征的一类非缺血性心肌病,与缩窄性心包炎(constrictive pericarditis, CP)有相似的病理生理和临床表现,但治疗方案及预后迥异。
CMR适用于RCM的病因学诊断,适用于RCM和CP的鉴别诊断。
在黑血序列或T1WI、T2WI序列中可见心室轮廓大致正常,心室腔大小正常或缩小,室壁厚度正常或轻度增厚;一般心房明显扩大,房室大小不成比例,心包无增厚。
心脏收缩功能正常或接近正常,而充盈受限,顺应性降低,房室瓣继发性关闭不全为常见征象,利用相位对比流速编码电影数据所测得的E/A比值>2时,提示舒张功能显著受损[54]。
患者可见不同形态的强化(弥漫性强化、粉尘状强化、"花瓣样"强化等)[55],以心内膜下或心肌壁内常见。
RCM需与CP鉴别(表2)。心包是否增厚是鉴别两者的关键,心包在T1WI、T2WI以及电影序列均表现为低信号。此外,CP患者有更高的"相对心房容积比",即左、右心房容积之比,以1.32为诊断界值,敏感度为82.6%,特异度为86.4%[56]。
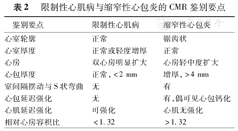
限制性心肌病与缩窄性心包炎的CMR鉴别要点
限制性心肌病与缩窄性心包炎的CMR鉴别要点
| 鉴别要点 | 限制性心肌病 | 缩窄性心包炎 |
|---|---|---|
| 心室轮廓 | 正常 | 锯齿状 |
| 心室厚度 | 正常或轻度增厚 | 正常 |
| 心房 | 双心房明显扩大 | 心房轻中度扩大 |
| 心包厚度 | 正常,<2 mm | 增厚,>4 mm |
| 室间隔摆动与S状弯曲 | 无 | 有 |
| 心包延迟强化 | 无 | 有,偶可见心包钙化 |
| 心肌延迟强化 | 可强化 | 心肌无强化 |
| 相对心房容积比 | <1.32 | >1.32 |
淀粉样变性是以细胞外不可溶纤维蛋白在体内各器官异常沉积为特征的组织结构紊乱,累及心脏者称心肌淀粉样变。心内膜活检是诊断该病的金标准,特异性高,敏感性较低。
CMR适用于所有疑诊心肌淀粉样变的诊断。
左心室和(或)右心室壁弥漫性增厚,以室间隔更为著;可伴有心房壁及房间隔的增厚(房间隔厚度>6 mm)[57]。多数患者伴胸腔及心包腔积液。
心室收缩及舒张功能明显减低,以舒张功能受限更为显著。
通过特征性的延迟强化可与冠心病、HCM相鉴别。冠心病延迟强化虽以心内膜下强化为主,但通常与冠状动脉分布一致,且对应的节段室壁多变薄。HCM强化形式多以局灶状为主,多见于肥厚心肌内,以右心室与室间隔移行处强化多见
该病一般预后不良,LGE范围可作为1年内死亡的预测因子[61]。
结节病是少见的全身性肉芽肿性疾病,心脏结节病以肉芽肿性炎症为特征,超过半数结节病患者的死亡与心脏受累相关[62],对心脏结节病的早期发现和治疗极其重要,CMR可早于常规检查方法发现心肌病变[63]。
CMR适用于所有疑诊心脏结节病的诊断以及心脏结节病治疗效果的监测。
心脏结节病在影像学上分为急性炎症期及纤维化期。
(1)炎症期:心肌炎症多累及室间隔基底段[64],心肌水肿在T2WI序列中表现为局限的高信号区,相应区域可见室壁增厚;融合的肉芽肿在T2WI像中显示为中心低信号外周高信号的结节。(2)纤维化期:部分患者室壁变薄,弥漫性病变者心室形态可与DCM相似。
发病各期可见受累节段出现局限或弥漫的收缩异常。
(1)炎症期:钆对比剂早期强化(early gadolinium enhancement,EGE)时(给予对比剂1~5 min后)可见炎症受累区域异常强化。(2)纤维化期:延迟强化对患者心脏受累的诊断有高度准确性(敏感度100%,特异度78%)[65],心脏结节病患者可见条状或灶状强化,多累及心外膜下,但与冠状动脉分布无关,兹与缺血性心脏病鉴别。
可通过疾病的好发部位、延迟强化的特征与淋巴结受累情况与HCM、DCM鉴别。心脏结节病多发于室间隔基底段,纤维化期可见灶状强化,心外膜下常见;HCM患者多表现为室间隔非对称性肥厚,强化多见于肥厚区域及右心室与室间隔移行处;DCM表现为广泛的室壁变薄,壁间强化多见。
血色素性心肌病是一类由心肌内铁离子沉积导致的疾病,可由遗传学性血色素病或地中海贫血患者反复输血后导致。血色素性心肌病表现为心肌舒张功能受损,后期也可表现为收缩功能受损,心脏扩张,产生类似于扩张性心肌病样改变,因此,在扩张性心肌病的鉴别诊断中常需排除血色素性心肌病。
CMR适用于疑诊血色素性心肌病的诊断,可用于血色素性心肌病铁鳌合剂治疗的疗效监测及预后判断。
血色素性心肌病可表现为心肌肥厚,因此需同左心室肥厚相关疾病鉴别,在后期多表现为心脏扩张,需与DCM鉴别。
常表现为舒张功能不全,可合并总体收缩功能不全,LVEF下降。心肌铁离子含量评估:通过T2*加权梯度回波序列可测定心肌T2*时间反映心肌内铁离子沉积的浓度[68]。正常心肌在1.5 T场强下T2*值为36~68 ms,当T2*值低于20 ms时高度提示心肌铁沉积。T2*值测定一般采用左心室中段短轴切面室间隔的心肌T2*值最为可靠,同时需测定肝脏的T2*值,患者可表现为肝脏和心脏同时受累或仅为心脏单独受累。
血色素性心肌病一般不出现心肌纤维化,无LGE表现,因此同其他心肌疾病鉴别时可采用LGE加以协助判断。
T2*值的下降同血色素性心肌病合并心衰的不良预后有关,同时T2*值的测定也可用于检测铁鳌合剂治疗的效果判断。
心肌炎是由多种病因引起的心肌组织的炎性病变,病毒感染是主要原因。其病理改变主要包括心肌水肿、毛细血管渗漏、充血、细胞坏死及纤维化瘢痕形成等。心内膜活检是诊断心肌炎的金标准,但由于其有创性,难以在临床广泛应用。依靠CMR多序列扫描以及高度的组织特异性能够无创性识别上述不同阶段的病理学改变,对心肌炎的早期诊断、早期治疗具有很高的价值。2006年首次提出了心肌炎的CMR诊断标准,即路易斯湖标准。
CMR适用于可疑心肌炎的诊断,适用于类似急性冠状动脉综合征表现但冠状动脉造影正常患者的病因学诊断,也适用于心肌炎预后的判断。
心肌水肿在T2WI呈局部或弥漫性高信号,以三反转恢复自旋回波序列(TIRM)最为敏感。心肌弥漫性水肿时单纯肉眼很难识别,需要把心肌与骨骼肌T2加权成像信号强度作对比,当T2加权成像信号强化比值≥2.0有诊断意义[71]。
EGE可提示毛细血管渗漏、充血。局限性EGE提示局灶性炎症,弥漫性EGE则需通过计算心肌早期钆强化率(EGEr):心肌增强/骨骼肌增强,增强=(增强后信号强度–增强前信号强度)/增强前信号强度进行判断。EGEr≥4.0诊断急性心肌炎的灵敏度、特异度及准确度分别为80%、68%及74.5%[71]。
LGE可以识别心肌坏死及纤维瘢痕。左心室侧壁心外膜下强化是心肌炎的特征性表现,其次为室间隔[72]。心内膜下强化很少单独出现,可与缺血性心肌病相鉴别。
32%~57%的心肌炎患者出现心包积液,CMR可以准确评估心包积液的量、分布范围以及是否具有血液动力学意义。
有关CMR心肌炎病程随访尚缺乏大样本循证医学依据。CMR可通过评估上述改变监测疾病进展并为临床决策提供参考依据。
总之,心肌病是心血管疾病中最为繁杂和棘手的问题之一,CMR在非缺血性心肌病中的价值越来越被重视,特别是LGE对心肌组织特征的识别更有助于临床鉴别诊断和预后评估,新技术如T1-mapping或ECV-mapping等不断发展,为未来可能的临床应用提供了新方向。目前在国内CMR临床应用价值还未能充分发挥:首先,应用限于少数大的中心,普及不够;其次,研究多关注常见心肌病,对少见心肌病认知和关注不足;最后,尽管一些研究在国际上被初步认可,但还缺乏足够的话语权。传统的超声和CT等技术在临床应用已相对普及,而CMR兼具了技术的无创性和功能评估的准确性,平衡了诊断时的可靠性和鉴别时的全面性,显现了在预后和治疗指导方面的双重价值,迫切需要被更多的医疗机构和人员掌握和开展。希望通过本共识的制定和推广,能够推动国内心肌病CMR临床应用的规范化以及技术创新,从单中心回顾性研究向多中心大规模前瞻性研究转变,最终将会使更多患者受益。
专家组成员(按姓氏拼音为序):曹丰(解放军总医院),陈敏(北京医院),陈韵岱(解放军总医院),陈玉成(四川大学华西医院),程敬亮(郑州大学第一附属医院),方全(中国医学科学院北京协和医院),方唯一(上海交通大学附属胸科医院),丁荣晶(北京大学人民医院),高炜(北京大学第三医院),葛均波(复旦大学附属中山医院),韩雅玲(沈阳军区总医院),何作祥(中国医学科学院阜外心血管病医院),胡大一(北京大学人民医院),惠汝太(中国医学科学院阜外心血管病医院),霍勇(北京大学第一医院),贾绍斌(宁夏医科大学附属医院),荆志成(中国医学科学院阜外心血管病医院),刘梅林(北京大学第一医院),卢光明(南京军区总医院),陆敏杰(中国医学科学院阜外心血管病医院),马长生(首都医科大学附属北京安贞医院),马依彤(新疆医科大学第一附属医院),孙英贤(中国医科大学附属第一医院),田野(哈尔滨医科大学附属第一医院),滕皋军(东南大学医学院),王建安(浙江大学附属第二医院),王景峰(中山大学孙逸仙纪念医院),夏黎明(华中科技大学附属同济医院),许建荣(上海交通大学医学院附属仁济医院),杨杰孚(北京医院),杨敏福(首都医科大学附属北京朝阳医院),杨新春(首都医科大学附属北京朝阳医院),杨跃进(中国医学科学院阜外心血管病医院),于波(哈尔滨医科大学附属第二医院),余永强(安徽医科大学第一附属医院),张运(山东大学齐鲁医院),张抒扬(中国医学科学院北京协和医院),张兆琪(首都医科大学附属北京安贞医院),赵世华(中国医学科学院阜外心血管病医院),周胜华(中南大学湘雅二医院)

























