
探讨人脐带间充质干细胞(hUC–MSCs)分泌的外泌体(exosomes)的免疫调节能力。
分离培养hUC–MSCs,收集第3代hUC–MSCs上清,提取外泌体,Western印迹检测其表面特异标志CD81、CD9的表达,BCA法测定浓度;不同浓度外泌体与CD3/CD28单抗刺激的正常人外周血单个核细胞(PBMC)作用72 h,流式检测作用前后Th17和Treg细胞的比例变化,检测对CD4+T、CD8+T细胞增殖能力的影响,ELISA检测干扰素(IFN)–γ、白细胞介素(IL)–6、肿瘤坏死因子α(TNF–α)、转化生长因子β1(TGF–β1)的水平变化。
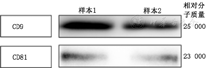
hUC–MSCs外泌体高表达CD9、CD81,可明显抑制CD4+T和CD8+T细胞的增殖,升高CD4+CD25+FoxP3+Treg细胞比例,经CD3/CD28单抗刺激后CD45+CD4+Ki67+和CD45+CD8+Ki67+细胞比例为85.3%±5.6%和72.6%±6.3%,同时升高PBMC分泌的TGF–β1水平,降低IFN–γ、IL–6、TNF–α的水平(均P<0.05)。
hUC–MSCs分泌的外泌体具有免疫调节功能,有望成为一种免疫治疗的新选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
外泌体(exosomes)是由各种细胞分泌的大小在20~140 nm之间的微小双层膜囊泡,其内含有与细胞来源相关的miRNA、mRNA及蛋白等物质[1]。外泌体既可以直接激活受体细胞,也可以通过转运其包含的生物活性物质进入受体细胞内,参与细胞间的信息交流及许多重要的生理或病理过程[2,3]。间充质干细胞(MSCs)的免疫调节特性已被证实为MSCs重要的生物学特性之一,然而MSCs发挥免疫调节作用的机制尚待进一步研究[4]。近年研究发现,MSCs分泌的外泌体可作为细胞间重要的信息传递,参与到MSCs介导的损伤修复中,提示MSCs所分泌的exosomes可能也参与了MSCs的免疫调节[5]。因此,本研究拟进一步探索人脐带间充质干细胞(hUC–MSCs)所分泌的exosomes在免疫调节中的作用。
RPMI–1640、α–MEM培养基、胎牛血清(FBS)(美国GIBCO公司),兔抗人CD9(英国Abcam公司)、CD81抗体(美国Santa Cruz公司),ExoQuick exosome提取试剂盒(美国SBI公司),CD90、CD29、CD44、CD105、CD73、CD166、CD34、CD45、HLA–DR、IL17、CD4、CD25、FoxP3、Ki–67流式抗体(美国eBioscience公司), γ–干扰素(IFN–γ)、肿瘤坏死因子α(TNF–α)、白细胞介素(IL)–6、转化生长因子β1(TGF–β1) ELISA试剂盒(美国RD公司)。
无菌条件下,将脐带剪成长约1 cm小段,充分洗涤,去除脐动静脉,将脐带小段剪碎,置于培养皿中,以Wharton胶直接与皿底贴壁,加入少量含10%FBS和5%青链双抗的α–MEM培养液,置于37 ℃、5%CO2培养箱内培养,4 h后添加培养液。3 d更换培养液1次。hUC–MSCs融合达70%~80%后,用0.25%的胰酶消化,传代培养。流式检测表面标志物CD90、CD29、CD44、CD105、CD73、CD166、CD34、CD45、HLA–DR的表达。
将P3代hUC–MSCs种植于培养皿中,当细胞融合60%~80%,PBS清洗细胞,更换无exosome血清的培养基,继续培养48~72 h后,收集细胞上清,2 000 r/min,离心10 min,然后10 000 r/min,离心30 min,去除细胞或者细胞碎片。使用SBI公司ExoQuick exosome提取试剂盒,分离提取MSC–exosomes。1∶10(试剂∶上清)上下颠倒混匀,置于4 ℃冰箱静置过夜,第2天取出后,10 000 r/min离心15 min,弃去上清,洗涤沉淀即为hUC–MSCs–exosomes(hUC–MSCs–ex)。
收集细胞提取蛋白,BCA试剂盒计算hUC–MSCs–ex浓度。15 μg/孔上样,90 V电泳30 min,110 V电压分离蛋白,380 mA转膜2 h,5%脱脂牛奶封闭30 min。加入一抗4 ℃孵育过夜,TBST洗膜5 min×3次后,加入对应HRP标记二抗,室温下孵育1 h后,TBST洗膜5 min×3次,然后显色,KOADA成像系统成像。
取健康成人外周血,将10 ml全血转入50 ml离心管中,加入10 ml PBS溶液稀释,轻轻混匀;将Ficoll分离液分离的PBMC PBS和RPMI 1640培养基清洗各1次;加入10 ml 10%胎牛血清的RPMI 1640培养基重悬细胞,计数培养。
1×106/孔PBMC种植于6孔板,加入CD3/CD28单抗刺激,然后将不同浓度的hUC–MSCs–ex(1, 5, 10 μg/106 PBMC)加入到6孔板中,同时设置空白组,和hUC–MSCs–ex共培养组,共培养3 d后,收集细胞。流式检测共培养前后Treg/Th17细胞比例的变化。
将hUC–MSCs–ex处理前后的PBMC,分别标记CD4–FITC, CD8–APC膜抗体,破膜后再加入Ki–67–PE及IgG1–PE同型对照抗体,上机流式检测分析CD4+T、CD8+T细胞中Ki–67的表达。
参照ELISA试剂盒操作说明,检测人脐带间充质干细胞exosomes处理前后细胞上清中IFN–γ、IL–6、TNF–α、TGF–β1的表达变化。
使用SPSS 19进行统计学分析。实验数据描述为 ±s,两组样本均数比较采用配对样本t检验,P<0.05为差异有统计学意义。
±s,两组样本均数比较采用配对样本t检验,P<0.05为差异有统计学意义。
流式细胞检测发现,hUC–MSCs细胞表达CD90、CD29、CD44、CD105、CD73、CD166(>95%),不表达CD34、CD45、HLA–DR(<1%)。使用BCA法定量外泌体总蛋白,测得样品蛋白浓度约为(370.0±12.5) μg/ml。每106个hUC–MSCs的细胞上清液中平均能提取约7.2 μg外泌体。蛋白质免疫印迹法检测结果显示,hUC–MSCs–ex表达CD9、CD81蛋白(图1)。

以Ki–67测定细胞增殖能力。结果发现,经CD3/CD28单抗刺激后CD45+CD4+Ki67+和CD45+CD8+Ki67+细胞比例为85.3%±5.6%和72.6%±6.3%,MSCs(10∶1)可明显抑制CD45+CD4+和CD45+CD8+细胞的增殖,而不同浓度的hUC–MSCs–ex(1, 5和10 μg/106 PBMC)同样可明显抑制CD45+CD4+和CD45+CD8+细胞的增殖,呈浓度依赖性(图2)。
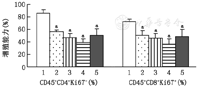

注:1:PBMC–st组;2:PBMC–st+MSC–ex 1;3:PBMC–st+MSC–ex 5;4:PBMC–st+MSC–ex 10;5:PBMC–st+MSC(10∶1)
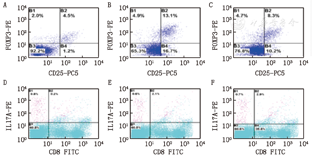
MSC分泌的exosomes同MSCs一样,可诱导CD4+CD25+FoxP3+T细胞比例的升高,对CD3+CD8–IL17A+T细胞的比例影响不明显(图3)。流式统计柱状图也显示PBMC+MSC–ex 5–Treg(7.1±1.5)%,PBMC+MSC–ex 10–Treg(8.2±2.0)%,PBMC+MSC (10∶1) –Treg(6.8±1.3)%,与PBMC组(4.9±1.5)%比较,差异有统计学意义,均P<0.05。

hUC–MSCs–ex能降低CD3/CD28单抗刺激后的PBMC产生IFN–γ、TNF–α、IL–6,而增加TGF–β1的表达(图4)。


注:1:PBMC组;2:PBMC–st组;3:PBMC–st+MSC–ex 10组;4:PBMC–st+MSC(10∶1)
间充质干细胞是一种具有高度自我更新能力与多向分化潜能的多能干细胞,目前已应用于临床治疗自身免疫性疾病、心肌损伤性疾病、神经损伤性疾病等,然而其治疗机制尚不明确。现已明确,hUC–MSCs具有免疫调节功能,可以抑制T、B、NK等细胞的增殖,调节Treg/Th17,1型和2型巨噬细胞等的平衡。既往的研究也发现,这种调节作用可由细胞、细胞直接接触或间接通过释放免疫抑制因子所介导,如TGF–β1、PGE2、IDO、IL–10等。近年研究发现MSCs分泌的外泌体亦参与细胞间的信息交流,可能是其发挥治疗作用的重要机制之一,也已证实MSCs分泌的exosomes能够有效减少心肌损伤范围、保护急性肾小管损伤、促进神经再生、减轻肺损伤[7,8]。因此,本研究是为了探索hUC–MSCs分泌的exosomes是否也具有免疫调节功能。
近年来研究发现,MSCs具有强大的免疫调节功能,其高表达IL–17受体,并通过分泌大量的细胞因子调节Treg和Th17细胞的增殖和分化[9,10]。给小鼠输注BM–MSCs可抑制Th17细胞的激活和迁徙,有效抑制Th17细胞分泌的细胞因子IL–17和IL–22的产生,促进Th17细胞向IL–10+FoxP3+ Treg细胞分化[11]。Blazquez等[12]发现脂肪来源的MSCs的外泌体能够调节T细胞的数量及功能。我们的结果也提示,hUC–MSCs分泌的exosomes可在体外明显抑制CD4+T和CD8+T细胞增殖。提示,hUC–MSCs分泌的exosomes可介导细胞的免疫抑制作用。进一步分析MSCs分泌的exosomes对T细胞亚群分化的影响,结果发现,MSCs分泌的exosomes可明显诱导CD4+CD25+FoxP3+Treg细胞比例的升高,这可能与exosomes上调Treg细胞分化的关键细胞因子TGF–β1的水平有关[13]。既往研究已发现MSCs及MSCs分泌的外泌体均可抑制淋巴细胞产生和分泌的促炎细胞因子[12],我们实验结果也证实hUC–MSCs分泌的外泌体能抑制PBMC其产生IFN–γ、IL–6、TNF–α,并且外泌体的抑制作用更加明显。提示hUC–MSCs分泌的外泌体有望在炎症、自身免疫异常疾病治疗中发挥治疗作用。
越来越多的发现也逐步认识到,MSCs分泌的外泌体可能是MSCs发挥治疗作用的重要机制之一,它可以通过与靶细胞的胞膜直接融合,释放mRNA、miRNA进入细胞质,或是通过内吞作用被靶细胞摄取以及识别细胞表面的特异性受体等方式调节疾病异常微环境,逆转疾病的发生发展[14]。这些发挥特定作用的分子及其在MSC分泌的外泌体免疫调节中的作用尚需进一步鉴定和研究。
总之,我们的研究发现,hUC–MSCs分泌的外泌体具有免疫调节功能。较之MSCs的直接输注,外泌体的应用更为安全,更为高效,可望成为未来细胞治疗的新手段,更好发挥MSCs的临床治疗价值。



























