
探讨原发乳腺弥漫大B细胞淋巴瘤(DLBCL)患者的临床特征、治疗及预后。
回顾性分析21例原发乳腺DLBCL患者的临床资料,用Kaplan-Meier法分析5年总生存(OS)率,采用Log-rank检验法进行亚组间差异性分析。
21例患者均为女性,中位年龄48(21~64)岁,其中国际预后指数(IPI)评分0分者13例,1分者6例,2分者2例。21例患者中R-CHOP/CHOP方案治疗组(6例)和EPOCH±R序贯DICE±R方案治疗组(15例)患者的5年OS率分别为40.0%和72.2%,差异有统计学意义(P=0.035);中枢神经系统复发率分别为16.7%和6.7%(P=0.500);ⅡE~ⅢE期组(9例)和ⅠE期(12例)患者5年OS率分别为21.4%和83.3%,差异有统计学意义(P=0.025)。
原发乳腺DLBCL临床少见,EPOCH±R序贯DICE±R方案治疗可改善患者预后,降低中枢神经系统复发率;ⅡE~ⅢE期者较ⅠE期者预后更差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴瘤是一种原发于淋巴结和(或)淋巴结外器官或淋巴组织的恶性肿瘤,25%~40%发生于淋巴结外,其中以胃肠道较常见[1,2,3]。原发乳腺淋巴瘤(primary breast lymphoma,PBL)临床少见,占乳腺恶性肿瘤的0.04%~1.00%[4,5,6],占结外非霍奇金淋巴瘤(Non-Hodgkin's lymphoma,NHL)的1.7%~2.2%[2,4,5]。PBL发病率低、临床表现无特异性,术前诊断困难。本研究我们回顾性分析我院21例原发乳腺弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)患者的临床资料,旨在探讨其临床特征、治疗及预后。
2005年1月至2014年12月经我院病理科确诊且资料完整的PBL患者共24例,排除3例黏膜相关组织淋巴瘤患者,共计纳入21例原发乳腺DLBCL患者。诊断参照1972年Wiseman等[7]提出的标准:既往无恶性淋巴瘤病史;首发部位位于乳腺,可同时或随后有同侧腋窝淋巴结受累(如果受累淋巴结超过乳腺肿块或肿块位于腋尾,应考虑为结内淋巴瘤);标本足够且交界部位有淋巴瘤病灶,又有正常乳腺组织;诊断时不伴有同时存在的广泛播散的淋巴瘤病灶。病理切片均经至少2位经验丰富的病理科医师重新观察并独立作出诊断。均获得患者及家属的知情同意。
21例患者中5例行细针穿刺,其余16例患者行手术治疗(15例行局部肿物切除术、1例行乳癌保乳术)获得标本。
21例患者均接受化疗,且行4~6次鞘内注射(阿糖胞苷50 mg+甲氨蝶呤15 mg+地塞米松10 mg)。21例患者中6例行CHOP(环磷酰胺750 mg/m2,第1天;长春新碱1.4 mg/m2,第1天;阿霉素50 mg/m2,第1天;泼尼松60 mg/m2,第1~5天;21 d为1个疗程)方案化疗,15例行EPOCH(依托泊苷50 mg/m2,表柔比星12 mg/m2,长春新碱1.4 mg/m2,持续24 h滴注,第1~4天;环磷酰胺750 mg/m2,第5天;泼尼松60 mg/m2,第1~5天;21 d为1个疗程)序贯DICE(地塞米松20 mg/m2,第1~4天;异环磷酰胺1.2 g/m2,第1~4天;顺铂25 mg/m2,第1~4天;依托泊苷60 mg/m2,第1~4天)方案化疗。21例患者中10例联合放疗,6例联合利妥昔单抗靶向治疗,3例联合造血干细胞移植(HSCT)(表1)。
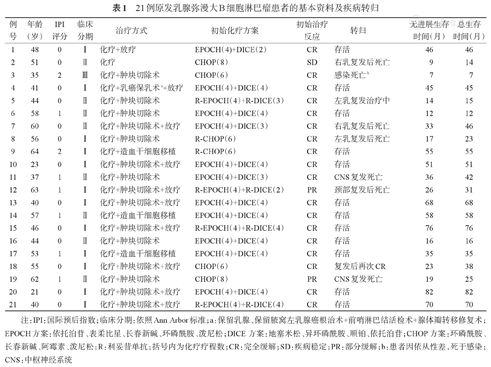
21例原发乳腺弥漫大B细胞淋巴瘤患者的基本资料及疾病转归
21例原发乳腺弥漫大B细胞淋巴瘤患者的基本资料及疾病转归
| 例号 | 年龄(岁) | IPI评分 | 临床分期 | 治疗方式 | 初始化疗方案 | 初始治疗反应 | 转归 | 无进展生存时间(月) | 总生存时间(月) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 48 | 0 | Ⅰ | 化疗+放疗 | EPOCH (4)+DICE(2) | CR | 存活 | 46 | 46 |
| 2 | 51 | 0 | Ⅱ | 化疗 | CHOP(8) | SD | 右乳复发后死亡 | 9 | 14 |
| 3 | 35 | 2 | Ⅲ | 化疗+肿块切除术 | CHOP(6) | CR | 感染死亡b | 7 | 7 |
| 4 | 41 | 0 | Ⅰ | 化疗+乳癌保乳术a+放疗 | EPOCH(4)+DICE(4) | CR | 存活 | 45 | 45 |
| 5 | 44 | 0 | Ⅱ | 化疗+肿块切除术 | R-EPOCH (4) +R-DICE (3) | CR | 左乳复发治疗中 | 14 | 15 |
| 6 | 58 | 1 | Ⅱ | 化疗+肿块切除术 | EPOCH(4)+DICE(4) | CR | 存活 | 12 | 12 |
| 7 | 60 | 0 | Ⅱ | 化疗+肿块切除术+放疗 | EPOCH(4)+DICE(3) | CR | 右乳复发后死亡 | 33 | 46 |
| 8 | 56 | 0 | Ⅰ | 化疗+肿块切除术 | R-CHOP(6) | CR | 左乳复发后死亡 | 17 | 23 |
| 9 | 64 | 2 | Ⅰ | 化疗+造血干细胞移植 | R-CHOP(6) | CR | 存活 | 55 | 55 |
| 10 | 23 | 0 | Ⅰ | 化疗+肿块切除术+放疗 | EPOCH(4)+DICE(4) | CR | 存活 | 51 | 51 |
| 11 | 37 | 1 | Ⅱ | 化疗+肿块切除术 | EPOCH(4)+DICE(3) | CR | CNS复发死亡 | 36 | 42 |
| 12 | 63 | 1 | Ⅰ | 化疗+肿块切除术+放疗 | R-EPOCH (4) +R-DICE (2) | PR | 颈部复发后死亡 | 26 | 31 |
| 13 | 40 | 0 | Ⅰ | 化疗+肿块切除术+放疗 | EPOCH(4)+DICE(4) | CR | 存活 | 68 | 68 |
| 14 | 57 | 1 | Ⅱ | 化疗+造血干细胞移植 | EPOCH(4)+DICE(4) | CR | 存活 | 58 | 58 |
| 15 | 46 | 0 | Ⅰ | 化疗+肿块切除术+放疗 | R-EPOCH (4)+R-DICE(4) | CR | 存活 | 76 | 76 |
| 16 | 44 | 0 | Ⅱ | 化疗+肿块切除术 | EPOCH(4)+DICE(4) | CR | 存活 | 16 | 16 |
| 17 | 53 | 1 | Ⅰ | 化疗+造血干细胞移植 | EPOCH(4)+DICE(4) | CR | 存活 | 35 | 35 |
| 18 | 55 | 0 | Ⅰ | 化疗+肿块切除术+放疗 | CHOP(6) | CR | 复发后再次CR | 23 | 38 |
| 19 | 62 | 1 | Ⅱ | 化疗+肿块切除术 | CHOP(8) | PR | CNS复发死亡 | 19 | 25 |
| 20 | 21 | 0 | Ⅰ | 化疗+肿块切除术+放疗 | EPOCH(4)+DICE(4) | CR | 存活 | 82 | 82 |
| 21 | 40 | 0 | Ⅰ | 化疗+肿块切除术+放疗 | R-EPOCH (4)+R-DICE(4) | CR | 存活 | 70 | 70 |
注:IPI:国际预后指数;临床分期:依照Ann Arbor标准;a:保留乳腺、保留腋窝左乳腺癌根治术+前哨淋巴结活检术+腺体瓣转移修复术;EPOCH方案:依托泊苷、表柔比星、长春新碱、环磷酰胺、泼尼松;DICE方案:地塞米松、异环磷酰胺、顺铂、依托泊苷;CHOP方案:环磷酰胺、长春新碱、阿霉素、泼尼松;R:利妥昔单抗;括号内为化疗疗程数;CR:完全缓解;SD:疾病稳定;PR:部分缓解;b:患者因依从性差,死于感染;CNS:中枢神经系统
症状、性别、年龄、LDH、血清β2微球蛋白(β2-MG)、国际预后指数(IPI)评分、临床分期、影像学表现、治疗及疾病转归等。
按照WHO疗效评价标准,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。无进展生存(PFS)时间定义为从患者确诊至疾病进展、死亡或随访结束的时间。总生存(OS)时间定义为从患者确诊至患者死亡或随访终点的时间。
随访方式包括电话随访和门诊复查等,截止日期为2014年12月30日,中位随访时间42(8~82)个月。
采用SPSS 18.0软件进行统计学分析,采用Kaplan-Meier法进行生存分析,组间差异性分析采用Log-rank检验。检验水准α=0.05,P<0.05为差异有统计学意义。
21例患者均为女性,中位年龄48(21~64)岁。2例患者以乳房针刺样疼痛为首发症状就诊,其余19患者均因乳腺无痛性肿块就诊,不伴红肿热痛,无乳头溢血、溢液。临床分期依照Ann Arbor标准,确诊时ⅠE期者12例,ⅡE期者8例,ⅢE期者1例。IPI 0分者13例,1分者6例,2分者2例。实验室检查:LDH中位数为194(115~281) U/L,5例患者LDH升高(正常值范围为109~245 U/L)。β2-MG中位数为1.98(1.34~2.78)mg/L, 6例患者β2-MG升高(正常值范围为0.8~2.2 mg/L)。
21例患者中生发中心亚型(GCB) 6例,非GCB亚型8例,具体分型不详7例,免疫组化:所有患者均表达CD20、CD79a,不表达上皮类标志CK、EMA及T细胞标志CD3、CD5。
21例患者中16例为孤立肿块影,4例为单侧多发肿块影,1例为弥漫性密度增高;肿块中11例边界清楚,9例边界不清,1例边缘可见毛刺征。
21例患者中8例表现为局限性低回声团,边界多不清晰,呈不规则状,CDFI显示6例见血流信号;9例表现为边界清楚,椭圆形低回声团,CDFI显示4例见血流信号;4例表现为乳腺腺体结构紊乱。
21例患者中7例行乳腺MRI检查,其中6例表现为T1W1低信号,T2W1脂肪抑制呈稍高信号,表观扩散系数(ADC)值显著降低。1例乳腺淋巴瘤MRI表现,T1W1见右乳多个边界清楚的低信号,增强早期快速强化,延迟期信号减低。
21例患者经初始治疗后,18例获得CR,2例获得PR, 1例获得SD。初始未获得CR及复发患者换用ESHAP (依托泊苷+甲泼尼龙+阿糖胞苷+顺铂)、DHAP(地塞米松+阿糖胞苷+顺铂)、GemOx(吉西他滨+奥沙利铂)方案继续治疗;3例患者化疗后联合HSCT,分别随访35、55、58个月,目前仍处于CR。R-CHOP/CHOP方案治疗组(6例)和EPOCH±R序贯DICE±R方案治疗组(15例)患者的5年OS率分别为40.0%和72.2%,差异有统计学意义(P=0.035);中枢神经系统(CNS)复发率分别为16.7%和6.7%(P=0.500)。
对21例患者进行单因素分析,结果显示EPOCH±R序贯DICE±R方案治疗组(15例)效果优于R-CHOP/CHOP方案治疗组(6例),两组患者的5年OS率分别为72.2%、40.0%,差异有统计学意义(P=0.035)。ⅡE~ⅢE期者(9例)较ⅠE期者(12例)预后差,5年OS率分别为21.4%、83.3%,差异有统计学意义(P=0.025)。年龄(P= 0.200)、LDH水平(P=0.955)、IPI评分(P=0.482)、是否接受放疗(P=0.072)、是否应用利妥昔单抗(P= 0.849)对预后影响的差异无统计学意义(表2)。
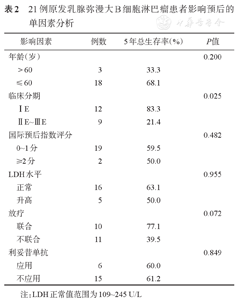
21例原发乳腺弥漫大B细胞淋巴瘤患者影响预后的单因素分析
21例原发乳腺弥漫大B细胞淋巴瘤患者影响预后的单因素分析
| 影响因素 | 例数 | 5年总生存率(%) | P值 | |
|---|---|---|---|---|
| 年龄(岁) | 0.200 | |||
| >60 | 3 | 33.3 | ||
| ≤60 | 18 | 68.1 | ||
| 临床分期 | 0.025 | |||
| ⅠE | 12 | 83.3 | ||
| ⅡE~ⅢE | 9 | 21.4 | ||
| 国际预后指数评分 | 0.482 | |||
| 0~1分 | 19 | 59.5 | ||
| ≥2分 | 2 | 50.0 | ||
| LDH水平 | 0.955 | |||
| 正常 | 16 | 63.1 | ||
| 升高 | 5 | 50.0 | ||
| 放疗 | 0.072 | |||
| 联合 | 10 | 77.1 | ||
| 不联合 | 11 | 39.5 | ||
| 利妥昔单抗 | 0.849 | |||
| 应用 | 6 | 60.0 | ||
| 不应用 | 15 | 61.2 | ||
注:LDH正常值范围为109~245 U/L
PBL是一种源于淋巴结外乳腺小叶淋巴组织或小叶内淋巴细胞的恶性肿瘤,患者多为女性[2,3,5],多以单侧乳房无痛性肿块为首发表现,多位于乳腺外上象限[6]。极少累及双侧。本组21例患者均为女性,中位发病年龄48岁,与国内外报道基本一致[2,3];其中原发乳腺DLBCL占同时期PBL的87.5%,与国内文献一致(82.2%~93.8%),较西方国家40%~80%稍高[3]。
原发乳腺DLBCL患者的影像学表现缺乏特异性,难与其他乳腺肿瘤鉴别,最终诊断依靠病理组织学检查[2,6,8,9]。但临床实践表明,穿刺获得标本有限,部分患者诊断困难,因此常采用肿物局部切除活检。本组患者5例行穿刺活检,其余16例患者均行手术切除活检。
目前PBL尚无统一的治疗方案,多采用手术、化疗联合局部放疗的综合治疗[1,4,6]。乳腺根治术不能使PBL患者获益[4,6],目前手术仅限于获取足够标本用于病理组织学诊断。PBL中比例最高的病理类型为DLBCL,原发乳腺DLBCL现多常用CHOP类方案化疗,多项研究报道患者的5年PFS[或无病生存(DFS)]率为40%~60%,5年OS率为53%~63%[2,10,11,12]。利妥昔单抗的应用将DLBCL的治疗推进到新时代,但目前尚未发现其可改善PBL患者的预后[8,9,11]。Aviles等[11]对104例原发乳腺DLBCL患者进行回顾性分析,发现CHOP方案治疗组与R-CHOP方案治疗组CR率分别为70%和78%,5年DFS率分别为60%和64%,5年OS率分别为52%和53%,差异均无统计学意义。2014年我国台湾地区有研究者发现是否联合利妥昔单抗治疗对原发乳腺DLBCL患者5年OS率(57.1%对58.3%)、PFS率(57.1%对50.0%)无影响,差异均无统计学意义[3]。与文献类似,本研究我们亦未发现利妥昔单抗可改善原发乳腺DLBCL患者的OS率(P=0.849)。但由于临床数据仍较少,利妥昔单抗对原发乳腺DLBCL患者预后的价值,仍需进一步研究证实。
传统的CHOP方案治疗原发乳腺DLBCL患者的5年OS率为53%~63%[2,10,11,12],CNS复发率高达11%~27%[2,3,5,12,13]。为减少耐药,提高缓解率,降低CNS复发率,我们尝试EPOCH±R序贯DICE±R方案进行治疗,同时常规给予鞘注,患者CR率为85.7%(18/21),高于国内外文献报道的75%和38%~47%[14]。王文武等[15]采用DICE与CHOP方案进行治疗,患者的OS率分别为78.3%、56.7%,差异有统计学意义。房佰俊等[16]报道CHOP序贯DICE方案治疗结内高危DLBCL患者,总反应率可达75.6%。DICE方案与CHOP方案相比:无交叉耐药;依托泊苷、顺铂、异环磷酰胺联合应用协同抗肿瘤作用更强,肿瘤细胞耐药发生率较小[16]。EPOCH方案治疗复发耐药B细胞NHL总反应率可达63.3%。EPOCH方案对复发或难治NHL患者具有显著疗效,药物低浓度长时间作用于肿瘤细胞具有更强的杀伤性,可克服P-糖蛋白对药物的泵出作用,且已证实持续灌注可部分逆转肿瘤细胞[17]。本研究中EPOCH±R序贯DICE±R方案治疗组、R-CHOP/CHOP方案治疗组患者的5年OS率分别为72.2%、40.0%,差异有统计学意义(P=0.035),后者OS率仅为40.0%可能与ⅡE~ⅢE患者比例较高有关。Jeanneret-Sozzi等[18]在一项多中心研究中发现,45%的PBL患者处于ⅡE期以上,其5年OS率仅42%。Wong等[19]对26例PBL患者进行研究,发现临床分期对患者预后具有重要价值,其Ⅰ期和Ⅱ期患者的5年OS率分别为83.0%和20.0% (P=0.002)。在本研究中我们亦发现ⅡE期及其以上患者预后较ⅠE期者差,与文献报道一致。对于ⅡE~ⅢE患者,接受EPOCH±R序贯DICE±R方案治疗可能有更好的预后。由于本组病例数较少,随访时间短,序贯方案对原发乳腺DLBCL的疗效仍需进一步观察及全国多中心随机临床试验证实。预防性鞘内注射对降低CNS复发率有重要作用,本组患者均接受4~6次鞘内注射,CNS复发率仅为9.5%,明显低于文献报道的11%~27%[2,3,5,12,13]。
既往有研究者报道原发乳腺DLBCL患者的预后可能与肿瘤的病理类型、临床分期、IPI评分、蒽环类为基础的化疗、是否放疗、是否手术等因素有关[2,3,10,11,12]。但在本研究中我们仅发现临床分期与预后相关,可能与随访时间短、病例数少有关。
综上,原发乳腺DLBCL临床罕见,预后较差,术前诊断困难,EPOCH±R序贯DICE±R方案治疗可改善患者预后,降低中枢神经系统复发率,ⅡE~ⅢE期者较ⅠE期者预后更差。



























