
应用三维斑点追踪技术(3D–STE)和实时三维超声心动图(RT3DE)评估探讨左室射血分数保留心衰(HFpEF)患者左房功能变化及意义。
将43例HFpEF患者根据左房大小分为A组(左房最大容积指数LAVImax<34 ml/m2)和B组(LAVImax≥34 ml/m2),18例健康者为对照组。应用3DSTE分析获取左房基底(Basal)、中间(Middle)、房顶(Roof)和整体(Global)的心室收缩期长轴峰值应变(LSs%)与心房收缩前长轴峰值应变(LSa%),结合RT3DE和多普勒超声参数进行比较分析。
左房中部应变参数具满意可重复性(ICC>0.8),A组左房充盈和排空期形变功能减低以中部为主[与对照组相比:MLSs(33±6)%与(45±9)%,MLSa(12±3)%与(17±5)%;P<0.05],B组基底和房顶部形变功能也明显降低[与A组和对照组相比:BLSs(18±7)%与(25±8)%与(29±8)%,RLSs(24±9)%与(28±8)%与(32±10)%;与对照组相比:BLSa(11±5)%与(14±4)%,RLSa(12±5)%与(15±5)%;P<0.05]。HFpEF患者左房僵硬度明显增加,左房充盈扩张分数(LAEI%)和被动射血分数(LAPEF%)明显降低,B组左房主动射血分数(LAAEF%)也显著降低。
3D–STE结合RT3DE可有效评估HFpEF左房功能。左房中部应变参数是评估左房功能的理想指标。HFpEF患者左房储备、通道和泵功能均明显降低,存在明显舒张功能不全,这些变化在左房明显增大患者中更为显著。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在门诊和住院心衰患者中,左室射血分数保留的心衰(HFpEF)已超过50%[1]。长期以来心衰研究重点在左室,左房研究较少。随着越来越多的研究表明左房在心脏疾病发生发展中起重要作用,HFpEF患者左房功能变化与临床症状、活动耐量等密切相关[2],是心血管事件的有效预测因子[3]。发现和有效评估左房功能改变对研究HFpEF病理生理,评估风险和治疗效果有重要意义。本研究应用三维斑点追踪技术(3D–STE)结合实时三维超声心动图(RT3DE)评估探讨HFpEF左房形变、容积变化及其意义。
目前HFpEF尚无统一诊断标准,参考近年HFpEF诊疗指南和相关研究[4,5,6]与解放军总医院心血管科患者情况,本研究选择的HFpEF诊断标准为:(1)明显心衰症状(NYHA分级Ⅱ~Ⅲ级);(2)左室射血分数(LVEF)>50%,左室舒张末容积指数(LVEDVI)<97 ml/m2;(3)舒张功能受损客观证据:超声心动图指标Ea<8,E/Ea>8(见后)[7];(4)血清脑钠肽(BNP)指标升高:BNP>200 ng/L或NTproBNP>220 ng/L。入选标准:(1)符合上述HFpEF诊断标准;(2)窦性心律。主要排除标准:房颤,轻中度以上二尖瓣反流,心脏瓣膜病,急性冠脉综合征,肺动脉高压(HFpEF以外原因)等。共入选2014年1–7月住院患者54例,男28例,女26例,年龄47~65岁。对照组为18例健康体检者,经体检、心电图、超声检查等排除心脏疾病。
为更准确评估HFpEF左房功能变化,我们将左房明显增大定义为LAVImax≥34 ml/m2,以此将患者分为A组(LAVImax<34 ml/m2)和B组(LAVImax≥34 ml/m2)。
西门子SC2000超声诊断仪(美国),配备eSieLVA左心定量分析软件。西门子工作站,配备3D–mechanics分析软件。4V1C探头,频率3~5 MHz,4Z1c容积探头,频率1~4 MHz。
研究对象左侧卧位,同步连接心电图,心尖四腔切面获取图像。彩色多普勒取样门置于二尖瓣口,组织多普勒(TDI)取样门置于二尖瓣环室间隔和侧壁水平,获取参数后转换探头采集左心全容积图像,调整取样框和图像模式,以增加空间和时间分辨率(容积帧频>25 Hz)。患者呼气末屏气时存储3个心动周期图像,各参数值取3次测量均值。
二尖瓣舒张早期和晚期峰值流速E、A,E/A,E峰减速时间(DT);TDI二尖瓣环舒张早期和晚期峰值速度Ea、Aa(取室间隔和侧壁均值);E/Ea。
eSie LVA软件将左房全容积图像切分显示为心尖四腔、两腔、三腔和短轴基底、中间和房顶切面,调整取样线清楚显示图像。设定左房舒张末(LAED)和收缩末(LAES)为左房容积最大(LAVmax)和最小处(LAVmin),LAES为时间起点。LAED、LAES帧手动标记房顶和二尖瓣环侧壁、房间隔三点,软件完成心房内膜边界追踪,逐帧观察,必要时手动调整边界(左心耳和肺静脉开口排除在外)(图1),显示左房容积曲线。
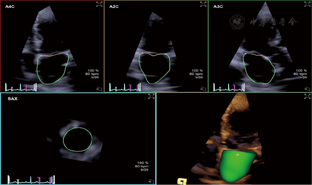

LAVmax,LAVmin及LAVpc(左房收缩前容积,心电图P波起始处)经体表面积标化后记为LAVImax,LAVImin,LAVIpc。左房充盈扩张分数(LAEI%)=LAVmax–LAVmin/LAVmin%,左房排空分数(LAEF%)=LAVmax–LAVmin/LAVmax%,左房被动射血分数(LAPEF%)=LAVmax–LAVpc/LAVmax%,左房主动射血分数(LAAEF%)=LAVpc–LAVmin/LAVpc%。
3D–mechanics软件将左房全容积图像切分显示为多切面(同前),软件默认将左房壁按左室16节段划分。根据解剖结构特点我们将左房划分为基底(Basal)、中间(Middle)、房顶(Roof)三部分(分别对应16节段基底、中间和心尖部)(图2),调整图像使三部分划分更接近其空间构型。LAES为时间起点,LAED、LAES帧手动描记左房内膜边界后软件自动追踪其运动轨迹,逐帧观察调整。左房三部分形变以三维速度向量(VVI)模式和应变曲线显示(图2),调整显示模式和时间间期,计算获取参数。主要参数:左房基底、中间、房顶部和整体(Global)心室收缩期长轴峰值应变(LSs%)和心房收缩前长轴峰值应变(LSa%),分别记为BLSs、MLSs、RLSs、GLSs和BLSa、MLSa、RLSa、GLSa(图2)。整体应变为三部分应变均值。在3D–STE基础上,参考既往研究[8]引入左房僵硬指数(LA stiffness index),其定义为E/Ea与GLSs%比值,数值越大表明左房僵硬度越高,顺应性越低。
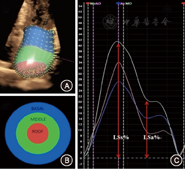

随机选取15名研究对象,间隔3日由同一操作者再次分析获取参数,观察者内变异性评价应用组内相关系数(ICC),绘制Bland–Altman图表。
采用SPSS 20.0统计软件,计量资料以 ±s表示,多组间比较采用单因素方差分析,两两比较采用最小有意义差异法(LSD)。相关性检验应用Person相关分析。P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析,两两比较采用最小有意义差异法(LSD)。相关性检验应用Person相关分析。P<0.05为差异有统计学意义。
容积分析中2例受肺静脉和左心耳开口影响无法获取理想曲线;3D–STE分析中6例房顶部受肺静脉开口影响无法有效追踪,3例基底部受左心耳和二尖瓣环影响无法有效追踪,以上11例排除,最终入选43例,A组19例,B组24例。一般资料比较(表1)。
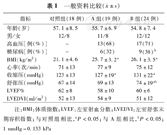
一般资料比较( ±s)
±s)
一般资料比较( ±s)
±s)
| 指标 | 对照组(18例) | A组(19例) | B组(24例) |
|---|---|---|---|
| 年龄(岁) | 57.1±8.5 | 55.7±6.9 | 54.8±7.4 |
| 男/女 | 12/8 | 11/8 | 12/12 |
| 高血压[例(%)] | – | 13(68) | 17(71) |
| 糖尿病[例(%)] | – | 6(32) | 9(38)b |
| BMI(kg/m2) | 21.1±4.6 | 25.7±3.2a | 26.1±3.5a |
| 心率(次/min) | 71±13 | 77±9 | 75±12 |
| 收缩压(mmHg) | 123±13 | 127±19a | 131±22a |
| 舒张压(mmHg) | 67±14 | 69±13 | 74±19ab |
| LVEF% | 62±8 | 58±10 | 60±6 |
| LVEDVI(ml/m2) | 52±13 | 54±9 | 51±12 |
注:BMI:体质指数;LVEF:左室射血分数;LVEDVI:左室舒张末期容积指数;与对照组相比,aP<0.05;与A组相比,bP<0.05;1 mmHg=0.133 kPa
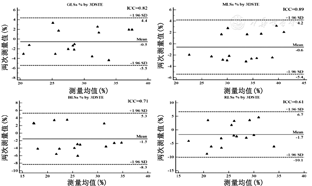
LSs参数中,MLSs、GLSs具满意可重复性(ICC>0.8,0.89和0.82),BLSs、RLSs的ICC为0.71、0.61,观察者间一致性Bland–Altman分析见图3。LSa参数MLSa、GLSa、BLSa、RLSa的ICC分别为0.81、0.78、0.71和0.57。

HFpEF患者E/Ea明显增高,Ea、Aa和DT均明显减小,B组较A组变化更为显著(表2)。以上结果提示HFpEF患者存在明显左室舒张功能不全和左室充盈压的增高,在左房明显增大者进一步加重。
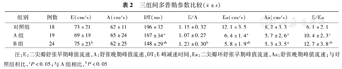
三组间多普勒参数比较( ±s)
±s)
三组间多普勒参数比较( ±s)
±s)
| 组别 | 例数 | E(cm/s) | A(cm/s) | DT(ms) | E/A | Ea(cm/s) | Aa(cm/s) | E/Ea |
|---|---|---|---|---|---|---|---|---|
| 对照组 | 18 | 73±21 | 62±11 | 196±32 | 1.15±0.32 | 12.1±3.5 | 8.2±3.3 | 6.1±2.1 |
| A组 | 19 | 69±19 | 65±24 | 167±34a | 1.07±0.27 | 6.4±1.4a | 5.7±2.6a | 10.4±2.3a |
| B组 | 24 | 75±23b | 62±25 | 148±29ab | 1.23±0.30b | 5.8±1.9ab | 5.3±3.5a | 12.7±3.8ab |
注:E:二尖瓣舒张早期峰值流速,A:舒张晚期峰值流速,DT:E峰减速时间,Ea:二尖瓣环舒张早期峰值流速,Aa:舒张晚期峰值流速;与对照组相比,aP<0.05;与A组相比,bP<0.05
(1)充盈功能参数:HFpEF患者LAEI明显降低,B组低于A组。A组GLSs、MLSs、BLSs低于对照组,B组进一步降低且RLSs也出现下降(表3)。HFpEF患者左房硬度指数显著增高,B组高于A组(表3)。GLSs、MLSs与LAVImax负相关(P<0.05),相关系数r值为–0.47和–0.57,GLSs、MLSs和LAEI正相关(P<0.05),相关系数r值为0.36和0.43。(2)排空功能参数:HFpEF患者LAEF、LAPEF明显降低,B组LAEF低于A组。LAAEF在A组患者中未明显降低(P>0.05),B组出现明显下降。与对照组相比,A组GLSa和MLSa明显下降,B组进一步降低且BLSa,RLSa也出现下降。GLSa、MLSa、BLSa与LAEF正相关(P<0.05),相关系数分别为0.35、0.39和0.29。

三组间3D–STE和RT3DE参数比较( ±s)
±s)
三组间3D–STE和RT3DE参数比较( ±s)
±s)
| 参数 | 对照组(18例) | A组(19例) | B组(24例) |
|---|---|---|---|
| LAVImax(ml/m2) | 24±6 | 29±4a | 38±3ab |
| LAVIpc(ml/m2) | 14±7 | 21±5a | 27±4ab |
| LAVImin(ml/m2) | 9.5±3 | 14±6a | 19±7ab |
| LAEF % | 62±11 | 54±9a | 45±8ab |
| LAEI % | 157±32 | 112±37a | 91±26ab |
| LAPEF % | 42±10 | 30±9a | 27±7ab |
| LAAEF % | 36±10 | 33±11 | 27±8ab |
| BLSs % | 29±8 | 25±8a | 18±7ab |
| MLSs % | 45±9 | 33±6a | 23±5ab |
| RLSs % | 32±10 | 28±8 | 24±9ab |
| GLSs % | 35±6 | 29±7a | 21±6ab |
| BLSa % | 14±4 | 13±4 | 11±5a |
| MLSa % | 17±5 | 12±3a | 9.5±4ab |
| RLSa % | 15±5 | 13±7 | 12±5a |
| GLSa % | 16±3 | 12±5a | 10.8±3ab |
| LA stiffness index | 0.18±0.08 | 0.35±0.11a | 0.64±0.10ab |
注:LA stiffness index:左房僵硬指数,其他英文缩写见文内;与对照组相比,aP<0.05;与A组相比,bP<0.05
二维斑点追踪(2D–STE)近年来已用于评估左房形变功能,但受左房复杂解剖结构所限存在较多不足:(1)形变分析局限在心尖四腔、二腔切面;(2)无法追踪心肌真实的跨平面运动;(3)左房分段沿用左室节段划分法,对左房解剖特点考虑不足。本研究应用3D–STE评估HFpEF左房形变功能和,并按解剖特点[9]对左房进行了分层分析,很大程度上克服了二维方法的不足。本研究中80%的研究对象完成左房内膜边界追踪并获取理想应变曲线。受肺静脉开口、左心耳、二尖瓣环等结构影响,部分基底和房顶无法有效追踪,左房中部较少受以上因素影响,经适当手动调整后均可获取理想分析曲线。
HFpEF左房功能变化及意义,心动周期中,左房功能按时相可分为充盈期(储备功能),被动排空期(通道功能))和主动排空期(泵功能)。左房充盈期形变LSs主要受左室收缩牵拉、左房主动松弛和僵硬度的影响[10]。虽然射血分数在正常范围,但Morris等[11]研究发现HFpEF患者左室收缩形变已明显减低。研究入组排除了房颤和明显二尖瓣反流等瓣膜病患者,故E/Ea可较好反映左房充盈压力变化,而GLSs%与左房充盈容量明显相关。因此在既往研究基础上我们引入左房僵硬度的3D–STE无创评估指标:定义为E/Ea与GLSs%的比值。研究结果表明HFpEF患者左房充盈期形变明显减低,形变与左房大小明显负相关,左房明显增大前形变减低以中间部为主,随左房进一步增大,除中部外,基底和房顶部形变功能也出现显著下降。HFpEF左房僵硬度明显增加,随着左房明显增大其变化幅度更加显著。
LAEI是左房充盈期容量变化的评估指标,其大小由LAVImin和LAVImax决定。LAEI减低是舒张功能不全患者左室舒张末压升高(>16 mmHg,1 mmHg=0.133 kPa)的独立预测因子[12]。本研究中,HFpEF患者LAVImin明显增大,变化幅度大于LAVImax,从而引起LAEI减低,这表明HFpEF患者随着左房增大,舒张功能降低和左室充盈压升高更加明显,这也与B组患者E/Ea、Ea、DT等舒张功能评估参数的变化相一致。
左房被动排空发生在左室舒张充盈早期,受左室舒张压、左房顺应性等影响。虽然HFpEF患者LAVImax增大起一定排空代偿作用,但由于舒张功能和左房顺应性的明显减低,LAVIpc增大更加显著,LAPEF出现明显减低。
HFpEF患者左房未明显增大前,反应心房中部主动排空期收缩形变的MLSa已明显减低,此时LAAEF尚未出现明显变化,这提示我们与容量变化参数相比,由于受心房前后负荷影响较少[13],3D–STE应变参数可以更敏感发现HFpEF左房泵功能的变化。左房明显增大的B组患者,舒张功能不全和左房僵硬程度加重,除MLSa、GLSa出现进一步降低外,左房基底和房顶部收缩形变功能和LAAEF也明显下降。
正常组左房充盈、收缩期形变均以中部最为明显,除受心房肌走行和分布影响外,还与房顶和基底部受到肺静脉、左心耳、二尖瓣环等结构的固定和牵拉有关。在左房未明显增大的HFpEF患者,左房充盈和收缩期形变功能降低也以中部为主,并在整体形变功能减低中起主导作用,在心房明显增大后,房顶和基底部形变才出现显著下降,上述结果提示我们在HFpEF病理生理发展过程中,左房中部较早受累出现形变功能减低,类似现象在其他研究中也曾有报道[14]。此外,3D–STE左房中部形变参数的重复性检验结果也最为理想,是左房功能较为理想的评估指标。
本研究应用3D–STE结合RT3DE新方法对HFpEF患者左房功能变化进行了初步评估,样本量较小。由于目前左房功能相关研究在标准制定、方法和技术路线选择上具明显多样性,新方法的应用推广需要更多研究证据的支持。



























