
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2010年,美国心脏病学学会、美国心脏协会发表"院内获得性尖端扭转型室性心动过速(TdP)防治专家共识"[1] (简称专家共识)后半年,中华医学会心血管病学分会心律失常学组、中国心脏起搏与心电生理杂志编委会、中华心血管病杂志编委会共同邀请部分中国专家起草并发表了"获得性长QT间期综合征的防治建议"[2](简称防治建议)。这两份文件是继CAST研究敲响抗心律失常药物治疗安全性的警钟后,再次警示医药工作者、政府药品安全监管机构应高度重视抗心律失常药物及所有药物对QT间期的影响,这是所有药物安全性评价不可或缺的指标。医药界相关人员增加对这一问题的重视,提高认识水平并加强防范后,绝大多数抗心律失常药物致心律失常的副反应,包括TdP均能有效预防。
防治建议中,TdP的定义仍沿用专家共识的意见:即TdP是一种特殊类型的多形性室速,所谓特殊是指发生在先天性或获得性QT间期延长患者的多形性室速称为TdP,而不伴QT间期延长而发生的多形性室速仍称为多形性室速。QT间期延长定义为:女性QTc >480 ms、男性QTc >470 ms,当QTc>500 ms时为明显延长。除基础心电图伴或不伴QT间期延长外,TdP和一般的多形性室速还有多方面不同。
引发TdP的室早联律间期多数>500 ms,可视为长联律间期的室早,但因基础心电图已存在QT间期的明显延长,使引发TdP的长联律间期室早仍然属于"R on T"室早。而引发一般的多形性室速的室早多数为短联律间期的室早,联律间期常在220~280 ms之间,一般不超过300 ms(图1)。Coumel报告的一组病例(25例)中,室早的联律间期为(245±28)ms。
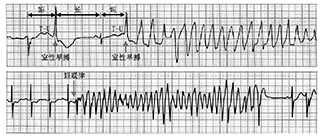

引发TdP室早的前周期一般较长,其有多种心脏电生理不良作用:(1)使延长的QT间期更为延长,因患者已有QT间期先天性或获得性延长和不应期存在一定程度的离散,而较长的前周期能进一步增加QT间期及离散度,较长的前心动周期起到一个缓慢心律的作用;(2)增加其后的早后除极的幅度,使其更容易达到除极的阈值而引起新激动,形成单个或成串室早;(3)增加复极离散度,使其后的T-U波变形,Tp-Te间期延长。上述三重不良作用使长周期这一因素在引发TdP的作用十分显要。除此,长周期后的室早在室内扩布时如果落入前次心肌除极后的复极离散区,则将发生折返。所以,TdP是一个慢频率依赖的典型的0相折返,这也是超速起搏或提高心率的异丙肾上腺素治疗有效的原因。而短联律间期室早诱发多形性室速时,室早的前心动周期较短,提示发作与交感神经兴奋性增加相关。
多数TdP发作时的上游心律存在短-长-短现象。第一个短是指首次室早,而长是指室早后较长的代偿间期,第二个短是指直接触发TdP的室早。短-长-短现象形成了一个组合拳,多重作用的叠加使TdP发生。而多形性室速的上游心律不需短-长-短现象。
先天性长QT间期综合征是一种离子通道病,系患者存在的致病基因或普通基因多态性引起,不同的基因突变能引起不同的离子通道(K+、Na+、Ca2+等)改变,并以不同的方式影响QTc值。如图2所示的LQT1型受损的IKs通道(图2b)、LQT2型受损的IKr通道(图2c)、和LQT3型受损的INa通道(图2d),三者约占先天性长QT间期综合征总病例的75%以上。
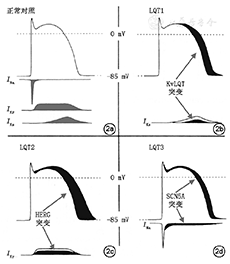

应当强调,6%~8%的先天性长QT间期综合征患者,心电图QTc始终<440 ms,但也能发生晕厥或心脏骤停事件,属于隐匿性先天性长QT间期综合征患者,这部分患者都混杂在医生面对的治疗人群。
获得性长QT间期综合征的发生率有逐渐升高趋势,常见的引发原因为心率缓慢、药物、电解质紊乱等。药物是最常见的引发原因,尤其是IKr阻滞剂或兼有K+和Na+通道阻滞的药物。获得性长QT间期综合征患者的遗传学检查结果5%~20%为阳性,提示遗传缺陷在获得性长QT间期综合征患者中的作用十分重要。
QTc值可随年龄增高而增大,女性QTc值长于男性。
Dessertenne[3]1966年提出TdP概念后,其推测患者心室内同时存在两个节律点发放快速的心室激动而形成这种特殊形态的TdP。随后,动物实验的结果也支持两个异位心室节律点发放的激动相互影响可形成TdP(图3)。El-Sherif等[4]认为,TdP最初的激动起源于心内膜的触发灶,随后激动形成折返的旋转波,旋转波的波锋(wave front)在室内扩布时,在室间隔邻近部位因遇功能性阻滞区而发生分裂。分裂后的两个同步旋转波分别激动左心室和右心室,引起QRS波的电轴发生周期性反转。折返的终止也与功能性阻滞有关,折返终止的同时TdP也即停止(图4)。
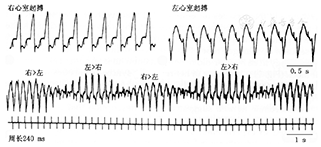

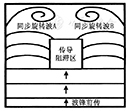

临床医生面对需要治疗的患者群体庞大而复杂,识别哪些是TdP的易患人群十分重要。复极异常是TdP发生的重要基质,影响复极的因素有些是生理性因素,有些则为病理性因素,凡复极存在异常者都属于TdP的易患人群。
在心律失常领域,最具性别差异的两个心律失常是男性的心肌缺血性心律失常和女性更具药物性心律失常发生的危险性。对于后者,这一明显性别倾向的原因就是女性复极储备功能较低。药物治疗时发现,女性比男性TdP的发生率高出2~3倍。研究证实,雌兔的IKr通道比雄兔少,服用同等剂量的IKr阻滞剂时,女性QT间期延长的程度比男性更显著。进一步研究发现,成年男性的心脏电生理特点与睾酮有关[5]。睾酮有抑制L型钙通道电流、增强钾通道电流、增加复极储备[6,7]等多种作用。而女性的黄体酮与睾酮有相似作用,但这些作用被女性雌激素的相反作用抵消。而且,黄体酮的体内含量能随女性月经周期有一定波动,使TdP发生的敏感性也能有相应变化,临床不少女性患者晕厥的发生与月经周期有关。
老年人的QT间期值相对长,同等剂量的IKr阻滞剂治疗时,老年人QT间期的延长更明显,TdP发生的概率也增加。因为增龄引起心脏结构和功能发生退行性改变的同时,心肌细胞膜的IKr和IKs通道的数量也发生下调。
在电解质紊乱的致心律失常作用中,低钾血症高居第一,因为低钾血症的发生率高,引起和促发心律失常的作用最强。
低钾血症是临床常见的电解质紊乱。住院患者中,20%以上的血钾水平低于3.6 mmol/L;服用噻嗪类利尿剂治疗时,10%~40%的患者存在低钾血症;而院外心室颤动复苏成功者中,50%存在低钾血症。除发生率高以外,很多低钾患者因不伴临床症状而被漏诊。
低钾血症有多种心脏电生理不良作用:(1)静息膜电位的负值变小:低钾血症可使静息膜电位的负值变小,形成心肌细胞的极化不全,使其更易达到除极阈值而表现为自律性增强。此外,不全极化的心肌细胞与极化完全的心肌细胞间的电位差能形成"损伤电流"性的ST段移位。(2)IKr电流减弱及复极延长:钾通道电流的高低受心肌细胞膜内外钾离子浓度差的影响。低钾血症可降低IKr电流,使复极延迟。(3)细胞内钙超载:低钾血症抑制Na+-K+交换后,间接激活Na+-Ca2+交换体,使Ca2+内流增加,发生Ca2+超载,增加延迟后除极的发生。(4)增强IKr阻滞剂的作用:低钾血症可使IKr阻滞剂的作用增强,增加心室复极离散度,增加心室颤动的发生。(5)引发TdP:低钾对IKs离子流有抑制作用,使恶性室性心律失常的发生率明显升高,并显著增加TdP的发生。
心衰患者心电活动的不稳定是其显著的特征,这使心衰患者50%的死亡形式为猝死,推测都与恶性室性心律失常相关。衰竭心肌心电不稳定性增加的机制尚不清楚,但缺血心肌的纤维化、坏死心肌的瘢痕都能成为折返性室性心律失常的发生基质,而心肌细胞的钙摄取异常、心肌细胞的电生理特性的改变都有很强的致心律失常作用。
有研究表明,衰竭心肌存在着复极重构(remodelling of cardiac repolarization),而复极重构是心肌细胞离子通道和离子流重构的结果[8]。肥厚型心肌病和严重心衰患者都存在心肌细胞动作电位持续时间的延长(图5),这一延长能代偿性增加Ca2+摄入和心肌收缩力增强,钙摄入增加在代偿性提高心肌收缩力的同时也有致心律失常作用。
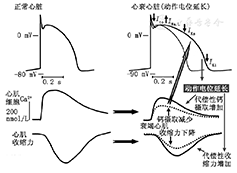

衰竭心肌细胞的离子通道重构有以下两个特点:(1)晚钠内流增加:晚钠电流的增强是快Na+通道失活变慢的结果,而增强的晚钠电流容易引起早后除极、迟后除极及T波电交替,这些心电异常都能引起触发活动及快速性室性心律失常,包括TdP;(2)IKs通道下调:衰竭心肌细胞的离子流重构主要是Ito和IK电流的减少和下调,而心衰患者IKs通道数量的下调多见于右室心肌细胞及其他部位。
先天性离子通道病的长QT间期综合征是指有遗传缺陷的突变基因引起离子通道的功能出现障碍,使患者的复极功能严重受损:(1)显性先天性长QT间期综合征:患者有基因突变的证据,又伴有QT间期的延长和相关的心律失常;(2)隐匿性先天性长QT间期综合征,即患者有基因突变,但不伴先天性长QT间期综合征的其他临床表现。
TdP发生的基质为复极改变,包括复极延长和跨室壁复极离散度的增加,而快速复极的3位相与心电图T波相对应,使TdP最重要的预警心电图表现为"三T"改变:QTc延长、T-U波畸形、T波电交替。
资料表明,随着QTc值的延长,TdP发生的危险呈指数样增长,但QTc值延长到多少就一定会引起TdP的意见尚不统一。Keren和Roden认为,药物获得性TdP患者的QT间期几乎都>600 ms。Haverkamp报告的一组28例TdP患者QTc的平均值超过了550 ms。T-U波畸形是另一警告性心电图改变,T-U波畸形包括T波低平或双向、U波增大、T-U波融合等。T波形态的改变和高大U波的出现是重要的TdP预警心电图表现。另一预警性较高的心电图表现是毫伏级T波电交替,这是细胞内Ca2+浓度发生周期性变化所致。专家共识提出,当QTc>500 ms或用药后QTc增加值>60 ms,并有预警性心电图出现时,应当考虑停用抗心律失常药物。
TdP的防治重在防范,提高防范意识和加强防范措施,能使绝大多数的TdP避免发生。
TdP的高危患者或称易患人群,包括老年、女性、遗传和获得性长QT间期综合征、低钾(包括正服利尿剂者)、器质性心脏病(尤其伴心衰者)等。
临床医生应当熟悉药物致TdP的相关因素:(1)抗心律失常及非抗心律失常药物均可能有致TdP作用,而非抗心律失常药物可能是心血管药物,也可能是非心血管药物(如精神科及抗过敏等多种药物);(2)药物诱发TdP几乎均随血药浓度升高而增加,仅少数与血药浓度无关;(3)与口服药相比,等同剂量的静脉用药因心脏作用强,引起血药浓度较高而更易引起TdP;(4)多种抗心律失常药物同时应用时易发TdP;(5)用药剂量偏高或过量时易发TdP;(6)TdP的高危者同样剂量时易发TdP;(7)单药有多种离子通道作用伴有多重QTc延长作用时,易发TdP(例如伊布利特);(8)QTc值>500 ms或用药后延长>60 ms,且伴有警告性心电图表现时,应当停药。
为有效监测心电图QTc值及变化,防治建议推荐应用自动化心电图动态监测QTc值。自动化心电图机在我国已十分普及,其测量与报告的QTc值相对可靠,容易做同一患者QTc值前后动态的比较。医生用药前、用药中、增加剂量、停止给药后的一定时间,都应检测心电图QTc值,并根据QTc值的变化指导用药。
除TdP警告性"三T"改变外,给药后室早增多也要格外注意;因频发室早形成二联律的同时也构成了短-长-短现象,是TdP常见的触发因素。除室早外,还需注意心律,不宜太慢或有较长间歇,因TdP的发生有慢频率依赖性。
对于一般患者及TdP发生的高危患者,预防性应用硫酸镁能明显预防TdP的发生。选择性IKr阻滞剂伊布利特能有效转复近90 d内新发生的心房颤动(房颤)或心房扑动(房扑),但治疗时诱发TdP的概率相对较高(4%)。而伊布利特给药前预防性应用硫酸镁能使TdP的发生明显下降[9]。
Pharm给20例房颤或房扑患者应用伊布利特转复前10 min静脉注射2.0 g硫酸镁,并持续静脉滴注硫酸镁,结果预防性应用硫酸镁能减少给药后QT及QTc的延长,能减少给药后QTc>500 ms的发生风险,而且无一例出现TdP,认为这是硫酸镁减少早后除极的结果。Tercius在229例伊布利特转复房颤、房扑治疗中,预防性给予硫酸镁时,不仅提高了转复成功率,而且转复中无TdP的发生。Craig的数学模型分析显示,预防性应用硫酸镁可降低伊布利特转复房颤、房扑治疗时42%的TdP发生。
因此,预防性应用硫酸镁可减少QT和QTc的过度延长,提高房颤、房扑的转复成功率,大大降低TdP的发生,甚至使其降为零[10]。
绝大多数获得性长QT间期综合征伴发的TdP为短阵、非持续性,常在几秒钟内自行终止,仅少数TdP持续时间较长或蜕化为心室颤动需要分秒必争地紧急处理,有时还需多种治疗措施联合进行。临床常用的6项治疗可归纳为12个字:停药、除颤、补镁、补钾、起搏、药物。
QT间期过度延长及发生TdP时,应立即停止所有可能引起QT延长的药物。
患者TdP持续存在或蜕化为心室颤动时,应立即行体外直流电除颤治疗,使用非同步最大电量(≥300 J)除颤治疗。
无论患者血清镁的水平如何,都应立即静脉给予硫酸镁,首选静脉推注硫酸镁2 g(用5%葡萄糖稀释至10 ml,5~20 min注入),无效时,可再给硫酸镁2 g,并采用硫酸镁持续静脉滴注,直至TdP消失。
及时补钾使血钾水平达到>4.5~5.0 mmol/L。
经心房、心室进行临时心脏快速起搏,以起搏频率>70次/min为宜,高频和心脏起搏能缩短QT间期,并能减少心电图出现的长间歇,减少其对早除极、迟后除极振幅的不良作用,减少TdP的发作。
应用增快心率的药物,如阿托品或异丙肾上腺素。心率的提高能缩短QTc值,减少长间歇依赖的TdP发作。必要时还可考虑利多卡因和美西律的应用。
综上,防治建议是在专家共识的基础上结合国情为我国临床及时提供的对获得性长QT间期综合征防治工作的实用性指南。应当强调,心血管专科、内科、精神科医师以及药物试验安全性评价者都应掌握其要领,有效提高获得性长QT间期综合征的防治水平。





























