
亚低温已成为足月儿围生期窒息后神经保护的标准治疗方法,但主动降温(头部或全身)成本高,相对复杂,现探讨被动式降温治疗重度窒息足月儿的临床可行性。
选取重度窒息足月儿32例,患儿均满足亚低温治疗标准,随机分为被动降温组(n=17)和主动降温组(n=15)。主动降温组采用MTRE ALLON™ -体温调节系统,被动降温组采用自然降温法。亚低温治疗时间均为72 h,治疗结束后总结2组患儿的临床表现、生化指标以及临床疗效。
2组患儿治疗期间均无心律失常、低血糖、持续代谢性酸中毒、血源性感染,无局部寒冷损伤或出血现象。被动降温组患儿的直肠温度波动范围相对较宽[平均(33.47±0.71) ℃],而主动降温组患儿直肠温度波动范围相对较窄[平均(33.66±0.29) ℃],但2组平均直肠温度差异无统计学意义(t=1.941,P=0.055)。在主动降温组中,1例患儿因窒息合并急性肾衰竭,家长要求放弃治疗,其余31例患儿均存活。2组存活患儿自行吃奶的日龄、住院天数、新生儿神经行为评定评分、颅脑超声及颅脑MRI异常比例差异均无统计学意义(P均>0.05)。
被动降温方式在环境温度相对稳定的NICU可以便利地作为重度窒息足月儿的亚低温治疗手段,且无明显的临床不良反应。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
亚低温治疗已经被证明能有效保护因围生期窒息导致的脑损伤[1,2,3,4],其中全身亚低温治疗能更有效地降低脑内温度,从而减少脑组织的耗氧[5]。全身亚低温诱导低温和维持低温的方法分主动降温(active coo-ling)和被动降温(passive cooling)。主动降温需要亚低温治疗仪(冰毯系统),该方法控制核心温度的精准性强,但需要在具备该设备的新生儿重症监护病房(NICU)进行。被动降温即自然降温,可辅助应用冷水袋、电扇、冰块等方法[6,7,8,9]。当前国内多数新生儿监护单元,尤其是基层医院还不具备新生儿专用的亚低温治疗仪,特别是有数名重度窒息患儿同时入院时难免发生低温设备短缺现象,另外主动诱导低温如果失控或过深,有可能带来肺动脉高压、低心排出量、心脏节律紊乱、凝血功能障碍、电解质紊乱等不良反应[8],因此,探讨有效、经济、安全和便捷的被动式降温方法在临床实践中还是有必要性的。本研究通过随机对照研究,探讨了被动式降温治疗足月儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)的临床可行性。
本研究为随机-对照研究,患儿入选前家长签署知情同意书,研究内容及知情同意书均经医院医学伦理委员会通过。
选取2013年5月至12月入住中国人民解放军白求恩国际和平医院儿科NICU的重度窒息新生儿,纳入研究的标准:胎龄>37周和出生体质量≥2 500 g,并同时存在下列情况:(1)有胎儿宫内窘迫的证据,至少包括以下1项:①急性围生期事件,如胎盘早剥或脐带脱垂或严重胎心异常变异或迟发减速;②脐血pH<7.0或碱缺失(BD)>16 mmol/L;③需要正压通气至少10 min。(2)有新生儿窒息的证据(满足以下3项中的任意1项):① 5 min Apgar评分<5分;②脐带血或出生后1 h内动脉血气分析pH<7.0或BD>16 mmol/L;③需要正压通气至少10 min。(3)振幅整合脑电图(aEEG)脑功能监测异常的证据,至少描记20 min并存在以下任意1项:①严重异常:上边界电压≤10 μV;②中度异常:上边界电压>10 μV和下边界电压<5 μV;③惊厥[10]。HIE临床分度参考《实用新生儿学》第4版相关内容[11]。剔除标准:凡合并先天畸形、染色体疾病、可疑遗传代谢性疾病、母亲为糖尿病、溶血病、脓毒症的新生儿不包括在此范围内。符合上述标准的研究对象,采用随机数字表的方法随机分为被动降温组和主动降温组,主动降温组作为对照组。
详细记录母亲的妊娠、疾病及生产史;记录新生儿出生体质量、孕周、Apgar评分以及抢救经过。所有参加研究的患儿入院后接受动脉血气、血糖、电解质、心肌酶、肝肾功能、凝血功能(包括凝血酶原时间、凝血酶原活动度、凝血酶时间、部分凝血活酶时间、纤维蛋白原水平、纤维蛋白原时间)、血常规、超敏C反应蛋白等检查。
对参与研究的患儿每日进行详细的体格检查,包括神经行为评定。所有患儿于出生后72 h接受颅脑超声检查,出生后7 d接受颅脑MRI检查和新生儿神经行为评定(neonatal behavioral neurological assessment,NBNA)。
一般治疗包括保暖、限制液体、维持血压血糖稳定、纠正代谢性酸中毒(代酸),对出现惊厥的患儿使用苯巴比妥止惊,负荷量累计不超过40 mg/kg,如惊厥仍不能停止,予咪达唑仑静脉泵入。对呼吸衰竭的患儿应用持续正压通气(CPAP)或常频机械通气,如合并肺动脉高压者给予口服西地那非。
全身亚低温治疗:(1)主动降温组:采用以色列MTRE ALLON™-体温调节系统,将患儿放置在闭式暖箱内,关闭暖箱电源,尽量裸露,将患儿用ThermoWrap控温服包裹起来,控温服覆盖头部、躯干和大腿,但不遮盖眼睛。将直肠温度探头插入直肠5 cm左右,并固定于大腿内侧。放置皮肤温度探头于腹部。直肠目标温度在33.5~34.0 ℃,维持上述治疗72 h。(2)被动降温组:通过中央控制系统,将NICU室温控制在24~25 ℃。将患儿放置在闭式暖箱内,关闭暖箱电源,除尿布其余身体裸露。目标温度同主动降温组,温度探头的放置同前,维持上述治疗72 h。如直肠温度>34.5 ℃,在暖箱内床垫下,头部附近加放冰袋。如直肠温度<33 ℃,去除冰袋,必要时开启暖箱电源[8]。(3)复温:治疗结束后,打开暖箱电源,从28 ℃起,复温时间不少于6 h(0.5 ℃/h),复温过程中出现抽搐的停止复温或治疗抽搐的同时降低复温幅度(0.2 ℃/h),复温结束后,再连续监测肛温24 h(维持在36.0~36.5 ℃)[8,10]。上述亚低温治疗期间密切观察皮肤是否出现硬肿、出血点,监测直肠温度、心率、呼吸、血压、血糖、尿量、血气等,如心率<80次/min加用多巴胺[5 μg/(kg·min)]。亚低温治疗72 h复查血常规、肝功能、肾功能、心肌酶、血气、电解质、血糖、血钙、凝血功能,上述指标必要时随时复查。
应用SPSS 13.0统计软件包,计量资料采用 ±s表示,计数资料采用数量或百分比表示。成组设计两样本均数的比较:若所得数据符合正态分布,应用t检验,否则用2个独立样本比较的Mann-Whitney U秩和检验;计数资料组间比较采用Pearson χ2检验,当四格列联表的理论频数<5时,计数资料的比较用Fisher's确切概率法。P<0.05为差异有统计学意义。
±s表示,计数资料采用数量或百分比表示。成组设计两样本均数的比较:若所得数据符合正态分布,应用t检验,否则用2个独立样本比较的Mann-Whitney U秩和检验;计数资料组间比较采用Pearson χ2检验,当四格列联表的理论频数<5时,计数资料的比较用Fisher's确切概率法。P<0.05为差异有统计学意义。
共有32例患儿参加本项研究,被动降温组患儿17例,主动降温组患儿15例,2组患儿在孕周、出生体质量、性别、生产方式、入院日龄上的差异均无统计学意义(P均>0.05),见表1;2组患儿1 min Apgar评分、5 min Apgar评分、入院后血气pH、碱剩余(BE)值、肉眼惊厥、需要呼吸机治疗、少尿/肾功能异常和肝功能异常患儿的比例差异也无统计学意义(P均>0.05),见表1。32例患儿重度HIE 7例,主动降温组3例,被动降温组4例;中度HIE 25例,主动降温组12例,被动降温组13例,2组患儿HIE程度比较差异无统计学意义(P>0.05),见表1。
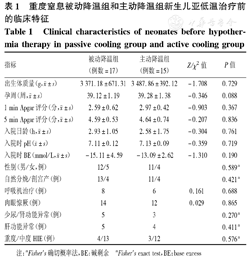
重度窒息被动降温组和主动降温组新生儿亚低温治疗前的临床特征
Clinical characteristics of neonates before hypothermia therapy in passive cooling group and active cooling group
重度窒息被动降温组和主动降温组新生儿亚低温治疗前的临床特征
Clinical characteristics of neonates before hypothermia therapy in passive cooling group and active cooling group
| 指标 | 被动降温组(例数=17) | 主动降温组(例数=15) | Z/χ2值 | P值 |
|---|---|---|---|---|
出生体质量(g, ±s) ±s) | 3 371.18±671.31 | 3 487.86±392.12 | -1.708 | 0.729 |
孕周(周, ±s) ±s) | 39.12±1.19 | 39.28±1.38 | -0.346 | 0.088 |
1 min Apgar评分(分, ±s) ±s) | 2.59±0.62 | 2.97±0.42 | -0.903 | 0.367 |
5 min Apgar评分(分, ±s) ±s) | 4.59±0.53 | 4.64±0.74 | -0.207 | 0.836 |
入院日龄(h, ±s) ±s) | 2.93±1.05 | 2.58±1.75 | -0.304 | 0.761 |
入院时pH( ±s) ±s) | 7.11±0.12 | 7.13±0.09 | -0.359 | 0.719 |
入院时BE(mmol/L, ±s) ±s) | -15.11±4.59 | -13.09±2.62 | -1.310 | 0.190 |
| 性别(男/女,例) | 12/5 | 11/4 | 0.589a | |
| 自然分娩/剖宫产(例) | 13/4 | 11/4 | 0.421a | |
| 呼吸机治疗(例) | 8 | 6 | 0.161 | 0.688 |
| 肉眼惊厥(例) | 14 | 12 | 0.029 | 0.865 |
| 少尿/肾功能异常(例) | 5 | 3 | 0.270a | |
| 肝功能异常(例) | 5 | 4 | 0.411a | |
| 重度/中度HIE(例) | 4/13 | 3/12 | 0.576a |
注:aFisher's确切概率法,BE:碱剩余 aFisher's exact test,BE:base excess
在被动降温组中,3例患儿因核心温度偏离需要加用冰块,但持续时间仅6~8 h。另2例患儿核心温度一过性低于33 ℃,开启暖箱(28 ℃)后核心温度回到预定目标,其余患儿采用自然降温法顺利完成了72 h的亚低温治疗。在亚低温治疗期间,2组患儿普遍心率减慢,一般维持在90次/min左右,其中被动降温组9例患儿、主动降温组8例患儿因心率≤80/min加用多巴胺[5 μg/(kg·min)]治疗。2组治疗期间均无心律失常、低血糖、持续代酸、血源性感染,也无局部寒冷损伤或出血现象发生。治疗期间患儿的直肠温度在被动降温组波动范围相对较宽[32.40~35.30(33.47±0.71) ℃],而在主动降温组波动范围相对较窄[33.00~34.30(33.66±0.29) ℃],但2组平均直肠温度差异无统计学意义(t=1.941,P=0.055),见表2。
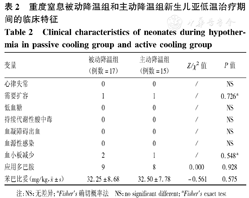
重度窒息被动降温组和主动降温组新生儿亚低温治疗期间的临床特征
Clinical characteristics of neonates during hypothermia in passive cooling group and active cooling group
重度窒息被动降温组和主动降温组新生儿亚低温治疗期间的临床特征
Clinical characteristics of neonates during hypothermia in passive cooling group and active cooling group
| 变量 | 被动降温组(例数=17) | 主动降温组(例数=15) | Z/χ2值 | P值 |
|---|---|---|---|---|
| 心律失常 | 0 | 0 | / | NS |
| 需要扩容 | 1 | 1 | / | 0.726a |
| 低血糖 | 0 | 0 | / | NS |
| 持续代谢性酸中毒 | 0 | 0 | / | NS |
| 血凝障碍出血 | 0 | 0 | / | NS |
| 血源性感染 | 0 | 0 | / | NS |
| 血小板减少 | 2 | 1 | / | 0.548a |
| 应用多巴胺 | 9 | 8 | 0.000 | 0.928 |
苯巴比妥(mg/kg, ±s) ±s) | 32.25±8.68 | 32.50±7.78 | -0.561 | 0.575 |
注:NS:无差异;aFisher's确切概率法 NS:no significant different;aFisher's exact test
在主动降温组中,1例患儿因窒息导致的急性肾衰竭,无尿、高血钾、深昏迷,于出生后48 h家长要求放弃治疗。其余患儿均存活,存活患儿中1例男婴于日龄11 d出现间断膈肌痉挛,经aEEG和常规EEG检查均证实有惊厥发作,但该患儿7 d颅脑MRI并未显示异常,遗传代谢筛查也未发现异常,患者电解质、血乳酸和血氨水平正常。被动降温组患儿均存活。经过72 h的亚低温治疗,2组患儿在自行吃奶的日龄、住院天数、7 d NBNA评分、3颅脑超声及7 d颅脑MRI异常比例的差异均无统计学意义(P均>0.05),见表3。

重度窒息被动降温组和主动降温组新生儿治疗后的临床特征
Clinical characteristics of neonates after hypothermia in passive cooling group and active cooling group
重度窒息被动降温组和主动降温组新生儿治疗后的临床特征
Clinical characteristics of neonates after hypothermia in passive cooling group and active cooling group
| 指标 | 被动降温组(例数=17) | 主动降温组(例数=14) | Z/χ2值 | P值 |
|---|---|---|---|---|
自行吃奶日龄(d, ±s) ±s) | 5.36±1.78 | 5.40±3.02 | 0.659 | 0.510 |
NBNA评分(分, ±s) ±s) | 36.00±1.84 | 35.73±2.63 | 0.307 | 0.759 |
平均住院日(d, ±s) ±s) | 14.88±5.29 | 13.79±4.59 | 0.319 | 0.750 |
| 3 d颅脑超声异常(例) | 7 | 8 | 0.784 | 0.376 |
| 7 d颅脑MRI异常(例) | 5 | 6 | 0.343a |
注:NBNA:新生儿神经行为评定;MRI:磁共振成像;aFisher's确切概率法 NBNA:neonatal behavioral neurological assessment;MRI:magnetic resonance imaging;aFisher's exact test
新生儿窒息是导致全世界新生儿死亡、脑性瘫痪和智力障碍的主要原因之一[12],中国儿童智力残疾原因排在第1位就是产时窒息[11]。在发达国家,1 000例足月活产儿中,有1.64%新生儿发展为中重度脑病,成为足月儿死亡和残疾的主要原因[13]。
窒息导致的组织缺氧缺血涉及2个阶段,即原发性和继发性能量衰竭。积极成功的复苏可以逆转原发性能量衰竭,避免大脑的损伤,但某些时候即便原发性能量衰竭已经解决了,经过一段时间(6~12 h),随着缺血再灌注的出现,出现继发性能量衰竭过程,该过程参与"迟发性"神经损伤,表现为神经细胞坏死和凋亡,可持续数周[1,11]。
亚低温是利用人工的方法诱导将体温下降2~6 ℃,以达到治疗目的。近年,循证医学证实该法能有效地降低足月或近足月儿HIE导致的死亡,改善幸存者的远期预后[2]。动物实验及临床试验显示亚低温通过以下可能的机制发挥了脑保护作用:脑内温度的下降,降低了脑对葡萄糖和氧的代谢速率,减少了缺血期间三磷酸腺苷的丢失;保护血脑脊液屏障,抑制乙酰胆碱、儿茶酚胺以及兴奋性氨基酸等内源性毒性物质对脑组织的损害作用;减少Ca2+内流、一氧化氮(NO)、自由基、兴奋性神经毒性,减少炎性介质的聚集,使细胞结构蛋白的破坏减少等[13,14]。亚低温治疗应起始于发病6 h内,即在继发性能量衰竭前,持续48~72 h,才能有效发挥脑保护作用[1]。新近的一项研究还显示对符合亚低温治疗标准的患儿尽早开始亚低温治疗(出生3 h内),其运动功能的改善好于3 h后开始亚低温治疗的患儿[15]。
亚低温有选择性头部亚低温和全身亚低温2种方式。新近对这2种方式治疗HIE患儿颅脑MRI的比较性研究显示,在选择性头部降温组患儿颅脑MRI异常比例显著高于全身亚低温组患儿(74%比45%)[16]。在全身亚低温治疗中按降温方式的不同还分为主动降温和被动降温。主动降温通过亚低温仪(冰毯)实现,优点是对机体核心温度的控制精确。被动降温即自然降温,将患儿裸露,必要时用冷水袋、电扇、冰块等辅助降温[6,7,8,9]。被动降温不需要专门的设备,容易因地制宜实施,在转运途中多采用该方法,缺点是核心温度受环境温度影响大[6,7,8,9]。在室内温度相对稳定的NICU,被动降温已经显示出与主动降温同样的疗效,核心温度的波动范围略宽,但完全可以接受[8,9]。在对瑞士17个新生儿单元的调查显示:65%的中心采用亚低温治疗围生期窒息导致的脑病,且采用的均为全身亚低温,其中82%的单元采用被动降温,只有当偏离目标温度太远,简易方法不能纠正时才应用亚低温设备[9]。
被动降温关键是控制NICU的环境温度,患儿的直肠温度波动范围略大于主动降温组患儿,但属于可接受范围,这点与国外报道一致[8]。被动降温治疗时,患儿机体的核心温度有一过性偏离预定目标,但通过开启暖箱或加用冰袋很快可以纠正在目标范围内。
在治疗期间2个亚低温组患儿除了窦性心动过缓,未发现心律失常。国外的研究还显示全身亚低温可以暂时影响心排出量,但停止亚低温治疗后很快恢复[17],本研究尽管未对患儿进行超声心功能检查,但也未发现患儿出现与亚低温相关的心功能不全。此外亚低温治疗后无一例发生出血倾向,尽管3例患儿有血小板减少[(54~68)×109/L]和凝血参数部分恶化(这部分内容将另文讨论),但不能除外与窒息导致的器官功能障碍有关,在近期国外的一个小样本的研究中也显示全身亚低温并未使患儿的凝血参数恶化,部分患儿甚至有所改善[18],因此目前下结论为时过早。以往有假设全身亚低温较选择性头部亚低温对全身组织器官干扰大,但新的研究显示多器官衰竭的窒息患儿在全身亚低温治疗或选择性头部亚低温治疗后,脑组织以外的多脏器功能障碍转归差异无统计学意义,也即全身亚低温治疗并未加重原有的疾病[19,20],这与本研究结论一致。
2组患儿除主动降温组放弃1例,其余存活,与以往不同的是,78%的患儿结束亚低温后,在日龄≤7 d可以自己吃奶,最长自己吃奶的日龄为11 d,以往重度窒息合并惊厥经过传统治疗成功存活者,大多数出院时不能自己吃奶,需要管饲。此外2组患儿住院天数和NBNA评分、3 d颅脑超声和7 d颅脑MRI异常比例差异也无统计学意义,所以,被动降温方式在环境温度相对稳定的NICU,可以便利地作为重度窒息足月儿并HIE治疗手段,且无明显的临床不良反应。



























